Introduction. Congenital atrioventricular block (BAVC) in the absence of other malformations or structural cardiac abnormalities is most often due to the transplacental transfer of maternal autoimmune antibodies anti-RO (SSA) or anti-LA (SSB) found in the serum of mothers with systemic lupus erytematosus or Sjögren sindrom. Only in 1-2% of cases, autoantibodies can affect fetal myocardial tissue, causing inflammation, subsequently fibrosis, ultimately leading to blocking in the atrioventricular node. The damage of the leading tissue can produce grade I, II or III (complete) atrioventricular block and can start in utero, at birth, or in the early neonatal period. While grade I and II atrioventricular block are reversible, BAV III (atrioventricular block) is always irreversible and its treatment consists in permanent pacing. Newborn babies may develop dilated cardiomyopathy. Case presentation. We present a case of neonatal bradyarrythmya, with onset in the first 48 hours of life, appearing in a newborn male, at term, without structural cardiac abnormalities, rhythm disorder detected on EKG by BAV grade II Mobitz I (Luciani-Weckebach period) and Mobitz II. We searched for and found anti-lupus antibodies in the serum of the mother, without having been presented at birth, or with a history of autoimmune disease. The particularity of the case consisted in the association of rhythm disorder with signs of superior digestive haemorrhage, and after that, ulceronecrotic enterocolitis. Besides the treatment of bradyarrhythmia with atropine, the administration of nonspecific human immunoglobulins has proven efficient in this case, leading to gradual disparagement of BAVC in a few days of treatment, the newborn being healthy at twelve days of life. Conclusion. The early diagnosis and prompt management were important in this case for a good prognosis and for preventing the complications.
Bloc atrioventricular congenital la nou-născut din mamă cu lupus eritematos sistemic - prezentare de caz
Congenital atrioventricular heart block in a newborn from mother with systemic lupus erytematosus - case report
First published: 16 iunie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Peri.1.2.2017.835
Abstract
Rezumat
Introducere. Blocul atrioventricular congenital (BAVC), în absenţa unor malformaţii sau anomalii cardiace structurale majore, este datorat cel mai frecvent transferului transplacentar al anticorpilor materni autoimuni anti-Ro (SSA) şi/sau anti-La (SSB), depistaţi în serul mamelor cu lupus eritematos sistemic sau sindrom Sjögren. Doar în 1-2% dintre cazuri autoanticorpii pot afecta ţesutul de conducere miocardic fetal, producând inflamaţie, ulterior fibroză şi, în final, ducând la blocarea conducerii în nodul atrioventricular. Afectarea ţesutului de conducere se poate manifesta prin BAV grad I, II sau III (complet) şi poate debuta in utero, la naştere sau în perioada precoce neonatală. În timp ce BAV de gradul I şi II sunt reversibile, BAV complet este întotdeauna ireversibil, iar tratamentul lui constă în pacing permanent. Nou-născuţii afectaţi pot dezvolta cardiomiopatie dilatativă. Prezentare de caz. Prezentăm un caz de bradiaritmie neonatală, cu debut în primele 48 de ore de viaţă, apărut la un nou-născut de sex masculin, la termen, fără anomalii structurale cardiace, cu tulburare de ritm obiectivată pe EKG prin BAV de grad II tip Mobitz I (perioadele Luciani-Weckebach) şi Mobitz II. S-au căutat şi au fost depistaţi anticorpii antilupici în serul mamei, fără ca aceasta să fi prezentat la naştere sau în antecedente manifestări de boli autoimune. Particularitatea cazului a constat în asocierea tulburării de ritm cardiac cu manifestări de hemoragie digestivă superioară şi ulterior debut de enterocolită ulceronecrotică. Pe lângă tratamentul bradiaritmiei cu atropină, administrarea de imunoglobuline umane nespecifice s-a dovedit eficientă în acest caz, ducând la dispariţia treptată a BAVC în câteva zile de tratament, nou-născutul externându-se sănătos la 12 zile de viaţă. Concluzii. Diagnosticul precoce şi managementul prompt în acest caz sunt importante pentru un prognostic bun şi pentru prevenirea apariţiei complicaţiilor.
Introducere
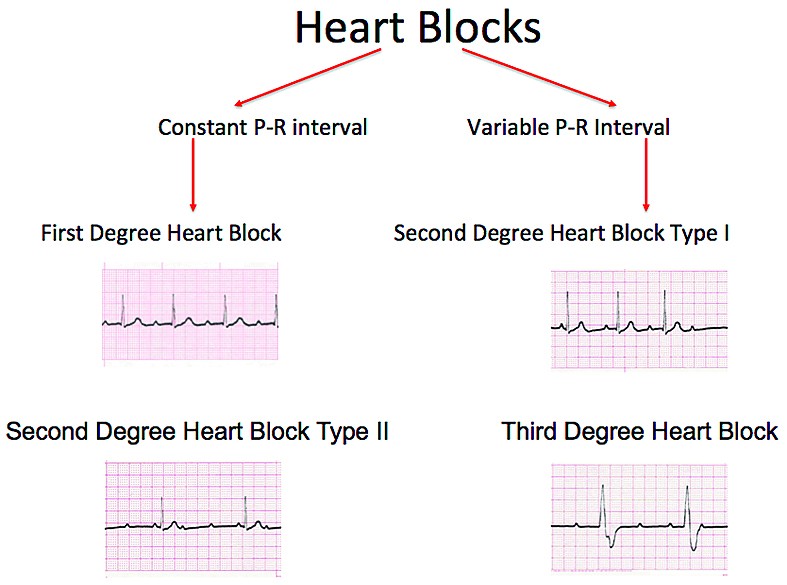
Blocul atrioventricular congenital (BAVC), ca manifestare principală a lupusul neonatal (LN), este o formă de boală autoimună dobândită pasiv, în care autoanticorpii materni faţă de ribonucleotidele intracelulare Ro (SS-A) şi La (SS-B) traversează placenta şi afectează ţesutul cardiac de conducere fetal anterior normal(2). Blocul atrioventricular (BAV) complet ireversibil este în principal manifestare cardiacă, deşi unii copii pot dezvolta alte complicaţii cardiace, precum fibroelastoză endocardială sau insuficienţă valvulară, chiar în absenţa blocului cardiac. Cele mai frecvente forme de prezentare a LN sunt BAVC, precum şi afectarea dermatologică (rash neonatal caracteristic) şi hepatobiliară (anomalii ale nivelurilor enzimelor hepatice şi icter). Mai rar se pot asocia şi anomalii splenice, hematologice (anemie, leucopenie şi trombocitopenie) şi ale SNC(2,9,10), datorate tot anticorpilor anti-Ro/La. Spre deosebire de BAVC complet, celelalte manifestări ale LN sunt de obicei autolimitante(1), dispărând odată cu epurarea autoanticorpilor. BAVC are, din fericire, o incidenţă redusă. Rata de apariţie a LN este considerată a fi de 2-3% din toate naşterile din rândul mamelor cu Ac anti-Ro sau anti-La. Rata de recurenţă creşte la 18% în cazul mamelor care au mai avut un copil anterior afectat(60). În timp ce mamele pot avea boli autoimune, precum lupus eritematos sistemic (LES) sau sindrom Sjögren, aproximativ jumătate dintre mame sunt asimptomatice la momentul diagnosticării LN. Testarea serului matern relevă titruri pozitive de anticorpi anti-Ro şi/sau anti-La, evaluate prin metoda ELISA(2). BAVC poate fi detectat in utero, la naştere sau în perioada neonatală. BAV poate fi complet (gradul III) sau incomplet (gradul I sau II) (figura 1).Patogenie. Mecanismul de producere a LN nu este pe deplin înţeles. Studii recente au evidenţiat că, la aproximativ 12 săptămâni de gestaţie, anticorpii materni de tip IgG împotriva riboproteinelor intracelulare Ro şi La sunt transportaţi activ prin placentă şi se fixează specific pe celulele ţesutului cardiac fetal de conducere, producând inflamaţie şi ulterior cicatrizare şi fibroză. Există, de asemenea, un element de maturare a sistemului imun fetal implicat în dezvoltarea bolii imune fetale. Mecanismul cardiomiopatiei tardive după naştere este necunoscut(2).
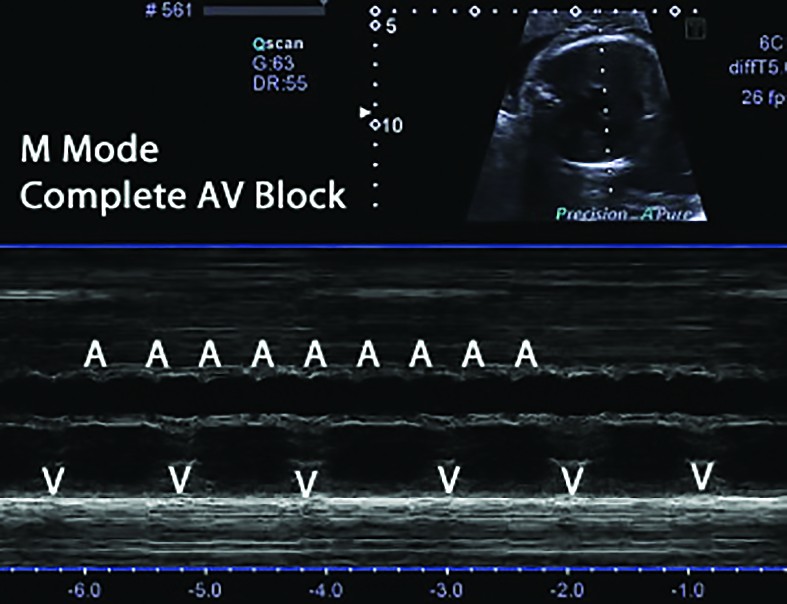
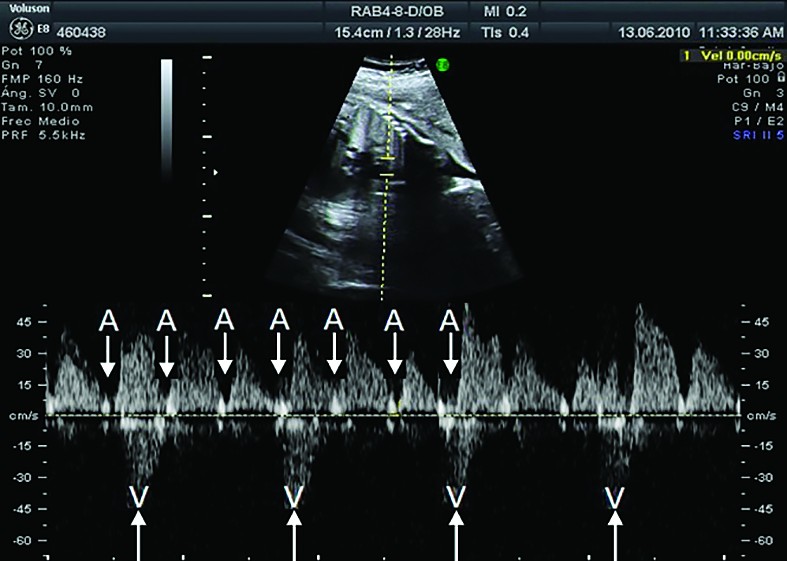
Diagnosticul fetal - BAVC se detectează in utero fie prin auscultaţie, fie la examenul ecocardiografic de rutină în sarcinile cu risc scăzut. Ecocardiografia fetală bidimensională M-mod şi tehnica Doppler confirmă şi stabilesc gradul de BAV, precum şi modificările secundare dilataţiei cardiace (regurgitaţie tricuspidiană, pericardită, hidrops fetal) şi exclud anomalii cardiace majore responsabile de BAV fără anticorpi (isomerism atrial stâng, cu sau fără defect septal atrioventricular, inversiune ventriculară)(2) (figurile 2 şi 3). Serul matern va fi testat prin metoda ELISA pentru depistarea de anticorpi anti-Ro şi/sau anti-La(1,2). La femeile gravide cu Ac anti-Ro/La se indică ecocardiografii fetale Doppler, seriate, la cel puţin două săptămâni, începând din săptămâna a 16-a de sarcină, pentru a determina intervalul PR mecanic şi a identifica BAV reversibil(1,6,8). Grupul cu risc crescut este reprezentat de acele mame cu titru crescut de anticorpi anti-Ro/La, precum şi acelea cu sarcini anterior afectate.
Opţiuni terapeutice. Tratamentul BAV diagnosticat in utero nu este bine stabilit. Nu se indică terapie profilactică, ci doar monitorizare prin ecocardiografii seriate în cazul sarcinilor cu risc. În prezenţa simptomelor de alarmă sunt indicate: betametazona/dexametazona şi/sau imunoglobuline intravenoase, precum şi simpatomimetice în cazul unei rate ventriculare fetale <50-55 bpm. Terapii mai agresive sunt considerate plasmafereza şi pacing in utero. Evoluţia BAVC se face prin ecografii săptămânale şi se impune naşterea electivă prin cezariaă la 36-37 de săptămâni sau mai devreme dacă se evidenţiază apariţia complicaţiilor cardiace(8).
După naştere, tratamentul este în principal simptomatic şi de susţinere cardiacă. În BAVC de tipul I, tratamentul constă în administrarea de atropină, care creşte temporar conducerea atrioventriculară. O abordare terapeutică mai agresivă prin implantare de pacing temporar sau permanent se indică în cazurile care nu răspund la terapia medicală.
Prognostic şi mortalitate. Severitatea BAV complet este ilustrată de rata de mortalitate de 20% şi de necesitatea implantării de pacemaker permanent la 60% dintre supravieţuitori, adesea în primul an de viaţă(2,12). Rata de supravieţuire la nou-născuţii cu BAV congenital este de 85%, în absenţa anomaliilor cardiace structurale(2).
Rata de mortalitate crescută se înregistrează la fetuşii diagnosticaţi in utero cu hidrops fetal. Pacienţii cu BAVC care au asociate boli cardiace structurale au o rată crescută de morbiditate şi mortalitate, mai ales ca urmare a afecţiunii cardiace în sine, decât a necesităţii unui pacemaker(2). Cardiomiopatia tardivă este asociată cu BAVC de cauză imună în 5-11% din cazuri(5).
Prezentare de caz
Prezentăm cazul unui nou-născut la termen - AGA, sex masculin, BIII Rh pozitiv, născut în Clinica de Obstetrică şi Ginecologie a Spitalului Universitar de Urgenţă „Elias”, prin operaţie cezariană, cu prezentaţie craniană deflectată, circulară pericervicală strânsă de cordon, vârsta de gestaţie 40 de săptămâni, Scor Apgar 9, greutatea la naştere 3140 g, membrane intacte, contracţii uterine dureroase, lichid amniotic normal, provenit din sarcină bine urmărită şi investigată, cu evoluţie normală, screening infecţios negativ, în afara unei infecţii de tract urinar cu E. coli la 35 săptămâni de sarcină, tratată şi vindecată. Mama are 32 de ani, IIIG, IIP, grup sangvin OI, Rh pozitiv, incompatibilitate de grup sangvin fără anticorpi, fără antecedente de boli autoimune, primul copil cu adaptare bună neonatală şi afirmativ sănătos. Fără alte antecedente heredocolaterale semnificative.Evoluţie în maternitate:
- Adaptare neonatală bună în primele 30 de ore de viaţă, apoi starea generală se modifică prin apariţia vărsăturilor „în zaţ de cafea” şi cu sânge proaspăt. Nou-născutul, transferat şi monitorizat în secţia de Terapie Intensivă Neonatală, se menţine rozat şi echilibrat cardio-respirator, iar paraclinic se înregistrează: echilibru acido-bazic şi schimburi respiratorii bune, hemogramă normală (Hb 15,5g%, Ht 43,9%, L=17470/mmc, PMN 10440/mmc, Tr 190000/mmc), ionogramă normală, CRP crescut (22,6 mg/L), hemocultură negativă, radiografie abdominală pe gol neconcludentă. Se instituie tratament cu spălături gastrice cu soluţie salină izotonică, hemostatice, vitamina K, plasmă proaspătă congelată, concentrat de factor VIIa recombinant de coagulare, medicaţie vasopresoare - dopamină 5 ug/kg/min, antisecretorii gastrice - ranitidină, antibioterapie empirică cu meroponem şi gentamicină.
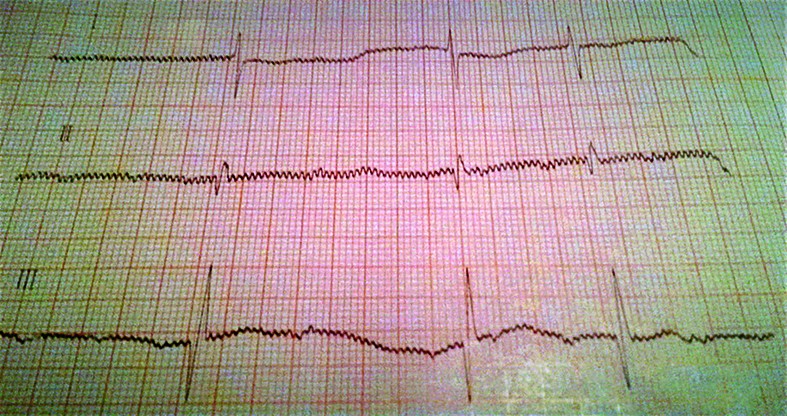
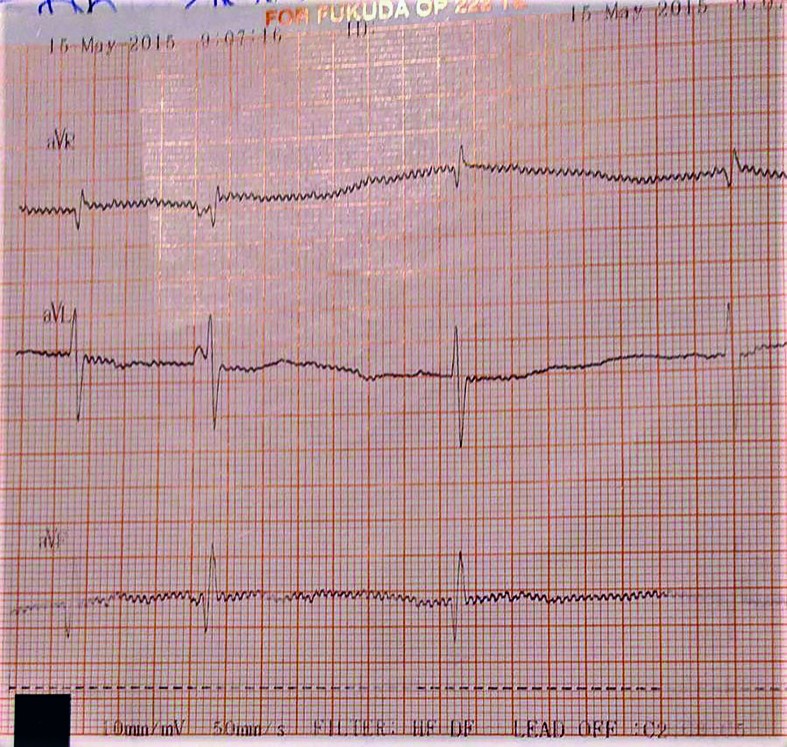
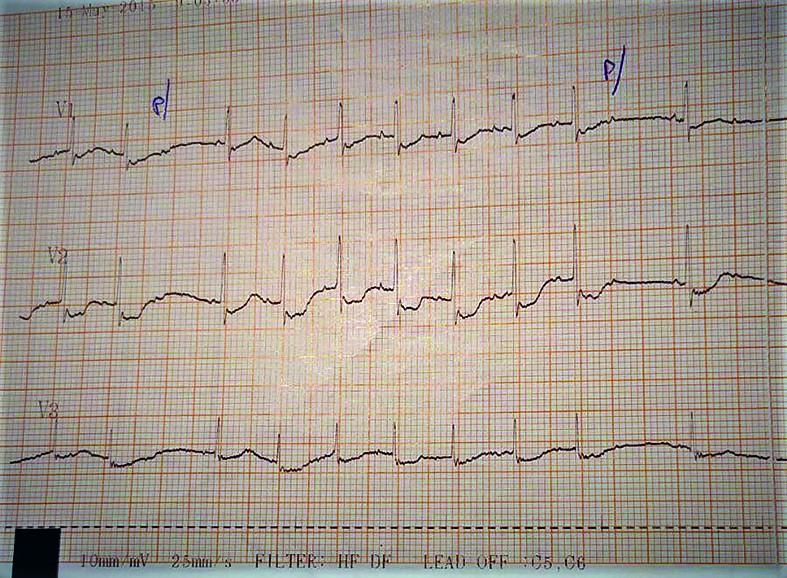
- La 36 de ore de viaţă, sângerarea digestivă este în continuare prezentă şi se exteriorizează pe sonda nazogastrică şi prin vărsătură „în zaţ de cafea” şi cu sânge proaspăt. Tegumentele şi mucoasele devin discret palide, timpul de recolorare capilară (TRC) întârziat la 4 secunde şi apare bradicardia cu ritm neregulat - AV cu tendinţă la scădere către 60-65 bpm în repaus, creşte până la 130 bpm în perioadele de activitate. TA şi SpO2 se menţin bune; apare suflu sistolic gradul II-III/VI parasternal stâng, uşoară alcaloză respiratorie. Traseu EKG: BAV gradul II (figurile 4-6) - ritm sinusal cu AV 150 bpm, BAV grad II Mobitz 1 cu perioade Wechenbach variabile la începutul traseului şi BAV grad II Mobitz 2 spre sfârşitul traseului, cu modificări primare difuze de repolarizare ventriculare antero-lateral întins.
- Hemograma se menţine în limite normale, ionograma serică - Na şi K uşor crescute, se normalizează rapid; Ca şi Mg serice normale; probe de coagulare - APTT1 scăzut la 23,7 secunde (normal: 42,9 +/- 5,8 secunde). Examen ETF normal. S-au administrat atropină 0,1 mg/kg/doză, pentru creşterea conducerii atrioventriculare, şi imunoglobuline nespecifice intravenoase, 0,5 g/kg/doză, pentru neutralizarea şi accelerarea clearance-ului autoanticorpilor imuni.
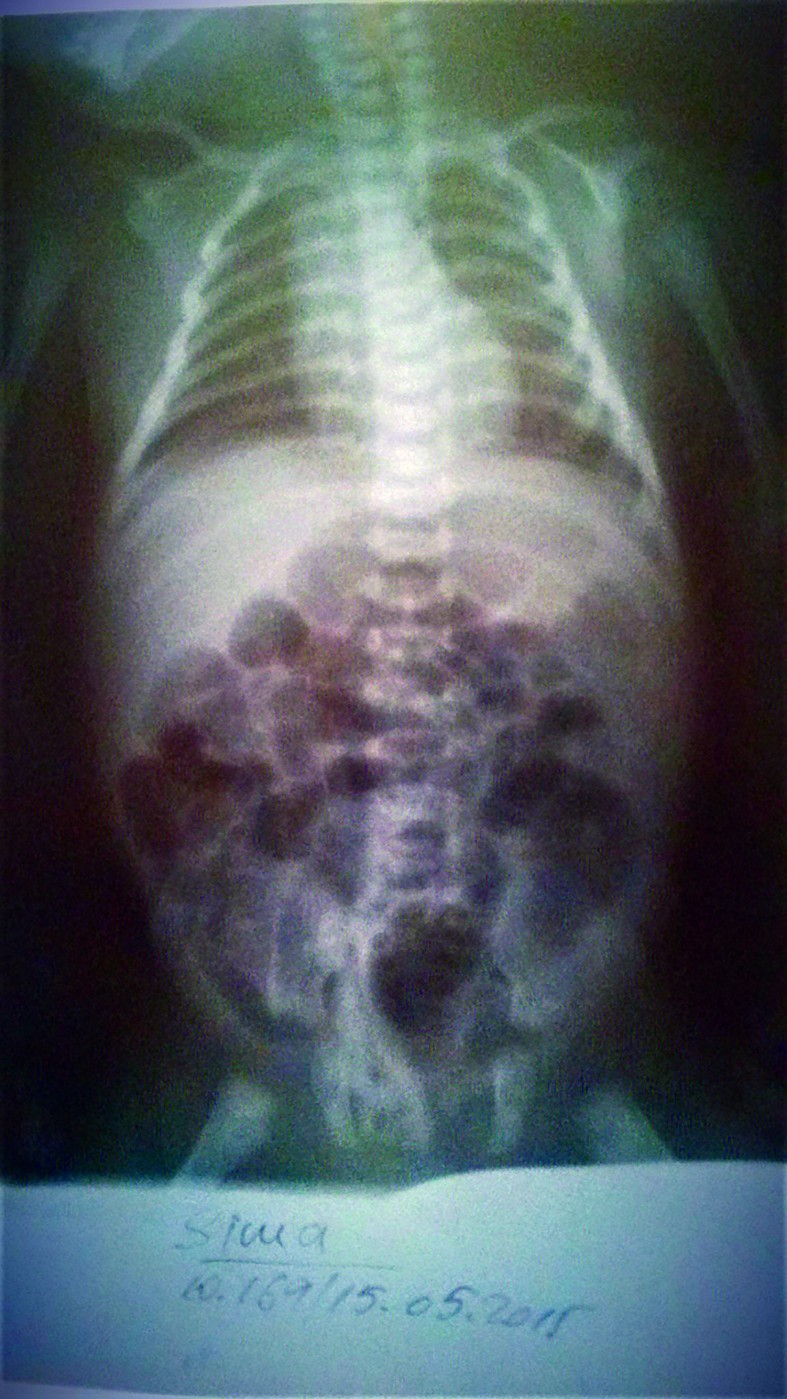
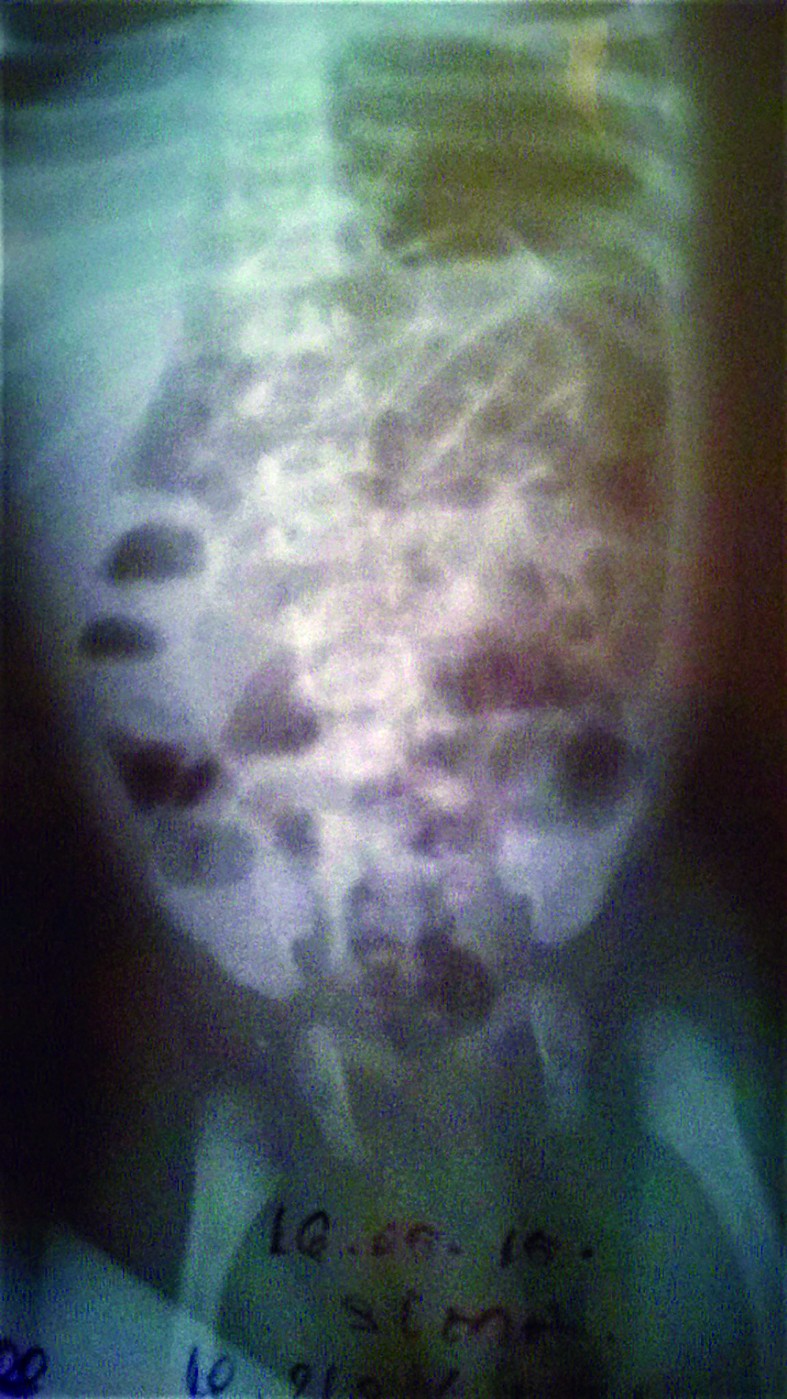
- La 60 ore de viaţă, starea generală se agravează prin apariţia scaunului melenic însoţit de vărsătură „în zaţ de cafea”, febră 38,6 °C, care cedează lent la antitermice, tegumentele şi mucoasele devin palide, TRC 4 secunde, desaturare până la 70%, se menţine bradiaritmia - AV scade până la 67-70 bpm şi creşte la 120 bpm la stimulare, hipotonie, hiporeactivitate. Manifestări clinice sugestive pentru enterocolită ulcero-necrotică (EUN) la debut (abdomen mult destins de volum, meteorizat), susţinute şi de modificările radiologice abdominale (figurile 7-8) - distensie abdominală marcantă, niveluri hidroaerice în hipocondrul şi flancul drept, aerocolie stângă marcantă, fără pneumoperitoneu.
- Evoluţie favorabilă sub tratament, iar la şase zile de viaţă: traseu EKG normalizat, AV 100-120 bpm, scade până la 80 bpm în repaus, ritm regulat, hemogramă normalizată - Hb 14,3 g%, Ht 41,5%, L 10870/mmc, N 3050/mmc, Tr 150000/mmc; ionograma serică normală, CRP normal.
- După ziua a şaptea de viaţă, AV se menţine >90 bpm, în jur de 110-120 bpm, ritm regulat, şi nou-născutul este externat clinic sănătos la 12 zile de viaţă. La externare, nou-născutul este examinat ecocardiografic în Serviciul de Cardiologie Pediatrică al Spitalului „M.S. Curie” şi rezultatul confirmă vindecarea tulburării de ritm şi lipsa instalării complicaţiilor cardiace.
Discuţii
În acest caz, drept cauză a BAV s-a suspicionat încă de la început lupusul neonatal congenital şi pentru confirmarea diagnosticului s-a recurs la dozarea anticorpilor autoimuni în serul mamei: anti-Ro/SS-A şi anti-La/SS-B, care au fost prezenţi. Astfel s-a putut stabili diagnosticul pozitiv: 1. Lupus neonatal congenital (BAV grad I şi II) 2. Hemoragie digestivă superioară 3. Debut de enterocolita ulceronecrotică. Dacă afectarea cardiacă datorată BAVC imun nu a pus probleme deosebite de tratament, prin natura caracterului reversibil al blocului atrioventricular, şi prognosticul afecţiunii a fost considerat bun datorită absenţei anomaliilor cardiace asociate, aşa cum au evidenţiat morfologiile fetale; în schimb, manifestările repetate de hemoragie digestivă superioară, precum şi cele de distensie marcantă abdominală au complicat evoluţia şi atitudinea terapeutică în acest caz.
Concluzii
BAVC apare în aproximativ 2-3% dintre sarcinile mamelor cu anticorpi anti-Ro/La, independent de statusul matern, şi în aproximativ 18% dintre sarcinile care urmează naşterii unui copil afectat de LN. Pentru monitorizarea sarcinilor cu risc crescut, se recomandă ecocardiografii seriate prin care se măsoară intervalul PR, pentru a identifica la timp apariţia BAV de grad I sau II, reversibile şi permiţând oportunităţi precoce de intervenţie terapeutică. Tratamentul BAV identificat in utero nu este încă bine stabilit, existând câteva scheme terapeutice acceptate(1). Diagnosticul precoce şi managementul prompt în cazul BAVC sunt importante pentru prevenirea instalării BAVC ireversibil şi a apariţiei complicaţiilor cardiace. Nou-născuţii cu BAV congenital au morbiditate şi mortalitate ridicată, dar acest rezultat poate fi îmbunătăţit printr-o diagnosticare precoce asociată cu o terapie agresivă.Bibliografie
2. DM Friedman, LJ Duncanson, J Glickstein, JP Buyon. A review of congenital heart block, Images Paediatr Cardiol. 2003 Jul-Sep; 5(3): 36–48.
3. Kertesz NJ, Fenrich AL, Friedman RA. Congenital complete atrioventricular block. Texas Heart Inst J. 1997; 24:301–307.
4. Jaeggi ET, Hamilton RM, Silverman ED, Zamora SA, Hornberger LK. Outcome of children with fetal, neonatal or childhood diagnosis of isolated congenital atrioventricular block. J Am Coll Cardiol. 2002; 39:130–137.
5. Moak JP, Barron KS, Hougen TJ, et al. Congenital heart block: development of late-onset cardiomyopathy, a previously underappreciated sequela. J Am Coll Cardiol. 2001; 37:238–242.
6. Glickstein JS, Buyon JP, Friedman D. Pulsed Doppler echocardiographic assessment of the fetal PR interval. Am J Cardiology. 2000; 86:236–239.
7. Brucato A. Prevention of congenital heart block in children of SSA-positive mothers, Rheumatology, 2008 Jun; 47 Suppl 3.
8. Ayse Yildirim, F Sedef Tunaodlu and Aysu Türkmen Karaadaç. Neonatal Congenital Heart Block, Indian Pediatrics, vol. 50, May 2013, 483-488.
9. Mahmoud A. Kiblawi, Alina Naeem, Elham A. Al Attrash, Subhranshu Kar, B.K.M. Goud Complete Congenital Heart Block in a Newborn Associated with Maternal Systemic Lupus Erythematosus: A Case Report, International Journal of Medical Students, vol. 1, no. 3, 2013.
10. Samo Vesel, Uros Mazic, Tanja Blejec, and Tomaz Podnar. First-Degree Heart Block in the Fetus of an Anti-SSA/Ro-Positive Mother. Reversal after a Short Course of Dexamethasone Treatment, Arthritis & Rheumatism, Volume 50, Issue 7, 2004.
11. Matthew Cauldwell, Catherine Nelson-Piercy. Maternal and fetal complications of systemic lupus erythematosus, TOG, Volume 14, Issue 3, July 2012.
12. Brito-Zerón P, Izmirly PM, Ramos-Casals M, Buyon. JP, Khamashta MA. The clinical spectrum of autoimmune congenital heart block. Nat Rev Rheumatol. 2015 May; 11(5):301-12.
13. http://www.elsevier.es/ficheros/publicaciones
14. http://www.elsevier.es/ficheors/publicaciones
Articole din ediţiile anterioare
Artrogripoza la un nou-născut prematur provenit din sarcină gemelară. Prezentare de caz
Artrogripoza congenitală multiplă (AMC) este caracterizată în literatura de specialitate de multiple contracturi articulare congenitale la nou-născ...
Infecţia herpetică neonatală – review
Autorii trec în revistă epidemiologia, etiologia, incidenţa, tabloul clinic, diagnosticul şi diagnosticul diferenţial al infecţiilor herpetice neon...
Sindromul Prader-Willi - prezentare de caz şi revizuirea literaturii
Sindromul Prader-Willi este consecinţa mai multor defecte genetice în regiunea 15q11-q13, între care şi modificările de metilare, şi este asociat l...
Managementul durerii la nou-născut
Progresele efectuate în ultimii ani au stabilit că nou-născutul poate experimenta durere acută sau cronică, iar managementul corect are beneficii a...