Beneficiile preparatelor antihipertensive la pacienţii cu hipertensiune arterială şi glaucom
The benefits of antihypertensive drugs in patients with high blood pressure and glaucoma
Abstract
Systemic hypertension, atherosclerosis and vasospasm have been recognized as potential factors that are capable of increasing the risk of glaucoma. Several other factors may contribute to the development and progression of the disease, including systemic drugs used to treat other pathologies. Numerous studies have examined the effect of antihypertensive medication on glaucoma, due to their property of modifying vascular events. Effective hypotensive drugs that lower blood pressure reduce the complications of high blood pressure, including changes in intraocular pressure (IOP). It has been shown that the most significant decrease in IOP was registered in patients taking calcium channel blockers, beta-adrenoblockers, angiotensin converting enzyme inhibitors, angiotensin receptor blockers and diuretics. The renin-angiotensin system plays a critical role in the pathophysiology of various ocular diseases by causing inflammation, oxidative stress and angiogenesis. All components are currently present in eye structures and play an important role in ocular pathology: diabetic retinopathy, age-related macular degeneration, glaucoma, retinitis pigmentosa. The use of angiotensin converting enzyme inhibitors and angiotensin receptor blockers reduces the formation of aqueous humor, increases uveoscleral flow, reduces intraocular pressure and has a protective effect by reducing the inflammatory process, oxidative stress and angiogenesis.Keywords
antihypertensive drugsglaucomacalcium channel blockersbeta-adrenoblockersangiotensin converting enzyme inhibitorsangiotensin receptor blockersdiureticsRezumat
Hipertensiunea arterială sistemică, ateroscleroza şi spasmul vascular au fost recunoscute ca factori potenţiali capabili să crească riscul de glaucom. Mai mulţi factori pot contribui la dezvoltarea şi progresia bolii, inclusiv medicamentele sistemice utilizate pentru tratarea altor patologii. Numeroase studii au examinat efectul preparatelor antihipertensive asupra glaucomului, deoarece aceste medicamente sunt capabile să modifice evenimentele vasculare. Medicamentele hipotensive eficiente pentru scăderea tensiunii arteriale reduc complicaţiile hipertensiunii arteriale, inclusiv modificările presiunii intraoculare (PIO). S-a demonstrat că cea mai semnificativă scădere a PIO a fost la pacienţii care au administrat blocante ale canalelor de calciu, beta-adrenoblocante, inhibitori ai enzimei de conversie a angiotensinei, blocante ale receptorilor angiotensinici şi diuretice. Sistemul renină-angiotensină joacă un rol critic în patofiziologia diferitelor boli oculare prin inducerea inflamaţiei, a stresului oxidativ şi a angiogenezei. Toate componentele sunt prezente în structurile oculare şi joacă un rol important în patologia oculară: retinopatie diabetică, degenerescenţă maculară legată de vârstă, glaucom, retinită pigmentară. Utilizarea inhibitorilor enzimei de conversie a angiotensinei şi blocantelor receptorilor angiotensinici reduce formarea umorii apoase, creşte fluxul uveoscleral, reduce presiunea intraoculară şi are un efect protector prin reducerea procesului inflamator, a stresului oxidativ şi a angiogenezei.Cuvinte Cheie
medicamente antihipertensiveglaucomblocante ale canalelor de calciubeta-adrenoblocanteinhibitori ai enzimei de conversie a angiotensineiblocante ale receptorilor angiotensinicidiureticeLa nivel mondial, glaucomul este principala cauză a pierderii ireversibile a văzului. Conform raportului Organizaţiei Mondiale a Sănătăţii (OMS), s-a estimat că aproximativ 3,2 milioane de persoane şi-au pierdut vederea din cauza glaucomului. Glaucomul este definit în general ca o neuropatie optică ce este caracterizată de deteriorarea celulelor ganglionare retiniene (CGR) în stratul central intern, asociată cu afectarea nervului optic şi pierderea câmpului vizual, care poate fi sau nu însoţită de o creştere a presiunii intraoculare (PIO). Glaucomul se datorează lezării nervului optic şi creşterii presiunii intraoculare şi determină pierderea câmpului vizual periferic, apoi a celui central şi în cele din urmă duce la vederea în tunel. Patologia, pe baza morfologiei unghiului iridocorneal, este subdivizată în glaucom cu unghi deschis (GUD) şi glaucom cu unghi închis. Creşterea presiunii intraoculare este considerată cel mai critic factor de risc. Echilibrul dintre producerea de umoare apoasă de către corpul ciliar şi drenajul prin căile trabeculare şi uveosclerale este un mecanism care menţine stabilitatea PIO. Menţinerea stabilităţii presiunii intraoculare este o provocare pentru a răspunde la problema orbirii cauzate de glaucom. Singurul tratament disponibil este scăderea PIO prin mijloace farmacologice sau chirurgicale, care s-a dovedit eficientă în încetinirea progresiei glaucomului, dar mulţi pacienţi prezintă intoleranţă sau nu răspund la medicamentele disponibile. În plus, glaucomul se poate dezvolta în absenţa creşterii PIO detectabile clinic. Prin urmare, concomitent cu dezvoltarea de noi medicamente care scad PIO, sunt necesare noi abordări neuroprotectoare ale glaucomului, independent de scăderea PIO(1,4,9).
Hipertensiunea arterială (HTA), datorată creşterii tensiunii arteriale sistemice (TA), atât diastolică (TAD), cât şi/sau sistolică (TAS), este asociată cu morbidităţi precum accidentul vascular cerebral, bolile cardiovasculare, renale sau oculare. Factorii de risc vascular, precum HTA, ateroscleroza şi spasmul vascular, au fost recunoscuţi ca factori potenţiali capabili să crească riscul de glaucom primar cu unghi deschis (GPUD) şi de glaucom de tensiune normală (GTN). Rezultatele mai multor studii indică faptul că există o relaţie semnificativă între hipertensiune arterială (HTA) şi PIO, iar HTA este un factor de risc semnificativ pentru progresia glaucomului. Mai multe studii epidemiologice au raportat că o creştere a TA sistemice este asociată cu o uşoară creştere a PIO. Acest lucru se datorează faptului că majorarea TA creşte presiunea venoasă a episclerei, astfel încât clearance-ul apos (excreţia umorii apoase) va scădea, ceea ce va determina o creştere a PIO. S-a emis ipoteza că TA, în comparaţie cu PIO, determină o presiune de perfuzie oculară scăzută a nervului optic, modificări ale discului glaucomat şi pierderea câmpului vizual. Creşterea constantă a TA determină modificări aterosclerotice şi ale lumenului arteriolelor precapilare, cu creşterea rezistenţei la fluxul sangvin şi la o perfuzie redusă. Presiunea de perfuzie oculară (PPO) este determinată de diferenţa dintre TA arterială şi cea venoasă. Diminuarea PPO este asociată cu scăderea circulaţiei şi a aportului de substanţe nutritive către discul nervului optic, declanşând ischemia acestuia, cu reducerea transmiterii fluxului axoplasmatic şi cu stază. Mai multe studii au raportat că, pentru fiecare creştere cu 1 mm a presiunii de perfuzie, PIO va creşte cu 1 mm. Se estimează că HTA şi PIO crescută au mecanisme fiziopatologice comune. Presiunea intraoculară este afectată de creşterea TA sistemice. În HTA şi în glaucom, creşterea TA, în special sistolice, majorează presiunea de perfuzie a arterei ciliare, care determină o filtrare crescută a lichidului apos prin corpul ciliar, cu creşterea PIO. Creşterea TA afectează şi presiunea venoasă episclerală care reglează fluxul apos prin reţeaua trabeculară prin canalul Schlemm. Concomitent, s-a constatat că TAD crescută a cauzat frecvent creşterea PIO. Un proces biochimic comun în apariţia HTA şi a glaucomului s-a dovedit a fi transportul alterat de sodiu în tubii contorţi distali ai nefronului şi în epiteliul ciliar mediat de receptorii gluco- şi mineralocorticoizi şi enzima 11β-hidroxisteroid dehidrogenază. Vârsta este un factor de risc comun în dezvoltarea glaucomului primar cu unghi deschis şi a HTA. Cu toate acestea, relaţia dintre TA şi incidenţa glaucomului este încă în dezbatere. Unele studii raportează că nu există o corelaţie între TA sistemică cu PIO şi incidenţa glaucomului. Alte studii au raportat că, la pacienţii mai tineri, HTA a avut un efect protector prin creşterea presiunii de perfuzie oculară(1,3,5,6,7,9,10).
La pacienţii cu HTA, cel mai frecvent s-a depistat hipertensiunea oculară (HTO), urmată de glaucomul primar cu unghi deschis (GPUD) şi glaucomul cu tensiune normală (GTN). Modificările predominante ale fundului de ochi la pacienţii cu HTO au fost creşterea discului nervului optic şi subţierea neuroretiniană, iar analiza câmpului vizual a evidenţiat scotoame izolate. Concomitent, mai frecvent s-a constatat îngroşarea corneei. Presiunea intraoculară, ca un factor de risc important, este singurul factor tratabil în glaucom care poate preveni secundar progresia modificărilor discului nervului optic sau a câmpului vizual(1).
Analiza literaturii a relevat date contradictorii referitoare la corelaţia dintre GPUD şi HTA. Literatura recentă sugerează că determinarea presiunii de perfuzie oculară este un parametru extrem de relevant la pacienţii cu CUD, iar fluctuaţiile acesteia sunt un factor cunoscut care contribuie la dezvoltarea modificărilor discului glaucomat la persoanele cu GPUD, cunoscut sub denumirea de glaucom cu tensiune normală. S-a observat că persoanele care administrează medicamente antihipertensive pot avea de două-trei ori mai multe şanse de a fi afectate de glaucom, în funcţie de doza de seară a antihipertensivelor, care provoacă o scădere a TA nocturne şi, respectiv, o reducere a PPO, cu modificări glaucomatoase. S-a descoperit o corelaţie pozitivă între TA şi PIO, iar disfuncţia circadiană a TA, a presiunii de perfuzie oculară şi a fluxului sangvin ocular este un factor de risc important pentru severitatea glaucomului. Studiile imagistice ale fluxului sangvin ocular au arătat anomalii vasculare, precum indicele de rezistivitate alterat al arterei oftalmice la pacienţii cu glaucom(3,7,12).
Pacienţii cu glaucom cu PIO normală – cunoscut sub numele de glaucom cu tensiune normală (GTN) – au caracteristici clinice distincte asociate cu dereglarea vasculară. Conform mai multor studii, hipotensiunea ortostatică, hipotensiunea arterială sistemică, fenomenul Raynaud şi migrena sunt frecvente la pacienţii cu GTN. Fluctuaţia TA sistolice este un factor care contribuie la dezvoltarea glaucomului cu unghi deschis cu PIO normală, care susţine asocierea instabilităţii hemodinamice sistemice cu GTN. Sistemul renină-angiotensină-aldosteron (SRAA) este important pentru reglarea stabilităţii hemodinamice şi a volumului lichidului din organism. Hipotensiunea arterială activează SRAA, cu eliberarea reninei din rinichi şi transformarea angiotensinogenului în angiotensină II (Ang II), care determină menţinerea unui volum constant de lichid în organism. S-a emis ipoteza că pacienţii cu GTN cu o probabilitate mare de instabilitate hemodinamică ar putea avea o funcţie alterată a SRAA în comparaţie cu persoanele normale. Cu acest scop, s-au studiat caracteristicile hemodinamice sistemice asociate cu funcţia SRAA la pacienţii cu GTN, prin determinarea nivelului de renină şi Ang II în sânge. În cadrul studiului, la pacienţii cu GTN s-a constatat o creştere semnificativă a concentraţiei reninei şi una neesenţială a AngII, care a identificat o legătură între funcţionarea sistemică a SRAA şi GTN şi a arătat un model diferit la pacienţii cu GTN în comparaţie cu pacienţii normali. La persoanele sănătoase, fluxul sangvin retinian este mediat de celulele endoteliale, deoarece nu există inervaţie a sistemului nervos autonom. AngII este unul dintre mediatorii care controlează contracţia şi relaxarea endoteliului vascular şi joacă un rol în reglarea microcirculaţiei oftalmice. O dereglare a permeabilităţii barierei hematoencefalice a discului nervului optic în glaucom ar permite trecerea componentelor sistemice ale SRAA, cu influenţarea microcirculaţiei retiniene. Concomitent, s-a raportat că SRAA local este un sistem care menţine homeostazia ţesutului şi ar putea avea o legătură între dereglarea vasculară şi moartea CGR asociată neuroinflamaţiei în glaucom(6).
Obiectivele tratamentului pentru GUD s-au concentrat aproape exclusiv pe scăderea PIO folosind medicamente, terapie cu laser sau intervenţii chirurgicale. Cu toate acestea, mulţi cercetători susţin că PIO nu este singurul factor cauzal de modificări ale nervului optic şi că unii factori care nu au legătură cu PIO joacă un rol semnificativ în cel puţin unele cazuri de GTN. Pacienţii cu glaucom la care PIO este scăzută în limitele normale continuă adesea să prezinte dereglări progresive ale glaucomului. Un studiu de monitorizare de 10 ani a arătat o corelaţie directă între nivelurile PIO şi stabilizarea discului nervului optic şi a câmpului vizual, dar aproximativ 10% dintre pacienţii cu o PIO finală medie în limitele normale au continuat să prezinte progresia bolii(5).
Medicamentele hipotensive eficiente în scăderea TA reduc complicaţiile HTA, inclusiv ducând la modificări ale PIO. S-a constatat că medicamentele antihipertensive au efect benefic în controlul PIO şi nu au fost asociate cu un risc crescut de GUD, iar presiunea de perfuzie oculară are un efect semnificativ asupra PIO. S-a demonstrat că scăderea cea mai semnificativă a PIO a fost în rândul pacienţilor care au administrat blocante ale canalelor de calciu (BCC), urmate de beta-adrenoblocante (BAB), inhibitorii enzimei de conversie a angiotensinei (IECA), blocante ale receptorilor angiotensinici (BRA) şi de diuretice. Cunoaşterea efectului asupra PIO al medicamentelor antihipertensive va fi utilă la selectarea acestora pentru tratamentul maladiilor cardiovasculare sau al altor boli sistemice. Studiile au demonstrat că BAB au avut un efect protector pentru glaucom şi HTA. Concomitent, BAB sistemice sunt un alt factor important care ar trebui luat în considerare, deoarece pot masca o PIO crescută, ceea ce face dificil un diagnostic de glaucom. Beta-adrenoblocantele nu sunt preferate în blocurile cardiace sau în bolile pulmonare obstructive, iar în asemenea situaţii sunt utilizaţi IECA, BCC fiind de obicei preparate de linia a doua. Este necesar de luat în considerare faptul că BAB topice, utilizate în gestionarea glaucomului, nu sunt eficiente la cei cu BAB sistemice şi, prin urmare, tratamentul va trebui să fie titrat. S-a observat că BCC au avut cea mai mică implicare în ischemia discului nervului optic, iar BAB au înregistrat cele mai scăzute valori ale PIO. Blocantele canalelor de calciu şi BAB în combinaţie cu BCC pot creşte fluxul sangvin ocular şi pot juca astfel un efect neuroprotector prin reducerea apoptozei neuronilor. S-a constatat că IECA, prescrişi pe scară largă ca agenţi antihipertensivi, au determinat o reducere a PIO numai la utilizarea pe termen lung (mai mare de un an). Există un risc crescut de glaucom atât în cazul TA crescute, cât şi reduse. Medicamentele care scad TA pot creşte uneori incidenţa glaucomului ca urmare a efectelor specifice asupra discului nervului optic. S-a sugerat că diverşi factori, precum relaţia dintre TA şi presiunea de perfuzie oculară, autoreglarea disfuncţională şi capacitatea vasculară periferică, pot influenţa incidenţa glaucomului(1,12).
Glaucomul se poate dezvolta pe fundalul mai multor boli care au ca rezultat neuropatia optică comună. S-a raportat asocierea glaucomului cu maladii vasculare sistemice, inclusiv HTA, hipotensiune arterială sistemică, scăderi nocturne tranzitorii ale TA, migrenă, spasme vasculare şi diabet zaharat. Mulţi pacienţi cu GUD prezintă tulburări vasculare coexistente, dintre care cea mai frecventă este HTA, constatată la 48% dintre pacienţii cu GUD. Tratamentul farmacologic al mecanismelor nondependente de PIO în glaucom a fost limitat în mare parte la utilizarea BCC, folosite frecvent în tratamentul HTA, al cardiopatiei ischemice, al tahiaritmiilor şi al accidentului vascular cerebral. Rezultatele studiilor pentru BCC sunt contradictorii, de la efecte pozitive până la absenţa diferenţei în progresia glaucomului la pacienţii care utilizează sau nu BCC. Blocantele canalelor de calciu, deşi pot creşte fluxul sangvin către discul nervului optic, sunt deosebit de utile la pacienţii cu GTN, dar pot avea efecte adverse cardiace, în special dacă pacientul este tratat cu BAB topice(5).
Tensiunea arterială crescută poate duce la creşterea PIO prin două mecanisme: creşterea producţiei de umoare apoasă, cauzată de majorarea presiunii capilare în corpul ciliar, respectiv a presiunii intravasculare şi gradientului PIO; scăderea absorbţiei umorii apoase din cauza creşterii presiunii venoase episclerale care obstrucţionează returul umorii apoase. Prin aceste mecanisme, HTA creşte PIO, ceea ce provoacă stres mecanic asupra lamei cribrose din segmentul posterior al ochiului şi determină deteriorarea axonilor şi a fibrelor nervului optic, cu dezvoltarea GUD. S-a raportat că, la pacienţii hipertensivi, leziunile glaucomatoase ar putea surveni din cauza ischemiei nervului optic sau a CGR ca urmare a scăderii presiunii de perfuzie. S-a raportat că HTA provoacă o îngustare a lumenului arterei centrale retiniene, care afectează fluxul către ochi, în special în discul nervului optic şi lamina cribrosa care declanşează glaucomul. Unele date relevă că la pacienţii mai tineri HTA exercită un efect protector prin creşterea presiunii de perfuzie oculară, dar acesta este temporar, deoarece efectul protector se pierde ca urmare a modificărilor morfologice ale vaselor cauzate de HTA sistemică prelungită, cu aprovizionarea deficitară cu oxigen şi substanţe nutritive. La pacienţii hipertensivi, o creştere constantă a TA duce la riscul de arterioscleroză şi de modificări ale dimensiunii arteriolare precapilare, cu creşterea rezistenţei la fluxul sangvin şi scăderea perfuziei în segmentul posterior al ochiului, contracarând astfel efectul protector care predomină la tineri. HTA reprezintă un factor de risc pentru glaucom prin mai multe mecanisme: prezenţa stresului mecanic pe lamina cribrosa ca urmare a creşterii PIO determinate de creşterea producţiei de umoare apoasă printr-o creştere a fluxului sangvin în corpul ciliar şi o scădere a absorbţiei umorii apoase din cauza creşterii presiunii venoase episclere; tulburări de autoreglare care rezultă dintr-un dezechilibru al nivelului de endotelină-1; îngustarea lumenului arterei centrale retiniene din cauza HTA cronice, care determină reducerea fluxului de sânge către ochi; incidenţa aterosclerozei în HTA cronică, ce are ca rezultat şi îngustarea lumenului arterei centrale retiniene (figura 1). S-a demonstrat că TAD mai mică a determinat o incidenţă mai mare a GUD decât TAD normală. S-a raportat că o scădere a presiunii de perfuzie diastolică a arătat o asociere semnificativă cu incidenţa GUD cu PIO>21 mm Hg. Aceasta este strâns legată de presiunea medie de perfuzie oculară (PPOM), care este gradientul de presiune dintre presiunea arterială medie (PAM) şi PIO. S-a concluzionat că PAM are o relaţie pozitivă cu PPOM, iar PIO are o relaţie negativă cu PPOM. Concomitent, s-a constatat că TAD are un efect de două ori mai mare decât TAS în calculul PAM, fapt care ar putea explica de ce o scădere a TAD poate avea un efect asupra reducerii presiunii de perfuzie în ochi, cu risc de GUD. Aceste rezultate conduc la presupunerea că persoanele care au TAD instabilă, fie ridicată, fie scăzută, pot avea un risc ridicat de evenimente GUD. Cu toate acestea, niciunul dintre studiile analizate nu a raportat o asociere specifică între TAS şi incidenţa GUD(9).
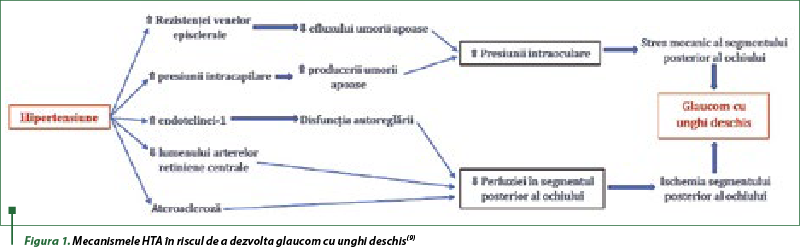
Un aspect separat în practica oftalmologică îl reprezintă GTN, care se referă la o modificare glaucomatoasă a discului nervului optic şi la defecte glaucomatoase ale câmpului vizual corespunzătoare fără creşterea PIO, iar reducerea PIO nu previne progresia la pacienţii cu GTN, indicând faptul că alţi factori decât PIO crescută sunt implicaţi în progresia glaucomului. Noile modalităţi de tratament aflate în cercetare includ agenţi care ar putea îmbunătăţi fluxul sangvin către ochi şi medicamente neuroprotectoare. Neuroprotecţia se referă la protecţia postlezională a neuronilor care iniţial nu au fost deterioraţi sau parţial deterioraţi, dar sunt expuşi riscului de stimuli toxici eliberaţi de celulele deteriorate, provocând degenerare secundară, care afectează neuroni aparent sănătoşi adiacenţi neuronilor lezaţi şi astfel expuşi mediului degenerativ care rezultă(5,6).
Utilizarea IECA şi a BRA în tratamentul glaucomului
Rolul SRA în procesele fiziologice şi patologice prezintă un interes din ce în ce mai mare, iar cel ocular merită o atenţie specială. Toate componentele SRA sunt constatate în prezent pe retină şi pe alte elemente ale ochiului, precum irisul, corneea etc. Manifestările maladiilor oculare apar mai ales în zona retinei şi sunt reflectate prin: retinopatie diabetică (RD), degenerescenţă maculară legată de vârstă (DMV), glaucom, retinită pigmentară. Confirmarea prezenţei SRA ocular şi afirmaţia că angiotensinogenul, Ang I şi Ang II din plasmă nu ar putea penetra în ochi induc concluzia că SRA are un rol imperativ în fiziopatologia oculară. Concentraţia Ang I şi II a fost de 5 până la 100 de ori mai mare decât ar putea fi explicată de difuziunea din sânge, ceea ce exclude influenţa semnificativă a SRA circulant asupra fiziopatologiei oculare. În retinopatia diabetică, activarea AT1R determină accelerarea procesului inflamator şi a angiogenezei. Utilizarea BRA permite obţinerea unui efect protector prin reducerea gradului de inflamaţie, a stresului oxidativ sau a angiogenezei. Utilizarea IECA a dus la o expresie redusă a FEVC, responsabil de angiogeneză. Stimularea AT1R reglează formarea umorii apoase, secreţia, fluxul uveoscleral şi PIO. Utilizarea IECA şi a BRA determină reducerea formării umorii apoase, creşterea fluxului uveoscleral şi reducerea PIO(13).
Inhibitorii enzimei de conversie a angiotensinei au atras recent atenţia ca o nouă clasă de medicamente pentru tratamentul glaucomului. S-a demonstrat că inhibitorii ECA scad PIO la pacienţii cu HTO sau GPUD. Unii autori au propus ipoteza de implicare a prostaglandinelor în efectul hipotensiv ocular al enalaprilatului, concluzie bazată pe constatarea că indometacina a blocat efectul de scădere a PIO al enalaprilatului. Inhibitorii ECA sunt, de asemenea, inhibitori ai kininazei II şi astfel previn inactivarea bradikininei, ale cărei niveluri crescute promovează sinteza prostaglandinelor, iar unele prostaglandine, în special PGF2α, cresc fluxul uveoscleral al umorii apoase. Bradikinina are o acţiune de protecţie împotriva neurotoxicităţii glutamatului prin B2-receptorii bradikininici din neuronii retinieni. S-a raportat că pacienţii cu GTN au fost mai sensibili la bradikinina exogenă decât subiecţii sănătoşi, ceea ce sugerează că nivelurile de bradikinină endogene pot fi mai mici la pacienţii cu GTN decât la cei sănătoşi. Se crede că enzima de conversie a angiotensinei I şi kininaza celulelor endoteliale reprezintă una şi aceeaşi enzimă, responsabilă de degradarea bradikininei. Astfel, IECA sunt capabili să prelungească timpul de înjumătăţire al oricărei bradikinine din apropierea endoteliului. Tratamentul pe termen lung cu IECA creşte nivelurile plasmatice de bradikinină. Acţiunea protectoare a bradikininei este mediată de deschiderea canalului mitocondrial de potasiu sensibil la adenozină trifosfat. Inhibarea degradării bradikininei de IECA poate creşte activitatea superoxid dismutazei (SOD) şi poate modula producţia de oxid nitric (NO), cu inactivarea speciilor reactive de oxigen (SRO), în acelaşi timp inhibând diferite mecanisme prooxidative din sistemului vascular. Niveluri mai scăzute de angiotensină II, observate în timpul tratamentului cu IECA, pot avea efecte benefice asupra funcţiei vasculare, prin scăderea producţiei vasculare de anioni superoxid. S-a raportat că IECA ar putea exercita efecte favorabile asupra câmpului vizual la pacienţii cu GTN datorită proprietăţilor care, teoretic, ar trebui să fie benefice în tratarea mecanismelor nondependente de PIO în glaucom(5).
La utilizarea topică a perindoprilului (sub formă de picături oftalmice 1%) s-a determinat diminuarea PIO la modelarea glaucomului acut şi cronic. Preparatul a manifestat un efect similar cu cel al pilocarpinei, iar pretratamentul cu indometacină nu a influenţat efectul perindoprilului. Inhibitorul enzimei de conversie a angiotensinei a inhibat activitatea colinesterazei şi pseudocolinesterazei, laolaltă cu inhibarea ECA, care poate constitui un mecanism de diminuare a PIO(8).
Retinopatia diabetică, caracterizată prin permeabilitate vasculară, progresează de la o formă uşoară neproliferativă la retinopatie diabetică neproliferativă moderată sau severă, în care vasele retiniene se închid, şi, în final, la retinopatie diabetică proliferativă, ce cuprinde angiogeneză, de obicei între retină şi suprafaţa posterioară a corpului vitros. Angiotensina II este un stimul cunoscut pentru exprimarea factorului endotelial vascular de creştere (FEVC), care este asociat cu inducerea neovascularizării retinei. Nivelurile vitroase atât ale angiotensinei II, cât şi ale FEVC sunt semnificativ mai mari în retinopatia diabetică proliferativă activă (RDP) decât în cea inactivă, ceea ce sugerează că angiotensina II poate fi implicată în progresia neovascularizării. În modelele experimentale cu diabet zaharat, inhibarea formării angiotensinei II prin inhibarea enzimei de conversie a angiotensinei (ECA) determină suprimarea expresiei FEVC. Nivelurile mai mari de FEVC în corpul vitros au fost la pacienţii cu RDP, decât la pacienţii fără diabet, care au fost reduse semnificativ după tratamentul cu IECA. Un număr tot mai mare de studii clinice şi experimentale sugerează că inhibarea SRA poate oferi efecte protectoare împotriva retinopatiei diabetice în absenţa hipertensiunii. Rolul SRA în retinopatia diabetică fără HTA a fost dovedit în studiile clinice, care au raportat că inhibarea ECA prin lisinopril şi enalapril a redus progresia retinopatie la pacienţii cu diabet de tip 1 şi la cei cu tip 2 care erau normotensivi. Aceste studii au arătat că o scădere a TA la pacienţii normotensivi cu diabet zaharat de tip 2 a fost asociată cu scăderea progresiei retinopatiei diabetice. Aceste rezultate pot sugera că reducerea TA în intervalul normotensiv ar putea contribui la scăderea progresiei retinopatiei diabetice, iar inhibarea SRA are efect asupra unui număr de factori circulanţi, inclusiv SRO, şi a citokinelor inflamatorii, care ar putea contribui indirect la efectele vasculare. În plus, întinderea mecanică poate activa receptorul angiotensinic tip 1 (AT1R) şi poate regla calea FEVC în celulele endoteliale retiniene, sugerând că TA poate afecta acţiunile AT1R. Blocantele receptorilor angiotensinici în condiţii experimentale au ameliorat fluxul sangvin afectat la nivelul discului nervului optic. Inhibitorii ECA pot creşte fluxul sangvin în ochi prin mai multe mecanisme. Bradikinina, în condiţii experimentale, s-a dovedit un activator puternic al căii L-argininei oxidului nitric de reglare locală al tonusului vascular cu relaxări pronunţate dependente de endoteliu în vasele sangvine izolate, care eliberează NO prin B2-receptorii şi creşte fluxul oftalmic în ochiul perfuzat izolat. Stimularea căii L-argininei oxidului nitric de către bradikinină determină inhibarea migrării şi proliferării celulelor musculaturii netede vasculare. Se presupune că Ang II joacă un rol în autoreglare miogenă, posibil prezentă în vascularizaţia coroidală. Astfel, blocarea receptorilor angiotensinici poate fi utilă pentru a preveni autoreglementarea anormală oculară la pacienţii cu SRA activat(5).
În glaucomul primar cu unghi deschis (GPUD), dereglările ischemice ale matricei celulare şi extracelulare în reţeaua trabeculară şi în canalul Schlemm au fost asociate cu creşterea PIO, ca urmare a modificărilor structurale şi a creşterii rezistenţei efluxului umorii apoase, cauzate de majorarea locală a nivelului de factor beta-2 transformator de creştere, care determină depunerea proteinelor şi creşterea rigidităţii în matricea extracelulară. Componentele SRA (renina, angiotensinogenul, Ang II, receptorii angiotensinici de tip 1), implicate în influenţarea hemodinamicii sistemice, pot fi responsabile de fibroză în mai multe ţesuturi, inclusiv în ochi. Astfel, s-a estimat că IECA şi BRA pot reduce PIO la pacienţii cu glaucom, iar în condiţii experimentale stimularea ECA2 prin diminazen a provocat o producţie de Ang1-7 cu reducerea PIO(11).
Un studiu observaţional a sugerat un efect cauzal, protector al medicamentelor antihipertensive, în special al celor cu influenţă asupra SRA, referitor la incidenţa glaucomului. S-a raportat că IECA şi BRA, prin reducerea nivelului Ang II sau blocarea acţiunii acestea, reduc activitatea complexului de oxidază dependent de NADPH şi, respectiv, stresul oxidativ şi apoptoza CGR. Concomitent, IECA, prin creşterea bradikininei în plasmă, oferă posibilităţi suplimentare: creşterea fluxului sangvin prin activarea căii L-argininei NO sau protecţie împotriva neurotoxicităţii induse de glutamat. Astfel, IECA şi BRA au redus semnificativ riscul de dezvoltare a GPUD sau al progresiei patologiei glaucomatoase, îndeosebi la pacienţii în vârstă. Efectele altor medicamente antihipertensive sunt mai puţin clare. S-a arătat că utilizarea medicamentelor antihipertensive a redus necesitatea de medicaţie topică adjuvantă pentru scăderea PIO, rezultate ce sugerează că clasele de medicamente AH ar putea contribui la evoluţia glaucomului prin mecanisme indiferente de efectul de scădere a TA, inclusiv de scădere a PIO, şi mecanisme neuroprotective suplimentare prin influenţarea SRA. S-a emis ipoteza că tratamentul antihipertensiv adecvat este benefic doar atunci când este început la timp şi este dăunător dacă este început după mulţi ani de HTA netratată. Totodată, tratamentul intensiv al HTA care duce la hipotensiune arterială poate fi ca un factor de risc pentru glaucom(10). Sistemul renină-angiotensină joacă un rol critic în reglarea TA, iar nivelul plasmatic crescut al Ang II determină creşterea TA, inducerea stresului oxidativ şi disfuncţia endotelială. În condiţii experimentale s-a demonstrat că Ang II induce un fenotip proinflamator prin infiltrarea monocitelor în peretele vascular şi prin creşterea nivelului speciilor reactive de oxigen (SRO), realizat prin intermediul receptorilor angiotensinici de tip 1 sau NADPH oxidaza fagocitară (NOX2). Concomitent, s-a demonstrat că disfuncţia endotelială şi vasculară progresează odată cu înaintarea în vârstă şi cu povara stresului oxidativ (reducerea activităţii enzimelor antioxidante mangan superoxid dismutazei sau glutation peroxidazei-1). Deteriorarea poate afecta, de asemenea, funcţia endotelială şi vasculară oftalmică. S-a demonstrat că Ang II prin receptorii angiotensinici, identificaţi pe vasele care alimentează retina şi nervul optic, pe lângă efectele sale asupra tonusului vascular, mediază diverse alte acţiuni patofiziologice, precum proliferarea şi migrarea celulelor musculare netede şi a pericitelor, absorbţia glucozei în pericitele retiniene, expresia factorului de creştere a endoteliului vascular (FCEV) şi potenţarea activităţii angiogenice induse de FCEV. S-a constatat că blocarea SRA stopează sau întârzie afectarea barierei sânge-retină şi previne neovascularizarea retiniană în retinopatia diabetică şi în retinopatia prematură. Efectele favorabile ale blocării SRA au fost raportate şi pentru degenerescenţa maculară legată de vârstă, uveita autoimună, leziunea de ischemie-reperfuzie şi glaucom(2).
În condiţii experimentale, s-a indus la şoareci glaucomul prin injectarea de microbile de polistiren în camera anterioară a ochiului, care s-a soldat cu creşterea PIO, pierderea numărului axonilor şi cu creşterea procentajului de axoni în nervii optici, care suferă degenerare. Telmisartanul a fost încorporat timp de 12 săptămâni în mâncarea pentru rozătoare în doză de 2 g/kg, concentraţie care în studiile anterioare a determinat o scădere a PIO şi o reducere a factorul de creştere transformant beta (TGFβ), semnalizarea în stratul CGR al retinei, precum şi scăderea TA la şoareci. Telmisartanul a redus cu 5,8% PIO în ochiul de control comparativ cu şoarecii trataţi cu vehicul, iar PIO medie pe parcursul experimentului nu a fost diferită între şoarecii trataţi cu vehicul şi cei trataţi cu telmisartan în ochiul cu glaucom, sugerând că preparatul nu a redus răspunsurile PIO la injectarea cu microbile. Blocantul receptorilor angiotensinici a prevenit în mare parte pierderea numărului axonilor şi creşterea procentajului de axoni în nervii optici care suferă degenerare, sugerând un efect neuroprotector al telmisartanului(4).
Blocantele receptorilor angiotensinici, medicamente utilizate în HTA, au fost investigate ca potenţiale tratamente pentru glaucom. S-a estimat că BRA reduc transducţia semnalului mediată de factorul de creştere transformant beta (TGFβ), care se crede că joacă un rol important în patogeneza glaucomului. În prezent, există o gamă variată de BRA pentru utilizare clinică (losartan, azilsartan, candesartan, eprosartan, irbesartan, olmesartan, telmisartan, valsartan), cu posibilele implicaţii în evoluţia glaucomului. Losartanul, în condiţii experimentale, a scăzut PIO crescută la iepuri, dar nu şi la şoareci. Preparatul, deşi nu a redus PIO, a diminuat degenerarea CGR la şoareci, sugerând un efect neuroprotector direct. S-a demonstrat că losartanul scade PIO la om, cu şi fără PIO crescută. În mod similar, candesartanul nu a afectat PIO într-un model de glaucom la şoarece şi şobolan, dar a protejat împotriva pierderii CGR, sugerând în continuare un efect neuroprotector pentru BRA, independent de scăderea PIO. Olmesartanul, pe modelele experimentale de glaucom, indus prin creşterea PIO, a demonstrat efecte de scădere a PIO(4).
Într-un studiu, s-au comparat capacităţile losartanului, irbesartanului şi ale telmisartanului de a scădea PIO şi de a suprima semnalizarea TGFβ în retina şoarecilor. Preparatele, încorporate în pelete de hrană solidă, au determinat concentraţii sistemice relevante cu scăderea TA. BRA au traversat barierele sânge‑creier şi sânge‑retină, sugerând că mecanismele directe de acţiunea în ochi sunt posibile folosind această metodă de administrare a medicamentului. Telmisartanul a determinat un grad mai mare de concentraţie în plasmă, creier şi ochi, în comparaţie cu celelalte BRA, probabil datorită naturii sale lipofile. S-a constatat că telmisartanul şi irbesartanul, dar nu losartanul, au scăzut PIO, iar telmisartan singur a suprimat semnalizarea TGFβ în CGR. Aceste date au sugerat că telmisartanul poate avea efecte benefice mai semnificative în comparaţie cu alte BRA, datorită capacităţilor sale duale de a reduce PIO şi de a suprima TGFβ, care sugerează un efect neuroprotector al tratamentului cu telmisartan(4).
Reducerea modestă a PIO indusă de telmisartan, observată în ochiul de control, nu ar susţine posibilul mecanism de reducere a PIO prin remodelarea pe termen lung a matricei extracelulare a reţelei trabeculare. Mecanismele de scădere a PIO, indusă de telmisartan, pot fi determinate fie de scăderea rezistenţei la ieşirea umorii apoase, de reducerea producţiei de umoare apoasă, fie de micşorarea presiunii venoase episclerale sau de o combinaţie a acestor mecanisme. Lipsa aparentă a unui efect de scădere a PIO al telmisartanului asupra creşterii acesteia, indusă de microbile de polisteren, poate fi cauzată de un efect mult mai mare asupra PIO de blocarea fizică a căii de ieşire din cauza acumulării de microbile în unghiul corneoscleral. Astfel, studiile experimentale sugerează că telmisartanul oferă neuroprotecţie împotriva degenerării CGR ca răspuns la creşterea PIO. Telmisartanul ar trebui investigat în continuare ca tratament potenţial pentru glaucom, în special la pacienţii predispuşi atât la HTA, cât şi la glaucom(4).
În studiile in vitro, candesartanul, dar nu blocantul AT2R, a prevenit disfuncţia endotelială, sugerând că aceasta a fost mediată prin AT1R. Concomitent, incubarea arterelor oftalmice izolate cu Ang II a determinat creşterea nivelului SRO în peretele vascular, iar captarea SRO a prevenit şi disfuncţia endotelială indusă de Ang II. Expunerea la Ang II a arterelor oftalmice de la şoareci a crescut expresia enzimei prooxidante, NOX2, confirmând că formarea SRO mediată de NOX2 este implicată în disfuncţia endotelială indusă de Ang II(2).
S-a demonstrat că Ang II, în diferite paturi vasculare nonoculare, induce stresul oxidativ şi disfuncţia endotelială prin implicarea enzimei redox prooxidant, NOX2, a enzimelor mitocondriale şi prin sintetaza endotelială a oxidului nitric (eNOS). S-a dovedit că NOX2 este critică pentru disfuncţia endotelială indusă de Ang II în arterele oftalmice şi contribuie la disfuncţia endotelială într-o varietate de modele de boli oculare, inclusiv glaucom, evidenţiind rolul fiziopatologic critic al NOX2 în sistemul vascular ocular(2).
În arterele oftalmice expuse vehiculului, vasodilataţia dependentă de endoteliu a fost determinată de NOS şi FCEV. Porţiunea FCEV a fost mediată de metaboliţii CYP450 şi 12/15-LOX. Contribuţia NOS la vasodilataţia dependentă de endoteliu a fost neglijabilă după incubarea Ang II, sugerând că NOS a fost disfuncţională în aceste artere. Studiile în celule endoteliale vasculare cultivate, vase de sânge izolate şi animale experimentale au arătat că expunerea la Ang II induce decuplarea eNOS pentru a produce superoxid în loc de oxid nitric. În arterele oftalmice expuse Ang II, vasodilataţia dependentă de endoteliu a fost mediată predominant de FCEV, în timp ce în arterele oftalmice incubate cu vehicul, vasodilataţia indusă de FCEV a fost mediată predominant de metaboliţii CYP450 în arterele expuse Ang II, ceea ce sugerează că aportul căii 12/15-LOX a devenit neglijabil. Studiile au raportat că unii blocanţi AT1R, precum telmisartanul, au exercitat efecte inhibitoare asupra enzimelor CYP450 implicate în generarea acizilor epoxieicosatrienoici (EET), care joacă un rol important în medierea vasodilataţiei dependente de FCEV, sugerând că, de fapt, căile CYP450 pot fi activate de Ang II. Astfel, căile de semnalizare dependente de CYP450 par a fi de o importanţă majoră pentru vasodilataţia dependentă de endoteliu a arterelor oftalmice după expunerea la Ang II, în timp ce semnalizarea NOS şi cea a 12/15-LOX devin afectate. În concluzie, studiile experimentale in vitro au evidenţiat mecanismele de semnalizare endotelială ce ar putea fi afectate de Ang II în artera oftalmică, care ar putea fi mai complexe în cercetările in vivo (figura 2). Din punct de vedere clinic, IECA şi BRA pot exercita efecte benefice în bolile oculare asociate cu disfuncţia endotelială. Astfel, în retinopatia diabetică, Ang II, stresul oxidativ şi inflamaţia s-au dovedit a juca un rol fiziopatologic important, iar modificările SRA au fost implicate în patofiziologia degenerescenţei maculare legate de vârstă şi a glaucomului(2).
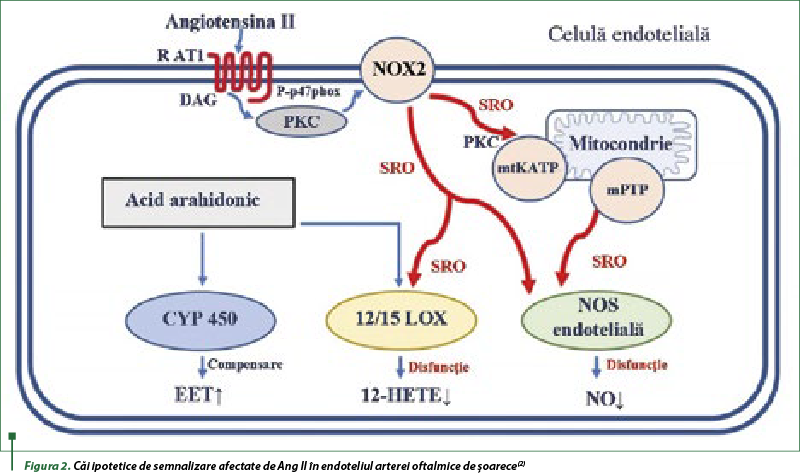
Activarea receptorului de angiotensină de tip 1 (AT1R) de către angiotensina II activează NADPH oxidaza 2 (NOX2) în membrana citoplasmatică prin diacilglicerol (DAG), protein kinaza C (PKC) şi fosforilarea subunităţii NADPH oxidazei p47phox la P-p47phox. S-a demonstrat că SRO derivate din NOX2 deschid canalele K-ATP mitocondriale (mtKATP) în membrana mitocondrială, provocând ulterior deschiderea porilor de tranziţie a permeabilităţii (mPTP), oferind un mecanism de amplificare pentru stresul oxidativ indus de Ang II. Speciile reactive de oxigen, derivate din NOX2, inactivează sintetaza endotelială de oxid nitric (eNOS), ceea ce duce la o producţie redusă de oxid nitric (NO). În plus, afectarea de către SRO a 12/15-lipoxigenazei (12/15-LOX) poate reduce generarea de acid 12-hidroxieicosatetraenoic (12-HETE), care este regioizomerul HETE şi care pare să acţioneze ca factor hiperpolarizant derivat de endoteliu (EDHF). Oxigenazele citocromului P450 (CYP450), care contribuie la vasodilataţia mediată de EDHF prin generarea de acizi epoxieicosatrienoici (EET), par a fi neafectate de formarea SRO indusă de Ang II şi pare să compenseze eNOS disfuncţională şi căii de semnalizare 12/15 dependente de LOX.
În concluzie, atât expunerea in vivo, cât şi cea in vitro la Ang II induc disfuncţie endotelială în arterele oftalmice, efect mediat în principal de AT1R, NOX2 şi SRO. În plus, este afectată vasodilataţia dependentă de eNOS şi de LOX, în timp ce contribuţia metaboliţilor CYP450 este îmbunătăţită după expunerea la Ang II. Din punct de vedere clinic, blocarea producţiei de Ang II sau a semnalizării AT1R şi/sau NOX2 poate fi utilă pentru menţinerea sau restabilirea funcţiei endoteliale vasculare în diferite boli asociate vârstei, precum degenerare maculară de vârstă, retinopatie diabetică şi glaucom. Deoarece căile de semnalizare dependente de CYP450 par să compenseze NOS şi 12/15-LOX disfuncţionale în timpul expunerii cronice la Ang II, blocarea suplimentară a CYP450 poate reduce şi mai mult funcţia endotelială în astfel de condiţii fiziopatologice(2).
Concluzii
Hipertensiunea arterială este un factor de risc pentru dezvoltarea şi progresia glaucomului prin creşterea presiunii intraoculare (creşterea formării şi/sau blocarea efluxului umorii apoase), modificările vasculare (reducerea circulaţiei şi a aportului de oxigen şi de substanţe nutritive, creşterea presiunii venoase şi staza, micşorarea presiunii de perfuzie oculară, ischemia discului nervului optic, disfuncţia endotelială), inducerea procesului inflamator şi a stresului oxidativ. Preparatele antihipertensive (BCC, BAB, IECA, BRA), prin controlul adecvat al tensiunii arteriale, pot influenţa mecanismele patogenetice responsabile de dezvoltarea şi/sau progresia glaucomului. Componentele sistemului renină-angiotensină, prezente în structurile oculare, crescute la pacienţii cu glaucom, sunt responsabile de modificările la nivelul vaselor retinei, de disfuncţia endotelială, dezvoltarea procesului inflamator, a stresului oxidativ şi a angiogenezei. Inhibitorii enzimei de conversie a angiotensinei şi blocantele receptorilor angiotensinici pot influenţa benefic dezvoltarea şi evoluţia glaucomului prin reducerea formării umorii apoase, creşterea fluxului uveoscleral, micşorarea presiunii intraoculare şi manifestarea unui efect neuroprotector prin reducerea procesului inflamator, a stresului oxidativ şi a angiogenezei. n
Bibliografie
-
Anamalai R, Priyadharshini P, Muthayya M. Clinical correlation of glaucoma with systemic hypertension and its effect on visual morbidity. Indian Journal of Clinical and Experimental Ophthalmology. 2020;6(4):558-562. doi.org/10.18231/j.ijceo.2020.117.
-
Birk M, Baum E, Zadeh JK, Manicam C, Pfeiffer N, Patzak A, Helmstädter J, Steven S, Kuntic M, Daiber A, Gericke A. Angiotensin II Induces Oxidative Stress and Endothelial Dysfunction in Mouse Ophthalmic Arteries via Involvement of AT1 Receptors and NOX2. Antioxidants (Basel). 2021 Aug 2;10(8):1238. doi: 10.3390/antiox10081238.
-
Deb AK, Kaliaperumal S, Rao VA, Sengupta S. Relationship between systemic hypertension, perfusion pressure and glaucoma: a comparative study in an adult Indian population. Indian J Ophthalmol. 2014 Sep;62(9):917-22. doi: 10.4103/0301-4738.143927.
-
Hazlewood RJ, Kuchtey J, Wu HJ, Kuchtey RW. Telmisartan Reduces Axon Degeneration in Mice with Experimental Glaucoma. Invest Ophthalmol Vis Sci. 2020 May 11;61(5):51. doi: 10.1167/iovs.61.5.51.
-
Hirooka K, Shiraga F. Potential role for angiotensin-converting enzyme inhibitors in the treatment of glaucoma. Clin Ophthalmol. 2007 Sep;1(3):217-23.
-
Jeon SJ, Hwang HB, Lee NY. Evaluation of Systemic Renin and Angiotensin II Levels in Normal Tension Glaucoma. J Clin Med. 2020 Nov 26;9(12):3838. doi: 10.3390/jcm9123838.
-
Khandelwal R, Khandelwal R, Raje D, et al. Correlation of open-angle glaucoma and ocular perfusion pressure in hypertensive individuals. J Clin Ophthalmol Res. 2020;8:5-9. doi: 10.4103/jcor.jcor_90_18.
-
Mehta A, Iyer L, Parmar S, Shah G, Goyal R. Oculohypotensive effect of perindopril in acute and chronic models of glaucoma in rabbits. Can J Physiol Pharmacol. 2010 May;88(5):595-600. doi: 10.1139/y10-026.
-
Nislawati R, Taufik Fadillah Zainal A, Ismail A, Waspodo N, Kasim F, Gunawan AMAK. Role of hypertension as a risk factor for open-angle glaucoma: a systematic review and meta-analysis. BMJ Open Ophthalmol. 2021 Sep 28;6(1):e000798. doi: 10.1136/bmjophth-2021-000798.
-
Pappelis K, Loiselle AR, Visser S, Jansonius NM. Association of Systemic Medication Exposure with Glaucoma Progression and Glaucoma Suspect Conversion in the Groningen Longitudinal Glaucoma Study. Invest Ophthalmol Vis Sci. 2019 Nov 1;60(14):4548-4555. doi: 10.1167/iovs.19-27984.
-
Seki VBB, Souza GR, Messias A, Casarini DE, Paula JS. Aqueous humor renin, angiotensin I, and angiotensin II activity in primary open-angle glaucoma. Arq Bras Oftalmol. 2020 Aug;83(4):318-322. doi: 10.5935/0004-2749.20200052.
-
Siddiqui M, Iltis J, Yanev P, Sladic J, Huynh C, Nolan D, Singer M. Effect of systemic antihypertensives on change in intraocular pressure after initiating topical prostaglandins for primary open-angle glaucoma. Clin Ophthalmol. 2019 Jan 23;13:207-213. doi: 10.2147/OPTH.S192010.
-
Ziaja M, Urbanek KA, Kowalska K, Piastowska-Ciesielska AW. Angiotensin II and Angiotensin Receptors 1 and 2-Multifunctional System in Cells Biology, What Do We Know? Cells. 2021 Feb 12;10(2):381. doi: 10.3390/cells10020381





