Rolul examinării Doppler în evaluarea patologiei ovariene
The role of Doppler examination in evaluating the ovarian pathology
Abstract
The role of diagnostic ultrasound in evaluating ovarian tumors remains undeniable. The ultrasound examination is important in assessing the benign or malignant character of the ovarian mass. Ultrasound allows the evaluation of prognostic parameters and helps individualizing the oncologic treatment. In the absence of a screening program for ovarian cancer, most ovarian tumors are identified by chance. In the study International Ovarian Tumor Analysis (IOTA) there have been developed a series of simple rules for the morphological characterization of ovarian masses. The criteria used to describe an ovarian malignancy are irregular solid tumor, ascites, at least 4 papillary structures, multiloculated solid tumor with the largest diameter over 100 mm and the presence of increased Doppler flow. The criteria used to describe benign ovarian tumors are unilocular cyst, presence of solid component with a maximum diameter less than 7 mm, posterior shadowing, multilocular tumor with regular contour, without increased Doppler flow. Simple rules can be used to characterize 75% of ovarian tumors (benign or malignant). Ovarian tumor evaluation by an expert is required when the mass can not be classified using the simple rules. Simple rules and logistic regression models can be used to evaluate premenopausal patients. Doppler is used to objectify movement in tumors. Pulsed Doppler is used to highlight the resistance and pulsatility index in the peritumoral circulation and intracystic formations. Doppler exam data does not bring significant diagnostic data in terms of benign / malignant differentiation, but improves the confidence level of the examiner regarding the characterization of tumors.Keywords
ovarian pathologyultrasonographyDoppler examinationimagistic diagnosisRezumat
Rolul diagnosticului ecografic în evaluarea tumorilor de ovar este de necontestat. Examenul ecografic are rolul de a evalua caracterele benigne sau maligne ale tumorilor ovariene. Examenul ecografic permite evaluarea parametrilor de prognostic şi ajută la individualizarea tratamentului oncologic. În absenţa unui program de screening pentru cancerul de ovar, majoritatea formaţiunilor tumorale ovariene sunt identificate întâmplător. În cadrul studiului International Ovarian Tumor Analysis (IOTA) au fost dezvoltate o serie de reguli simple pentru caracterizarea morfologică a tumorilor ovariene. Criteriile folosite pentru descrierea unei tumori ovariene cu caracter malign sunt: tumoră neregulată solidă, prezenţa ascitei, minimum 4 structuri papilare, tumoră multiloculară solidă cu cel mai mare diametru de minimum 100 mm şi prezenţa unui flux Doppler crescut. Criteriile folosite pentru descrierea unei tumori ovariene cu caracter benign sunt: chist unilocular, prezenţa unei componente solide cu diametrul maxim mai mic de 7 mm, con de umbră posterior, tumoră multiloculară cu contur regulat, fără flux Doppler crescut. Regulile simple pot fi folosite pentru a caracteriza 75% din formaţiunile tumorale ovariene (benigne sau maligne). Evaluarea formaţiunilor tumorale ovariene de către un expert se impune în momentul în care formaţiunea tumorală nu poate fi clasificată folosind regulile simple. Regulile simple şi modelele de regresie logistică pot fi folosite pentru a evalua pacientele aflate în premenopauză. Examenul Doppler este folosit pentru a obiectiva circulaţia la nivelul tumorilor. Ecografia Doppler în mod pulsatil trebuie să pună în evidenţă indicele de rezistenţă şi pulsatilitate la nivelul circulaţiei peritumorale şi al formaţiunilor intrachistice. Examenul Doppler nu aduce date diagnostice semnificative privind diferenţierea benign/malign, dar îmbunătăţeşte rata de încredere a examinatorului în ceea ce priveşte caracterizarea tumorilor.Cuvinte Cheie
patologie ovarianăultrasonografieexaminare Dopplerdiagnostic imagisticIntroducere
Evaluarea optimă a patologiei ovariene înainte de a decide sancţiunea chirurgicală îmbunătăţeşte conduita terapeutică(1,2,3).
Imagistica joacă un rol central în identificarea formaţiunilor tumorale ovariene cu potenţial malign. Examenul ecografic a devenit o extensie a examenului clinic deoarece este o metodă neinvazivă, reproductibilă, accesibilă şi ieftină.
Rolul diagnosticului ecografic în evaluarea tumorilor de ovar este de necontestat. Examenul ecografic are rolul de a evalua caracterele benigne sau maligne ale tumorii ovariene. Tumorile benigne beneficiază de conduită conservatoare sau tratament laparoscopic. Planificarea tratamentului chirurgical într-un centru calificat este crucială în cazul tumorilor de ovar cu suspiciune ridicată de malignitate. Examenul ecografic permite evaluarea parametrilor de prognostic şi ajută la individualizarea tratamentului oncologic. În acest caz putem vorbi despre un raport cost-beneficiu important, având în vedere faptul că putem avea un impact terapeutic maxim, însoţit de o morbiditate minimă pentru pacient.
Diferenţierea între tumorile benigne şi cele maligne permite îndrumarea pacientei către un specialist în chirurgie minim-invazivă şi infertilitate (în cazul endometriozei).
În absenţa unui program de screening pentru cancerul de ovar, formaţiunile tumorale ovariene sunt identificate întâmplător în momentul efectuării ecografiei transvaginale pentru diagnosticul diferenţial al altor patologii ginecologice (menometroragii, dureri pelvi-abdominale cronice sau infertilitate). Din acest motiv, numărul de formaţiuni tumorale ovariene diagnosticate este în creştere(4). Scopul evaluării formaţiunilor tumorale ovariene de către clinicianul experimentat este triajul leziunilor şi evitarea intervenţiilor chirurgicale ca urmare a unei evaluări eronate. În urma evaluării de către un expert, majoritatea formaţiunilor tumorale pot fi tratate conservator din momentul în care natura benignă a chistului a fost confirmată(5).

Strategia în trei paşi pentru evaluarea patologiei anexiale
Diagnosticul „instant” al formaţiunilor tumorale anexiale
Diagnosticul „instant” al formaţiunilor tumorale anexiale poate fi obţinut în urma evaluării a 6 criterii ecografice. Evaluarea ultrasonografică de către un utilizator cu experienţă medie poate facilita triajul formaţiunilor tumorale ovariene. Diagnosticul „instant” se referă la formaţiunile tumorale ovariene care nu necesită investigarea suplimentară (modele diagnostice, regulile simple, indexul riscului de malignitate, modelele de regresie logistică LR1 şi LR2 sau evaluarea ecografică de către un expert).
Criteriile folosite pentru diagnosticul „instant” al formaţiunilor tumorale ovariene sunt obţinute în urma evaluării ultrasonografice şi a măsurării nivelului seric de CA-125: patru criterii descriu caracteristicile morfologice descoperite în cazul formaţiunilor tumorale benigne şi două criterii evaluează probabilitatea ca formaţiunea respectivă să fie malignă(6). În cazul în care nici unul dintre aceste criterii nu este prezent sau formaţiunea tumorală prezintă simultan criterii maligne şi benigne, diagnosticul este considerat dificil („non-instant”). În aceste cazuri se impune evaluarea suplimentară folosind regulile simple sau modelele de regresie logistică. Criteriile folosite pentru diagnosticul „instant” al formaţiunilor tumorale prezintă o sensibilitate de 98% şi o specificitate de 97%(7).
Regulile simple
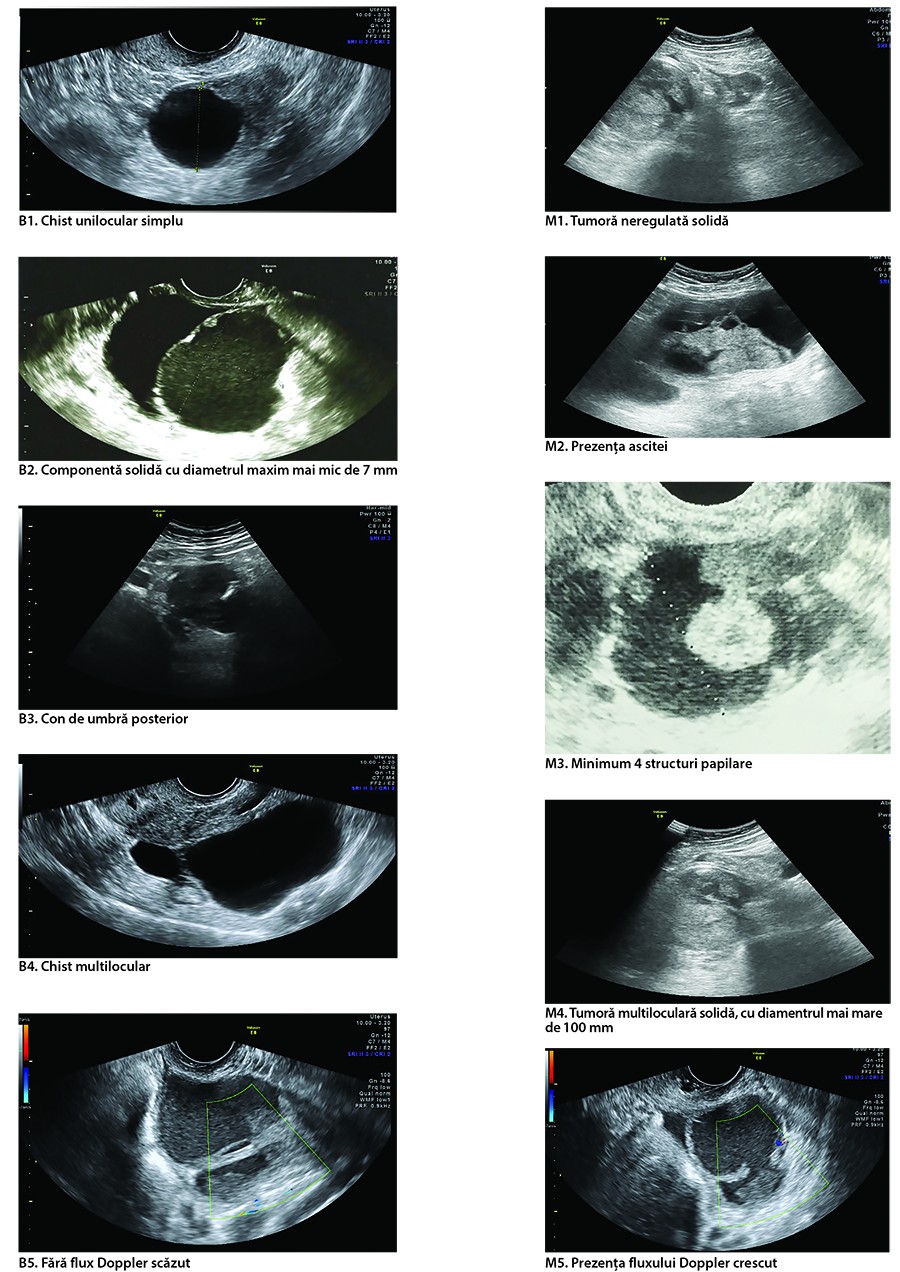
În cadrul studiului International Ovarian Tumor Analysis (IOTA) au fost dezvoltate o serie de reguli simple pentru caracterizarea morfologică a tumorilor ovariene(8). Criteriile folosite pentru descrierea unei tumori ovariene cu caracter malign sunt: tumoră neregulată solidă (M1), prezenţa ascitei (M2), minimum 4 structuri papilare (M3), tumoră multiloculară solidă, cu cel mai mare diametru de minimum 100 mm (M4) şi prezenţa unui flux Doppler crescut (M5). Criteriile folosite pentru descrierea unei tumori ovariene cu caracter benign sunt: chist unilocular (B1), prezenţa unei componente solide cu diametrul maxim mai mic de 7 mm (B2), con de umbră posterior (B3), tumoră multiloculară cu contur regulat (B4), fără flux Doppler crescut (B5)(7).
În cazul în care formaţiunea tumorală prezintă una sau mai multe caracteristici morfologice maligne şi nici o caracteristică benignă, această formaţiune va fi încadrată drept o formaţiune malignă (regula 1).
În cazul în care formaţiunea tumorală prezintă una sau mai multe caracteristici morfologice benigne şi nici o caracteristică malignă, această formaţiune va fi încadrată drept o formaţiune benignă (regula 2).
În cazul în care există simultan caracteristici maligne şi benigne sau nici una dintre caracteristici nu este prezentă, regulile simple nu pot fi aplicate (regula 3). Aceste cazuri impun evaluarea de către un expert (medic ginecolog cu experienţă clinică).
Indexul riscului de malignitate (IRM)
Riscul de malignitate este determinat folosind caracteristicile ultrasonografice (U), statusul de menopauză şi nivelul seric de CA-125. Cinci caracteristici ultrasonografice (U) au fost incluse în scorul ecografic sugestiv pentru malignitate: tumoră multiloculară, componente solide, formaţiuni tumorale prezente bilateral, ascită sau prezenţa metastazelor. Scorul ecografic (U) este 0 în cazul în care nici una dintre aceste caracteristici nu este prezentă. Scorul ecografic (U) este 1 în cazul în care una dintre aceste caracteristici este prezentă şi 3 în cazul în care două sau mai multe caracteristici sunt prezente.
Scorul atribuit menopauzei (M) a fost împărţit după cum urmează: 1 în cazul în care pacienta se află în premenopauză şi 3 în cazul în care pacienta se află în postmenopauză. Indexul riscului de malignitate (IRM) este definit ca U × M × [nivelul seric de CA-125 (U/ml)]. În cazul în care IRM >200, riscul de cancer este crescut(9). Indexul riscului de malignitate prezintă două dezavantaje principale.
Primul dezavantaj este faptul că valoarea sa este influenţată în principal de valoarea CA-125.
Al doilea dezavantaj este reprezentat de folosirea unor criterii ultrasonografice specifice stadiilor avansate (chist multilocular, ascită, arii solide, leziuni bilaterale, metastaze).
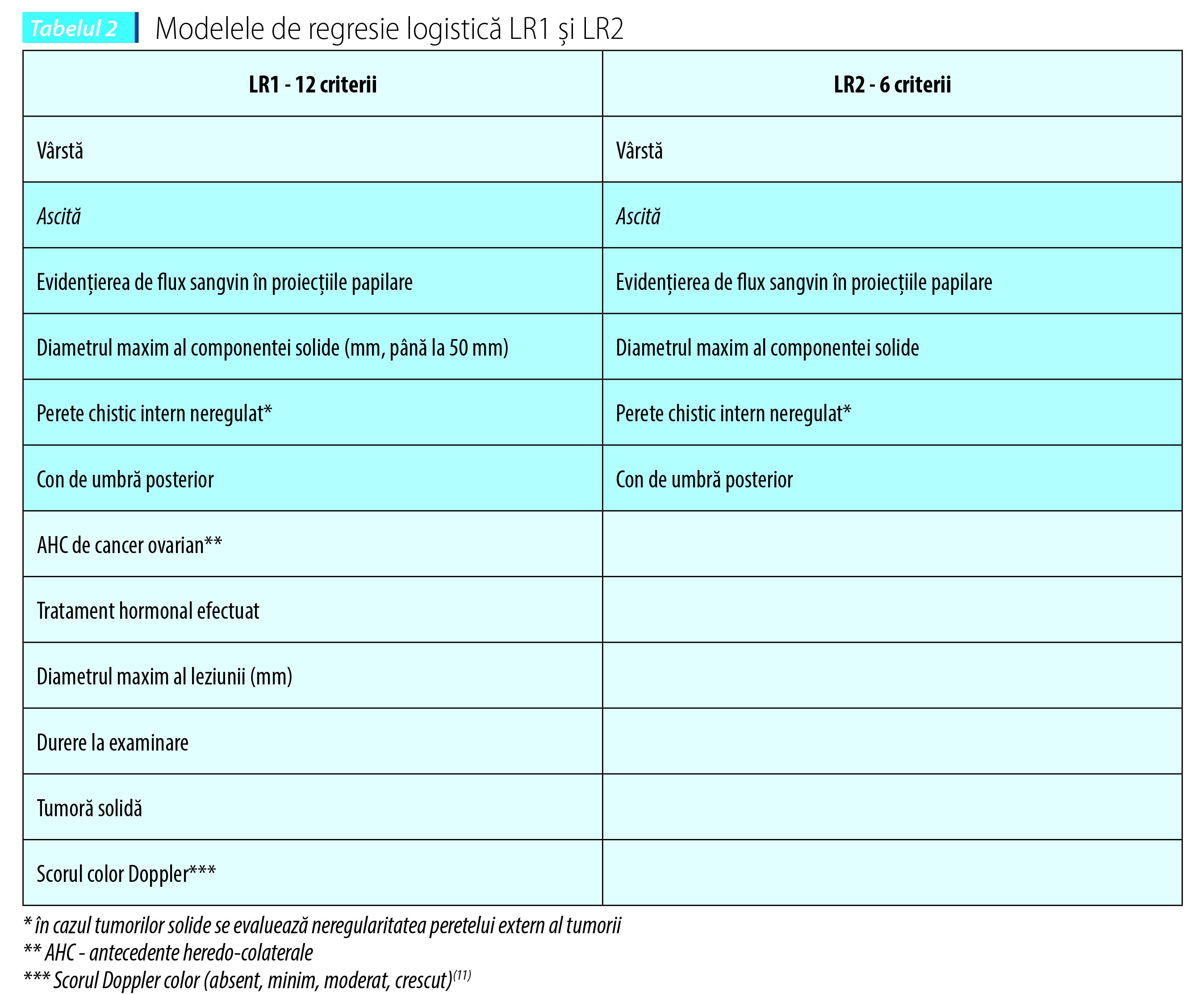
Modele de regresie logistică LR1 şi LR2
Modelele de regresie logistică LR1 şi LR2 sunt algoritmi dezvoltaţi în cadrul studiului IOTA pentru a indica probabilitatea ca o formaţiune tumorală ovariană să fie malignă. Riscul este calculat după o formulă matematică folosind un set de 12 criterii în cazul modelului LR1 şi 6 criterii în cazul modelului LR2.
Modelul de regresie logistică LR1 prezintă o sensibilitate de 92% şi o specificitate de 87%. Modelul de regresie logistică LR2 prezintă o sensibilitate de 92% şi o specificitate de 86%(10).
Examinarea Doppler
Examenul Doppler a fost studiat pentru a detecta structura fluxului vascular şi pentru a caracteriza indicele de rezistenţă al fluxului sanguin în tumorile ovariene. Datele obţinute în urma acestei examinări pot fi coroborate cu restul investigaţiilor clinice şi paraclinice pentru a determina caracterul benign sau malign. Examenul Doppler color reprezintă o modalitate indispensabilă de a caracteriza o formaţiune tumorală ovariană după descrierea morfologică.
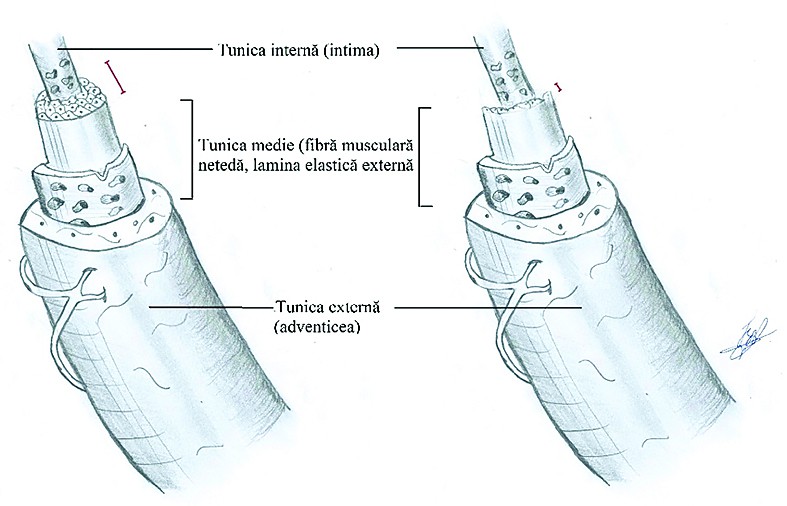
Tumorile ovariene maligne sunt caracterizate de neoangiogeneză şi vase de sânge cu strat muscular slab dezvoltat. Din cauza stratului muscular slab reprezentat, în aceste vase se vor observa un flux diastolic continuu şi o diferenţă minimă între peak-ul sistolic şi cel diastolic. Din acest motiv, fluxul de sânge în aceste vase este caracterizat printr-un indice de rezistenţă scăzut (IR <0,4).
Tumorile ovariene benigne şi fluxul de sânge la nivelul ovarului sunt caracterizate printr-un indice de rezistenţă crescut(12). Neoangiogeneza este caracterizată prin lipsa tunicii media, arhitectură haotică, şunturi arterio-venoase şi fluxuri cu rezistenţă scăzută.
Vascularizaţia unei formaţiuni tumorale reflectă statutul biologic. Tumorile caracterizate prin neoangiogeneză semnificativă sunt mai agresive şi au tendinţa de a metastaza în stadii incipiente. Din acest motiv, aceste formaţiuni tumorale sunt întâlnite în stadiile avansate(13,14,15,16). În momentul în care examinatorul evaluează „cantitatea” semnalului Doppler color/power Doppler putem întâlni următoarele situaţiile ilustrate în tabelul 3.
Principalul avantaj al examenului Doppler este că poate face diferenţa între papilele benigne sau maligne în momentul în care există dubii morfologice. Ajustarea corectă a parametrilor de achiziţie în timpul examinării este importantă deoarece la o setare incorectă papila poate să lase impresia că nu are semnal Doppler. Includerea în scorul 1 sau 4 este clară. Includerea în scorul 2 sau 3 este subiectivă.
Caracterizarea morfologică a formaţiunilor tumorale ovariene trebuie completată de un studiu Doppler pentru a obiectiva vascularizaţia. Setarea corectă în examinarea Doppler trebuie să ţină cont de mai multe variabile.
Achiziţia Doppler (Doppler gain) se scade până în momentul în care dispar artefactele intrachistice. În momentul în care achiziţia Doppler este prea mică, informaţiile pot fi pierdute şi fluxul sanguin nu poate fi demonstrat. Achiziţia Doppler prea mare reprezintă, de asemenea, un caz de rezultat fals-pozitiv. În acest caz vom observa vascularizaţie în zonele fără flux sau aleatorie. Din acest motiv, setările ecografului sunt deosebit de importante: PRF - 0,3. Velocity scale 3-6 cm/sec, filtru 50 Hz. Suspiciunea de malignitate trebuie ridicată în momentul în care observăm un număr mare de vase dezorganizate, cu diametre diferite şi multiple anastomoze care intră în formaţiunea tumorală (indiferent de indicele de rezistivitate).
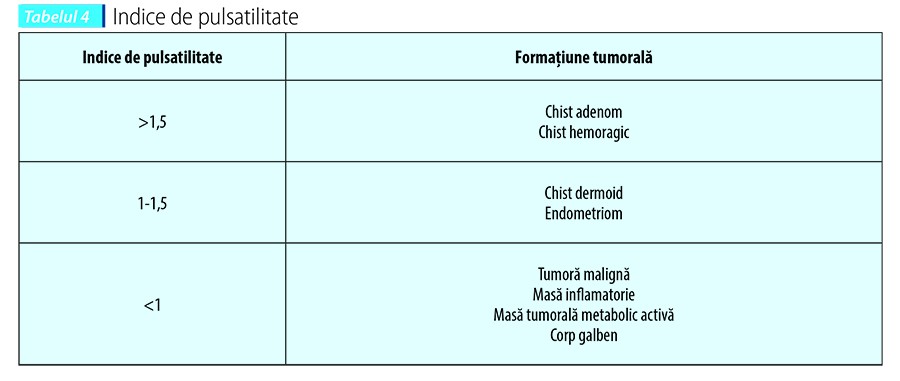
Examenul Doppler trebuie folosit pentru a obiectiva fluxul sanguin la nivelul formaţiunilor tumorale ovariene. Ecografia Doppler în mod pulsatil trebuie să pună în evidenţă indicele de rezistenţă şi pulsatilitate la nivelul ramurii ovariene a arterei uterine, arterei ovariene şi intratumoral. Pentru a evita rezultatele fals-pozitive, pacientele trebuie examinate în primele 10 zile ale ciclului menstrual (paciente cu ciclu menstrual regulat). Scopul este de a evita confuzia cu modificările fiziologice observate la ecografia Doppler în faza luteală a ciclului menstrual. În această fază, modificările circulatorii intraovariene de la nivelul corpului galben vor determina un flux diastolic crescut şi vom putea observa un indice de rezistenţă scăzut (vase tortuoase cu impedanţă scăzută)(17).
Proiecţia papilară intrachistică este definită ca o formaţiune care porneşte de la nivelul peretelui chistic cu o înălţime de peste 3 mm. Vizualizarea fluxului Doppler la nivelul unei proiecţii papilare reprezintă un semn sugestiv pentru malignitate. Examenul Doppler scoate în evidenţă vase cu impedanţă scăzută, şunturi arterio-venoase şi tendinţa de a se grupa(18,19). În momentul de faţă există o dezbatere privind valoarea indicelui de rezistenţă pentru a face diferenţa între natura benignă sau malignă a formaţiunilor tumorale ovariene. Valoarea cut-off pentru indicele de rezistenţă este IR >0,4. Valoarea cut-off pentru indicele de pulsatilitate (IP) este IP >1. Diagnosticul diferenţial al acestor formaţiuni tumorale este important deoarece flux Doppler anormal poate fi observat: în cadrul unui proces inflamator (din cauza vasodilataţiei locale), la nivelul unei formaţiuni tumorale active metabolic (sarcină extrauterină) sau corp galben(7). Shah et al. au observat că 87,5% din formaţiunile tumorale ovariene maligne analizate au un indice de pulsatiliate IP <0,8 în comparaţie cu 4,54% din formaţiunile tumorale ovariene benigne. Indicele de rezistenţă IR <0,6 a fost observat în 82,5% din formaţiunile tumorale maligne în comparaţie cu formaţiunile benigne (6,81%)(20). Examinarea Doppler color şi pulsatil a înregistrat o sensibilitate de 97,5%, specificitate de 84,1%, valoare predictiv pozitivă de 84,78% şi o valoare predictiv negativă de 97,4%.
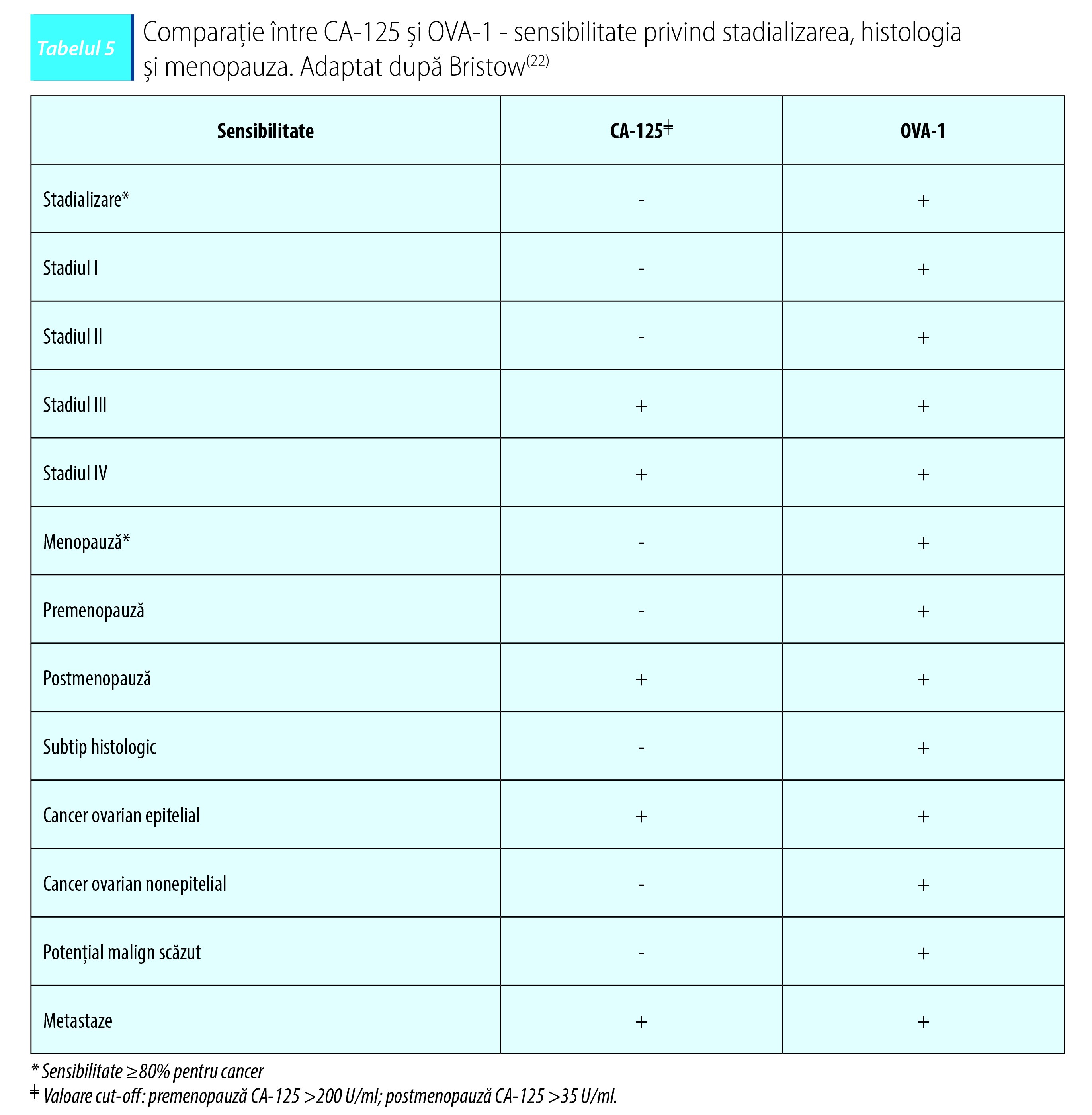
CA-125 versus OVA-1
CA-125 este o proteină serică folosită ca biomarker pentru detectarea prezenţei cancerului ovarian. Unul dintre dezavantajele utilizării acestui biomarker este reprezentat de faptul că valoarea serică poate fi crescută în anumite tipuri de cancer şi scăzută în altele. CA-125 nu este exprimat pe epiteliul de suprafaţă al ovarelor normale. Nivelul seric al CA-125 este crescut în cazul pacientelor cu cancer ovarian epitelial metastazant. Utilizarea pe scară largă a acestui biomarker a fost adoptată pentru a evalua potenţialul malign al unei formaţiuni tumorale pelvine.
Sensibilitatea, specificitatea şi valoarea predictiv pozitivă a CA-125 în evaluarea potenţialului malign al unei formaţiuni tumorale rămân scăzute. Sensibilitatea CA-125 pentru pacientele cu cancer ovarian epitelial în stadiul I este cuprinsă între 23% şi 50%. În plus, există mai multe patologii care vor conduce la un nivel crescut de CA-125: endometrioză, adenomioză, boală inflamatorie pelviană sau ciroză(21).
OVA-1 reprezintă un test cu variabile multiple în care sunt incluse: transtiretina (prealbumina), apolipoproteina A-1, 2-microglobulina, transferina şi CA-125. OVA-1 oferă o probabilitate ca formaţiunea tumorală ovariană investigată să fie malignă. În cazul pacientelor aflate în premenopauză (OVA-1 >5) şi postmenopauză (OVA-1 >4,4) indică o suspiciune ridicată de malignitate(23). Longoria et al. au observat în cazul pacientelor cu formaţiuni tumorale ovariene maligne o sensibilitate de 92,2% pentru OVA-1. În momentul în care OVA-1 a fost folosit împreună cu evaluarea clinică, sensibilitatea a fost de 95,3%. Sensibilitatea CA-125 observată în acest studiu a fost de 70,6%(24).

Discuţii
Examinarea ecografică de către un expert a formaţiunilor tumorale ovariene reprezintă metoda de elecţie utilizată pentru determinarea caracterelor morfologice de benignitate sau malignitate(25).
Examinatorii cu experienţă medie au tendinţa de a încadra formaţiunile tumorale ovariene, după caracterele morfologice, în formaţiuni simple sau complexe, fără a ţine cont de vascularizaţia formaţiunii şi de caracteristicile structurilor intrachistice.
Fără a stabili corect etiologia formaţiunii tumorale, este posibil ca sancţiunea chirurgicală să nu aducă beneficiile scontate în cazul în care aceasta nu este efectuată într-un centru calificat (examen extemporaneu, biopsii peritoneale, citologie, stadializare sau intervenţie radicală).
Diagnosticul „instant” al formaţiunilor tumorale ovariene este posibil în aproximativ 50% din cazuri(7). Acest procent este observat şi în cazul examinatorilor cu experienţă medie. În cazul în care nu există criterii de diagnostic „instant” sau formaţiunea tumorală prezintă simultan criterii maligne şi benigne, se impune aplicarea regulilor simple.
În cadrul studiului IOTA observăm că utilizarea regulilor simple (caracteristicile morfologice şi Doppler) de către un examinator cu experienţă medie obţine rezultate similare cu cele raportate de către un expert. În acest mod există un număr redus de paciente care trebuie îndrumate pentru evaluare la un expert(8). Un alt beneficiu este reprezentat de planificarea tratamentului chirurgical într-un centru specializat pentru formaţiunile tumorale cu potenţial malign crescut.
Cancerul ovarian epitelial este împărţit în două tipuri: tipul I şi tipul II(26,27,28). Tipul I are ca punct de plecare formaţiunile tumorale borderline seroase sau endometrioza şi include: carcinomul seros de grad scăzut, endometrioid şi cu celule clare. Aceste formaţiuni tumorale sunt frecvent surprinse într-un stadiu incipient, cu grad scăzut de malignitate, şi sunt caracterizate printr-o evoluţie lentă.
Tipul II de cancer ovarian este mai frecvent întâlnit, fiind caracterizat de un grading tumoral crescut. Formaţiunile tumorale din tipul II prezintă origine seroasă şi au ca punct de plecare epiteliul fimbrial în 60% din cazuri(29). Din acest motiv, formaţiunile tumorale de tip II sunt mai frecvent întâlnite în stadiul III sau IV. Această afirmaţie este în concordanţă cu ipoteza conform căreia diseminarea peritoneală se produce prin intermediul celulelor maligne de la nivelul fimbriilor tubare.
În momentul de faţă există mai multe date care susţin existenţa leziunilor precursoare intraepiteliale la nivelul fimbriilor. La nivelul acestor leziuni precursoare tubare au fost observate mutaţia genei p53 şi un indice de proliferare crescut (MIB-1), în comparaţie cu restul epiteliului(30,31).
Coexistenţa leziunilor precursoare intraepiteliale tubare a fost demonstrată în 33-59% din cazurile cu cancer ovarian seros. Mutaţiile observate la nivelul p53 şi alterarea ADN-ului la nivelul celulelor secretoare tubare sunt considerate etape incipiente ale carcinogenezei(32). Pierderea funcţiei normale a genei p53 (genă supresoare tumorală de pe cromozomul 17p) este asociată cu dereglarea creşterii şi diviziunii celulare. Mutaţia genei (supraexprimarea sau deleţia) este asociată cu inhibarea activităţii ei şi cu o activitate proliferativă anormală. Kristjansdottir et al. au evaluat performanţa diagnostică a HE4 (human epididymis protein 4) şi CA-125 la pacientele cu formaţiuni tumorale ovariene cu suspiciune ridicată de malignitate în urma examenului clinic şi ecografic(33).
Autorii au observat că HE4 şi CA-125 sunt fezabile pentru detectarea formaţiunilor tumorale de tip II (sensibilitate 94,4% şi specificitate 75%). În cazul formaţiunilor tumorale de tip I, sensibilitatea (61,9%) şi specificitatea (75%) nu sunt acceptabile. Istoria naturală a formaţiunilor tumorale de tip II prezintă o perioadă preclinică detectabilă mai mică în comparaţie cu cele de tip I. Trebuie menţionat că în momentul de faţă nu se cunoaşte intervalul de timp în care carcinomul seros metastazează la nivel peritoneal.
În momentul de faţă, metodele de screening testate pentru cancerul ovarian au prezentat rate inacceptabile de sensibilitate şi specificitate. Absenţa unei scăderi semnificative a mortalităţii cancerului ovarian a condus la imposibilitatea implementării unei metode de screening pentru cancer ovarian(34). Screeningul efectuat pentru cancerul de sân, colon sau cervical este asociat cu un impact semnificativ asupra mortalităţii(35).
Cheia succesului într-un program eficient de screening este reprezentată de înţelegerea fiziopatologiei, a evoluţiei naturale şi de identificarea unor leziuni precursoare. În cadrul unui program de screening pentru cancer ovarian (examen ecografic şi dozare serică CA-125) în care au fost incluse 30.630 de paciente nu au fost observate diferenţe semnificative statistic asupra mortalităţii (118 în grupul de screening în comparaţie cu 100 în lotul de control). Sensibilitatea testării pentru cancer ovarian a fost de 69,5%. În plus, numai 28% din formaţiunile tumorale ovariene au fost descoperite în stadiul I/II(36,37).
Criteriile folosite pentru screening în cadrul acestui studiu au fost ecografia transvaginală şi markerul CA-125 (valoare cut-off 35 U/ml). Van Naggel et al. au efectuat, în cadrul Kentucky Screening Study, evaluarea ecografică în scop de screening a unui lot de 25.327 de paciente(38). În cadrul acestui program de screening, supravieţuirea la 5 ani a fost semnificativ mai mare în grupul-ţintă (74,8%), în comparaţie cu pacientele tratate în acelaşi centru (53,7%).
Dezavantajul acestui studiu este reprezentat de faptul că nu a fost un studiu randomizat. Deşi nu a fost un studiu randomizat, a demonstrat posibilitatea de diagnosticare în stadii precoce a cancerului de ovar prin monitorizarea ecografică a pacientelor. Deşi ecografia transvaginală nu poate fi considerată o metodă de screening pentru cancerul de ovar, reprezintă un mijloc de investigaţie neinvaziv, ce permite unui examinator cu instruire medie diagnosticarea unei formaţiuni tumorale ovariene cu caractere de malignitate. Având în vedere natura eterogenă a cancerului de ovar, pentru a putea fi implementat un program de screening, se impune folosirea unui panel de markeri tumorali asociaţi cu investigaţia imagistică.
Concluzii
Ecografia este considerată metoda de elecţie pentru evaluarea formaţiunilor tumorale ovariene deoarece poate oferi o caracterizare morfologică adecvată în mâinile unui clinician cu experienţă medie.
Diferenţierea între tumorile benigne şi maligne reprezintă cheia pentru planificarea tratamentului într-un centru specializat.
Se observă un impact terapeutic maxim, însoţit de o morbiditate minimă pentru pacientă.
Regulile simple pot fi folosite pentru a caracteriza 75% din formaţiunile tumorale (benigne sau maligne). Evaluarea formaţiunilor tumorale ovariene de către un expert se impune în momentul în care formaţiunea tumorală nu poate fi clasificată folosind regulile simple. Regulile simple şi LR2 pot să fie folosite pentru a caracteriza tumorile ovariene la pacientele aflate în premenopauză.
Examenul Doppler este folosit pentru a obiectiva circulaţia la nivelul tumorilor. Ecografia Doppler în mod pulsatil trebuie să pună în evidenţă indicele de rezistenţă şi pulsatilitate la nivelul circulaţiei peritumorale şi al formaţiunilor intrachistice. Examenul Doppler nu aduce date diagnostice semnificative în ceea ce priveşte diferenţierea benign/malign, dar îmbunătăţeşte rata de încredere a examinatorului în ceea ce priveşte caracterizarea tumorilor.
Bibliografie
1. Hennessy BT, Coleman RL, Markman M. Ovarian cancer. Lancet 2009; 374: 1371-1382.
2. Moore RG, Bast RC. How do you distinguish a malignant pelvic mass from a benign pelvic mass? Imaging, biomarkers, or none of the above. J ClinOncol 2007; 25: 4159-4161.
3. Vergote I, De Brabanter J, Fyles A, Bertelsen K, Einhorn N, Sevelda P, Gore ME, Kaern J, Verrelst H, Sjo¨ vall K, Timmerman D, Vandewalle J, Van Gramberen M, Trop´e CG. Prognostic importance of degree of differentiation and cyst rupture in stage I invasive epithelial ovarian carcinoma. Lancet 2001; 357: 176-182.
4. Hartge P, Hayes R, Reding D, Sherman ME, Prorok P, Schiffman M, Buys S. Complex ovarian cysts in postmenopausal women are not associated with ovarian cancer risk factors: preliminary data from the prostate, lung, colon, and ovarian cancer screening trial. Am J Obstet Gynecol 2000; 183: 1232-1237.
5. Valentin L, Akrawi D. The natural history of adnexal cysts incidentally detected at transvaginal ultrasound examination in postmenopausal women. Ultrasound Obstet Gynecol 2002; 20: 174-180.
6. Timmerman D. The use of mathematical models to evaluate pelvic masses; can they beat an expert operator? Best Pract Res Clin Obstet Gynaecol 2004; 18: 91-104.
7. Ameye L, Timmerman D, Valentin L, Paladini D, Zhang J, Van Holsbeke C, Lissoni AA, Savelli L, Veldman J, Testa AC, Amant F, Van Huffel S, Bourne T. Clinically oriented three-step strategy to the assessment of adnexal pathology. Ultrasound Obstet Gynecol 2012; 40: 582-591.
8. Timmerman D, Ameye L, Fischerova D, Epstein E, Melis GB, Guerriero S, Van Holsbeke C, Savelli L, Fruscio R, Lissoni AA, Testa AC, Veldman J, Vergote I, Van Huffel S, Bourne T, Valentin L. Simple ultrasound rules to distinguish between benign and malignant adnexal masses before surgery: prospective validation by IOTA group. BMJ 2010; 341: c6839.
9. Jacobs I, Oram D, Fairbanks J, Turner J, Frost C, Grudzinskas JG. A risk of malignancy index incorporating Ca-125, ultrasound and menopausal status for the accurate preoperative diagnosis of ovarian cancer. Br J Obstet Gynaecol 1990; 97:922-929.
10. Timmerman D, Van Calster B, Valentin L. Ovarian cancer prediction in adnexal masses using ultrasound-based logistic regression models: a temporal and external validation study by the IOTA group. Ultrasound Obstet Gynecol 2010; 36:226-234.
11. Timmerman D, Testa AC, Bourne T, Ferrazzi E, Ameye L, Konstantinovic ML, Van Calster B, Collins WP, Vergote I, Van Huffel S, Valentin L; International Ovarian Tumor Analysis Group. Logistic regression model to distinguish between the benign and malignant adnexal mass before surgery: a multicenter study by the International Ovarian Tumor Analysis Group. J ClinOncol 2005; 23: 8794-8801.
12. Kurjack A, Fleischer AC. Doppler Ultrasound in Gynecology. Parthenon Publishing Group, 1998, New York.
13. Alcazar JL, Castillo G, Jurado M, Lopez-Garcıa G. Intratumoral blood flow in cervical cancer as assessed by transvaginal color Doppler ultrasonography: Correlation with tumor characteristics. Int J Gynecol Cancer 2003; 13: 510-514.
14. Cheng WF, Wei LH, Su YN, Cheng SP, Chu JS, Lee CN. The possible use of colour flow Doppler in planning treatment in early invasive carcinoma of the cervix. Br J Obstet Gynaecol 1999; 106: 1137-1142.
15. Testa AC, Ferrandina G, Distefano M, Fruscella E, Mansueto D, Basso D, Salutari V, Scambia G. Color Doppler velocimetry and three-dimensional color power angiography of cervical carcinoma. Ultrasound Obstet Gynecol 2004; 24: 445-452.
16. Testa AC, Ciampelli M, Mastromarino C, Lopez R, Zannoni G, Ferrandina G, Scambia G. Intratumoral color Doppler analysis in endometrial carcinoma: is it clinically useful? Gynecol Oncol 2003; 88: 298-303.
17. Joshi, M., Ganesan, K., Munshi, H., Ganesan, S. and Lawande, A. (2008). Ultrasound of Adnexal Masses. Seminars in Ultrasound, CT and MRI, 29(2), pp.72-97.
18. Timor-Tritsch IE, Lerner JP, Monteagudo A, et al: Transvaginal ultrasonographic characterization of ovarian masses by means of color flowdirected Doppler measurements and a morphologic scoring system. Am J Obstet Gynecol 168:909-913, 1993.
19. Bhatt S, Dogra V: Doppler imaging of the uterus and adnexae. Ultrasound Clin 1:201-221, 2006.
20. Shah, D., Shah, S., Parikh, J., Bhatt, C., Vaishnav, K. and Bala, D. (2012). Doppler Ultrasound: A Good and Reliable Predictor of Ovarian Malignancy. J Obstet Gynecol India, 63(3), pp.186-189.
21. Buamah P. Benign conditions associated with raised serum CA-125 concentration. J Surg Oncol 2000;75:264-5.
22. Bristow RE, Smith A, Zhang Z, Chan DW, Crutcher G, Fung ET, et al. Ovarian malignancy risk stratification of the adnexal mass using a multivariate index assay. Gynecol Oncol 2013;128: 252-259.
23. Ueland FR, Desimone CP, Seamon LG, et al. Effectiveness of a multivariate index assay in the preoperative assessment of ovarian tumors. Obstet Gynecol. 2011; 117(6):1289-1297.
24. Longoria TC, Ueland FR, Zhang Z, et al. Clinical performance of a multivariate index assay for detecting early-stage ovarian cancer. Am J Obstet Gynecol 2014;210:78.e1-9.
25. Valentin L, Hagen B, Tingulstad S, Eik-Nes S. Comparison of ‘pattern recognition’ and logistic regression models for discrimination between benign and malignant pelvic masses: a prospective cross validation. Ultrasound Obstet Gynecol 2001; 18: 357-365.
26. Karst AM, Levanon K, Drapkin R. Modeling high-grade serous ovarian carcinogenesis from the fallopian tube. Proc Natl Acad Sci USA 2011;108:7547-52.
27. Kurman RJ. Origin and molecular pathogenesis of ovarian high-grade serous carcinoma. Ann Oncol 2013;24(Suppl 10):x16-21.
28. Nezhat FR, Pejovic T, Reis FM, Guo SW. The link between endometriosis and ovarian cancer: clinical implications. Int J Gynecol Cancer 2014;24:623-8.
29. Przybycin CG, Kurman RJ, Ronnett BM, Shih IM, Vang R. Are all pelvic (nonuterine) serous carcinomas of tubal origin? Am J Surg Pathol 2010;34:1407-16.
30. Crum CP, Drapkin R, Miron A, et al. The distal fallopian tube: a new model for pelvic serous carcinogenesis. Curr Opin Obstet Gynecol 2007;19:3-9.
31. Crum CP,McKeon FD, XianW. The oviduct and ovarian cancer: causality, clinical implications, and “targeted prevention”. Clin Obstet Gynecol 2012;55:24-35.
32. Kindelberger DW, Lee Y, Miron A, et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: evidence for a causal relationship. Am J Surg Pathol 2007;31:161-9.
33. Kristjansdottir, B., Levan, K., Partheen, K. and Sundfeldt, K. (2013). Diagnostic performance of the biomarkers HE4 and CA125 in type I and type II epithelial ovarian cancer. Gynecologic Oncology, 131(1), pp.52-58.
34. Moyer VAUS Preventive Services Task Force. Screening for ovarian cancer: U.S. Preventive Services Task Force reaffirmation recommendation statement. Ann Intern Med 2012;157: 900-4.
35. Castle PE. Gynecological cancer: more evidence supporting human papillomavirus testing. Nat Rev Clin Oncol 2012;9:131-2.
36. Buys SS, Partridge E, Greene MH, et al. Ovarian cancer screening in the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial: findings fromthe initial screen of a randomized trial. Am J Obstet Gynecol 2005;193:1630-9.
37. Buys SS, Partridge E, Black A, et al. Effect of screening on ovarian cancer mortality: the Prostate, Lung, Colorectal and Ovarian (PLCO) cancer screening randomized controlled trial. JAMA 2011;305:2295-303.
38. van Nagell Jr JR, DePriest PD, Ueland FR, et al. Ovarian cancer screening with annual transvaginal sonography: findings of 25,000 women screened. Cancer 2007;109:1887-96.



