Tumori ovariene cu celule granuloase
Granulosa cell tumor of the ovary
Abstract
Granulosa cell tumor of the ovary (TCG) in female adults is often a stromal neoplasm, hormone based, which is characterized by its capacity to produce sexual steroids, such as estrogen. TCGs are characterized by a long-term development, as well as the possibility of recurrence. The common symptoms are limited to the level of estradiol, vaginal bleeding and early puberty. TCG is a vascularized tumor which may lead to abdominal pain, hemoperitoneum and low blood pressure, often suggestive of or mistaken for an extra-uterine pregnancy in young females. The surgery is recommended in order to set the histologic, staging notation system and tumor-removal coordinates. The most important factor to prognosticate a possible recurrence of the tumor is the cancer staging. The post-procedure treatment for patients who present a high risk has not been subject to random prospective clinical studies, because they are difficult to run due to the rarity of the tumor. Yet, chemotherapy or radiotherapy sometimes have led to long-term survival for the patients with high risk, without any symptoms of the disease. Due to a quite imminent recurrence, long-term investigations are imperative.Keywords
neoplasmtumor markerspost-procedure treatmentrecurrenceRezumat
Tumora ovariană cu celule granuloase (TCG) la adulţi este deseori un neoplasm celular stromal, activ hormonal, care se distinge prin capacitatea sa de a secreta steroizi sexuali, cum ar fi estrogenul. TCG sunt caracterizate printr-o istorie naturală lungă şi tendinţa de a se repeta după ani de la diagnosticul iniţial. Se manifestă cu simptome şi semne datorate secreţiei de estradiol, inclusiv hemoragii vaginale şi pubertate precoce. TCG este o tumoră vasculară care se poate rupe ocazional şi duce la dureri abdominale, hemoperitoneu şi hipotensiune arterială, mimând o sarcină extrauterină la pacientele mai tinere. Intervenţia chirurgicală este pilonul de bază al managementului iniţial pentru diagnosticul histologic, stadializare corespunzătoare şi rezecţia chirurgicală. Cel mai important factor de prognostic asociat cu un risc crescut de recidivă este stadiul bolii. Valoarea tratamentului adjuvant postoperatoriu pentru pacientele cu risc ridicat nu a fost investigată prin studii clinice prospective randomizate, care sunt dificil de efectuat din cauza rarităţii acestei tumori. Cu toate acestea, utilizarea chimioterapiei adjuvante sau a radiaţiilor a fost uneori asociată cu supravieţuirea prelungită fără semne de boală a pacientelor cu caracteristici de risc ridicat. Ca urmare a tendinţei lor de a se repeta după ani de la diagnosticul iniţial, supravegherea prelungită este esenţială.Cuvinte Cheie
neoplasmmarkeri tumoralitratament adjuvantrecidivăIntroducere
Tumorile ovariene cu celule granuloase (TCG) sunt neoplasme mai puţin frecvente, care apar din celule stromale de cordoane sexuale ale ovarului şi reprezintă 2% până la 5% din totalul cazurilor de cancer ovarian(1,2). Acest neoplasm este împărţit în tipuri adulte şi juvenile, în funcţie de diferite caracteristici clinice şi histopatologice. TCG juvenilă reprezintă doar 5% din acest tip de tumoră şi apare, de obicei, la fete aflate la prepubertate şi la femei mai tinere de 30 de ani(3,4). Vârsta medie la diagnosticarea TCGJ a fost raportată la 8-9 ani şi 13-17 ani, în seriile alcătuite din fete mai mici de 16 ani(5) şi, respectiv, în seriile care includ adulţi(6). Aceste paciente pot prezenta o pseudopubertate precoce izosexuală sau dureri abdominale şi pelviene din cauza unei mase pelviene mari. Pacientele cu TCG juvenilă se prezintă, de obicei, într-un stadiu incipient şi au un prognostic favorabil, deşi cele cu boală în stadiu mai avansat pot suferi o evoluţie clinică mai agresivă(3,4,7). La pacientele mai în vârstă, TCGJ activ hormonală poate provoca tulburări ale ciclului menstrual şi, rar, virilizare. La toate pacientele, umflarea abdomenului, dureri şi o masă palpabilă la nivelul abdomenului inferior sunt simptome importante. În 10% dintre cazuri, TCGJ se poate rupe şi, astfel, primul simptom poate fi reprezentat de dureri abdominale acute. Ascita este prezentă la 10% dintre paciente(8). TCG sunt bilaterale la doar 3% dintre paciente şi, în majoritatea cazurilor, sunt limitate la ovar la momentul diagnosticului.
Epidemiologie
TCG apar la orice vârstă, dar cel mai frecvent la femei cu vârstă reproductivă şi la femeile care sunt la menopauză(1,9,10,11). O serie de factori de risc prezumtivi a fost asociată cu dezvoltarea TCG, deşi majoritatea acestora nu sunt reproductibili şi au o semnificaţie clinică sau biologică necunoscută. De exemplu, starea de menopauză şi paritate nu par să influenţeze riscul(1,12,13,14,15). Alţi factori, cum ar fi utilizarea medicamentelor pentru fertilitate sau a contraceptivelor orale, nu sunt asociaţi în mod constant cu un risc mai mare(16,17). Spre deosebire de cancerul ovarian epitelial, nu pare să existe vreo predispoziţie moştenită cunoscută pentru dezvoltarea acestei tumori. În special mutaţii ale liniei germinale BRCA1 sau BRCA2 moştenite nu au fost asociate până în prezent unui risc mai mare de dezvoltare a TCG(9).
Prezentare clinică
Sângerarea postmenopauzală este un semn comun(1,8,11,12,13) şi este cauzată de expunerea prelungită a endometrului la estradiol derivat tumoral, rezultând hiperplazie endometrială sau adenocarcinom endometrial(1,19,20). În grupa de vârstă reproductivă, pacientele pot prezenta tulburări ale ciclului menstrual, menoragie, sângerări intermenstruale sau amenoree(8,12). Ocazional, carcinomul endometrial poate fi diagnosticat întâmplător în momentul stadializării chirurgicale efectuate pentru TCG. Carcinomul endometrial asociat TCG este, de obicei, bine diferenţiat, timpuriu şi asociat cu un bun prognostic(1,3,10).
Pacientele pot descrie dureri abdominale sau dureri pelviene persistente, localizate, uneori asociate cu distensie abdominală dintr-o masă ovariană mare. Un debut mai acut al durerii pelviene poate fi rezultatul unei torsiuni ovariene. Din cauza naturii sale vasculare, TCG se poate prezenta, ocazional, cu ruptură hemoragică a tumorii în cavitatea abdominală, uneori mimând o sarcină extrauterină ruptă(11,12,20). Femeile premenopauzale care se prezintă în acest mod resimt debutul acut al durerii abdominale, distensie abdominală şi hipotensiune arterială cauzată de dezvoltarea hemoperitoneului.
Examinări paraclinice
O evaluare cu ultrasunete este următorul pas rezonabil la o femeie cu o masă pelviană, pentru a confirma rezultatele examinării fizice şi pentru a obţine informaţii calitative cu privire la masă. Ultrasonografia efectuată pentru TCG poate dezvălui o masă chistică ecogenică, septată, de dimensiuni mari, care apare din ovar(21,22), sau formaţiunea poate părea ca fiind de natură solidă. La pacientele care se prezintă cu sângerare postmenopauzală, o biopsie uterină este necesară pentru a exclude un adenocarcinom concomitent. Investigaţiile markerilor tumorali, cum ar fi estradiolul şi inhibina, nu se obţin de obicei preoperator, deoarece natura histologică a diagnosticului nu este adesea suspectată. Pacientele cu o masă ovariană suspectă pentru boli maligne pe baza constatărilor clinice şi ecografice necesită o intervenţie chirurgicală iniţială pentru diagnosticul definitiv de ţesut, stadializare şi tratament.
Markeri tumorali
Estradiolul a fost identificat ca fiind una dintre primele substanţe secretate de TCG şi este responsabil pentru unele dintre manifestările clinice descrise anterior. Această observaţie a condus la sugestia timpurie că estradiolul ar putea servi drept posibil marker tumoral pentru TCG(23), deşi s-a dovedit ulterior că nu este un marker fiabil al activităţii bolii la toate pacientele. Rey şi colab.(24) nu au constatat nicio corelaţie între nivelurile de estradiol şi evoluţia bolii. TCG nu produce estradiol în aproximativ 30% dintre cazuri, din cauza lipsei de celule tecale în stroma tumorală.
De aceea, cu toate că estradiolul poate fi de ajutor în monitorizarea stării unor paciente, nu este întotdeauna suficient de sensibil pentru a servi ca marker tumoral de încredere în cazul acestei boli. În cazul rar al unei TCG secretoare de androgeni, poate fi, de asemenea, posibil să se utilizeze testosteron sau precursorii săi ca un marker tumoral.
Inhibina este un hormon polipeptidic heterodimer produs de celulele granuloase ale foliculilor ovarieni normali şi este un regulator puternic de feedback negativ al secreţiei hormonului foliculo-stimulant (SHF) de către glanda pituitară anterioară.
Inhibina este un hormon glicoproteină dimerică ovariană care include a- şi una dintre cele două subunităţi b (bA - care dă inhibina-A sau bB - care dă inhibina-B)(25).
Autorii au ajuns la concluzia că inhibina este un marker tumoral mai fiabil al activităţii bolii decât estradiolul. Aceste rezultate au fost confirmate de alţi cercetători(26,27).
Proteina de reglare foliculară (PFR) este secretată de celulele granuloase şi în mod normal este prezentă în limfa unei femei cu menstruaţie regulată. Reglarea secreţiei PFR are loc cu diferenţierea celulei granuloase. Niveluri crescute de PFR au fost detectate la unele paciente cu TCG(28). Importanţa clinică a acestui marker nu este încă cunoscută.
Substanţa inhibitoare mülleriană (SIM), numită şi hormonul antimüllerian, a apărut recent ca posibil marker tumoral pentru TCG. La bărbaţi, este produsă de celulele testiculare Sertoli şi determină regresia ductelor mülleriane fetale. La femei, SIM este produsă de celulele granuloase din foliculii în dezvoltare ai ovarului. Prin urmare, nivelurile SIM sunt crescute într-un mod ciclic de-a lungul vieţii reproductive, dar devin nedetectabile în perioada postmenopauză. Utilizarea SIM ca marker tumoral pentru TCG a fost studiată de mai mulţi cercetători(24,29). Deşi utilitatea clinică a SIM este încă în curs de investigare, studiile indică faptul că acest hormon poate fi un marker util al activităţii TCG.
Patologie
TCG sunt tumori solide, moi sau ferme, în funcţie de cantităţile relative ale celulelor neoplazice şi stromei fibrotecomate pe care acestea le conţin, şi sunt galbene sau gri, în funcţie de cantitatea de lipide intracelulare din leziune. Mai frecvent, TCG este predominant chistică, iar la examenul extern poate semăna cu chistadenom mucinos sau chistadenocarcinom. La microscop, TCG este alcătuită din celule granuloase, care apar singure sau în combinaţie cu alte elemente din cordoanele sexuale stromale. Aceste celule granuloase sunt mici, palide, rotunde sau ovale, cu nuclee caracteristice de tip „boabe de cafea”, care se referă la şanţul longitudinal nuclear observat în multe celule tumorale. Corpii Call-Exner sunt caracteristici pentru TCG şi apar în 30% până la 60% dintre cazuri(10,11,12). Aceşti corpi sunt mici zone chistice de resturi de fluid şi de celule înconjurate de celule granuloase bine diferenţiate.
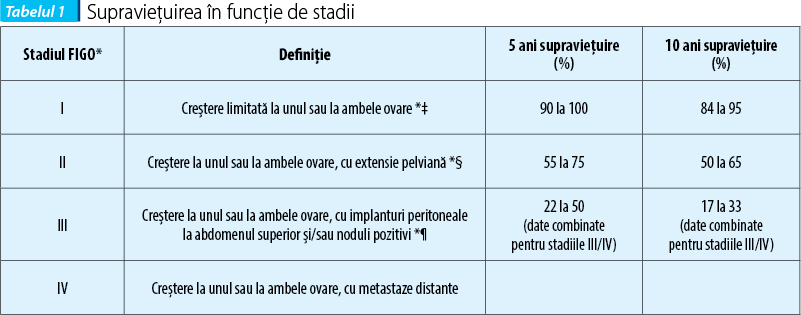
Factori prognostici
Identificarea factorilor prognostici este valoroasă în luarea deciziilor postoperatorii. O serie de factori clinici, patologici şi moleculari au fost propuşi pentru TCG, deşi reproductibilitatea mai multor factori a fost dificil de stabilit. Evoluţia lor clinică se caracterizează printr-o creştere indolentă, care duce la dimensiunea mare a tumorii la momentul diagnosticului, cu toate că la majoritatea pacientelor tumora este încă limitată la ovar. Singurul factor clinic legat în mod neechivoc de recurenţă este stadiul(12,10-13,14,28).

Tratament
Managementul chirurgical
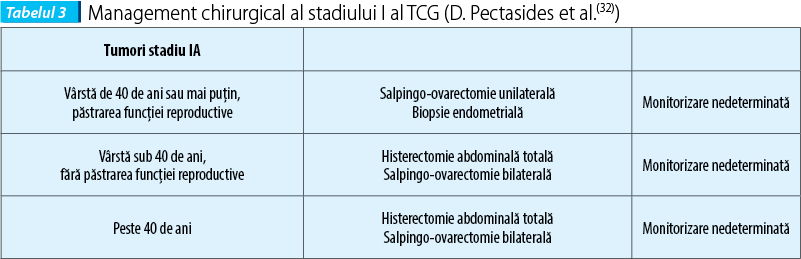
Tratamentul chirurgical a fost în mod tradiţional similar cu cel utilizat pentru cancerul ovarian epitelial. Pacientele cu TCG se prezintă, în general, cu boala în stadiul I (78-91%), în timp ce restul prezintă boală avansată(1,12,11,13,30,31). Rareori, pacientele se pot prezenta cu boală metastatică care implică ficatul, plămânii sau oasele. Sistemul de stadializare utilizat pentru TCG este cel aplicat pentru cancerul ovarian epitelial. Deoarece majoritatea pacientelor se prezintă cu boala în stadiu incipient, de obicei limitată la ovar, o SOU ar trebui să se efectueze, în special în cazul în care pacienta doreşte să-şi păstreze fertilitatea. La acele paciente a căror fertilitate nu este o problemă sau la cele cu boală mai avansată ar părea rezonabil să se efectueze HAT SOU.
Tratamentul postoperator
Pacientele cu stadiul I al TCG au adesea un prognostic excelent, cu supravieţuire pe termen lung fără boală de 90%, iar majoritatea acestor paciente nu necesită în continuare tratament adjuvant postoperatoriu(11-13,15). În schimb, terapia postoperatorie este adesea luată în calcul la pacientele cu un prognostic mai nefavorabil, din cauza prezenţei bolii mai avansate. Astfel, pacientele cu stadiile II, III şi IV de TCG au un prognostic de supravieţuire mai puţin favorabil pe termen lung (figura 1) şi sunt adesea considerate ca fiind candidaţii rezonabili pentru tratamentul postoperatoriu. În plus, pacientele selectate cu boala în stadiul I asociată cu o dimensiune mare a tumorii, IM ridicat sau ruptură a tumorii pot prezenta un risc mai mare de recidivă şi ar putea fi, de asemenea, luate în considerare pentru tratament adjuvant.
Nu se cunoaşte încă dacă utilizarea tratamentului postoperatoriu la pacientele cu TCG cu risc ridicat poate conferi, de fapt, un avantaj de supravieţuire. Deciziile tratamentului adjuvant postoperatoriu se bazează pe riscul estimat de recidivă (sau riscul de progresie a bolii simptomatice), cu observaţia că tratamentul adjuvant poate duce la prelungirea supravieţuirii fără boală la cel puţin unele dintre pacientele cu risc ridicat.
Radioterapia
Mai multe studii au demonstrat o asociere între utilizarea radioterapiei şi supravieţuirea prelungită fără boală la pacientele cu TCG avansată sau recurentă(15,33,34-36). Cu toate acestea, în prezent nu există date prospective, randomizate, care să definească valoarea radioterapiei în tratamentul acestei boli. Mai mult decât atât, nu este clar dacă este necesară radioterapia asupra întregului abdomen, în cazul în care radioterapia este luată în considerare în regiunea adjuvantă. De asemenea, este neclară doza care trebuie administrată pentru tratarea acestor paciente.
Chimioterapia
Terapia postoperatorie adjuvantă rămâne controversată din cauza numărului mic de paciente din orice serie raportată. Pentru pacientele considerate a fi bune candidate pentru tratamentul postoperatoriu, chimioterapia pe bază de platină este adesea luată în calcul. Cu toate că radioterapia adjuvantă poate fi luată în considerare pentru pacientele cu tumori reziduale cu volum redus, datele din literatura de specialitate nu permit concluzii ferme în ceea ce priveşte faptul dacă radioterapia este superioară chimioterapiei în stabilirea cadrului adjuvant. Chimioterapia şi terapia hormonală au fost adesea luate în considerare pentru pacientele care aveau stadiu avansat/inoperabil (stadiile II, III, IV) sau boală recurentă, unde o altă intervenţie chirurgicală sau radioterapia nu pot fi urmate din motive medicale sau tehnice.
Tumora ovariană cu celule granuloase
1. Presupune stadializare chirurgicală adecvată.
2. Pacientele cu boală în stadiul IA nu necesită, în general, nicio terapie postoperatorie adjuvantă. Cu toate acestea, există o controversă în ceea ce priveşte semnificaţia prognosticului în cazul dimensiunilor mari (de exemplu, diametru >10-15 cm) şi/sau a ratei mitotice ridicate (de exemplu, ≥4 la 10 mitoze pe 10 câmpuri de mare putere). Astfel, la pacientele selectate cu stadiul IA TCG, este rezonabil să se ia în considerare tratamentul adjuvant dacă o caracteristică sau ambele sunt prezente, cu toate că beneficiul este nedovedit.
3. Ruptura tumorii, dimensiunea mare şi/sau rata mitotică ridicată, aşa cum este definit mai sus, poate identifica un grup de paciente cu risc mai mare în stadiul I TCG care pot fi luate în considerare pentru tratamentul adjuvant. Semnificaţia de prognostic a altor caracteristici, cum ar fi citologie pozitivă sau implicarea suprafeţei, nu este bine definită, iar decizia de a folosi tratament adjuvant pe baza unor astfel de caracteristici ar trebui să fie individualizată.
4. BEP: bleomicină, etopozidă, cisplatină; EP: etoposidă, cisplatină; PAC: ciclofosfamidă, doxorubicină, cisplatină.

5. Nu se cunoaşte dacă vreo formă de tratament adjuvant conferă un avantaj de supravieţuire la pacientele cu TCG. În mod similar, de asemenea, nu se cunoaşte dacă schemele terapeutice în asociere pe bază de platină sunt superioare faţă de agentul de platină individual (cisplatina sau carboplatina) în această circumstanţă.
6. Valoarea altor medicamente, cum ar fi paclilaxel, în configurarea rezistenţei la platină este în prezent în curs de investigare.
Monitorizare şi managementîn tumori recurente
Pacientele cu TCG necesită o supraveghere pe termen lung, deoarece timpul mediu de recidivă este de aproximativ 4 până la 6 ani după diagnosticare(1,13,14,37,38,37). Cronje şi colab.(38) au constatat că 17% dintre recurenţe în seria lor au avut loc la mai mult de 10 ani de la diagnosticare. Mai multe rapoarte menţionează, de asemenea, recidive care apar la mai mult de 20 de ani(1,39,37). Natura indolentă a acestei tumori şi tendinţa sa pentru recidivă târzie necesită o monitorizare prelungită a pacientei cu istoric, examen fizic şi studii cu marker tumoral, cum ar fi inhibina şi estradiolul. În ciuda lipsei de orientări stabilite, anumite principii ar trebui luate în considerare în managementul bolii recurente (tabelul 4).

Concluzii
TCG sunt neoplasme mai puţin frecvente, care sunt caracterizate de un istoric natural îndelungat şi tendinţa de a se repeta după ani de la diagnosticul iniţial. Acestea se prezintă cu simptome şi semne datorate secreţiei de estradiol, inclusiv hemoragii vaginale şi pubertate precoce.
Ocazional, ruptura tumorii provoacă dureri abdominale şi hemoperitoneu.
TCG este, de obicei, asociată cu o masă la examinarea pelviană, care ulterior se confirmă prin tehnici de imagistică.
Tratamentul iniţial este o intervenţie chirurgicală necesară pentru diagnosticul histologic, stadializare corespunzătoare şi chirurgie de rezecţie.
La pacientele cu boala în stadiul I şi la cele de vârstă reproductivă este indicată o intervenţie chirurgicală mai conservatoare, inclusiv salpingo-ovarectomie unilaterală.
La femeile la postmenopauză şi la cele cu stadiu mai avansat al bolii este indicată o histerectomie abdominală totală cu salpingo-ovarectomie.
Deoarece majoritatea pacientelor cu TCG se prezintă cu boala în stadiul I, prognosticul este excelent. În stadii mai avansate şi în cele cu grad ridicat de risc al bolii în stadiul I (mari dimensiuni ale tumorii, IM ridicat, tumoră ruptă), prognosticul este mai puţin favorabil.
Chimioterapia trebuie luată în considerare pentru pacientele cu boală avansată recurentă sau metastatică, iar BEP este schema preferată în prezent.
Bibliografie
1. Evans 3rd AT, Gaffey TA, Malkasian Jr GD, Annegers JF. Clinicopathologic review of 118 granulosa and 82 theca cell tumors. Obstet Gynecol 1980;55(2):231–8.
2. Unkila-Kallio L, Tiitinen A, Wahlstrom T, Lehtovirta P, Leminen A. Reproductive features in women developing ovarian granu-losa cell tumour at a fertile age. Hum Reprod 2000;15(3):589–93.
3. Young RH, Dickersin GR, Scully RE: Juvenile granulosa cell tumors of the ovary: A clinicopathologic anaysis of 125 cases. Am J Surg Pathol, 1984;8:575-96.
4. Calaminus G, Wessalowski R, Harms K, et al: Juvenile granulosa cell tumor of the ovary in children and adolescents: Results from 33 patients registered in a prospective cooperative study. Gynecol Oncol, 1997;65:447-52
5. Vassal G, Flamant F, Caillaud JM, Demeocq F, Nihoul-Fekete C, Lemerle J. Juvenile granulosa cell tumor of the ovary in children: a clinical study of 15 cases. J Clin Oncol 1988;6(6):990–5.
6. Biscotti CV, Hart WR. Juvenile granulosa cell tumors of the ovary. Arch Pathol Lab Med 1989;113(1):40–6.
7. Powell JL, Johnson NA, Bailey CL, et al: Management of advanced juvenile granulosa cell tumors of the ovary. Gynecol Oncol, 1993;48:119-23.
8. Cronje HS, Niemand I, Bam RH, Woodruff JD. Granulosa and theca cell tumors in children: a report of 17 cases and literature review. Obstet Gynecol Surv 1998;53(4):240–7.
9. Schumer ST, Cannistra SA. Granulosa cell tumor of the ovary. J Clin Oncol 2003;21(6):1180–9.
10. Bjorkholm E, Silfversward C. Prognostic factors in granulosa-cell tumors. Gynecol Oncol 1981;11(3):261–74.
11. Stenwig JT, Hazekamp JT, Beecham JB. Granulosa cell tumors of the ovary. A clinicopathological study of 118 cases with long-term follow-up. Gynecol Oncol 1979;7(2):136–52.
12. Fox H, Agrawal K, Langley FA: A clinicopathologic study of 92 cases of granulosa cell tumor of the ovary with special reference to the factors influencing prognosis. Cancer, 1975; 35:231-41.
13. Malmstrom H, Hogberg T, Risberg B, et al: Granulosa cell tumors of the ovary: Prognostic factors and outcome. Gynecol Oncol, 1994, 52:50-5.
14. Miller BE, Barron BA, Wan JY, et al: Prognostic factors in adult granulosa cell tumors of the ovary. Cancer, 1997; 79:1951-5.
15. Savage P, Constenla D, Fisher C, et al: Granulosa cell tumors of the ovary: Demographics, survival and the management of advanced disease. Clin Oncol (R Coll Radiol), 1998,10:242-5.
16. Willemsen W, Kruitwagen R, Bastiaans B, et al: Ovarian stimulation and granulosa-cell tumor. Lancet, 1993; 341:986-8.
17. The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development: The reduction in risk of ovarian cancer associated with oral-contraceptive use. N Engl J Med, 1987; 316:650-5
18. Pankratz E, Boyes DA, White GW, et al: Granulosa cell tumors: A clinical review of 61 cases. Obstet Gynecol, 1978; 52:718-23.
19. Brătilă E, Coroleucă CB, Coroleucă CA, Comandaşu DE, Mehedinţu C, Bohîlţea R, Cîrstoiu M, Mitran M, Berceanu C. Rolul examinării Doppler in evaluarea patologiei ovariene. Ginecologia.ro, 2016; 4(14): 46-54.
20. Griffiths CT, Koelliker DD. Case records of the Massachusetts General Hospital: Weekly clinico-pathological exercises-Case 10-1995, a 56-year-old woman with abdominal pain, anemia, and a pelvic mass. N Engl J Med, 1995;332:876-81.
21. Ko SF, Wan YL, Ng SH, et al: Adult ovarian granulosa cell tumors: Spectrum of sonographic and CT findings with pathologic correlation. Am J Roentgenol 1999; 172:1227-3.
22. Bohîlţea RE, Cîrstoiu M, Brătilă E, Bohîlţea LC, Ionescu CA, Turcan N, Turcan Gh, Mitran M, Vladăreanu R. Raport de examinare ginecologică bazat pe consensul grupurilor internaţionale de studiu al tumororilor. Ginecologia.ro, 2017; 5(15):48-56.
23. Kaye SB, Davies E. Cyclophosphamide, adriamycin, and cis-platinum for the treatment of advanced granulosa cell tumor, using serum estradiol as a tumor marker. Gynecol Oncol, 1986;24:261-4.
24. Rey RA, Lhomme C, Marcillac I, Lahlou N, Duvillard P, Josso N, et al. Antimullerian hormone as a serum marker of granulosa cell tumors of the ovary: comparative study with serum alpha-inhibin and estradiol. Am J Obstet Gynecol, 1996;174(3): 958–65.
25. Burger HG. What do inhibin measurements tell a clinician today? Ann Med, 1992;24(6):419–21.
26. Healy DL, Burger HG, Mamers P, Jobling T, Bangah M, Quinn M, et al. Elevated serum inhibin concentrations in postmeno-pausal women with ovarian tumors. N Engl J Med. 1993;329(21): 1539–42.
27. Boggess JF, Soules MR, Goff BA, Greer BE, Cain JM, Tamimi HK. Serum inhibin and disease status in women with ovarian granulosa cell tumors. Gynecol Oncol, 1997;64(1):64–9.
28. Rodgers KE, Marks JF, Ellefson DD, Yanagihara DL, Tonetta SA, Vasilev SA, et al. Follicle regulatory protein: a novel marker for granulosa cell cancer patients. Gynecol Oncol, 1990;37(3): 381–7.
29. Lane AH, Lee MM, Fuller AF, et al: Diagnostic utility of mullerian inhibiting substance determination in patients with primary and recurrent granulosa cell tumors. Gynecol Oncol, 1999;73:51-5.
30. Segal R, DePetrillo AD, Thomas G. Clinical review of adult granulosa cell tumors of the ovary. Gynecol Oncol, 1995; 56(3):338–44.
31. Fontanelli R, Stefanon B, Raspagliesi F, Kenda R, Tomasic G, Spatti G, et al. Adult granulosa cell tumor of the ovary: a clinico pathologic study of 35 cases. Tumori, 1998;84(1):60–4.
32. Pectasides D, Pectasides E, Psrry A. Granulosa cell tumor of the ovary, Cancer treat rev, 2008;34(1):1-12.
33. Schwartz PE, Smith JP: Treatment of ovarian stromal tumors. Am J Obstet Gynecol, 1976;125:402-8.
34. Wolf JK, Mullen J, Eifel PJ, et al: Radiation treatment of advanced or recurrent granulosa cell tumor of the ovary. Gynecol Oncol, 1999;73:35-41.
35. Engle RB. Roentgen treatment of granulosa cell carcinoma of the ovary. AJR Am J Roentgenol, 1958; 80:793-8.
36. Lee IW, Levin W, Chapman W, et al. Radiotherapy for the treatment of metastatic granulosa cell tumor in the mediastinum: A case report. Gynecol Oncol, 1999; 73:455-60.
37. Hines JF, Khalifa MA, Moore JL, et al. Recurrent granulosa cell tumor of the ovary 37 years after initial diagnosis: A case report and review of the literature. Gynecol Oncol, 1996;60:484-8.
38. Cronje HS, Niemand I, Bam RH, et al: Review of the granulosa-theca cell tumors of the Emil Novak ovarian tumor registry. Am J Obstet Gynecol, 1999;180:323-7.
39. Piura B, Nemet D, Yanai-Inbar I, et al. Granulosa cell tumor of the ovary: A study of 18 cases. J Surg Oncol, 1994; 55:71-7.
40. Fujimoto T, Sakuragi N, Okuyama K, et al. Histopathologic prognos-tic factors of adult granulosa cell tumors of the ovary. Acta Obstet Gynecol Scand, 2001;80:1069-74.
41. Lauszus FF, Peterson AC, Greisen J, et al. Granulosa cell tumor of the ovary: A population based study of 37 women with stage I disease. Gynecol Oncol, 2001;81:456-60.

