Component-resolved diagnosis (CRD) has improved in the last years due to the production of standardized testing materials such as purified natural allergens and recombinant proteins, produced by techniques of genetic engineering. CRD has several advantages, such as the ability to identify markers of genuine, primary sensitization, but also to indicate cross-reactivity, an improved analytical sensitivity of the assay when the allergen molecules are of low abundance or missing in the extract, avoidance of exposure to risk- or severity-associated molecules, and also the evaluation of allergen-specific immunotherapy indications. The main disadvantage or limitation of this method is the fact that the vast information provided by molecular allergy needs a structured approach in order to be adequately interpreted. The article below presents the utility of component-resolved diagnosis in food allergies, as well as the molecular allergens from the main food allergen sources.
Diagnosticul molecular în alergiile alimentare
Component resolved diagnosis in food allergy
First published: 24 decembrie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.2.4.2018.2129
Abstract
Rezumat
Diagnosticul molecular al alergiilor (component-resolved diagnosis; CRD) s-a îmbunătăţit în ultimii ani datorită producţiei de materiale de testare standardizate, cum ar fi alergenele naturale purificate şi alergenele recombinate produse prin tehnici de inginerie genetică.
CRD prezintă mai multe avantaje, printre care se numără capacitatea de a indica sensibilizarea autentică, primară, dar şi reacţiile de sensibilizare încrucişată, îmbunătăţirea sensibilităţii analitice a metodei, în cazurile în care alergenele moleculare se găsesc în concentraţie scăzută sau sunt absente din extractele de alergene, evitarea expunerii pacientului la alergene asociate cu risc crescut de reacţii severe ori evaluarea indicaţiei de imunoterapie alergen-specifică. Principalul dezavantaj – sau limitare – al acestei metode este reprezentat de faptul că interpretarea în context clinic este uneori dificilă, din cauza cantităţii vaste de informaţii furnizate de diagnosticul alergiei bazat pe componente. În acest articol vor fi prezentate utilitatea diagnosticului molecular în alergiile alimentare, precum şi alergenele moleculare din principalele surse de alergene alimentare.
Diagnosticul alergiilor se bazează pe demonstrarea unei corelaţii între sensibilizarea la un anumit alergen – producţia de IgE specifice – şi istoricul de simptome care apar după expunerea la alergenul respectiv. Sensibilizarea poate fi dovedită prin teste in vivo (prick test) sau in vitro (IgE serice specifice).
La pacienţii cu suspiciune de reacţii şi/sau afecţiuni mediate de IgE, algoritmul de diagnostic ar trebui să includă următoarele etape:
-
Evaluarea clinică
-
istoricul bolii alergice, inclusiv informaţii despre comorbidităţi, diagnostice diferenţiale
-
examinare clinică.
-
-
Teste de evaluare a sensibilizării cu extracte de alergen, cum ar fi testele cutanate prick (skin prick tests; SPT), determinarea IgE serice sau teste de activare a bazofilelor (BAT).
-
Testul pentru evaluarea sensibilizării cu alergene moleculare (IgE alergen-specifice). Aceste rezultate trebuie interpretate pentru evidenţierea relevanţei clinice.
-
Teste de provocare (opţionale, în funcţie de sursa de alergen cauzatoare), pentru evidenţierea apariţiei simptomelor clinice la expunerea la alergen.
Este indicat ca în cadrul evaluării clinice să fie discutate elementele din tabelul 1, obţinând informaţii care pot orienta ulterior decizia medicală(1).
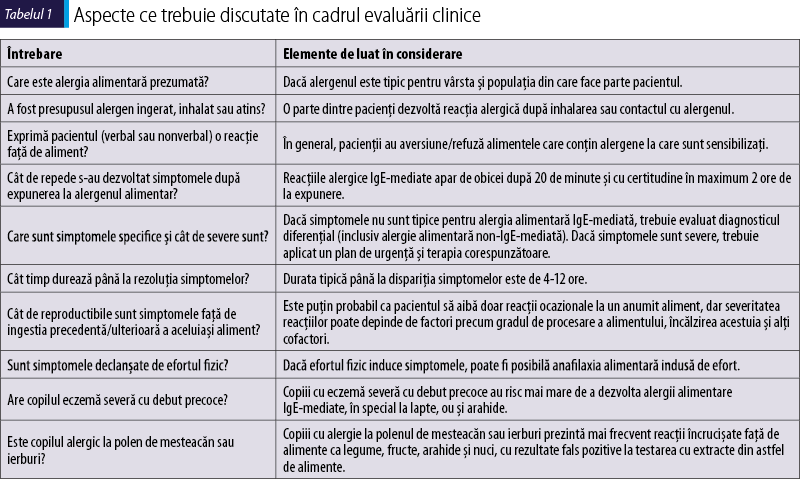
Extractele de alergene naturale au o compoziţie eterogenă şi pot conţine, alături de alergenele majore, şi alte molecule: alergene încrucişate, antigene nonalergenice şi alte molecule. Moleculele alergenice implicate în inducerea răspunsului alergic specific au fost descoperite şi introduse recent în practica medicală, iar utilizarea lor permite caracterizarea şi definirea exactă a profilului de sensibilizare, precum şi excluderea reactivităţii încrucişate faţă de panalergene(2).
Tehnologia de tip microarray se bazează pe alergene imprimate pe un cip de dimensiuni reduse, alergenele fiind purificate din surse naturale sau produse ca proteine recombinate(3). Ea permite identificarea profilurilor de reactivitate ale pacienţilor, cu determinarea moleculelor trigger pentru alergie şi a alimentelor la care pacientul va dezvolta manifestări clinice. Se poate, de asemenea, prezice severitatea reacţiilor induse de un anumit pattern de reactivitate (figura 1)(4).
Pot fi prezentate argumente pentru utilizarea alergenelor moleculare în locul extractelor alergenice. Acestea sunt în principal legate de performanţa îmbunătăţită a testului (sensibilitatea şi specificitatea analitică) şi/sau posibilitatea unor niveluri suplimentare de interpretare, cum ar fi evaluarea sau diferenţierea riscului între sensibilizarea reală şi reactivitatea încrucişată, în special când există suspiciunea de polisensibilizare. În timp ce aceste argumente susţin în mod clar utilizarea de alergene individuale în rutina clinică, interpretarea rezultatelor diagnosticului prin alergie moleculară trebuie făcută cu atenţie, pentru unele molecule alergenice fiind definite limite clare când vine vorba de prezicerea rezultatelor clinice. Rezultatele testului de sinteză – indiferent de utilizarea extractelor sau a moleculelor unice – reflectă doar starea de sensibilizare şi trebuie întotdeauna interpretate în contextul datelor clinice.
Există mai multe motive pentru care s-ar justifica utilizarea pentru diagnosticul alergiei a componentelor alergenice moleculare în loc de extracte(5):
-
prezenţa unor molecule în cantitate mică sau cu stabilitate redusă – astfel de molecule ar putea lipsi din extractul produs din sursa de alergen, aşa că ele pot îmbunătăţi sensibilitatea analitică (LoQ) a testului, utilizarea componentelor moleculare fiind semnificativă şi importantă pentru diagnostic (ex.: Gly m 4 vs. extract de soia, omega-5-gliadină Tri a 19 vs. extract de grâu);
-
existenţa unor alergene moleculare asociate cu riscul sau severitatea reacţiilor alergice – este justificată şi recomandată utilizarea unor componente moleculare, dacă acestea îmbunătăţesc specificitatea analitică şi oferă informaţii clinice suplimentare privind riscul de reacţii sistemice, gradarea severităţii alergiei sau alte caractere clinice ale bolii (ex.: proteinele de depozit Ara h 1, 2, 3, 6 vs. extract de arahide);
-
utilizarea ca indicatori de reacţii încrucişate a unor componente alergenice – un rezultat pozitiv de sensibilizare faţă de acestea poate fi interpretat ca lipsă de semnificaţie a rezultatului pozitiv faţă de extractul integral, la pacienţi cu potenţial de reacţii încrucişate (ex.: profiline, polcalcine, membri ai familiilor de panalergene);
-
prezenţa unor molecule marker de sensibilizare autentică (prin specificitate de specie) – anumite componente alergenice pot indica sensibilizarea autentică, primară, cu specificitate de familie sau de specie, astfel îmbunătăţind performanţa testelor in vitro comparativ cu utilizarea extractelor alergenice (ex.: alergenele marker Ves v 1 şi Ves v 5 din veninul de viespe sau Api m 1, Api m 3 şi Api m 10 din veninul de albină având performanţe diagnostice superioare faţă de preparatele din venin de himenoptere).
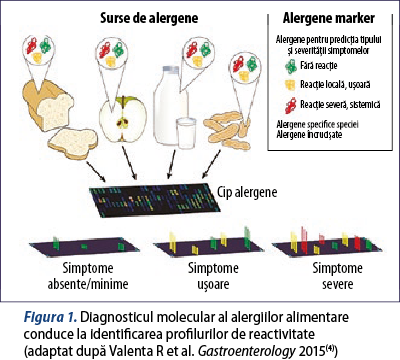
În tabelul 2 sunt prezentate principalele familii de proteine implicate în reacţiile alergice la alimente de origine vegetală.
Alergia la proteinele din laptele de vacă (Bos domesticus; Bos d)
Laptele de vacă este un produs lichid al glandelor mamare de bovine (Bos domesticus). Copiii şi adulţii consumă cantităţi sub formă lichidă, precum şi sub formă de diferite produse lactate, cum ar fi brânzeturile, untul, iaurtul sau smântâna. Majoritatea formulelor pentru sugari, inclusiv formulele hipoalergenice hidrolizate şi cele care conţin aminoacizi, au la bază laptele de vacă, acesta reprezentând de obicei prima proteină introdusă în alimentaţia sugarilor care nu sunt exclusiv alăptaţi. Laptele şi produsele lactate sunt principala sursă de proteine, calorii şi calciu din dieta sugarilor şi a copiilor sub vârsta de 2 ani. Proteinele laptelui de vacă sunt printre cele mai frecvente alergene alimentare la sugarii şi copiii cu alergie alimentară IgE-mediată şi non-IgE-mediată.
Prevalenţa alergiei la proteinele laptelui de vacă a fost estimată la 0,5‑7,5% în ţările occidentale(11-13), dar prevalenţa percepută este în cele mai multe cazuri mult mai mare decât cea reală. Proteinele laptelui de vacă sunt clasificate ca alergene alimentare din clasa I, dată fiind rezistenţa lor la digestie şi încălzire.
Proteinele din laptele de vacă au o omologie de secvenţă ridicată (> 80%) cu proteine din caprine şi ovine şi din acest motiv produc frecvent (> 90%) reacţii încrucişate cu aceste specii, dar produc rar (< 5%) reacţii încrucişate cu laptele de vacă, iapă sau cămilă(14).
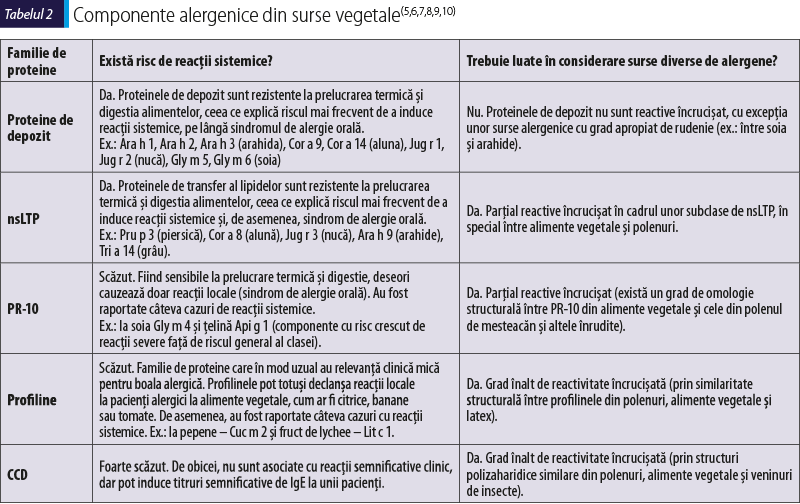
Laptele de vacă conţine aproximativ 30‑35 g de proteine pe litru. Sub influenţa chimozinei sau după acidifierea laptelui la pH de 4,6, proteinele se separă în două fracţiuni: fracţiunea coagulabilă, care conţine aproximativ 80% din proteine, şi zerul (lactoserul), care conţine aproximativ 20% din proteine (figura 2). Toate proteinele prezente în laptele de vacă se găsesc şi în laptele matern uman, cu excepţia beta-lactoglobulinei. Cazeinele, beta-lactoglobulina şi alfa-lactalbumina sunt considerate alergene majore. Majoritatea pacienţilor alergici la proteinele din laptele de vacă sunt polisensibilizaţi(15).
Cazeinele (Bos d 8) furnizează aminoacizi, carbohidraţi şi două elemente anorganice – calciu şi fosfor. Fracţiunea de cazeine este foarte rezistentă la temperaturi ridicate, putând lega IgE-urile specifice chiar şi după 90 minute de fierbere la >90 °C(16). Din acest motiv, prezenţa IgE-urilor specifice la cazeine indică risc crescut de reacţii alergice la toate produsele lactate şi se asociază cu persistenţa alergiei la lapte.
Zerul este un amestec de beta-lactoglobulină (~ 65%), alfa-lactalbumină (~ 25%), albumină serică bovină (~ 8%) şi imunoglobuline. Acestea sunt solubile în formele lor native, independent de pH. Sunt mai sensibile la încălzire decât cazeinele şi îşi pierd capacitatea de a lega IgE după 15-20 minute de fierbere la > 90 °C(10). Alfa-lactalbumina (Bos d 4) este o proteină prezentă în laptele aproape tuturor mamiferelor. La primate, exprimarea alfa-lactalbuminei este dependentă de prolactină.
Beta-lactoglobulina (Bos d 5) formează în condiţii fiziologice dimeri, dar disociază la formă monomerică la pH de 3. Nu a fost identificată nicio funcţie clară pentru beta-lactoglobulină, deşi se leagă de mai multe molecule hidrofobe, ceea ce sugerează un potenţial rol în transportul acestora. Beta-lactoglobulina este singura proteină din laptele de vacă absentă în laptele matern uman.
Albumina serică bovină (BSA, Bos d 6) este o proteină globulară, solubilă în apă, neglicozilată, care funcţionează în primul rând ca o proteină purtătoare pentru steroizi, acizi graşi şi hormoni tiroidieni în sânge şi joacă un rol important în stabilizarea volumului fluidului extracelular prin contribuţia la presiunea oncotică a plasmei. BSA prezintă omologie înaltă cu albumina serică umană şi cu albuminele altor specii, de exemplu pisică sau câine. BSA a fost identificat ca fiind unul dintre principalele alergene bovine şi este responsabil pentru reacţiile încrucişate dintre laptele de vacă şi carnea de vită(17).
Lactoferina este o proteină multifuncţională din familia transferinelor, care transferă fier în celule şi controlează nivelul de fier liber în sânge şi în secreţiile externe. Lactoferina este o glicoproteină globulară cu o masă moleculară de aproximativ 80 kDa, exprimată în diferite fluide secretate, cum ar fi laptele, saliva, lacrimile şi secreţiile nazale. De asemenea, este unul dintre componentele sistemului imunitar, având activitate antimicrobiană (bactericidă, fungicidă). Lactoferina reprezintă un alergen minor din laptele de vacă(15).
Alergia la oul de găină (Gallus domesticus; Gal d)
Oul de găină este o hrană omniprezentă, consumată în majoritatea părţilor lumii. Este o sursă de hrană ieftină şi uşor accesibilă, utilizată în multe feluri de mâncare şi utilizată pe scară largă de industria alimentară în alimentele procesate. Expunerea la proteinele din oul de găină se realizează în cea mai mare parte prin ingestie, dar aceste proteine se pot găsi şi în particule aerosolizate produse prin gătire.
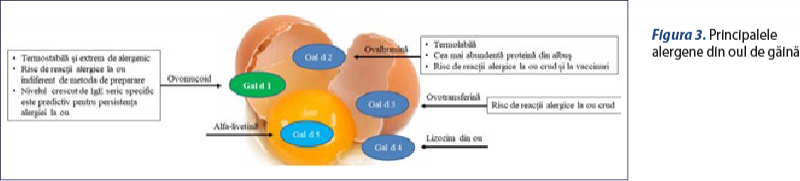
Până în prezent au fost identificate şi caracterizate cinci proteine implicate cel mai frecvent în reacţiile alergice la ouă de găină (Gal d 1 până la Gal d 5) (figura 3). S-a observat că albuşul este mai alergenic decât gălbenuşul. Deşi ovomucoidul (Gal d 1) se găseşte într-o cantitate mai mică în albuş decât ovalbumina, s-a demonstrat că acesta este cel mai important alergen(18). Determinarea componentelor albuşului este utilă pentru discriminarea între sensibilizare şi alergie clinic manifestă şi pentru discriminarea între alergia la ouă crude sau uşor încălzite şi cea la toate formele de ou (inclusiv preparat termic)(19).
Alergia la grâu (Triticum aestivum; Tri a)
Grâul (Triticum aestivum) poate fi considerat cea mai importantă sursă de hrană la nivel global. Comerţul mondial cu grâu este mai mare decât toate celelalte culturi laolaltă. Cele mai multe culturi alimentare consumă grâu ca o parte importantă a meselor zilnice, sub formă de pâine, paste, cereale pentru micul dejun, grâu, bulgur şi cuşcuş. Grâul conţine mai multe proteine decât alte două cereale importante la nivel mondial – porumbul şi orezul. Există mai multe clasificări ale speciilor şi subspeciilor de grâu, în care se includ peste 25000 de soiuri(20), dar nu par să existe diferenţe clinic semnificative în ceea ce priveşte alergenicitatea acestora.
Prevalenţa alergiei la grâu variază în funcţie de vârstă şi de regiune între 0,4% şi 4%(21). Cele mai tipice manifestări clinice ale alergiilor alimentare provocate de grâu includ alergia alimentară IgE-mediată şi boala celiacă. Aceasta din urmă este considerată o boală autoimună, din acest motiv nefiind inclusă în algoritmii clasici de tratament al alergiei şi fiind adesea tratată de gastroenterologi.
Determinarea IgE specifice la grâu şi utilizarea acestuia pentru diagnosticul clinic sunt problematice din cauza specificităţii scăzute când se utilizează extractul de grâu, fie în testul prick cutanat, fie în analizele serologice. Prezenţa IgE specifice la grâu este des întâlnită la copiii atopici de toate vârstele fără alergii alimentare reale, iar până la 65% dintre pacienţii cu alergie la polenul de graminee au avut rezultate fals pozitive pentru alergia la extractul de grâu(22). Pe de altă parte, unele alergene sunt subreprezentate în testele bazate pe extract de grâu din cauza insolubilităţii lor relative.
Proteinele din grâu se împart în albumine (solubile în apă), globuline (solubile în soluţie salină) şi prolamine (insolubile), unde se includ gliadinele (solubile în alcoolii apoşi) şi gluteninele(23) (figura 1). Gliadinele şi gluteninele sunt principalele proteine de depozitare din grâu. Fiecare dintre aceste fracţiuni conţine proteine alergenice care au fost asociate cu simptome clinice, dar până în prezent nu există un consens cu privire la definirea alergenelor majore şi minore din grâu. De asemenea, se ştie puţin despre păstrarea alergenicităţii la încălzirea şi prelucrarea fracţiunilor. Cele mai importante alergene din grâu se regăsesc în figura 4.
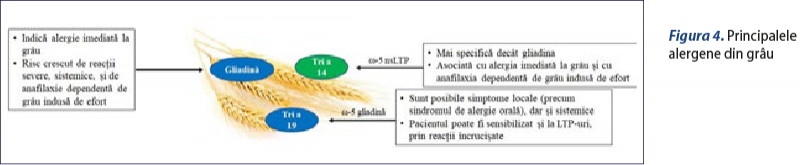
Componenta unică a grâului cel mai bine caracterizată este omega-5-gliadina (Tri a 19). Gliadina este principalul alergen implicat în anafilaxia dependentă de grâu indusă de efort, dar şi în alergia la grâu din copilăria timpurie, cu simptome de reacţie de hipersensibilitate de tip I şi eczemă atopică, şi în alergia/astmul brutarului. Alte alergene relativ bine caracterizate includ inhibitorii alfa-amilazei, asociate cu alergia brutarului şi cu alergia alimentară(24), precum şi proteinele de transfer lipidic (lipid transfer protein; LTP) din grâu (Tri a 14), cu relevanţă clinică evidentă şi asociate cu astmul brutarului şi cu alergia alimentară(25).
Până în prezent, încercările de a găsi componente singulare care să prezică reactivitatea clinică au avut ca rezultat, în cel mai bun caz, o sensibilitate ridicată, cu costul specificităţii scăzute.
Alergia la soia (Glycine max; Gly m)
Soia, o specie de leguminoase originară din Asia de Est, reprezintă o sursă bogată şi ieftină de proteine pentru hrana animalelor şi alimente, inclusiv ca proteine vegetale texturale, care se găsesc în mulţi analogi de carne şi lactate.
Soia se află printre cele opt alimente principale implicate în reacţiile alergice, care sunt responsabile pentru 90% din toate reacţiile alergice la alimente. De asemenea, reprezintă un important alergen „ascuns”, ca urmare a utilizării pe scară largă în alimentele prelucrate. Din aceste motive, evitarea completă a tuturor produselor din soia afectează calitatea vieţii pacienţilor alergici la aceasta. Produsele fermentate de soia, cum ar fi sosul de soia şi miso, sunt mult mai puţin alergenice în comparaţie cu tofu şi laptele de soia(26).
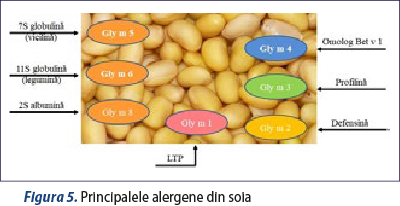
Au fost identificate cel puţin 16 alergene din soia, cu diferite funcţii metabolice, de depozitare sau de protecţie. Acestea aparţin unor familii de proteine diverse, caracterizate prin structuri tridimensionale conservate, care duc la reacţii încrucişate IgE-mediate cu diferiţi membri ai familiilor de leguminoase sau cu alte alimente vegetale. Datorită complexităţii şi eterogenităţii proteinelor din soia, relaţia dintre structura lor şi alergenicitate a fost abordată doar parţial. S-au propus numeroase fracţiuni din soia şi diferite proteine din soia cu potenţial de inducere a reacţiilor alergice, care au fost caracterizate parţial. Cele mai importante dintre acestea se regăsesc în figura 5. Dintre acestea, IgE specifice la Gly m 4, care face parte din familia de proteine PR-10 (pathogenesis-related, class 10), poate indica o reacţie încrucişată cu alte proteine omoloage cu Bet v 1, iar IgE specifice la Gly m 5 şi Gly m 6 indică o alergie primară la soia(27,28).
Alergia la arahide (Arachis hypogaea; Ara h)
Arahidele aparţin familiei leguminoase (Leguminosae). Arahidele sunt cel mai frecvent cultivate în China, urmate de India şi Statele Unite ale Americii. Arahidele sunt un declanşator frecvent al anafilaxiei induse de alimente. În multe părţi ale lumii, arahidele sunt consumate în principal în formă prăjită, dar pot fi consumate şi sub formă de arahide întregi, unt de arahide sau ca ingredient în multe produse. În Asia şi Africa, arahidele crude sunt folosite mai des ca ingrediente pentru gătit. Arahidele au un conţinut ridicat de proteine (24‑29%) şi conţin diverse alergene. Prelucrarea arahidelor pare să fie importantă pentru alergenicitate, probabil deoarece prăjirea la temperaturi ridicate induce agregarea proteinelor globulare compacte, ceea ce poate creşte alergenicitatea Ara h 1 şi Ara h 2(29), în timp ce gătitul ar putea reduce alergenicitatea lor. De asemenea, uleiul de arahide nerafinat poate conţine cantităţi suficiente de alergene pentru a declanşa reacţii alergice.
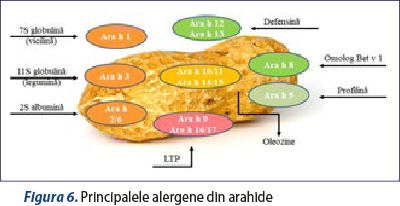
Au fost identificate mai multe alergene din arahide (figura 6). Multe dintre ele au funcţii de protecţie sau sunt proteine de depozitare. Dintre acestea, IgE specifice la Ara h 1, Ara h 2, Ara h 3 şi Ara h 6 indică o sensibilizare primară la arahide şi risc crescut de reacţii alergice severe, sistemice (în special IgE specifice la Ara h 2 şi Ara h 6), IgE specifice la Ara h 8 indică predispoziţie pentru reacţii alergice locale, iar IgE specifice la Ara h 9 denotă posibile reacţii încrucişate cu alte LTP-uri; astfel, la fel ca pentru soia, alergenele din arahide pot duce la reacţii încrucişate IgE-mediate cu diferiţi membri ai familiilor de leguminoase sau cu alte alimente vegetale(30,31).
Valoarea generală a testelor diagnostice în alergia alimentară IgE-mediată
Testele convenţionale, care utilizează proteine întregi, au avantajul de a include majoritatea alergenelor relevante, care sunt în principal stabile şi se găsesc în cantitate mare în sursele de alergene, şi de asemenea sunt utile în cazul în care alergenele moleculare relevante nu sunt încă disponibile comercial. Cele mai importante avantaje şi dezavantaje ale principalelor metode de diagnostic în alergiile alimentare se regăsesc în tabelul 3.
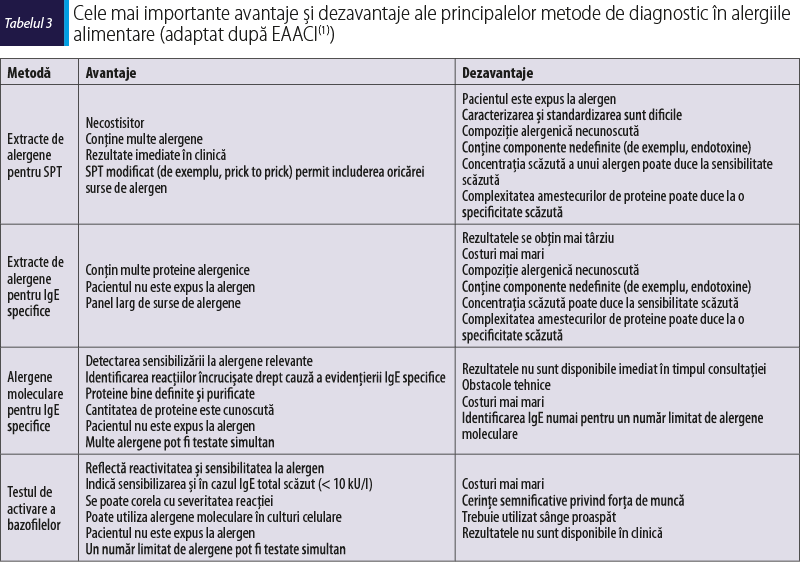
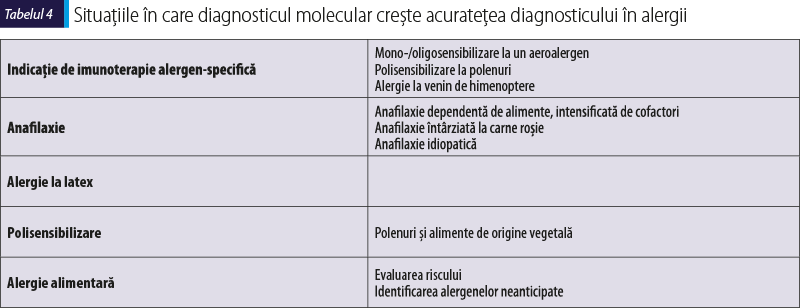
În tabelul 4 se pot observa situaţiile în care acurateţea diagnosticului este crescută de diagnosticul molecular(5).
Cazuri clinice
Caz clinic 1
Istoricul bolii: O pacientă, în vârstă de 16 ani, prezintă de la vârsta de 6 ani rinoconjunctivită manifestată prin rinoree apoasă, obstrucţie nazală, strănut în salve, chemosis, prurit nazal şi conjunctival, în timpul primăverii. La vârsta de 16 ani a prezentat un episod de reacţie locală în urma consumului de arahide, manifestat prin prurit perioral şi edem labial.
Teste in vivo: SPT 4+ la polen de mesteacăn, 4+ la arahide.
Teste in vitro: IgE serice specifice la arahide: 28 kUA/l; diagnostic molecular: IgE serice specifice la: Ara h 1 = 2,1 kUA/l; Ara h 2 = 12,3 kUA/l; Ara h 3 = 3,3 kUA/l; Ara h 8 = 10,3 kUA/l; Ara h 9 < 0,1 kUA/l.
Diagnostic: Alergie primară la arahide
Recomandări: Evitarea strictă a arahidelor şi a produselor care conţin arahide. Autoinjector cu adrenalină.
Caz clinic 2
Istoricul bolii: O pacientă, în vârstă de 16 ani, prezintă de la vârsta de 6 ani rinoconjunctivită manifestată prin rinoree apoasă, obstrucţie nazală, strănut în salve, chemosis, prurit nazal şi conjunctival, în timpul primăverii. La vârsta de 16 ani a prezentat un episod de reacţie locală în urma consumului de arahide, manifestat prin prurit perioral şi edem labial.
Teste in vivo: SPT 4+ la polen de mesteacăn, 4+ la arahide
Teste in vitro: IgE serice specifice la arahide: 26 kUA/l; diagnostic molecular: IgE serice specifice la: Ara h 1 <0,1 kUA/l; Ara h 2 <0,1 kUA/l; Ara h 3 = <0,1 kUA/l; Ara h 8 = 33 kUA/l; Ara h 9 < 0,1 kUA/l.
Diagnostic: Alergie la arahide asociată alergiei la polen (reacţie încrucişată cu Bet v 1 din polenul de mesteacăn).
Recomandări: Arahidele se pot reintroduce treptat în dietă. Nu este necesar autoinjector cu adrenalină.
Concluzii
Diagnosticul molecular al alergiilor furnizează deja informaţii valoroase cu privire la sensibilităţile individuale ale pacienţilor, care, când sunt combinate cu istoricul şi examenul obiectiv, pot fi relevante pentru procesul decizional clinic. Diagnosticul molecular contribuie la identificarea diferitelor fenotipuri ale populaţiilor alergice şi suplimentează testele de determinare a IgE serice specifice la extracte de alergene.
Pentru un diagnostic corect al alergiilor alimentare este necesară atât evaluarea valorilor pozitive sau negative ale alergenelor moleculare, cât şi a „imaginii de ansamblu”. În momentul în care se iau decizii diagnostice şi terapeutice pe baza acestor informaţii, trebuie avut în vedere ce este inclus în teste şi ce lipseşte, precum şi faptul că poate nu toate alergenele moleculare se găsesc în extracte, dar majoritatea sunt prezente. Acest lucru este relevant atât în cazul căutării alergenului incriminat, cât şi în cazul excluderii eventualelor cauze ale unor reacţii alergice.
Bibliografie
- EAACI, Molecular Allergology User’s Guide, 2016. ISBN 978-3-033-05653-4.
- Ciprandi G. Serum IgE as biomarker for predicting allergen immunotherapy effectiveness. J Allergy Clin Immunol. 2017 Jun;139(6):2029.
- Incorvaia C, Mauro M, Ridolo E, Makrì E, Montagni M, Ciprandi G. A Pitfall to Avoid When Using an Allergen Microarray: The Incidental Detection of IgE to Unexpected Allergens. J Allergy Clin Immunol Pract. 2015 Nov-Dec;3(6):879-82.
- Valenta R, Hochwallner H, Linhart B, Pahr S. Food Allergies: The Basics. Gastroenterology. 2015 May; 148(6): 1120‑1131.e4.
- Luengo O, Cardona V. Component resolved diagnosis: when should it be used? Clinical and Translational Allergy. 2014;4:28.
- Smith JJ, Pennings MT, Willemsen M et al. Heterogeneous responses and cross reactivity between the major peanut allergens Ara h 1, 2,3 and 6 in a mouse model for peanut allergy. Clinical and Translational Allergy. 2015;5:13.
- Ito K, Sjolander S, Sato S, et al. IgE to Gly m 5 and Gly m 6 is associated with severe allergic reactions to soybean in Japanese children. Journal of Allergy and Clinical Immunology. 2011;128:3,673-5.
- Nilsson N et al. Wheat allergy in children evaluated with challenge and IgE antibodies to wheat components. Pediatr Allergy Immunol. 2015;26:119-125.
- Sankian M, Bagheri Y, Vahedi F et al. Validity of using recombinant melon profilin, Cuc m 2, for diagnosis of melon allergy. Rep Biochem Mol Biol. 2012;1(1),14-20.
- Song JJ, Zhang HY, Liu ZG et al. Cloning of the panallergen profilin from lychee fruit and its cross-reactivity with birch pollen profilin Bet v 2. Food and Agricultural Immunology. 2007;18:2,129-138.
- Muraro A, Werfel T, Hoffmann‐Sommergruber K, Roberts G, Beyer K, Bindslev‐Jensen C, Cardona V, Dubois A, Dutoit G, Eigenmann P, Fernandez Rivas M. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy. Allergy. 2014 Aug;69(8):1008-25.
- Schoemaker AA, Sprikkelman AB, Grimshaw KE, Roberts G, Grabenhenrich L, Rosenfeld L, Siegert S, Dubakiene R, Rudzeviciene O, Reche M, Fiandor A. Incidence and natural history of challenge‐proven cow’s milk allergy in European children –EuroPrevall birth cohort. Allergy. 2015 Aug;70(8):963-72.
- Nwaru BI, Hickstein L, Panesar SS, Roberts G, Muraro A, Sheikh A, EAACI Food Allergy and Anaphylaxis Guidelines Group. Prevalence of common food allergies in Europe: a systematic review and meta‐analysis. Allergy. 2014 Aug; 69(8):992-1007.
- Restani P, Beretta B, Fiocchi A, Ballabio C, Galli CL. Cross-reactivity between mammalian proteins. Annals of Allergy, Asthma & Immunology. 2002 Dec 1;89(6):11-5.
- Fiocchi A, Dahdah L, Albarini M, Martelli A. Cow’s milk allergy in children and adults. Chem Immunol Allergy. 2015; 101: 114‑123.
- Bloom KA, Huang FR, Bencharitiwong R, Bardina L, Ross A, Sampson HA, Nowak‐Węgrzyn A. Effect of heat treatment on milk and egg proteins allergenicity. Pediatric Allergy and Immunology. 2014 Dec;25(8):740-6.
- Restani P, Ballabio C, Cattaneo A, Isoardi P, Terracciano L, Fiocchi A. Characterization of bovine serum albumin epitopes and their role in allergic reactions. Allergy. 2004 Aug; 59:21-4.
- Cooke SK, Sampson HA. Allergenic properties of ovomucoid in man. The Journal of Immunology. 1997 Aug 15; 159(4):2026-32.
- Benhamou Senouf AH, Borres MP, Eigenmann PA. Native and denatured egg white protein IgE tests discriminate hen’s egg allergic from egg‐tolerant children. Pediatric Allergy and Immunology. 2015 Feb;26(1):12-7.
- Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PH, Hadjivassiliou M, Kaukinen K, Rostami K, Sanders DS, Schumann M, Ullrich R. Spectrum of gluten-related disorders: consensus on new nomenclature and classification. BMC Medicine. 2012 Dec;10(1):13.
- Östblom E, Lilja G, Pershagen G, Van Hage M, Wickman M. Phenotypes of food hypersensitivity and development of allergic diseases during the first 8 years of life. Clinical & Experimental Allergy. 2008 Aug;38(8):1325-32.
- Constantin C, Quirce S, Poorafshar M, Touraev A, Niggemann B, Mari A, Ebner C, Akerström H, Heberle‐Bors E, Nystrand M, Valenta R. Micro‐arrayed wheat seed and grass pollen allergens for component‐resolved diagnosis. Allergy. 2009 Jul 1;64(7):1030-7.
- Mäkelä MJ, Eriksson C, Kotaniemi‐Syrjänen A, Palosuo K, Marsh J, Borres M, Kuitunen M, Pelkonen AS. Wheat allergy in children – new tools for diagnostics. Clinical & Experimental Allergy. 2014 Nov;44(11):1420-30.
- Palacin A, Quirce S, Armentia A, Fernández-Nieto M, Pacios LF, Asensio T, Sastre J, Diaz-Perales A, Salcedo G. Wheat lipid transfer protein is a major allergen associated with baker’s asthma. Journal of Allergy and Clinical Immunology. 2007 Nov 1;120(5):1132-8.
- Sander I, Rihs HP, Doekes G, Quirce S, Krop E, Rozynek P, van Kampen V, Merget R, Meurer U, Brüning T, Raulf M. Component-resolved diagnosis of baker’s allergy based on specific IgE to recombinant wheat flour proteins. Journal of Allergy and Clinical Immunology. 2015 Jun 1;135(6):1529-37.
- Kobayashi M, Hashimoto Y, Taniuchi S, Tanabe S. Degradation of wheat allergen in Japanese soy sauce. International Journal of Molecular Medicine. 2004 Jun 1;13(6):821-7.
- Kleine-Tebbe J, Wangorsch A, Vogel L, Crowell DN, Haustein UF, Vieths S. Severe oral allergy syndrome and anaphylactic reactions caused by a Bet v 1 – related PR-10 protein in soybean, SAM22. Journal of Allergy and Clinical Immunology. 2002 Nov 1;110(5):797-804.
- Komata T, Söderström L, Borres MP, Tachimoto H, Ebisawa M. Usefulness of wheat and soybean specific IgE antibody titers for the diagnosis of food allergy. Allergology International. 2009 Jan 1;58(4):599-603.
- Comstock SS, Maleki SJ, Teuber SS. Boiling and frying peanuts decreases soluble peanut (Arachis hypogaea) allergens Ara h 1 and Ara h 2 but does not generate hypoallergenic peanuts. PloS one. 2016 Jun 16;11(6):e0157849.
- Aalberse JA, Meijer Y, Derksen N, van der Palen‐Merkus T, Knol E, Aalberse RC. Moving from peanut extract to peanut components: towards validation of component‐resolved IgE tests. Allergy. 2013 Jun;68(6):748-56.
- Lieberman JA, Glaumann S, Batelson S, Borres MP, Sampson HA, Nilsson C. The utility of peanut components in the diagnosis of IgE-mediated peanut allergy among distinct populations. The Journal of Allergy and Clinical Immunology: In Practice. 2013 Jan 1;1(1):75-82.
Articole din ediţiile anterioare
Ce ştim despre sindromul Frey?
Sindromul Lucja Frey, descris de medicul neurolog cu acelaşi nume, este o afecţiune rar întâlnită, care se caracterizează prin eritem şi disconfort...
Rolul diagnosticului molecular în anafilaxie
Anafilaxia reprezintă o reacţie alergică severă, cu potenţial letal, caracterizată prin debutul acut al simptomelor şi care necesită intervenţie me...
Alergia alimentară – patogenie
Alergia alimentară este o afecţiune cu impact socioeconomic semnificativ şi reprezintă un subiect de interes pentru clinicieni şi pacienţi deopotri...
Kiss allergy – despre sărut şi alergie
Calitatea vieţii pacienţilor alergici la alimente sau medicamente poate fi afectată de posibile reacţii de hipersensibilitate în urma expunerii acc...