Allergen immunotherapy (AIT) is a proven therapeutic option for the treatment of allergic rhinitis and/or asthma. Many guidelines or national practice guidelines have been produced but the evidence-based method varies, many are complex and none propose care pathways. This paper reviews care pathways for AIT using strict criteria and provides simple recommendations that can be used by all stakeholders, including healthcare professionals. The decision to prescribe AIT for the patient should be individualized and based on the relevance of the allergens, the persistence of symptoms despite appropriate medications according to guidelines, as well as the availability of good-quality and efficacious extracts. Allergen extracts cannot be regarded as generics. Immunotherapy is selected by specialists for stratified patients. There are no currently available validated biomarkers that can predict AIT success. In adolescents and adults, AIT should be reserved for patients with moderate/severe rhinitis or for those with moderate asthma who, despite appropriate pharmacotherapy and adherence, continue to exhibit exacerbations that appear to be related to allergen exposure, except in some specific cases. Immunotherapy may be even more advantageous in patients with multimorbidity. In children, AIT may prevent asthma onset in patients with rhinitis. mHealth tools are promising for the stratification and follow-up of patients.
Recomandări de imunoterapie cu vaccinuri alergenice – ARIA 2019
2019 ARIA Care pathways for allergen immunotherapy
First published: 15 decembrie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.3.4.2019.2749
Abstract
Rezumat
Imunoterapia alergen specifică (AIT) este o opţiune terapeutică confirmată pentru tratamentul rinitei alergice şi/sau al astmului. S-au creat multe ghiduri sau protocoale naţionale de practică, dar metodele bazate pe dovezi variază, multe sunt complexe şi niciuna nu propune căi de îngrijire. Acest articol revizuieşte căile de îngrijire/recomandările pentru AIT folosind criterii stricte şi oferă recomandări simple care pot fi utilizate de toate părţile interesate, inclusiv de profesioniştii din domeniul sănătăţii. Decizia de a prescrie AIT pentru un pacient ar trebui individualizată şi bazată pe relevanţa alergenelor, persistenţa simptomelor în ciuda tratamentului adecvat conform ghidurilor, cât şi pe disponibilitatea extractelor alergenice bune calitativ şi eficiente. Extractele de alergen nu pot fi considerate generice. Imunoterapia este selectată de specialişti pentru anumiţi pacienţi. În prezent nu sunt disponibili biomarkeri validaţi care să prezică succesul AIT. La adolescenţi şi adulţi, AIT trebuie rezervată pacienţilor cu rinită moderată/severă sau celor cu astm moderat care, în ciuda tratamentului adecvat şi a respectării acestuia, continuă să prezinte exacerbări legate de expunerea la alergen, cu excepţia unor cazuri specifice. Imunoterapia poate fi şi mai avantajoasă la pacienţii cu multimorbidităţi. La copiii cu rinită alergică, AIT poate preveni apariţia astmului. Instrumentele mHealth sunt promiţătoare pentru stratificarea şi urmărirea pacienţilor.
Abrevieri:
AIT – imunoterapie cu alergenAR – rinită alergică
ARIA – rinita alergică şi impactul său asupra astmului
SSDC/CDSS – sistemul de suport al deciziilor bazate pe clinică
CRD – boli respiratorii cronice
DB-PC-RCT – studiu dublu-orb randomizat, placebo‑controlat
EIP-AHA – Parteneriatul european pentru inovare privind îmbătrânirea activă şi sănătoasă
EIT – Institutul European pentru Inovaţie şi Tehnologie
UE – Uniunea Europeană
GRADE – gradarea elaborării, evaluării şi analizei recomandărilor
ICER – raportul cost-eficienţă incremental
ICP – calea de îngrijire integrată
JA-CHRODIS – acţiune comună privind bolile cronice şi promovarea îmbătrânirii sănătoase pe tot ciclul de viaţă
MACVIA – combaterea bolilor cronice pentru îmbătrânirea activă şi sănătoasă
MASCA – Mobile Airways Sentinel NetworK
MASK-air® – (fostul Jurnal alergologic)
NICE – Institutul Naţional pentru Sănătate şi Excelenţă Clinică (Marea Britanie)
PCP – profesionist în asistenţa medicală primară
QALY – anul de viaţă ajustat calitativ
QOL – calitatea vieţii
RCT – studiu randomizat controlat
RWE – dovezi din viaţa reală
SCIT – imunoterapie subcutanată
SCUAD – boală cronică severă a căilor respiratorii superioare
SLIT – imunoterapie sublinguală
RCP – rezumatul caracteristicilor produsului
OMS – Organizaţia Mondială a Sănătăţii
1. Introducere
În toate societăţile, povara şi costurile bolilor alergice sunt în creştere rapidă, fiind necesare strategii de „gestionare a schimbărilor”, pentru a sprijini transformarea sistemului de asistenţă medicală pentru o îngrijire integrată. Ca exemplu pentru îngrijirea bolilor alergice, cel mai nou proiect ARIA (rinita alergică şi impactul său asupra astmului) (faza 4 ARIA(1,2)) şi POLLAR (impactul POLLuării aerului asupra astmului şi rinitei; EIT Health)(3) propune îngrijirea prin metode digitale (prin mijloace electronice), îngrijirea integrată, centrată pe persoană, pentru rinita şi astmul care încorporează expunerea la mediu(2,4).
Căile de îngrijire integrată (ICP) sunt planuri structurate de îngrijire multidisciplinară care detaliază etapele-cheie ale îngrijirii pacienţilor(5). Acestea promovează traducerea recomandărilor din ghiduri în protocoale locale şi aplicarea lor în practica clinică(6,7). ICP ar trebui să integreze recomandările din ghidurile de practică clinică, dar de obicei îmbunătăţesc recomandările prin combinarea intervenţiilor iterative, integrează asigurarea calităţii şi oferă recomandări privind coordonarea îngrijirii.
Imunoterapia alergen-specifică (AIT) este o opţiune terapeutică dovedită pentru multe produse standardizate pentru administrare pe calea sublinguală (SLIT) sau subcutanată (SCIT) în tratamentul rinitei alergice şi/sau al astmului(8-14). Studii care au utilizat baze de date ale prescripţiilor AIT au relevat recent că eficacitatea demonstrată în studiile clinice dublu-orb randomizate, placebo-controlate (DB-PC-RCT) se regăseşte în viaţa reală(15). În majoritatea ţărilor, AIT este mai costisitoare decât alte tratamente medicale pentru rinita alergică (AR) şi, prin urmare, ar trebui recomandată pacienţilor printr-o abordare medicală stratificată(16). Au fost create multe ghiduri internaţionale şi naţionale privind AIT(8-14,17), dar metodele bazate pe dovezi variază, multe ghiduri sunt complexe şi niciunul nu propune ICP.
Scopul prezentei lucrări este de a dezvolta căile de îngrijire ARIA, atât pentru SCIT, cât şi pentru SLIT, aşa cum sunt propuse de grupul de lucru EAACI(18).
2. Elaborarea documentului
Schiţa originală a acestui document a fost pregătită de J. Bousquet şi a fost distribuită mai multor autori pentru comentarii. De asemenea, a fost distribuit un chestionar (Anexa 1), iar răspunsurile au fost colectate.
Documentul şi răspunsurile la chestionar au fost revizuite în cadrul unei reuniuni, incluzând ARIA, EIT Health (POLLAR: Impact of Air POLLution on Asthma and Rhinitis)(3), Parteneriatul european pentru inovaţie pentru îmbătrânirea activă şi sănătoasă(19) şi Alianţa globală împotriva bolilor respiratorii cronice (GARD, Alianţa OMS), cu participarea celor mai importante societăţi de alergologie şi a organizaţiilor de pacienţi (Paris, 3 decembrie 2018). Întâlnirea a fost realizată cu sprijinul mai multor organizaţii (figura 1).

Documentul final a fost aprobat de membrii Grupului de studiu de la Paris şi de Grupul de lucru ARIA.
A fost elaborat un ghid de buzunar care include principalele recomandări ale acestui document într-un format simplu. Acesta trebuie utilizat în format digital şi tipărit, pentru a ghida practicile clinice pentru toţi cei implicaţi, inclusiv pacienţii, toţi furnizorii de servicii medicale şi factorii de decizie.
3. Lacune în cunoaşterea AIT
AIT este un tratament eficient, dar există multe lacune, inclusiv cele identificate de AIRWAYS ICPs(19,20) (tabelul 1)(21).
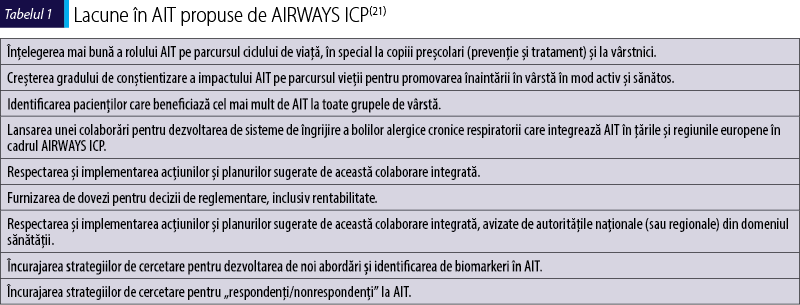
Unele dintre aceste lacune stau la baza dezvoltării ICP-urilor ARIA pentru AIT.
4. Alergene de utilizat
4.1 Extractul relevant
Decizia de a prescrie AIT pentru un pacient ar trebui să se bazeze pe relevanţa alergenului şi pe persistenţa simptomelor clinice prezente sub tratament corespunzător conform ghidurilor, precum şi pe disponibilitatea de extracte de bună calitate.
O calitate adecvată este esenţială pentru ca orice medicament să fie eligibil pentru comercializare(10,22). Pentru AIT trebuie utilizate doar extracte de alergen standardizate, reglementate, eficiente şi sigure(23,24).
4.2 Extrapolarea la produsele netestate
Produsele AIT trebuie să prezinte eficacitate şi siguranţă, în conformitate cu cerinţele de reglementare. Extractele de alergen nu pot fi considerate generice. În UE, fiecare produs individual (produs individual sau amestecuri), cu excepţia celor produse de EMA (Agenţia Europeană a Medicamentelor) sau PEI (Paul Ehrlich Institute), trebuie să-şi dovedească eficienţa(23).
În unele cazuri se pot accepta fără documentaţie clinică specifică excepţii legate de conceptul de grupuri omoloage, care definesc alergeni cu o reactivitate încrucişată relevantă clinic. Aceste grupuri omoloage includ o serie de extracte de alergene de polen şi acarieni, care sunt definite în ghidurile EMA respective pentru produsele alergene(23).
Nu există dovezi că mixarea diferitelor alergene va avea acelaşi efect ca administrarea separată a alergenelor individuale. Amestecarea diferitelor alergene poate duce la un efect de diluare – subdozare a tratamentului şi degradare a potenţialului alergenic specific – ca urmare a activităţii enzimatice a anumitor alergene(26). Riscul de reacţii adverse alergice poate creşte, în special prin degradare, când este utilizat un lot nou(27). Prin urmare, EMA a recomandat să se utilizeze numai produse mixte cu alergenele reprezentate de sursele de alergene din grupuri omoloage(23).
4.3 Produse cu numele pacientului
În multe ţări, produsele cu numele pacientului (NPP) sunt folosite de către practicieni în efortul de a aplica un tratament precis pacienţilor. Totuşi, această practică necesită studii de confirmare adecvate şi dovezi din viaţa reală, deoarece datele clinice cu unele alergene nu pot fi direct extrapolate în practica NPP. NPP-urile sunt comercializate prin excepţie faţă de legislaţia europeană privind extractele de alergene(14,28).
4.4 Pacienţii polisensibilizaţi
Bolile alergice sunt printre cele mai complexe şi diverse suferinţe. Pacienţii sunt adesea sensibilizaţi (IgE) la multe alergene (polisensibilizare), dar se poate ca nu toate aceste sensibilizări să fie relevante clinic. De aceea, este important să se trateze alergiile care dau naştere la simptome alergice, şi nu sensibilizările potenţial irelevante pentru pacient. Există o serie largă de dovezi în ceea ce priveşte eficacitatea clinică a extractelor individuale la pacienţii polisensibilizaţi(29-31).
În locul mixturilor de extracte, diferitele alergene pot fi aplicate separat(12). Cu toate acestea, s-a propus fără date de susţinere că două extracte pot fi administrate la un interval de 30 de minute în două zone diferite de injectare. Procedând astfel, fiecare alergen poate fi monitorizat separat pentru reacţia locală şi potenţialele efecte secundare sistemice.
În general, întrebările referitoare la eficacitatea polialergenelor în comparaţie cu imunoterapia cu oligoalergene sau monoalergen la pacienţii polisensibilizaţi nu au fost abordate în studii clinice atent concepute. Un raport recent al unui atelier de lucru internaţional sponsorizat de NIH privind imunoterapia cu aeroalergene conturează conceptele de studiu pentru rezolvarea acestui important decalaj de cunoaştere(32).
5. Stratificarea pacienţilor alergici pentru AIT
5.1 Conceptul de stratificare a pacienţilor
Medicina de precizie îşi propune să personalizeze asistenţa medicală cu decizii, practici şi/sau produse medicale adaptate fiecărui pacient. De asemenea, se referă la adaptarea tratamentului medicamentos la caracteristicile clinice şi sociale ale fiecărui pacient, şi nu neapărat la genomică(33). Stratificarea pacienţilor în subpopulaţii stă la baza luării deciziilor clinice pentru creşterea eficacităţii diagnosticului şi tratamentului(34,35). Stratificarea pacienţilor integrează, de asemenea, tendinţe de costuri şi modele de riscuri determinante social pentru a se potrivi pacientului la gestionarea corectă a îngrijirii. Acest model se aplică şi AIT(36).
În bolile neameninţătoare de viaţă cu o prevalenţă foarte mare, cum sunt bolile alergice, este necesară stratificarea pacienţilor (a) pentru a identifica cei mai buni candidaţi pentru intervenţie prin management complex de îngrijire, (b) pentru a reduce timpul şi resursele necesare identificării pacientului compatibil cu un program de management de îngrijire şi (c) pentru a optimiza costurile, deoarece unele intervenţii terapeutice nu pot fi administrate tuturor pacienţilor. Stratificarea pacienţilor poate ajuta, de asemenea, la îmbunătăţirea implicării pacientului(37).
Diagnosticul molecular, când este utilizat alături de alte instrumente şi de fişele medicale ale pacienţilor, poate ajuta clinicienii să selecteze mai bine cei mai potriviţi pacienţi şi alergenele pentru AIT(38) şi, în unele cazuri, să prezică riscul reacţiilor adverse(39). Modelul de sensibilizare la alergene ar putea prezice eficacitatea imunoterapiei cu alergen, cu condiţia ca aceste produse de imunoterapie să conţină o cantitate suficientă din aceste alergene. Totodată, testul multiplex rămâne o abordare de nivelul al treilea, care nu trebuie utilizat ca metodă de screening în practica curentă(39).
Scala vizuală analogică (VAS) poate fi de asemenea utilă pentru monitorizarea eficacităţii AIT şi a utilizării medicamentelor, deoarece este uşor de utilizat şi a fost validată pentru evaluarea severităţii AR. A fost, de asemenea, utilizată ca parametru secundar atât în studiile pentru adulţi, cât şi în cele pentru copii(40,41).
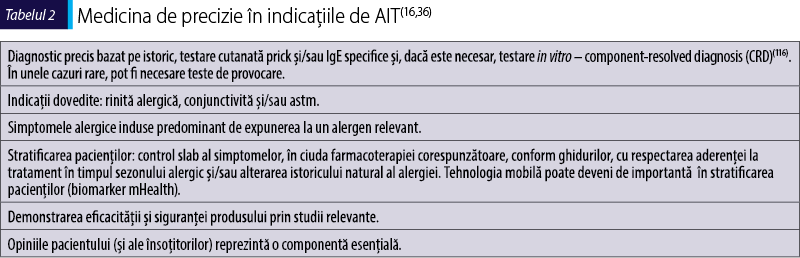
Rolul medicinei de precizie în selectarea unei scheme de AIT a fost propus de către o reuniune de experţi(36) (tabelul 2).
Fluxul abordării medicinei de precizie în bolile alergice a fost adaptat (figura 2).
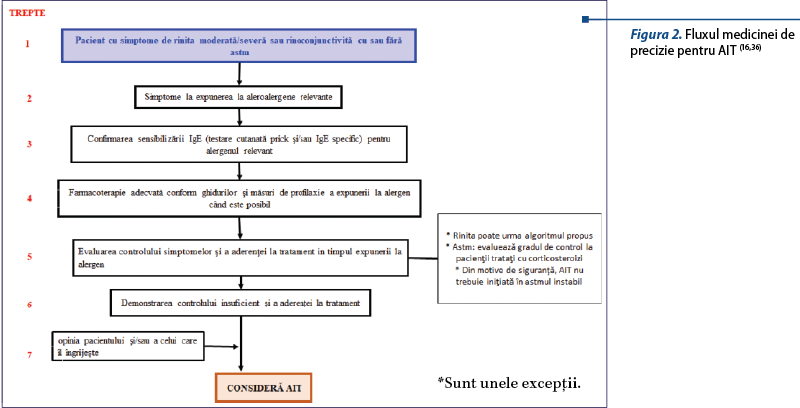
În unele cazuri, AIT poate fi recomandată pacienţilor a căror AR este controlată prin farmacoterapie, cum ar fi cei care pot dezvolta astm indus de furtună(42,43). AIT trebuie să fie luată în considerare chiar şi în AR moderată, în special (nu neapărat doar) la pacienţii care au avut exacerbări ale astmului în timpul sezonului de polen şi care trăiesc în regiuni geografice de risc.
5.2 Biomarkeri în AIT
Biomarkerii – particularităţi clinice sau de laborator care reflectă procesele biologice – sunt esenţiali pentru monitorizarea stării de sănătate a pacienţilor. Aceştia includ semne clinice identificate prin examen fizic, analize biologice, parametri mHealth, indici genomici şi altele, care pot fi măsurate în mod obiectiv şi utilizate ca indicatori ai proceselor fiziopatologice(44). Pot fi utilizaţi individual sau în combinaţie, dar necesită studii suplimentare.
În prezent, nu există biomarkeri genetici sau sangvini validaţi pentru a prezice sau a monitoriza eficacitatea AIT la nivel individual, deşi mai mulţi candidaţi au fost analizaţi(45). Biomarkerii asociaţi cu mHealth şi un sistem de decizie bazat pe clinică (CDSS – clinical decision support system)(46) pot schimba scopul AIT, deoarece vor ajuta la monitorizarea controlului bolii pacientului(47,48) prin:
(a) stratificarea pacienţilor
(b) efectuarea de studii clinice şi colectarea de dovezi din viaţa reală
(c) monitorizarea eficacităţii şi siguranţei terapiilor ţintite (un proces critic pentru identificarea rambursării corespunzătoare)
(d) punerea în aplicare a regulilor de oprire (figura 3).
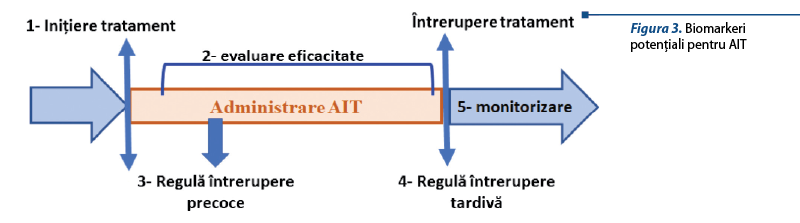
Este necesară dezvoltarea de norme clinice de oprire a tratamentului AIT, similar regulilor folosite în administrarea terapiei biologice în astmul sever, ca ghid pentru continuarea sau oprirea tratamentului după o perioadă scurtă (regulă de oprire precoce) sau lungă (regulă de oprire tardivă). Ca exemplu, o evaluare globală a tratamentului după 16 săptămâni este utilizată ca regulă de oprire precoce pentru tratamentul cu omalizumab(49,50).
5.3 ARIA
În ARIA 2008(16) s-a arătat că studiile dublu-orb randomizate placebo-controlate au confirmat eficacitatea SCIT şi SLIT. Cu toate acestea, eficacitatea clinică bazată pe studii este unul dintre numeroşii factori în procesul de luare a deciziilor unui clinician pentru utilizarea AIT, mai ales că RCT-urile AIT sunt concepute pentru a satisface cerinţele de reglementare pentru autorizarea de introducere pe piaţă(51). Înainte de a începe AIT este esenţial să apreciem valoarea relativă a farmacoterapiei şi a AIT, precum şi gradul de control al bolii obţinut prin farmacoterapie. În plus, este important să avem în vedere restul istoricului medical al pacientului, precum şi mediul său social şi geografic. Indicaţiile pentru SCIT în ARIA 2008 au fost similare cu cele publicate în 1998(52) şi 2001(53).
6. Povara economică a rinitei alergice şi a astmului şi rentabilitatea AIT
Bolile alergice constituie o povară imensă pentru societate, prin prevalenţa ridicată, morbiditatea, costurile directe (serviciile de sănătate şi medicamentele prescrise) şi costurile indirecte, în special cele legate de prezenteism(54). În plus, alergiile au un impact asupra studiului şi performanţei la toate nivelurile de educaţie(55,56). O mai bună îngrijire a alergiilor bazată pe ghiduri terapeutice ar avea beneficii substanţiale pentru economia Europei(55).
Este posibil ca pacienţii cu boli alergice să nu înţeleagă beneficiile tratamentului, iar aderenţa la tratament să fie redusă(47). O proporţie semnificativă a pacienţilor cu AR poate fi gestionată printr-un tratament farmacologic adecvat(1). Cu toate acestea, un subgrup de pacienţi (10% până la 20%) este slab controlat şi este atribuit SCUAD (boală cronică severă a căilor respiratorii superioare)(57-59). Pacienţii cu astm necesită costuri mai mari pentru îngrijirea rinitei.
Rentabilitatea AIT ar trebui luată în considerare pentru ICP. Cu toate acestea, variază mult între ţări, iar în unele ţări, precum Japonia, costurile AIT şi ale farmacoterapiei sunt similare, în timp ce în UE costurile de achiziţie ale AIT sunt mai mari decât farmacoterapia. O evaluare tehnologică medicală a examinat costurile comparative ale SLIT şi SCIT folosind modelul de costuri din Marea Britanie(60). S-a demonstrat constant un beneficiu atât pentru SCIT, cât şi pentru SLIT în comparaţie cu placebo, dar nivelul acestei eficienţe în ceea ce priveşte beneficiile clinice a fost considerată neclară. Studiul a ajuns la concluzia că atât SCIT, cât şi SLIT pot fi rentabile pe parcursul a şase ani, comparativ cu tratamentul standard, folosind o analiză de rentabilitate a Institutului Naţional de Excelenţă în Sănătate şi Îngrijire (NICE), rentabilitate la un nivel de 20000–30000 de lire pe an de viaţă ajustat calitativ (QALY)(60-61). O privire de ansamblu a arătat că raportul cost-eficienţă al AIT este limitat şi de calitatea metodologică scăzută, dar sugerează că AIT poate fi rentabilă pentru persoanele cu AR cu sau fără astm(62). Această analiză a sugerat că SLIT şi SCIT pot fi considerate rentabile folosind pragul de rentabilitate NICE de 20000 de lire sterline pe QALY. Multe dintre studii s-au bazat pe ipotezele efectului profilactic al AIT folosind modele de predicţie cum ar fi modelul lui Markov. Aceste costuri ar trebui comparate cu cele ale tratamentelor biologice în astmul sever. Deşi au fost identificate multe limitări, NICE a propus că omalizumab(64), mepolizumab(65) sau reslizumab(66) ar putea fi rentabile în astmul sever la pragul de 30000 de lire sterline pe QALY.
Cu toate acestea, modelul de costuri al NICE poate fi pus sub semnul întrebării, deoarece a fost dezvoltat pentru bolile care afectează mobilitatea sau pentru bolile grave şi nu ia în considerare costurile indirecte (de exemplu, prezenteismul). În plus, modelul neglijează eventualele economii din afara sistemului de sănătate din Marea Britanie, care poate să nu fie generalizabil.
7. Siguranţă
7.1 Imunoterapia subcutanată
O reacţie tipică (reacţie locală) constă în roşeaţa şi umflarea la locul injectării imediat sau la câteva ore după injectare. Uneori pot apărea strănut, congestie nazală sau urticarie (reacţii sistemice)(67). Reacţiile grave la administrarea injectabilă sunt foarte rare, dar necesită îngrijiri medicale imediate. Simptomele unei reacţii anafilactice pot include edem glotic, respiraţie şuierătoare sau senzaţie de constricţie toracică, greaţă şi ameţeli. Cele mai grave reacţii apar în primele 30 de minute de la injecţii şi, prin urmare, este recomandat ca pacienţii să aştepte în cabinetul medicului cel puţin 30 de minute după o injecţie.
7.2 Imunoterapia sublinguală
Picăturile sau comprimatele de alergen au un profil de siguranţă mai bun decât injecţiile. SLIT poate fi administrată acasă după ce prima doză este administrată sub supravegherea unui medic. Majoritatea reacţiilor adverse sunt locale (mâncărimi ale gurii, umflarea buzelor, greaţă) şi se reduc spontan după primele zile de administrare. Severitatea efectelor secundare locale este clasificată în funcţie de persistenţă şi de impactul asupra calităţii vieţii(68). În unele ţări din afara Europei, comprimatele de SLIT includ un avertisment despre posibile reacţii alergice severe şi se recomandă în mod obişnuit autoinjectoare de adrenalină. Nu este cazul în Europa, deşi în rarele cazuri în care apare o reacţie alergică generală după SLIT, raportul risc/beneficiu trebuie reevaluat şi trebuie luată o decizie dacă trebuie să continue SLIT şi, dacă este cazul, dacă pacientul trebuie să se prevadă un autoinjector de urgenţă.
8. Perspectiva pacientului
Perspectiva pacientului ar trebui să fie întotdeauna luată în considerare pentru a permite o abordare personalizată în luarea deciziilor de comun acord. Există studii contrastante în viaţa reală care evaluează nivelul de cunoştinţe, percepţii, aşteptări şi satisfacţii despre AIT. În două studii europene a existat un grad relativ ridicat de percepţie şi satisfacţie a pacientului, care corespundea bine cu părerile medicului(69,70). Cu toate acestea, majoritatea studiilor raportează o lipsă de informaţii din partea pacienţilor alergici şi ar trebui depuse toate eforturile pentru îmbunătăţirea comunicării, ceea ce duce la creşterea cunoştinţelor pacientului şi la creşterea satisfacţiei pacientului(71,72). Mulţi pacienţi cu AR nu au auzit niciodată de AIT(72).
Aderenţa la imunoterapia cu alergene este crucială pentru eficacitatea acesteia. SCIT necesită vizite regulate (adesea lunare), în timp ce SLIT se efectuează cu o administrare zilnică de comprimate de alergen sau picături la domiciliu. Nerespectarea schemei AIT şi întreruperea prematură a tratamentului sunt probleme frecvente(73). Diverse studii au arătat rezultate controversate în ceea ce priveşte rata de aderenţă la AIT. Comunicarea bazată pe dovezi, strategiile şi îngrijirea centrate pe pacient, discuţia motivaţională şi luarea deciziilor de comun acord, toate acestea scot în evidenţă importanţa timpului necesar pentru a stabili o relaţie de încredere, pentru a înţelege preocupările şi priorităţile pacientului şi a implica pacientul în deciziile referitoare la AIT(74). Programul bine organizat al alergologului nu doar creşte siguranţa, dar oferă şi posibilitatea unei monitorizări strânse şi creşte încrederea pacientului(73).
Informaţiile din perspectivă medicală, economică şi juridică ilustrează importanţa efortului pentru dovezi. Din punct de vedere medico-legal, aplicarea cunoştinţelor medicale actuale, în combinaţie cu îngrijirea pentru bunăstarea pacientului, ar trebui să conducă practica medicală zilnică. Criteriile medicale trebuie să prioritizeze aspectele economice, deoarece medicii trebuie să aleagă tratamente conform standardelor profesionale recunoscute în mod obişnuit. Mai mult, medicul are obligaţia de a informa pacientul despre opţiunile de tratament în conformitate cu standardele profesionale – detalierea căilor de administrare, beneficiile şi riscurile tratamentelor/medicamentelor disponibile – şi de a implica pacientul în decizie(75).
9. Perspectiva farmacistului
Automedicaţia pentru a trata simptomele AR este frecventă, iar majoritatea pacienţilor îşi îngrijesc singuri AR cu puţine interacţiuni cu medicul lor(76). Farmaciştii comunitari sunt cei mai accesibili profesionişti din domeniul sănătăţii pentru public, iar AR este una dintre cele mai frecvente boli gestionate de farmacişti. Aceştia joacă un rol esenţial în managementul farmacoterapiei, în consilierea, prevenţia bolilor şi în îngrijirea primară. În mod particular, prin disponibilitatea de medicamente fără prescripţie (OTC), farmacia comunitară este adesea prima oprire pentru gestionarea AR(77,78).
Tratamentul AR cuprinde trei aspecte diferite: evitarea expunerii la alergeni, farmacoterapie şi imunoterapie. Intervenţia farmacistului poate aborda în mod specific primele două şi poate fi o oportunitate pentru educarea pacientului în ceea ce priveşte evitarea expunerii la alergeni, informarea despre boală şi utilizarea medicamentelor, în special administrarea de medicamente şi aderenţa. Mai mult, produsele pentru imunoterapia cu alergeni sunt disponibile în farmaciile din multe ţări, iar farmacistul trebuie să fie bine informat despre acest tratament. Farmacistul poate juca un rol important în educarea pacienţilor asupra angajamentelor pe care le implică imunoterapia şi asupra riscurilor acesteia. De exemplu, dacă pacienţii ratează mai multe doze de imunoterapie, pot fi nevoiţi să reia tratamentul de la început. Prin urmare, este important ca pacienţii să ştie la ce să se aştepte, iar farmacistul poate juca un rol semnificativ în furnizarea acestor informaţii.
10. Perspectiva medicului de familie
În multe ţări, diagnosticul şi gestionarea bolilor alergice au loc aproape exclusiv la nivel de asistenţă primară, care are un rol esenţial(79,80). Rolul continuu, uşor de accesat şi holistic al îngrijirii primare poate sprijini identificarea pacienţilor alergici, poate asigura diagnosticul precoce şi poate urmări regulat pacienţii alergici pentru evaluarea controlului bolii, ajustările tratamentului şi luarea în comun a deciziilor legate de pacient. Cu toate acestea, puţini medici generalişti au pregătire formală prin licenţă sau postuniversitară în alergologie(81,82). Deşi sunt considerate importante(80,83,84), există cerinţe minime pentru instruirea şi certificarea subspecialiştilor în alergologie(85). De aceea este important ca medicii de familie să aibă acces la instruire şi la ghidurile de alergologie bazate pe dovezi pentru asistenţa primară(86). Deşi s-au făcut unele încercări de ICP-uri(87), colaborarea strânsă cu specialiştii pentru rezolvarea corectă şi eficientă, la timp, a cazurilor va fi benefică pentru pacient şi pentru sistemul de sănătate. Sunt necesare crearea, aplicarea şi validarea de criterii clare de trimitere a pacienţilor către specialişti, puse în aplicare şi validate în contextul circumstanţelor naţionale şi al evaluării eficienţei costurilor(88). Mai mult, medicii de familie joacă un rol major în educaţia pacienţilor, în managementul automedicaţiei şi în luarea deciziilor în comun(34,88,89), împrumutând bune practici din gestionarea altor boli cronice. Aderenţa pacientului la AIT este raportată ca fiind mai mare dacă aceasta este furnizată de către generalist, şi nu de un medic specialist(90). SCIT ar putea fi, de asemenea, administrată în asistenţa primară şi, deşi este asociată cu unele riscuri, acestea pot fi reduse la minimum când este efectuată de medicii generalişti instruiţi, care selectează cu atenţie pacienţii într-un mediu adecvat, cu facilităţi de asistenţă primară disponibile pentru tratarea reacţiilor anafilactice sistemice(91-94).
11. Abordare practică privind stratificarea pacienţilor pentru AIT
Luarea deciziilor de comun acord este necesară pentru AIT. Pacienţii trebuie informaţi despre toate opţiunile de tratament, beneficiile şi dezavantajele AIT, inclusiv durata acesteia. Mai mult decât atât, pacienţii ar trebui să ştie dacă AIT este acoperită de sistemul lor de sănătate sau de compania de asigurări şi dacă va genera costuri parţiale personale sau va trebui să fie acoperită complet din buzunar.
Deşi terapiile biologice în astmul sever şi AIT în bolile alergice vizează două populaţii diferite, costurile per QALY, cel puţin în unele ţări europene, par a fi similare între AIT şi biologice. Acest lucru indică faptul că AIT trebuie rezervată pentru categoria de pacienţi cu rinită care nu răspund suficient la tratamentul farmacologic (de exemplu, SCUAD(57)), care au fost evaluaţi şi îndrumaţi cu privire la aderenţa la farmacoterapie. Pentru astm se aplică o recomandare similară, dar AIT nu trebuie luată în considerare pentru pacienţii cu astm sever care sunt candidaţi pentru terapie biologică. Această recomandare este în conformitate cu indicaţiile de imunoterapie sublinguală pentru acarienii din praful de casă, cu tablete, aprobată recent de Agenţia Europeană a Medicamentului(95).
11.1 Rinita şi rinoconjunctivita la adolescenţi şi adulţi
Selecţia farmacoterapiei pentru pacienţii cu AR depinde de mai mulţi factori, inclusiv vârsta, simptomele dominante, severitatea, controlul AR, preferinţele pacientului şi costurile. Expunerea la alergeni şi simptomele derivate din aceasta variază, de exemplu, în funcţie de expunerea sezonieră sau de schimbarea mediului, ceea ce face necesară ajustarea terapiei. CDSS-urile pot fi benefice prin evaluarea controlului bolii(96). Acestea ar trebui să se bazeze pe cei mai buni algoritmi de dovezi pentru a ajuta pacienţii şi profesioniştii din domeniul sănătăţii să decidă în comun asupra tratamentului şi a strategiei step-up sau step-down, în funcţie de controlul AR (luarea deciziilor în comun).
Tratamentul AR necesită, de asemenea, să fie luate în considerare: (a) fenotipul (rinită, conjunctivită şi/sau astm) şi severitatea simptomelor, (b) eficacitatea relativă a tratamentului, (c) viteza de debut a acţiunii tratamentului,
(d) tratament curent, (e) răspuns istoric la tratament,
(f) preferinţa pacientului, (g) interesul pentru autogestionare şi (h) utilizarea resurselor. Ghidurile şi diversele declaraţii ale experţilor pentru farmacoterapia AR propun, de obicei, abordarea rezumată în tabelul 3(8,97,98).

Toate medicamentele recomandate sunt considerate sigure la doza uzuală, cu excepţia antihistaminicelor orale H1 de primă generaţie, care ar trebui evitate(99). În mod particular, în ciuda ghidurilor, practica de a prescrie atât un INCS (corticosteroid intranazal), cât şi un antihistaminic H1 oral este comună la nivel mondial.
În ceea ce priveşte algoritmul de step-up sau step-down, unul simplu a fost conceput de MACVIA, dar aplicabilitatea acestuia variază în funcţie de disponibilitatea medicamentelor şi a resurselor în diferite ţări (figura 4)(100).
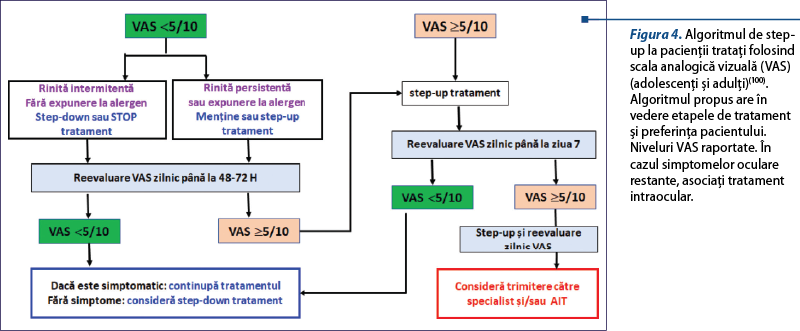
Algoritmii rezultă în mod inerent din combinarea punctelor de decizie individuale care reprezintă recomandări separate. Pentru a fi complet validat, algoritmul trebuie testat ca un plan de management complet şi comparat cu planurile alternative, pentru a analiza dacă combinaţia acestor recomandări separate duce la un beneficiu mai mare decât la daune, când este aplicată în practică. Un studiu la scară largă asupra tehnologiei mobile(47), un studiu asupra vitezei de debut(101) şi noile recomandări – toate au susţinut algoritmul(97,98).
11.2 Astmul la adolescenţi şi adulţi
Un algoritm nu este încă disponibil pentru astm. Astmul necontrolat este o contraindicaţie pentru AIT(102).
GINA (Global INitiative for Asthma) a aprobat SLIT pentru astmul alergic la acarieni(103). Conform RPC pentru comprimatul de acarieni aprobat pentru SLIT(95),
(a) pacientul trebuie să nu fi avut o exacerbare severă a astmului în ultimele 3 luni înainte de iniţierea AIT; (b) la pacienţii cu astm şi care suferă de o infecţie acută a tractului respirator, iniţierea tratamentului trebuie amânată până la rezolvarea infecţiei; (c) AIT nu este indicată pentru tratamentul exacerbărilor acute şi pacienţii trebuie informaţi cu privire la necesitatea de a solicita asistenţă medicală imediat dacă astmul lor se deteriorează brusc şi (d) AIT pentru acarieni ar trebui utilizată iniţial ca terapie suplimentară pentru tratamentul controller, iar reducerea lui ar trebui să fie efectuată treptat sub supravegherea unui medic, conform instrucţiunilor din ghid.
Niciun alt produs de AIT nu a fost aprobat pentru astm în UE.
11.3 Multimorbiditate
Multimorbiditatea – coexistenţa mai multor afecţiuni alergice la acelaşi pacient – este foarte frecventă şi peste 85% dintre pacienţii cu astm prezintă şi AR. Pe de altă parte, doar 20%-30% dintre pacienţii cu AR au astm. Multimorbiditatea cu AR creşte severitatea astmului(104).
Un avantaj al AIT este că poate controla multe aspecte ale multimorbidităţii, inclusiv AR, astmul şi conjunctivita. Deşi pacienţii cu multimorbiditate par să aibă simptome mai severe legate de fiecare componentă a constelaţiei bolii lor alergice, nu se ştie încă dacă AIT este la fel de eficientă sau mai eficientă la aceşti pacienţi, comparativ cu pacienţii fără multimorbiditate. Acest lucru poate fi testat folosind bazele de date existente, dar un studiu controlat va oferi, de asemenea, dovezi utile. În condiţiile autorizării tabletei de acarieni pentru SLIT(95), multimorbiditatea a fost recunoscută ca o indicaţie pentru SLIT la acarieni.
11.4 Copiii
La copii, AIT este eficientă, aşa cum se arată în studiile randomizate controlate (RCT)(105), şi poate avea efecte pe termen lung după oprirea sa(106). Un studiu recent al SLIT(107), unul anterior asupra imunoterapiei subcutanate cu polen de graminee la copii(108) şi o metaanaliză(109) au furnizat unele dovezi că AIT poate întârzia sau preveni apariţia astmului la copii. Cu toate acestea, (a) metaanaliza a arătat un risc limitat pe termen scurt de apariţie a astmului la cei cu AR, cu beneficii neclare pe termen lung(109) şi (b) costurile nu pot fi suportate de sistemele de sănătate, din cauza numărului foarte mare de pacienţi care ar putea fi trataţi existând o incertitudine privind eficienţa costurilor.
Astfel, AIT poate fi iniţiată la copii cu AR moderată/severă care nu este controlată de farmacoterapie. La aceşti copii fără astm ar trebui luată în considerare posibilitatea prevenirii debutului astmului, deşi sunt necesare mai multe studii pentru o indicaţie fără rezerve(9).
Vârsta cea mai mică pentru iniţierea AIT nu a fost clar stabilită. În multe ţări, produsele sunt autorizate pentru copii fără o limită inferioară de vârstă. Studiile prospective observaţionale şi/sau registrele pot ajuta la confirmarea siguranţei şi performanţei AIT la cei mai tineri destinatari, poate chiar cu vârsta mai mică de 3 ani.
AIT este o paradigmă pentru medicina de precizie, deoarece ţine seama de multitudinea de profiluri de sensibilizare şi multimorbiditate ale fiecărui pacient, atât în secţiune transversală, cât şi în raport cu istoricul lor natural. Dovezi indirecte, dar importante, oferă indicii despre pacienţii tineri care pot beneficia cel mai mult: (a) severitatea bolii alergice respiratorii este asociată cu persistenţa acesteia(110); (b) răspândirea epitopului şi dezvoltarea de noi sensibilizări sugerează beneficii ale intervenţiei timpurii(111) şi (c) efectele AR în performanţa şcolară şi educaţie(56) sprijină concentrarea tratamentului pe repere de dezvoltare/carieră. Prin urmare, este de aşteptat să se ia în considerare AIT în faze timpurii, folosind riscul, pe lângă severitatea bolii, drept criteriu-cheie de selecţie, pentru a maximiza impactul asupra istoricului natural al bolii, precum şi asupra costului/povarei.
Sunt necesare mai multe studii pentru a caracteriza efectele pe termen lung ale AIT. Aceste studii nu pot fi randomizate şi, cu atât mai puţin, oarbe. Prin urmare, trebuie utilizate abordări observaţionale, precum studierea registrelor(112).
În plus, există oportunităţi pentru prevenirea bolilor, care nu au fost explorate în mod adecvat, cum ar fi prevenţia primară. Avem nevoie de mai multe dovezi care să stabilească dacă AIT poate juca un rol în prevenirea sensibilizării alergice, a primei boli alergice(9). Sprijinul pentru astfel de studii trebuie să vină de la organizaţii guvernamentale/surse publice, pentru a identifica strategii optime de eficienţă a costurilor.
11.5 Imunoterapia cu alergeni la vârstnici
Caracteristicile imunologice şi alergice ale pacienţilor în vârstă diferă de cele ale adulţilor de vârstă mică şi medie. Studii limitate au descoperit că AIT poate fi eficientă la această populaţie(113,114). Sunt necesare, cu siguranţă, mai multe date pentru o recomandare puternică. În acest moment, şi înainte de a lua decizia de a iniţia AIT la pacienţii în vârstă, medicii trebuie să aibă indicii puternice privind rolul alergenilor specifici în AR sau astm pentru aceşti pacienţi şi să ţină seama de comorbidităţile non‑alergice care ar putea avea impact asupra siguranţei AIT.
12. mHealth în abordarea AIT prin medicina de precizie
12.1 Stratificarea pacienţilor
Se recomandă stratificarea pacienţilor cu AR necontrolată, în ciuda tratamentului corespunzător şi a respectării lui(115). Acest lucru poate fi realizat cu uşurinţă folosind jurnale electronice obţinute cu ajutorul telefoanelor mobile, aşa cum este demonstrat în MASK-air®(2,3,47). Astfel de jurnale ar trebui să includă lista completă a medicamentelor. După un singur an de urmărire, medicii pot evalua dacă SCUAD este prezent şi ar putea iniţia AIT dacă
(a) simptomele sunt asociate cu sezonul de polen, (b) există aderenţă la tratamentul farmacologic, (c) durata simptomelor necontrolate a fost suficient de lungă şi (d) a fost observat un impact asupra muncii sau a productivităţii şcolare. Mai mult, astmul şi simptomele oculare pot fi înregistrate, ca în MASK-air®(2) şi în alte aplicaţii, permiţând evaluarea rolului multimorbidităţii.
12.2 Urmărirea pacienţilor sub AIT
Aceeaşi abordare poate fi propusă pentru monitorizarea pacienţilor cu AIT pentru a evalua eficacitatea acesteia, aşa cum sugerează un grup de experţi internaţionali într-un document de poziţie AIT(18).
12.3 Sistemul de suport electronic pentru deciziile clinice
Algoritmul AR a fost digitalizat în tablete pentru profesioniştii din domeniul sănătăţii(46).
13. Concluzii
AIT este un tratament eficient pentru bolile alergice cauzate de alergenele inhalatorii. Utilizarea acesteia ar trebui totuşi limitată la pacienţii selectaţi cu atenţie, care nu răspund la farmacoterapia corespunzătoare, în conformitate cu ghidurile, şi pentru care este disponibilă o AIT eficientă şi rentabilă. Acest raport examinează căile de îngrijire pentru administrarea AIT, folosind criterii bazate pe dovezi. Se speră că aceste recomandări vor fi luate în considerare de către profesioniştii din domeniul sănătăţii, astfel încât utilizarea adecvată a AIT să-şi maximizeze impactul asupra bolilor alergice.
Traducere de: Elena Violeta Madalan, Elena Camelia Berghea.
Bibliografie
- Bousquet J, Hellings PW, Agache I, et al. ARIA Phase 4 (2018): Change management in allergic rhinitis and asthma multimorbidity using mobile technology. J Allergy Clin Immunol. 2018;pii:S0091–6749(18)31359–9. https ://doi.org/10.1016/j. jaci.2018.08.049
- Bousquet J, Arnavielhe S, Bedbrook A, et al. MASK 2017: ARIA digitally‐enabled, integrated, person‐centred care for rhinitis and asthma multimorbidity using real‐world‐evidence. Clin Transl Allergy. 2018;8:45.
- Bousquet J, Anto JM, Annesi‐Maesano I, et al. POLLAR: Impact of air pollution on Asthma and Rhinitis; a European Institute of Innovation and Technology Health (EIT Health) project. Clin Transl Allergy. 2018;8:36.
- Bousquet J, Hellings P, Agache I, et al. ARIA Phase 4 (2018): Change management in allergic rhinitis and asthma multimorbidity using mobile technology. J Allergy Clin Immunol. 2018;66:179‐181.
- Campbell H, Hotchkiss R, Bradshaw N, Porteous M. Integrated care pathways. BMJ. 1998;316(7125):133‐137.
- Hujala A, Taskinen H. How to support integration to promote care for people with multimorbidity in Europe? In: Rissanen S, Richardson E, vanGinneken E, eds. European Observatory Policy Briefs. Copenhagen;2017. http://www.euro.who.int/__data/asset s/pdf_file/0008/33758 9/PB_26.pdf. Accessed April 26, 2019.
- Palmer K, Marengoni A, Forjaz MJ, et al. Multimorbidity care model: Recommendations from the consensus meeting of the Joint Action on Chronic Diseases and Promoting Healthy Ageing across the Life Cycle (JA‐CHRODIS). Health Policy. 2018;122(1):4‐11.
- Brożek JL, Bousquet J, Baena‐Cagnani CE, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 revision. J Allergy Clin Immunol. 2010;126(3):466‐476.
- Halken S, Larenas‐Linnemann D, Roberts G, et al. EAACI guidelines on allergen immunotherapy: Prevention of allergy. Pediatr Allergy Immunol. 2017;28(8):728‐745.
- Bonertz A, Roberts G, Slater JE, et al. Allergen manufacturing and quality aspects for allergen immunotherapy in Europe and the United States: An analysis from the EAACI AIT Guidelines Project. Allergy. 2018;73(4):816‐826.
- Muraro A, Roberts G, Halken S, et al. EAACI guidelines on allergen immunotherapy: Executive statement. Allergy. 2018;73(4):739‐743.
- Roberts G, Pfaar O, Akdis CA, et al. Guidelines on Allergen Immunotherapy: Allergic rhinoconjunctivitis. Allergy. 2018;73(4):765‐798.
- Ryan D, Gerth van Wijk R, Angier E, et al. Challenges in the implementation of the EAACI AIT guidelines: A situational analysis of current provision of allergen immunotherapy. Allergy. 2018;73(4):827‐836.
- Pfaar O, Bachert C, Bufe A, et al. Guideline on allergen‐specific immunotherapy in IgE‐mediated allergic diseases: S2k Guideline of the German Society for Allergology and Clinical Immunology (DGAKI), the Society for Pediatric Allergy and Environmental Medicine (GPA), the Medical Association of German Allergologists (AeDA), the Austrian Society for Allergy and Immunology (OGAI), the Swiss Society for Allergy and Immunology (SGAI), the German Society of Dermatology (DDG), the German Society of Oto‐ Rhino‐Laryngology, Head and Neck Surgery (DGHNO‐KHC), the German Society of Pediatrics and Adolescent Medicine (DGKJ), the Society for Pediatric Pneumology (GPP), the German Respiratory Society (DGP), the German Association of ENT Surgeons (BV‐HNO), the Professional Federation of Paediatricians and Youth Doctors (BVKJ), the Federal Association of Pulmonologists (BDP) and the German Dermatologists Association (BVDD). Allergo J Int. 2014;23(8):282‐319.
- Zielen S, Devillier P, Heinrich J, Richter H, Wahn U. Sublingual immunotherapy provides long‐term relief in allergic rhinitis and reduces the risk of asthma: A retrospective, real‐world database analysis. Allergy. 2018;73(1):165‐177.
- Bousquet J, Khaltaev N, Cruz AA, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008;63(Suppl 86):8‐160.
- Larenas‐Linnemann D, Antolín‐Amérigo D, Parisi C, et al. National clinical practice guidelines for allergen immunotherapy: An international assessment applying AGREE‐II. Allergy. 2018;73(3):664‐672.
- Pfaar O, Demoly P, Gerth van Wijk R, et al. Recommendations for the standardization of clinical outcomes used in allergen immunotherapy trials for allergic rhinoconjunctivitis: an EAACI Position Paper. Allergy. 2014;69(7):854‐867.
- Bousquet J, Addis A, Adcock I, et al. Integrated care pathways for airway diseases (AIRWAYS‐ICPs). Eur Respir J. 2014;44(2):304‐323.
- Bousquet J, Barbara C, Bateman E, et al. AIRWAYS‐ICPs (European Innovation Partnership on Active and Healthy Ageing) from concept to implementation. Eur Respir J. 2016;47(4):1028‐1033.
- Calderon MA, Demoly P, Casale T, et al. Allergy immunotherapy across the life cycle to promote active and healthy ageing: from research to policies: An AIRWAYS Integrated Care Pathways (ICPs) programme item (Action Plan B3 of the European Innovation Partnership on active and healthy ageing) and the Global Alliance against Chronic Respiratory Diseases (GARD), a World Health Organization GARD research demonstration project. Clin Transl Allergy. 2016;6:41.
- Bonertz A, Roberts GC, Hoefnagel M, et al. Challenges in the implementation of EAACI guidelines on allergen immunotherapy: A global perspective on the regulation of allergen products. Allergy. 2018;73(1):64‐76.
- Committee for medicinal products for human use (CPMP). Guideline on allergen products: production and quality issues. EMEA/CHMP/BWP/304831/2007. London; 2008.
- Kowalski ML, Ansotegui I, Aberer W, et al. Risk and safety requirements for diagnostic and therapeutic procedures in allergology: World Allergy Organization Statement. World Allergy Organ J. 2016;9(1):33.
- Bachert C, Larché M, Bonini S, et al. Allergen immunotherapy on the way to product‐based evaluation‐a WAO statement. World Allergy Organ J. 2015;8(1):29.
- Nelson HS, Ikle D, Buchmeier A. Studies of allergen extract stability: the effects of dilution and mixing. J Allergy Clin Immunol. 1996;98(2):382‐388.
- Reid MJ, Lockey RF, Turkeltaub PC, Platts‐Mills TA. Survey of fatalities from skin testing and immunotherapy 1985–1989. J Allergy Clin Immunol. 1993;92(1 Pt 1):6‐15.
- Bousquet J, Lockey R, Malling HJ, et al. Allergen immunotherapy: therapeutic vaccines for allergic diseases. World Health Organization. American academy of Allergy, Asthma and Immunology. Ann Allergy Asthma Immunol. 1998;81(5 Pt 1):401‐405.
- Didier A, Malling H‐J, Worm M, et al. Optimal dose, efficacy, and safety of once‐daily sublingual immunotherapy with a 5‐grass pollen tablet for seasonal allergic rhinitis. J Allergy Clin Immunol. 2007;120(6):1338‐1345.
- Nelson H, Blaiss M, Nolte H, Wurtz SO, Andersen JS, Durham SR. Efficacy and safety of the SQ‐standardized grass allergy immunotherapy tablet in mono‐ and polysensitized subjects. Allergy. 2013;68(2):252‐255.
- Durham SR, Emminger W, Kapp A, et al. SQ‐standardized sublingual grass immunotherapy: confirmation of disease modification 2 years after 3 years of treatment in a randomized trial. J Allergy Clin Immunol. 2012;129(3):717‐725.
- Wheatley L, Wood R, Nadeau K, et al. Mind the gaps: Clinical trial concepts to address unanswered questions in aeroallergen immunotherapy. An NIAID/AHRQ workshop. J Allergy Clin Immunol. 2019. https ://doi.org/10.1016/j.jaci.2019.01.032
- Paving the way for personalized medicine, FDA’s role in a new era of medical product development; 2013. http://wwwfd agov/downl oads/Scien ceRes earch/ Speci alTop ics/Perso naliz edMed icine/ UCM37 2421pdf
- Hellings PW, Fokkens WJ, Bachert C, et al. Positioning the principles of precision medicine in care pathways for allergic rhinitis and chronic rhinosinusitis ‐ A EUFOREA‐ARIA‐EPOS‐AIRWAYS ICP statement. Allergy. 2017;72(9):1297‐1305.
- Muraro A, Fokkens WJ, Pietikainen S, et al. European symposium on precision medicine in allergy and airways diseases: report of the European Union parliament symposium (October 14, 2015). Rhinology. 2015;53(4):303-307.
- Canonica GW, Bachert C, Hellings P, et al. Allergen Immunotherapy (AIT): a prototype of Precision Medicine. World Allergy Organ J. 2015;8(1):1‐10.
- Pfaar O, Bonini S, Cardona V, et al. Perspectives in allergen immunotherapy: 2017 and beyond. Allergy. 2018;73(Suppl 104):5‐23.
- Del‐Rio Camacho G, Montes Arjona AM, Fernandez‐Cantalejo Padial J, Rodriguez CJ. How molecular diagnosis may modify immunotherapy prescription in multi‐sensitized pollen‐allergic children. Allergol Immunopathol (Madr). 2018;46(6):552‐556.
- Sastre J, Sastre‐Ibanez M. Molecular diagnosis and immunotherapy. Curr Opin Allergy Clin Immunol. 2016;16(6):565‐570.
- Frew AJ, Powell RJ, Corrigan CJ, Durham SR. Efficacy and safety of specific immunotherapy with SQ allergen extract in treatment‐ resistant seasonal allergic rhinoconjunctivitis. J Allergy Clin Immunol. 2006;117(2):319‐325.
- Corrigan CJ, Kettner J, Doemer C, Cromwell O, Narkus A. Efficacy and safety of preseasonal‐specific immunotherapy with an aluminium‐adsorbed six‐grass pollen allergoid. Allergy. 2005;60(6):801‐807.
- Lee J, Kronborg C, O'Hehir RE, Hew M. Who's at risk of thunderstorm asthma? The ryegrass pollen trifecta and lessons learnt from the Melbourne thunderstorm epidemic. Respir Med. 2017;132:146‐148.
- O’Hehir RE, Varese NP, Deckert K, et al. Epidemic thunderstorm asthma protection with five‐grass pollen tablet sublingual immunotherapy: a clinical trial. Am J Respir Crit Care Med. 2018;198(1):126‐128.
- Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69(3):89‐95.
- Shamji MH, Kappen JH, Akdis M, et al. Biomarkers for monitoring clinical efficacy of allergen immunotherapy for allergic rhinoconjunctivitis and allergic asthma: an EAACI Position Paper. Allergy. 2017;72(8):1156‐1173.
- Courbis AL, Murray RB, Arnavielhe S, et al. Electronic clinical decision support system for allergic rhinitis management: MASK e‐ CDSS. Clin Exp Allergy. 2018;48(12):1640-1653
- Bousquet J, Arnavielhe S, Bedbrook A, et al. Treatment of allergic rhinitis using mobile technology with real world data: The MASK observational pilot study. Allergy. 2018;73(9):1763-1774.
- Bousquet J, Hellings PW, Agache I, et al. ARIA 2016: Care pathways implementing emerging technologies for predictive medicine in rhinitis and asthma across the life cycle. Clin Transl Allergy. 2016;6:47.
- Bousquet J, Rabe K, Humbert M, et al. Predicting and evaluating response to omalizumab in patients with severe allergic asthma. Respir Med. 2007;101(7):1483-1492.
- Diaz RA, Charles Z, George E, Adler AI. NICE guidance on omalizumab for severe asthma. Lancet Respir Med. 2013;1(3):189‐190.
- Committee for medicinal products for human use. Guideline on the clinical development of products for specific immunotherapy for the treatment of allergic diseases. CHMP/EWP/18504/2006. London. European Medicines Agency. Pre‐authorisation evaluation of medicines for human use; 2008.
- Bousquet J, Lockey R, Malling H. WHO Position Paper. Allergen Immunotherapy: Therapeutic Vaccines for allergic diseases. Allergy. 1998;53(suppl):54.
- Bousquet J, Demoly P, Michel FB. Specific immunotherapy in rhinitis and asthma. Ann Allergy Asthma Immunol. 2001;87(1 Suppl 1):38‐42.
- Vandenplas O, Vinnikov D, Blanc PD, et al. Impact of Rhinitis on Work Productivity. A Systematic Review. J Allergy Clin Immunol Pract. 2018;6(4):1274‐1286.
- Zuberbier T, Lotvall J, Simoens S, Subramanian SV, Church MK. Economic burden of inadequate management of allergic diseases in the European Union: a GA(2) LEN review. Allergy. 2014;69(10):1275‐1279.
- Walker S, Khan‐Wasti S, Fletcher M, Cullinan P, Harris J, Sheikh A. Seasonal allergic rhinitis is associated with a detrimental effect on examination performance in United Kingdom teenagers: case‐control study. J Allergy Clin Immunol. 2007;120(2):381‐387.
- Bousquet J, Bachert C, Canonica GW, et al. Unmet needs in severe chronic upper airway disease (SCUAD). J Allergy Clin Immunol. 2009;124(3):428‐433.
- Hellings PW, Fokkens WJ, Akdis C, et al. Uncontrolled allergic rhinitis and chronic rhinosinusitis: where do we stand today? Allergy. 2013;68(1):1‐7.
- Bousquet PJ, Demoly P, Devillier P, Mesbah K, Bousquet J. Impact of allergic rhinitis symptoms on quality of life in primary care. Int Arch Allergy Immunol. 2013;160(4):393‐400.
- Meadows A, Kaambwa B, Novielli N, et al. A systematic review and economic evaluation of subcutaneous and sublingual allergen immunotherapy in adults and children with seasonal allergic rhinitis. Health Technol Assess. 2013;17(27):vi, xi‐xiv, 1‐322.
- Devlin N, Parkin D. Does NICE have a cost‐effectiveness threshold and what other factors influence its decisions? A binary choice analysis. Health Econ. 2004;13(5):437‐452.
- Asaria M, Dhami S, van Ree R, et al. Health economic analysis of allergen immunotherapy for the management of allergic rhinitis, asthma, food allergy and venom allergy: A systematic overview. Allergy. 2018;73(2):269‐283.
- Bruggenjurgen B, Reinhold T. Cost‐effectiveness of grass pollen subcutaneous immunotherapy (SCIT) compared to sublingual immunotherapy (SLIT) and symptomatic treatment in Austria, Spain, and Switzerland. J Med Econ. 2018;21(4):374‐381.
- Faria R, McKenna C, Palmer S. Optimizing the position and use of omalizumab for severe persistent allergic asthma using cost‐effectiveness analysis. Value Health. 2014;17(8):772‐782.
- Bermejo I, Stevenson M, Cooper K, et al. Mepolizumab for treating severe eosinophilic asthma: an evidence review group perspective of a NICE single technology appraisal. Pharmacoeconomics. 2018;36(2):131‐144.
- Cooper K, Frampton G, Harris P, Rose M, Chorozoglou M, Pickett K. Reslizumab for treating asthma with elevated blood eosinophils inadequately controlled by inhaled corticosteroids: an evidence review group perspective of a nice single technology appraisal. Pharmacoeconomics. 2018;36(5):545‐553.
- Cox L, Larenas‐Linnemann D, Lockey RF, Passalacqua G. Speaking the same language: The World Allergy Organization Subcutaneous Immunotherapy Systemic Reaction Grading System. J Allergy Clin Immunol. 2010;125(3):569‐574.
- Passalacqua G, Baena‐Cagnani CE, Bousquet J, et al. Grading local side effects of sublingual immunotherapy for respiratory allergy: speaking the same language. J Allergy Clin Immunol. 2013;132(1):93‐98.
- Baiardini I, Puggioni F, Menoni S, et al. Patient knowledge, perceptions, expectations and satisfaction on allergen‐specific immunotherapy: a survey. Respir Med. 2013;107(3):361‐367.
- Nam YH, Lee SK. Physician's recommendation and explanation is important in the initiation and maintenance of allergen immunotherapy. Patient Prefer Adherence. 2017;11:381‐387.
- Chivato T, Álvarez‐Calderón P, Panizo C, et al. Clinical management, expectations, and satisfaction of patients with moderate to severe allergic rhinoconjunctivitis treated with SQ‐standardized grass‐allergen tablet under routine clinical practice conditions in Spain. Clin Mol Allergy. 2017;15:1.
- Skoner DP, Blaiss MS, Dykewicz MS, et al. The Allergies, Immunotherapy, and RhinoconjunctivitiS (AIRS) survey: patients' experience with allergen immunotherapy. Allergy Asthma Proc. 2014;35(3):219‐226.
- Pitsios C, Dietis N. Ways to increase adherence to allergen immunotherapy. Curr Med Res Opin. 2018:1‐9.
- Bender BG, Lockey RF. Solving the Problem of Nonadherence to Immunotherapy. Immunol Allergy Clin North Am. 2016;36(1):205‐213.
- Bachert C, Gräfin‐von‐Strachwitz‐Helmstatt K. Zur Diskussion gestellt: Der Arzt und die Spezifische Immuntherapie im Spannungsfeld von Leitlinie, Wirtschaftlichkeit und Medizinrecht. Allergologie. 2016;39:381‐388.
- Kuehl BL, Abdulnour S, O'Dell M, Kyle TK. Understanding the role of the healthcare professional in patient self‐management of allergic rhinitis. SAGE Open Med. 2015;3:2050312115595822.
- Bosnic‐Anticevich S, Kritikos V, Carter V, et al. Lack of asthma and rhinitis control in general practitioner‐managed patients prescribed fixed‐dose combination therapy in Australia. J Asthma. 2018;55(6):684‐694.
- Bosnic‐Anticevich S, Costa E, Menditto E, et al. ARIA pharmacy 2018 "Allergic rhinitis care pathways for community pharmacy". Allergy. 2018. https ://doi.org/10.1111/all.13701
- Jutel M, Papadopoulos NG, Gronlund H, et al. Recommendations for the allergy management in the primary care. Allergy. 2014;69(6):708‐718.
- Finlay I, Egner W. Allergy–will we ever meet the unmet need? J R Soc Med. 2010;103(11):430‐431.
- Shehata Y, Ross M, Sheikh A. Undergraduate allergy teaching in a UK medical school: comparison of the described and delivered curriculum. Prim Care Respir J. 2007;16(1):16‐21.
- Ewan PW, Durham SR. NHS allergy services in the UK: proposals to improve allergy care. Clin Med (Lond). 2002;2(2):122‐127.
- Agache I, Ryan D, Rodriguez MR, Yusuf O, Angier E, Jutel M. Allergy management in primary care across European countries – actual status. Allergy. 2013;68(7):836‐843.
- Ellis J, Rafi I, Smith H, Sheikh A. Identifying current training provision and future training needs in allergy available for UK general practice trainees: national cross‐sectional survey of General Practitioner Specialist Training programme directors. Prim Care Respir J. 2013;22(1):19‐22.
- Gerth van Wijk R, Eguiluz‐Gracia I, Gayraud J, et al. The roadmap for allergology in Europe: The subspecialty of allergology as "stopover" on the way to a full specialty. An EAACI position statement. Allergy. 2018;73(3):540‐548.
- Levy ML, Fletcher M, Price DB, Hausen T, Halbert RJ, Yawn BP. International Primary Care Respiratory Group (IPCRG) Guidelines: diagnosis of respiratory diseases in primary care. Prim Care Respir J. 2006;15(1):20‐34.
- Flokstra‐de Blok B, Brakel TM, Wubs M, et al. The feasibility of an allergy management support system (AMSS) for IgE‐mediated allergy in primary care. Clin Transl Allergy. 2018;8:18.
- Jutel M, Angier L, Palkonen S, et al. Improving allergy management in the primary care network–a holistic approach. Allergy. 2013;68(11):1362‐1369.
- Pinnock H, Thomas M, Tsiligianni I, et al. The International Primary Care Respiratory Group (IPCRG) Research Needs Statement 2010. Prim Care Respir J. 2010;19(Suppl 1):S1‐20.
- Kiel MA, Roder E, Gerth van Wijk R, Al MJ, Hop WC, Rutten‐van Molken MP. Real‐life compliance and persistence among users of subcutaneous and sublingual allergen immunotherapy. J Allergy Clin Immunol. 2013;132(2):353‐360.
- Alvarez‐Cuesta E, Bousquet J, Canonica GW, Durham SR, Malling HJ, Valovirta E. Standards for practical allergen‐specific immunotherapy. Allergy. 2006;61(Suppl 82):1‐20.
- Landi M, Meglio P, Praitano E, Lombardi C, Passalacqua G, Canonica GW. The perception of allergen‐specific immunotherapy among pediatricians in the primary care setting. Clin Mol Allergy. 2015;13(1):15.
- Zuberbier T, Bachert C, Bousquet PJ, et al. GA(2) LEN/EAACI pocket guide for allergen‐specific immunotherapy for allergic rhinitis and asthma. Allergy. 2010;65(12):1525‐1530.
- Stokes JR, Casale TB. Allergy immunotherapy for primary care physicians. Am J Med. 2006;119(10):820‐823.
- European Medicines Agency. Summary of product characteristics. Acarizax 12 SQ‐HDM oral lyophilisate; 2016. https ://mricts-mrpeu/ Human/ Downl oads/DE_H_1947_001_Final SPCpdf
- Bousquet J, Schunemann HJ, Fonseca J, et al. MACVIA‐ARIA Sentinel NetworK for allergic rhinitis (MASK‐rhinitis): The new generation guideline implementation. Allergy. 2015;70(11):1372-1392.
- Brożek JL, Bousquet J, Agache I, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) Guidelines ‐ 2016 Revision. J Allergy Clin Immunol. 2017;140(4):950‐958.
- Dykewicz MS, Wallace DV, Baroody F, et al. Treatment of seasonal allergic rhinitis: An evidence‐based focused 2017 guideline update. Ann Allergy Asthma Immunol. 2017;119(6):489‐511.
- Church MK, Maurer M, Simons FE, et al. Risk of first‐generation H(1)‐antihistamines: a GA(2)LEN position paper. Allergy. 2010;65(4):459‐466.
- Bousquet J, Schunemann HJ, Hellings PW, et al. MACVIA clinical decision algorithm in adolescents and adults with allergic rhinitis. J Allergy Clin Immunol. 2016;138(2):367‐374.
- Bousquet J, Meltzer EO, Couroux P, et al. Onset of action of the fixed combination intranasal azelastine‐fluticasone propionate in an allergen exposure chamber. J Allergy Clin Immunol Pract. 2018;6(5):1726‐1732.
- Pitsios C, Demoly P, Bilò MB, et al. Clinical contraindications to allergen immunotherapy: an EAACI position paper. Allergy. 2015;70(8):897‐909.
- Global Strategy for Asthma Management and Prevention (2018 update). wms‐GINA‐2018 report‐V13‐002pdf; 2018.
- Amaral R, Fonseca JA, Jacinto T, et al. Having concomitant asthma phenotypes is common and independently relates to poor lung function in NHANES 2007–2012. Clin Transl Allergy. 2018;8:13.
- Masuyama K, Okamoto Y, Okamiya K, et al. Efficacy and safety of SQ house dust mite sublingual immunotherapy‐tablet in Japanese children. Allergy. 2018;73(12):2352-2363.
- Penagos M, Eifan AO, Durham SR, Scadding GW. Duration of allergen immunotherapy for long‐term efficacy in allergic rhinoconjunctivitis. Curr Treat Options Allergy. 2018;5(3):275‐290.
- Valovirta E, Petersen TH, Piotrowska T, et al. Results from the 5‐year SQ grass sublingual immunotherapy tablet asthma prevention (GAP) trial in children with grass pollen allergy. J Allergy Clin Immunol. 2018;141(2):529‐538.
- Möller C, Dreborg S, Ferdousi HA, et al. Pollen immunotherapy reduces the development of asthma in children with seasonal rhinoconjunctivitis (the PAT‐study). J Allergy Clin Immunol. 2002;109(2):251‐256.
- Kristiansen M, Dhami S, Netuveli G, et al. Allergen immunotherapy for the prevention of allergy: A systematic review and meta‐analysis. Pediatr Allergy Immunol. 2017;28(1):18‐29.
- Tai A, Tran H, Roberts M, et al. Outcomes of childhood asthma to the age of 50 years. J Allergy Clin Immunol. 2014;133(6):1572‐1578.
- Lau S, Matricardi PM, Wahn U, Lee YA, Keil T. Allergy and atopy from infancy to adulthood: Messages from the German birth cohort MAS. Ann Allergy Asthma Immunol. 2019;122(1):25-32.
- Price D, Bateman ED, Chisholm A, et al. Complementing the randomized controlled trial evidence base. Evolution not revolution. Ann Am Thorac Soc. 2014;11(Suppl 2):S92‐S98.
- Bozek A, Kolodziejczyk K, Kozlowska R, Canonica GW. Evidence of the efficacy and safety of house dust mite subcutaneous immunotherapy in elderly allergic rhinitis patients: a randomized, double‐blind placebo‐controlled trial. Clin Transl Allergy. 2017;7:43.
- Bozek A, Kolodziejczyk K, Warkocka‐Szoltysek B, Jarzab J. Grass pollen sublingual immunotherapy: a double‐blind, placebo‐controlled study in elderly patients with seasonal allergic rhinitis. Am J Rhinol Allergy. 2014;28(5):423‐427.
- Bousquet J, Schunemann HJ, Fonseca J, et al. MACVIAARIA Sentinel NetworK for allergic rhinitis (MASK‐rhinitis): the new generation guideline implementation. Allergy. 2015;70(11):1372‐1392.
- Canonica GW, Ansotegui IJ, Pawankar R, et al. A WAO ‐ ARIA ‐ GA(2)LEN consensus document on molecular‐based allergy diagnostics. World Allergy Organ J. 2013;6(1):17.
- Hampel FC, Ratner PH, Van Bavel J, et al. Double‐blind, placebo‐ controlled study of azelastine and fluticasone in a single nasal spray delivery device. Ann Allergy Asthma Immunol. 2010;105(2):168‐173.
- Carr W, Bernstein J, Lieberman P, et al. A novel intranasal therapy of azelastine with fluticasone for the treatment of allergic rhinitis. J Allergy Clin Immunol. 2012;129(5):1282‐1289.
- Meltzer EO. Pharmacotherapeutic strategies for allergic rhinitis: matching treatment to symptoms, disease progression, and associated conditions. Allergy Asthma Proc. 2013;34(4):301‐311.
- Seidman MD, Gurgel RK, Lin SY, et al. Clinical practice guideline: allergic rhinitis executive summary. Otolaryngol Head Neck Surg. 2015;152(2):197‐206.
- Seidman MD, Gurgel RK, Lin SY, et al. Clinical practice guideline: Allergic rhinitis. Otolaryngol Head Neck Surg. 2015;152(1 Suppl):S1‐43.
- Bachert C, Bousquet J, Hellings P. Rapid onset of action and reduced nasal hyperreactivity: new targets in allergic rhinitis management. Clin Transl Allergy. 2018;8:25.
Articole din ediţiile anterioare
Ţintind un diagnostic mai precis în hipersensibilitatea la betalactamine
Un studiu recent al Grupului de interes pentru alergia medicamentoasă (DAIG) al Academiei Europene de Alergologie şi Imunologie Clinică (EAACI), de...
Infecţiile virale şi astmul
Virusurile respiratorii reprezintă un factor de exacerbare a astmului, atât la copil, cât şi la adult. Infecţiile virale ale tractului respirator s...
Corelaţia dintre rinita alergică şi astm
Conceptul de „o singură boală a căilor respiratorii” subliniază legătura strânsă dintre căile respiratorii superioare şi inferioare în bolile alerg...
Imunoterapia cu alergeni în astmul alergic
Imunoterapia cu alergeni (AIT) este recomandată pacienţilor simptomatici cu sensibilizare IgE mediată şi constă în administrarea unor cantităţi cre...