In 2012, eight million cancer deaths were recorded, this disease being the second leading cause of death worldwide, after cardiovascular disease. The onset of cancer is the result of the interaction between a person genetic factors and the environmental factors and lifestyle. The major factors involved in cancer are: smoking, drinking alcohol, obesity, exposure to sunlight and some viral infections. An important role in initiating anticancer treatment is staging of cancer, as therapy is guided by this criterion. The article reviews the types of therapy used for the most common forms of cancer: lung, breast, colorectal and prostate.
Cancerul – de la etiologie la abordări terapeutice
Cancer – from etilogy to therapeutic approaches
First published: 30 aprilie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.181.2.2018.1681
Abstract
Rezumat
În 2012 au fost înregistrate 8 milioane de decese provocate de cancer, această afecţiune reprezentând cea de-a doua cauză de deces la nivel global, după bolile cardiovasculare. Apariţia cancerului este rezultatul interacţiunii dintre factorii genetici ai unei persoane cu factorii de mediu cu care aceasta intră în contact şi stilul de viaţă adoptat. Factorii majori implicaţi în apariţia cancerului sunt: fumatul, consumarea de băuturi alcoolice, obezitatea, expunerea la radiaţiile solare şi unele infecţii virale. Un rol important în iniţierea tratamentului anticanceros îl reprezintă stadializarea cancerului, deoarece terapia este ghidată în funcţie de acest criteriu. Articolul trece în revistă tipurile de terapie folosite pentru cele mai răspândite forme de cancer: pulmonar, de sân, colorectal şi de prostată.
Abrevieri: 5-FU fluorouracil; CAF ciclofosfamidă + doxorubicină + fluorouracil ; CMF ciclofosfamidă + metotrexat + fluorouracil ; EGFR receptorul factorului de creştere epidermică; FAC fluorouracil + doxorubicină + ciclofosfamidă (doze şi intervale diferite faţă de CAF); FEC fluorouracil + epirubicină + ciclofosfamidă ; FLOX oxaliplatin + 5-FU + leucovorin ; FOLFIRI leucovorin + 5-FU + irinotecan ; FOLFOX oxaliplatin + 5-FU + leucovorin (doze şi intervale diferite faţă de FLOX); FOLFOXIRI leucovorin + 5-FU + oxaliplatin + irinotecan; HBV virusul hepatitei B; HCV virusul hepatitei C ; HER2 receptori pentru factorul de creştere epidermică, HPV Human papilloma viruses; LHRH hormonul eliberator al hormonului luteinizant ; NSCLC cancerul pulmonar cu celule non-mici ; PlGF factorul de creştere placentară; PSA antigen specific prostatic ; SCLC cancerul pulmonar cu celule mici ; VEGF factorul de creştere al endoteliului vascular; XELOX oxaliplatin + capecitabină; XELOX sin. CAPOX capecitabină + oxaliplatin.
Care este incidenţa cancerului?
Conform Agenţiei Internaţionale de Cercetare a Cancerului (IARC), în 2012 au fost înregistrate 14,1 milioane cazuri de cancer. În acelaşi an au fost înregistrate 8 milioane de decese provocate de cancer, această afecţiune reprezentând cea de-a doua cauză de deces la nivel global, după bolile cardiovasculare(1). Cele mai frecvente cauze ale decesului provocat de cancer sunt cancerele de plămâni (1,69 milioane de decese), de ficat (788.000 de decese), colorectal (774.000 de decese), de stomac (754.000 de decese) şi de sân (571.000 de decese)(2). Se aşteaptă ca, până în 2030, numărul cazurilor noi de cancer să crească la 21,7 milioane, iar numărul deceselor, la 13 milioane, în principal ca urmare a creşterii şi îmbătrânirii populaţiei(1).
Care sunt cauzele cancerului?
Cancerul apare ca urmare a transformării celulelor normale în celule tumorale, într-un proces complex, alcătuit din mai multe etape, care în general progresează de la o leziune precanceroasă la o tumoare malignă. Aceste schimbări sunt rezultatul interacţiunii dintre factorii genetici ai unei persoane cu factorii de mediu cu care aceasta intră în contact şi stilul de viaţă adoptat(2).
Îmbătrânirea este un alt factor fundamental pentru dezvoltarea cancerului. În ţările dezvoltate, 58% dintre cazurile de cancer nou diagnosticate apar după vârsta de 65 de ani(1). Incidenţa cancerului creşte exponenţial cu vârsta, cel mai probabil din cauza acumulării mai multor factori de risc, care se suprapun pe tendinţa de scădere a mecanismelor de reparare celulară, care sunt mai puţin eficiente odată cu înaintarea în vârstă(2).
Factori genetici
Mutaţiile genetice ereditare sunt responsabile de 5-10% din totalul cazurilor de cancer. Mutaţia unor gene este asociată cu aproximativ 50 de sindroame ereditare canceroase(3).
Dacă un părinte are o altfel de mutaţie, există o probabilitate de 50% să o transmită copiilor săi. Nu este obligatoriu ca aceste persoane să facă pe parcursul vieţii cancer, dar prezintă un risc mai crescut. De asemenea, este mult mai probabil să dezvolte cancer la o vârstă mai mică(4).
Majoritatea acestor mutaţii genetice sunt defecte ale genelor care ne protejează de cancer, deoarece repară ADN-ul deteriorat, care poate apărea în mod normal în timpul diviziunii celulare. Aceste gene poartă numele de gene supresoare tumorale sau antioncogene. Exemple de astfel de gene sunt BRCA1, BRCA2 şi p53 sau TP53(4).
Mutaţia genelor BRCA1 sau BRCA2 creşte riscul de a dezvolta cancer de sân sau ovarian la femei. iar la bărbaţi, de a dezvolta cancer de prostată sau de sân. De asemenea, creşte, pentru ambele sexe, riscul de cancer pancreatic şi melanom(5).
Gena cel mai frecvent mutantă la persoanele cu cancer este p53 sau TP53, genă implicată în sinteza unei proteine care suprimă creşterea tumorilor. În apariţia a mai mult de 50% dintre cazurile de cancer este implicată lipsa sau deteriorarea unei gene p53, însă majoritatea mutaţiilor genei p53 sunt dobândite. Mutaţiile ereditare ale genei p53 sunt rare, dar la persoanele care apar există un risc mai mare de a dezvolta mai multe tipuri de cancer(4,5).
Factori cancerigeni
Fumatul
Fumatul este responsabil de aproximativ 30% dintre decesele cauzate de cancer şi de 80% dintre decesele cauzate de cancer de plămâni. În plus, fumatul este un factor de risc implicat în apariţia cancerelor de cavitate bucală, de laringe, de faringe, de esofag, de rinichi, de col uterin, de ficat, pancreas, stomac, cel colorectal şi a leucemiei mieloide. Acest lucru se datorează prezenţei în fumul de ţigară, pe lângă nicotină, a peste 70 de substanţe recunoscute ca fiind cancerigene, precum: formaldehidă, plumb, arsenic, benzen, elemente radioactive (uraniu), nitrozamine şi hidrocarburi policiclice aromatice(6).
Alcoolul etilic
Este în general cunoscut faptul că un consum crescut de băuturi alcoolice poate provoca multe probleme de sănătate. Mai puţin cunoscut este faptul că acest obicei poate creşte riscul de apariţie a unor tipuri de cancer precum: de cavitate bucală, faringe, laringe, esofag, ficat, colorectal şi de sân(7).
Mecanismul prin care alcoolul creşte riscul de cancer nu este complet elucidat, existând mai multe explicaţii:
- efect iritant asupra mucoaselor cu care intră în contact – celulele afectate vor încerca să se repare, ceea ce creşte riscul de apariţie a modificărilor de ADN;
- alcoolul se metabolizează la acetaldehidă, substanţă cancerigenă – această transformare are loc în principal în hepatocit, dar şi la nivelul cavităţii bucale şi al intestinului, sub influenţa florei bacteriene;
- alcoolul şi metaboliţii săi sunt toxici pentru hepatocit, ceea ce induce o stare inflamatorie, care favorizează apariţia modificărilor ADN-ului;
- alcoolul poate facilita intrarea în celulă a componentelor fumului de ţigară – astfel se explică de ce riscul de a dezvolta cancer este mai mare în rândul persoanelor care fumează şi consumă băuturi alcoolice în cantităţi mari;
- alcoolul scade absorbţia mai multor substanţe nutritive, precum acidul folic. Niveluri scăzute de acid folic sunt implicate în apariţia unor tipuri de cancer precum cel de sân şi colorectal;
- alcoolul creşte nivelul de estrogen, hormon implicat în apariţia riscului de cancer de sân;
- alcoolul creşte sinteza speciilor reactive de oxigen, molecule care pot deteriora ADN-ul(7,8).
Obezitatea
Persoanele obeze sau supraponderale prezintă un risc mai mare de a dezvolta cancer. Conform cercetărilor efectuate de Societatea Americană pentru Cancer (ACS), greutatea corporală excesivă este considerată responsabilă pentru aproximativ 8% dintre cazurile de cancer din SUA. Obezitatea creşte riscul cancerelor de: sân (la femeile aflate în menopauză), colon şi rect, endometru, esofag, rinichi şi pancreas(9).
Creşterea riscului de cancer este probabil datorată mai multor mecanisme:
- Creşterea activităţii sistemului imunitar, care este implicat în înlăturarea adipocitelor moarte. Se eliberează astfel citokine cu rol proinflamator. Inflamaţia duce la creşterea diviziunilor celulare şi astfel creşte riscul apariţiei de modificări la nivelul ADN-ului.
- Afectarea metabolismului hormonal, în special a insulinei şi a estrogenului.
- Modificarea unor factori de creştere celulară, precum factorul de creştere asemănător insulinei (IGF)(9,10).
Radiaţiile
Radiaţiile ionizante provenite atât din surse naturale (materiale radioactive existente în mod natural în mediu – de exemplu, radon), cât şi din surse artificiale (materiale radioactive produse artificial sau expunerile în scop medical – de exemplu, raze X, gamma etc.) cresc incidenţa leucemiei acute, a cancerului de tiroidă, de sân sau de plămâni(11,12). Este cunoscut faptul că majoritatea cancerelor de piele sunt cauzate de expunerea la raze UV, atât naturale, cât şi artificiale. Carcinomul bazal sau cel cu celule scuamoase (cele mai întâlnite tipuri de cancer de piele) sunt, în general, localizate în zonele expuse în mod normal la soare(13).
Agenţii de natură biologică
Infecţiile cu anumite virusuri, bacterii şi paraziţi sunt recunoscute ca factori de risc pentru mai multe tipuri de cancer la om. La nivel mondial, infecţiile sunt responsabile de aproximativ 15-20% dintre cazurile de cancer. Acest procent este chiar mai mare în ţările în curs de dezvoltare, unde aceste infecţii sunt mai frecvente, dar este mai mic în ţările dezvoltate, unde alţi factori de risc pentru cancer – de exemplu, obezitatea – sunt mai frecvenţi(14).
Mecanismele implicate în creşterea riscului apariţiei cancerului sunt variate:
- Afectarea în mod direct a genelor responsabile de creştere, din interiorul celulelor. Unele virusuri sunt capabile să îşi introducă propriile gene în celulă, determinând astfel o creştere necontrolată.
- Unele infecţii pot provoca o inflamaţie cronică, ducând la perturbarea homeostaziei atât a celulelor afectate, cât şi a celulelor sistemului imun din apropiere şi la apariţia cancerului.
- Suprimarea sistemului imunitar al unei persoane, care în mod normal ajută la protejarea organismului împotriva unor forme de cancer(15).
Virusurile HPV (Human papilloma viruses) sunt un grup de mai mult de 150 de virusuri care se dezvoltă la nivelul pielii şi mucoaselor. 40 de tulpini se transmit prin contact sexual, majoritatea persoanelor active sexual fiind infectate cu cel puţin o tulpină pe parcursul vieţii. Dintre acestea, cel puţin 12 tipuri pot produce cancer, în special de col uterin. Incidenţa acestui tip de cancer a scăzut în ultimii ani, mai ales în ţările dezvoltate, datorită disponibilităţii testului Papanicolau, care detectează modificările precanceroase de la nivelul colului uterin şi datorită apariţiei vaccinului anti-HPV(15).
Virusul Epstein-Barr este un virus herpetic (HHV-4, human herpesvirus 4) responsabil de mononucleoza infecţioasă (boala sărutului). Transmiterea se face pe cale respiratorie sau prin folosirea aceloraşi pahare sau tacâmuri. Până la sfârşitul adolescenţei, majoritatea persoanelor sunt infectate cu acest virus, dar nu toate dezvoltă simptome de mononucleoză. Virusul rămâne în organism toată viaţa, stocat la nivelul limfocitelor B. Infecţia cu acest virus creşte probabilitatea ca o persoană să dezvolte anumite tipuri de limfoame, precum Burkitt şi Hodgkin, sau cancer nazofaringian şi de stomac(15).
Virusul hepatitei B (HBV) şi virusul hepatitei C (HCV) produc hepatită virală şi cresc probabilitatea apariţiei cancerului hepatic. Unele cercetări sugerează că o infecţie cronică cu HCV poate creşte riscul apariţiei limfomului non-Hodgkin(15).
Virusul imunodeficienţei umane (HIV) nu este implicat direct în apariţia cancerului, dar creşte riscul ca o persoană să dezvolte mai multe tipuri de cancer, în special cele cauzate de alte virusuri, cum ar fi sarcomul Kaposi şi cancerul de col uterin(15).
Sarcomul Kaposi este un tip de cancer rar, datorat infecţiei cu virusul herpetic 8 (HHV-8), caracterizat prin apariţia de tumori roşii-violet sau albastru-maronii sub piele. Aproximativ 10% din populaţia SUA este infectată cu acest virus, însă sarcomul Kaposi apare doar când sunt asociaţi şi alţi factori de risc pentru cancer, cum ar fi infecţia cu HIV(15).
Helicobacter pylori este o bacterie Gram-negativă care poate produce ulcer gastroduodenal. De asemenea, produce o inflamaţie cronică şi leziuni ale mucoasei gastrice, care pot duce în timp la apariţia cancerului gastric(16). Aproximativ 4 din 10 cazuri de cancer gastric sunt cauzate de această bacterie. În plus, creşte şi riscul apariţiei limfomului non-Hodgkin şi intestinal(17).
Care sunt semnele şi simptomele cancerului?
Prezenţa oricăruia dintre aceste semne trebuie să ducă la examinarea promptă a pacientului de către medic(18,19,20).
La nivel digestiv:
- modificarea tranzitului intestinal – diareea, constipaţia, dificultăţile de defecare şi apariţia unor scaune gri sau negre pot sugera prezenţa icterului sau a sângerării gastrointestinale
- indigestia sau disfagia, deşi cel mai frecvent sunt de cauză benignă, cum ar fi hernia hiatală, dacă persistă, pot fi datorate unei tumori esofagiene sau gastrice
- pierderea apetitului.
La nivel genito-urinar:
- prezenţa sângelui sau a puroiului în urină, micţiunile frecvente şi dureroase şi apariţia bruscă a nocturiei pot indica sângerarea tractului urinar, o obstrucţie prostatică sau de altă etiologie.
- sângerări vaginale între menstruaţii sau după menopauză.
La nivelul pielii:
- o leziune tegumentară care nu se vindecă poate sugera un cancer tegumentar
- modificări evidente ale unei veruci sau ale unui nev, cum ar fi creşterea în dimensiuni, modificarea culorii sau a formei, pot fi semnele unui melanom malign
- o îngroşare sau prezenţa unui nodul la nivelul unui ţesut poate fi primul semn al unui sarcom de ţesuturi moi.
La nivelul sânilor:
- o îngroşare sau prezenţa unui nodul la nivelul sânului ori a unor scurgeri de la nivelul mameloanelor pot fi primele semne ale unui cancer de sân.
La nivel respirator:
- tusea sâcâitoare, în special dacă este însoţită de expectoraţii sangvinolente şi răguşeală, poate fi semn al unui cancer pulmonar, mai ales dacă apare la un fumător
- sângerări nazale
Care sunt stagiile cancerului?
Există mai multe tipuri de stadializare a cancerului, dar cele mai folosite sunt sistemul numeric şi sistemul TNM.
Sistemul numeric
Acest sistem foloseşte numere pentru a identifica cât de departe s-a răspândit cancerul(21,22).
Cancer stadiul 0 (cancer in situ, carcinom in situ)
Celulele canceroase se găsesc încă în locul unde au apărut şi nu s-au răspândit deloc. Numărul de celule anormale este prea mic pentru a forma o tumoare şi nu este obligatoriu ca aceste celule să se transforme în cancer. De cele mai multe ori pot fi detectate doar dacă sunt localizate la nivelul pielii sau există teste ultraperformante de detecţie, precum în cazul celulelor canceroase de la nivelul sânului sau al colului uterin.
Cancer stadiul 1
Tumoarea este încă de dimensiuni mici şi nu s-a răspândit sau s-a răspândit foarte puţin în ţesuturile învecinate. Nu s-a răspândit la nivelul ganglionilor limfatici.
Cancer stadiul 2 sau 3
Tumoarea are dimensiuni mai mari şi s-a răspândit în ţesuturile învecinate sau la ganglionii limfatici.
Cancer stadiul 4
Cancerul s-a răspândit în organism. Mai poartă numele de cancer metastazat, avansat sau secundar.
Pentru anumite tipuri de cancer, stadiile sunt divizate în mai multe subcategorii, notate cu majuscule(22).
Sistemul TNM
Este sistemul cel mai utilizat pentru stadializarea cancerului. În tabelul 1 sunt explicate literele şi cifrele atribuite fiecărui tip de cancer.
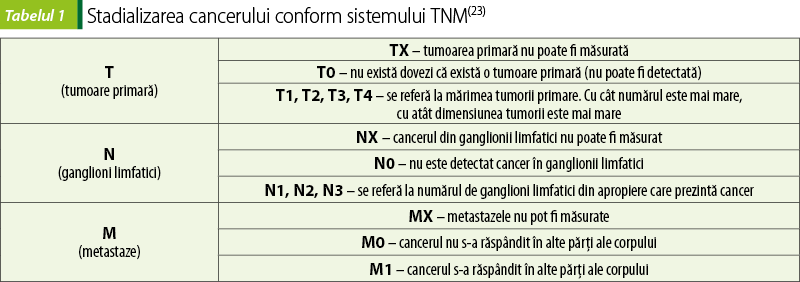
Majoritatea tipurilor de cancer au versiunea proprie a acestei clasificări, motiv pentru care literele, respectiv cifrele, nu reprezintă acelaşi lucru pentru toate tipurile de cancer. De exemplu, pentru anumite tipuri de cancer, cifrele corespunzătoare literei T reprezintă mărimea tumorii, iar pentru altele, cât de profund a crescut tumoarea în organul în care a apărut; pentru unele tipuri de cancer pot exista şi subclasificări, de exemplu T3a şi T3b, iar altele nu au categoria N3(24).
Care sunt principiile de tratament anticanceros?
Scopul tratamentului anticanceros este eradicarea cancerului. Dacă acest obiectiv nu poate fi îndeplinit, se recurge la îngrijiri paliative, pentru ameliorarea simptomelor şi păstrarea calităţii vieţii. Dacă eradicarea cancerului este posibilă, tratamentul anticanceros trebuie iniţiat şi dus la capăt, în ciuda reacţiilor adverse severe, care pot pune viaţa în pericol. Este cunoscut faptul că majoritatea tratamentelor anticanceroase au un indice terapeutic foarte mic(25).
Tratamentul anticanceros este împărţit în patru mari clase:
- Tratament chirurgical
- Radioterapie (inclusiv terapie fotodinamică)
- Chimioterapie (inclusiv terapie hormonală şi terapie moleculară ţintită)
- Terapie biologică (inclusiv imunoterapie şi terapie genică).
Chirurgia şi radioterapia sunt considerate tratamente locale, iar chimioterapia şi terapia biologică sunt considerate tratamente sistemice(25).
Conform statisticilor mondiale, în 2012, cele mai întâlnite tipuri de cancer, cu peste un milion de cazuri înregistrate, sunt de plămâni (1,825 milioane de cazuri), de sân (1,677 milioane de cazuri), colorectal (1,361 milioane de cazuri) şi de prostată (1,112 milioane de cazuri(1). Din acest motiv ne-am propus prezentarea terapiei anticanceroase pentru aceste tipuri de cancer.
Care este tratamentul cancerului pulmonar?
Cele mai întâlnite tipuri de cancer pulmonar sunt cancerul pulmonar cu celule mici (SCLC), care este întâlnit în 10-15% dintre cazuri, şi cancerul pulmonar cu celule non-mici (NSCLC), întâlnit în 80-85% dintre cazuri. Exemple de NSCLC sunt adenocarcinomul, carcinomul cu celule scuamoase şi carcinomul cu celule mari(26).
NSCLC
Dacă este diagnosticat în stadiile incipiente, tratamentul chirurgical duce la vindecare. În plus, adăugarea la schema de tratament a agenţilor chimioterapici derivaţi de platină creşte rata de supravieţuire la pacienţii cu cancer în stadiile 1B, 2 şi 3A(11).
Când este diagnosticat în stadii avansate, prognosticul este prost, cu o perioadă medie de supravieţuire de 8 luni. Pentru aceşti pacienţi este recomandată terapie sistemică combinată, ţinând cont de următoarele principii:
- este de preferat ca unul dintre cele două chimioterapice să fie un compus cu platină (cisplatin sau carboplatin)
- cel de-al doilea chimioterapic poate fi paclitaxel sau vinorelbină; pentru cancerul cu celule scuamoase, pemetrexed, iar pentru cel cu celule non-scuamoase, gemcitabină
- pentru pacienţii cu histologie non-scuamoasă, combinaţia bevacizumab + carboplatin + paclitaxel este cea mai eficientă
- pentru pacienţii cu histologie scuamoasă sau cărora le este contraindicată administrarea de bevacizumab, se poate folosi combinaţia între un compus cu platină şi cetuximab(11).
SCLC
Acest tip de cancer este cea mai agresivă formă de cancer pulmonar. Dacă este diagnosticat precoce, se obţine o rată bună de vindecare folosind chimioterapie combinată cu radioterapie. Este foarte sensibil, iniţial, la chimioterapia combinată care conţine un compus cu platină, cum ar fi: cisplatin + etoposide sau cisplatin + irinotecan, însă pentru aproape toţi pacienţii se dezvoltă rezistenţă. În cazul în care terapia cu compuşi cu platină nu este eficientă, se foloseşte topotecan, ca terapie de a doua linie(11).
Care este tratamentul cancerului de sân?
În funcţie de stadiul cancerului de sân, tratamentul constă în extirparea tumorii şi a ţesutului din jur, cu conservarea sânului, sau mastectomie totală, cu înlăturarea unor ganglioni limfatici axilari. În plus, se pot asocia radioterapie, chimioterapie (atât înainte, cât şi după operaţie), terapie hormonală şi terapie biologică ţintită(1).
Tipul de chimioterapie folosită depinde foarte mult de prezenţa la nivelul tumorii a receptorilor hormonali (receptorii estrogenici sau progesteronici) şi de numărul de receptori pentru factorul de creştere epidermică (HER2), proteină sintetizată de celulele canceroase(1).
Pentru femeile diagnosticate cu cancer de sân în stadiul 1 (tumori primare mici, care nu s-au răspândit la nivelul ganglionilor limfatici axilari), chirurgia oferă o şansă de vindecare de 80%. Se poate asocia chimioterapie pentru femeile care nu sunt la menopauză, sau terapie cu tamoxifen la femeile în postmenopauză, pentru a reduce semnificativ riscul recurenţelor(11).
În cazul în care cancerul s-a răspândit la nivelul ganglionilor limfatici (cancer în stadiul 2), există şanse de recidivă şi micrometastaze, motiv pentru care se foloseşte obligatoriu postoperatoriu chimioterapie. Pentru femeile care au avut prinşi 1-3 ganglioni limfatici se pot efectua:
- 6 cicluri de CMF: ciclofosfamidă + metotrexat + fluorouracil (5-FU), sau
- 6 cicluri de FAC: 5-FU + doxorubicină (adriamicină) + ciclofosfamidă, sau
- 4 cicluri de doxorubicină + ciclofosfamidă, sau
- 6 cicluri de FEC: 5-FU + epirubicină +ciclofosfamidă.
Dacă au fost prinşi patru sau mai mulţi ganglioni limfatici, există beneficii limitate ale chimioterapiei(11).
Tamoxifenul, un inhibitor al receptorilor estrogenici, se foloseşte în cazul femeilor aflate la menopauză, singur sau în combinaţie cu un chimioterapic citotoxic. Durata tratamentului este de 5 ani şi trebuie continuat cu un inhibitor de aromatază, precum anastrazolul, pentru cel puţin 2,5 ani. Altă schemă agreată este: tamoxifen (2-3 ani) + inhibitor de aromatază, durata totală de tratament hormonal fiind de 5 ani. Doza zilnică de tamoxifen este de 20-40 mg, fracţionată în două prize, iar cea de anastrazol, de 1 mg(27,28).
Pentru cancerul de sân avansat (stadiile 3 şi 4) prognosticul este prost, chimioterapia combinată, terapia hormonală sau asocierea celor două duc la un răspuns pozitiv pentru 40-50% dintre paciente, doar 10-20% având un răspuns complet.
Administrarea chimioterapiei şi radioterapiei neoadjuvante înainte de operaţie, în cancerul de sân avansat, poate conduce la scăderea tumorii până la o dimensiune operabilă. Cele mai bune rezultate clinice s-au obţinut cu chimioterapie combinată, care conţine antracicline (CAF: ciclofosfamidă + doxorubicină + 5-FU; FAC: 5-FU + doxorubicină + ciclofosfamidă; FEC: 5-FU + epirubicină + ciclofosfamidă), urmată de taxani (paclitaxel sau docetaxel) sau invers(29).
Pentru pacientele cu tumori cu receptori hormonali, după operaţie, chimioterapia adjuvantă, de primă linie, constă în administrarea de inhibitori de aromatază (anastrazol şi letrozol).
Ca a doua linie de tratament este recomandat tamoxifen, urmat de anastrazol, letrozol sau exemestane. Pentru pacientele cu cancer de sân HER2-pozitiv se foloseşte anticorpul monoclonal anti-HER-2/neu trastuzumab, singur sau în combinaţie cu chimioterapie citotoxică(11,29).
Care este tratamentul cancerului colorectal?
Cancerul de colon şi cel de rect sunt frecvent grupate, deoarece au multe caracteristici comune. Majoritatea cancerelor colorectale pornesc de la nişte excrescenţe epiteliale care apar la nivelul mucoasei intestinului gros, care poartă numele de polipi. Nu este obligatoriu ca aceşti polipi să devină maligni(30).
Pentru cancerele colorectale de stadiul 1, îndepărtarea chirurgicală duce, în majoritatea cazurilor, la vindecare(11).
În cazul cancerelor în stadiul 2 cu risc crescut şi în stadiul 3, după operaţie este recomandată chimioterapie adjuvantă, timp de 6 luni, tratament care reduce rata recidivelor cu 35%. Se alege una dintre următoarele scheme:
- oxaliplatin + 5-FU + leucovorin (FOLFOX sau FLOX, diferenţele dintre cele două scheme fiind de doze utilizate şi intervale diferite între administrări)
- oxaliplatin + capecitabină (XELOX)(31).
În cazul cancerului colorectal metastazat, chimioterapia poate fi iniţiată atât înainte de operaţie (terapie neoadjuvantă), cât şi după operaţie (terapie adjuvantă), agenţii activi fiind:
- Agenţii citotoxici: 5-FU, capecitabina, oxaliplatin şi irnotecan. În general, fluoropirimidinele (5-FU sau capecitabina) fac parte obligatoriu din schema de chimioterapice.
- Agenţii biologici ţintiţi: bevacizumab, ramucirumab (anticorpi anti-VEGF, factorul de creştere al endoteliului vascular), ziv-aflibercept (proteina de fuziune recombinată ţintită către VEGF-A, VEGF-B şi PlGF, factorul de creştere placentară), cetuximab şi panitumumab (anticorpi monoclonali anti-EGFR, receptorul factorului de creştere epidermică)(11).
Cele mai utilizate scheme pentru cancerul colorectal în stadiul 4 sunt:
- FOLFOX: leucovorin + 5-FU + oxaliplatin
- FOLFIRI: leucovorin + 5-FU + irinotecan
- XELOX sin. CAPOX: capecitabină + oxaliplatin
- FOLFOXIRI: leucovorin + 5-FU + oxaliplatin + irinotecan
- oricare dintre cele patru combinaţii + unul dintre agenţii biologici ţintiţi enumeraţi mai sus
- 5-FU + leucovorin ± agent biologic ţintit
- capecitabină ± agent biologic ţintit
- irinotecan ± agent biologic ţintit(30).
Pentru stadiile avansate, radioterapia se poate folosi pentru a preveni sau uşura simptomele, precum durerea(30).
Care este tratamentul cancerului de prostată?
Opţiunile de tratament trebuie să ţină cont de vârstă, de stadiu şi de alte condiţii medicale asociate. Până în acest moment nu există dovezi ştiinţifice care să ateste care este tratamentul cel mai bun pentru cancerul de prostată(1).
Deoarece acest tip de cancer avansează foarte încet, pentru stadiile incipiente, la pacienţii mai în vârstă sau la cei cu o formă mai puţin agresivă, în locul tratamentului, o abordare poate fi supravegherea activă. Aceasta constă în monitorizarea pacientului, o dată la 6 luni, cu determinarea antigenului specific prostatic (PSA) şi tuşeu rectal(32).
Alte opţiuni de tratament pentru stadiile incipiente sunt chirurgia (deschisă sau laparoscopică) sau radioterapia. Terapia hormonală poate fi asociată în cazurile incipiente mai avansate, dar tratamentul are un impact negativ asupra calităţii vieţii, din cauza reacţiilor adverse urinare şi a tulburărilor erectile, care pot fi de scurtă sau de lungă durată(1).
În cazul formelor avansate se utilizează: terapie hormonală combinată cu radioterapie sau rezecţia chirurgicală a prostatei şi limfadectomie pelviană(33).
Terapia hormonală din cancerul de prostată mai poartă numele de terapie de privare androgenică (ADT). Scopul acestei terapii este să scadă nivelurile de hormoni masculini din organism, care stimulează înmulţirea celulelor canceroase din prostată. Acest lucru se realizează prin mai multe metode:
- castrarea chirurgicală (orhiectomie bilaterală)
-
castrare chimică, care se poate face cu:
- agonişti ai hormonului eliberator al hormonului luteinizant (LHRH): leuprolidă, goserelin, triptorelin, histrelin – tratamentul cu aceşti analogi scade nivelurile de androgeni similar cu orhiectomia
- antagonişti ai LHRH: degarelix, abiraterone
- antiandrogeni: flutamidă, bicalutamidă, nilutamidă, enzalutamidă, apalutamidă(32)
Pentru tratamentul cancerului de prostată metastazat se folosesc ca ADT agoniştii LHRH, singuri sau în combinaţie cu antiandrogeni(11). Pentru pacienţii care pot suporta chimioterapia se recomandă combinarea cu docetaxel(33).
Pentru pacienţii cu cancer de prostată metastazat, cu simptome uşoare sau moderate, care nu mai răspund la ADT, se poate folosi vaccinul sipuleucel-T. Acesta stimulează sistemul imunitar să atace celulele canceroase prostatice(1,33).
Concluzie
Speranţa de viaţă în rândul pacienţilor cu neoplasm a crescut spectaculos în ultimii ani, chiar şi a celor care suferă de forme avansate, în special datorită apariţiei noilor terapii anticanceroase. Cu toate acestea cele mai importante arme în lupta cu această afecţiune, sunt reprezentate de adoptarea unui stil de viaţă sănătos şi un screening riguros pentru detectarea cancerului în stadiile lui incipiente.
Bibliografie
- Global Cancer Facts & Figures, 3rd edition. Atlanta: American Cancer Society. 2015
- WHO Cancer Fact Sheet. Updated February 2018. http://www.who.int/mediacentre/factsheets/fs297/en/. Accesat aprilie 2018
- National Cancer Institute. The Genetics of Cancer. Last update: October 2017. https://www.cancer.gov/about-cancer/causes-prevention/genetics. Accesat aprilie 2018
- Cancer Research UK. Family history and inherited cancer genes. Last updated: June 2015. http://www.cancerresearchuk.org/about-cancer/causes-of-cancer/inherited-cancer-genes-and-increased-cancer-risk/family-history-and-inherited-cancer-genes. Accesat aprilie 2018
- American Society of Clinical Oncology. The Genetics of Cancer. Approved March 2018. https://www.cancer.net/navigating-cancer-care/cancer-basics/genetics/genetics-cancer. Accesat aprilie 2018
- The American Cancer Society. Health Risks of Smoking Tobacco and Harmful Chemicals in Tobacco Products. Last Revised: April 2017. https://www.cancer.org/cancer/cancer-causes/tobacco-and-cancer.html. Accesat aprilie 2018
- The American Cancer Society. Alcohol Use and Cancer. Last Revised: April 2017. https://www.cancer.org/cancer/cancer-causes/diet-physical-activity/alcohol-use-and-cancer.html. Accesat aprilie 2018
- Cancer Research UK. How alcohol causes cancer. Last Revised: September 2016. http://www.cancerresearchuk.org/about-cancer/causes-of-cancer/alcohol-and-cancer/how-alcohol-causes-cancer. Accesat aprilie 2018
- The American Cancer Society. Does body weight affect cancer risk? Last Revised: January 2018. https://www.cancer.org/cancer/cancer-causes/diet-physical-activity/body-weight-and-cancer-risk/effects.html. Accesat aprilie 2018
- Cancer Research UK. How being overweight causes cancer. Last Revised: July 2016. http://www.cancerresearchuk.org/about-cancer/causes-of-cancer/obesity-weight-and-cancer/how-being-overweight-causes-cancer. Accesat aprilie 2018
- Chu E and Sartorelli AC. Cancer chemotherapy. Basic and Clinical Pharmacology, 13th Ed. (Katzung BG and Trevor A, ed.). McGraw Hill Education. 2015
- Burkhardt R, Dan T, Bogdan L. Ce este necesar să ştim despre radiaţiile ionizante şi efectele lor asupra omului ghid de educaţie pentru sănătatea populaţie. Ghid de educaţie pentru sănătatea populaţiei. Ministerul Sănătăţii. Institutul Naţional de Sănătate Publică. 2016. http://www.insp.gov.ro/cnmrmc/images/ghiduri/Ghid-Educatie-pentru-sanatate.pdf. Accesat aprilie 2018
- The American Cancer Society. Ultraviolet (UV) Radiation. Last Revised: August 2015. https://www.cancer.org/cancer/cancer-causes/radiation-exposure/uv-radiation.html. Accesat aprilie 2018
- The American Cancer Society. Infections That Can Lead to Cancer. Last Revised: July 2016. https://www.cancer.org/cancer/cancer-causes/infectious-agents/infections-that-can-lead-to-cancer.html. Accesat aprilie 2018
- The American Cancer Society. Viruses that can lead to cancer. Last Revised: July 2016. https://www.cancer.org/cancer/cancer-causes/infectious-agents/infections-that-can-lead-to-cancer/viruses.html. Accesat aprilie 2018
- The American Cancer Society. Bacteria that can lead to cancer. Last Revised: July 2016. https://www.cancer.org/cancer/cancer-causes/infectious-agents/infections-that-can-lead-to-cancer/bacteria.html. Accesat aprilie 2018
- Cancer Research UK. H. pylori and cancer. Last Revised: September 2016. http://www.cancerresearchuk.org/about-cancer/causes-of-cancer/infections-hpv-and-cancer/h-pylori-and-cancer. Accesat aprilie 2018
- Ihde DC, Longo DL. Forme de prezentare a pacienţilor neoplazici: tumori solide la adulţi. Capitolul 63, Tratatul de Medicină Internă al lui Harrison, Ed a XIV-a. Editura All. Bucureşti. 2003
- The American Cancer Society. How does cancer cause signs and symptoms? Last Revised: August 2014. https://www.cancer.org/cancer/cancer-basics/signs-and-symptoms-of-cancer.html. Accesat aprilie 2018
- Balentine J, Davis CP. 18 Cancer Symptoms. https://www.emedicinehealth.com/cancer_symptoms/article_em.htm#cancer_facts. Accesat aprilie 2018
- Cancer Institute NSW. What are the different stages of cancer? Published: October 2017. https://www.cancerinstitute.org.au/understanding-cancer/what-are-the-different-stages-of-cancer. Accesat aprilie 2018
- Cancer Research UK. Stages of cancer. Last revised: December 2017. http://www.cancerresearchuk.org/about-cancer/what-is-cancer/stages-of-cancer. Accesat aprilie 2018
- National Cancer Institute. Cancer Staging. Last revised: March 2015. https://www.cancer.gov/about-cancer/diagnosis-staging/staging. Accesat aprilie 2018
- The American Cancer Society. Cancer Staging. Last Revised: March 2015. https://www.cancer.org/treatment/understanding-your-diagnosis/staging.html. Accesat aprilie 2018
- Sausville EA and Longo DL. Chapter 85. Principles of Cancer Treatment. Harrison’s Principles of Internal Medicine, 18e (Fauci AS et al., editors). The McGraw-Hill Companies, Inc. 2012
- American Society of Clinical Oncology. Lung Cancer. https://www.cancer.org/cancer/lung-cancer.html. Accesat aprilie 2018
- ANMDM. Rezumatul Caracteristicilor Produsului Tamoxifen Sandoz. Ultima revizuire: Ianuarie 2017. https://www.anm.ro/_/_RCP/rcp_2715_13.08.10.pdf. Accesat aprilie 2018
- ANMDM. Rezumatul Caracteristicilor Produsului Arimidex. Ultima revizuire: Octombrie 2014. https://www.anm.ro/_/_RCP/RCP_7053_23.10.14.pdf. Accesat aprilie 2018
- Jardines L, Royce M, Jaiyesimi I, Goldfarb SB. Stages III and IV Breast Cancer, 2015. http://www.cancernetwork.com/cancer-management/stages-iii-and-iv-breast-cancer. Accesat aprilie 2018
- American Society of Clinical Oncology. Colorectal Cancer. https://www.cancer.org/cancer/colon-rectal-cancer.html. Accesat aprilie 2018
- Labianca R, Nordlinger B, Beretta GD, Brouquet A, Cervantes A. Cancerul de colon primar: Ghidurile de practică clinică ESMO pentru diagnostic, tratament adjuvant şi urmărire. Annals of Oncology 21 (Supplement 5): v70–v77, 2015. http://www.srrom.ro/Ghiuri_ESMO/03.3.1_Primarycolon_v70_RO_05.08.2014.pdf. Accesat aprilie 2018
- American Society of Clinical Oncology. Prostate Cancer. https://www.cancer.org/cancer/prostate-cancer.html. Accesat aprilie 2018
- Parker C, Gillessen S, Heidenreich A, Horwich A. Cancer of the prostate: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v69–v77, 2015, doi:10.1093/annonc/mdv222