Chronic obstructive pulmonary disease (COPD) is a chronic, irreversible disease, characterized by narrowing of the lungs’ airways. Frequently it is accompanied by dyspnoea and productive cough, due to the exaggerated sputum production. Smoking or exposure to other harmful particles are the most common causative factors. Adrenomimetic or anticholinergic bronchodilators are essential in the treatment of symptomatic COPD. They reduce symptoms, improve exercise tolerance and increase the quality of life. Maintenance treatment is performed in stages, and inhalation or inhibition of phosphodiesterase inhibitors may also be associated. The maintenance treatment aims to decrease the frequency and intensity of acute episodes. Severe exacerbations often require hospitalization, sometimes in the intensive care unit, with intensified treatment and respiratory and hemodynamic support. Many exacerbations are caused by infections, which is why antibiotics are a common practice in COPD patients. Pneumococcal vaccination and annual influenza vaccination are measures that should be applied in all COPD patients.
Managementul terapeutic al bolii pulmonare obstructive cronice
Therapeutic management of chronic obstructive pulmonary disease
First published: 21 octombrie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.191.6.2019.2683
Abstract
Rezumat
Boala pulmonară obstructivă cronică (BPOC) este o boală cronică progresivă, ireversibilă, caracterizată prin îngustarea căilor aeriene pulmonare. Frecvent, este însoţită de dispnee şi tuse productivă, datorată producţiei exagerate de spută. Fumatul sau expunerea la alte particule de noxe constituie cei mai frecvenţi factori cauzatori. Bronhodilatatoarele adrenomimetice sau anticolinergice sunt esenţiale în tratarea BPOC simptomatice. Ele reduc simptomele, îmbunătăţesc rezistenţa la efort şi sporesc calitatea vieţii. Tratamentul de întreţinere se face în trepte, putându-se asocia şi corticosteroizi inhalatori sau inhibitoare ale fosfodiesterazei. Tratamentul de întreţinere are drept scop scăderea frecvenţei şi intensităţii episoadelor de acutizare. Exacerbările severe necesită de multe ori spitalizare, uneori în secţia de terapie intensivă, cu intensificarea tratamentului şi suport respirator şi hemodinamic. Multe dintre exacerbări apar pe fondul unor infecţii, de aceea administrarea antibioticelor este o practică uzuală la pacienţii cu BPOC. Vaccinarea antipneumococică şi vaccinarea anuală antigripală sunt măsuri care trebuie aplicate tuturor pacienţilor cu BPOC.
Abrevieri: AAT – α1-antitripsină; BPOC – Boală Pulmonară Obstructivă Cronică; CVF – Capacitate vitală forţată; DPI – Inhalatoare cu pudră uscată (Dry Powder Inhaler); GOLD – Global Initiative for Chronic Obstructive Lung Disease; ICS – Corticosteroizi inhalatori (Inhaled Corticosteroids); IL – Interleukină; LABA – β2-agonişti cu durată lungă de acţiune (Long-Acting Beta Agonists); LAMA – Anticolinergice cu durată lungă de acţiune (Long-Acting Muscarinic Antagonists); LTRA – Antagonist al receptorilor leucotrienelor (Leukotriene Receptor Antagonist); MDI – Metered-dose Inhaler; NO – Oxid nitric; SABA – β2-agonişti cu durată scurtă de acţiune (Short-Acting Beta Agonists); SAMA – Anticolinergice cu durată scurtă de acţiune (Short-Acting Muscarinic Antagonists); VEMS – Volum expirator maxim pe secundă
La nivel global, se estimează că prevalenţa BPOC este de 11,7%. În prezent, BPOC este a treia cauză de deces la nivel global(1). În jur de 3 milioane de oameni au murit în 2016 din cauza acestei patologii, iar mortalitatea şi morbiditatea asociate acestei boli vor creşte în viitor ca urmare a îmbătrânirii populaţiei şi a expunerii crescânde la factorii de risc pentru această patologie.
Conform definiţiei actuale date de GOLD, BPOC este o „afecţiune cronică frecventă, netransmisibilă, prevenibilă şi tratabilă, caracterizată de simptome respiratorii persistente şi de îngustarea căilor respiratorii”, datorată expunerii semnificative la particule nocive sau gaze(2).
Bronşita cronică şi emfizemul fac parte din tabloul clinic al BPOC. Se vorbeşte despre bronşită cronică atunci când tusea productivă cronică apare pentru cel puţin 3 luni pe an în doi ani consecutivi, fără altă cauză decelabilă. Emfizemul este distrugerea patologică a alveolelor pulmonare(3).
Fumatul este cel mai important factor nociv implicat în apariţia BPOC. Poluarea şi gazele provenite din arderea combustibililor fosili contribuie şi ei. Factorii etiologici care ţin de individ sunt genetici, dezvoltarea pulmonară anormală şi îmbătrânirea accelerată.
Cele mai frecvente simptome respiratorii sunt dispneea, tusea şi producerea de spută. Evoluţia este una progresivă, ireversibilă, însoţită adesea de exacerbări. Dispneea este persistentă, se agravează în timp şi este mai severă la efort. Apare şi respiraţia şuierătoare (wheezing). Tusea cronică poate fi intermitentă şi neproductivă, dar de obicei este însoţită de hipersecreţie de mucus, devenind productivă. Simptomele nespecifice includ oboseala, scăderea ponderală şi anorexia.
Fiziopatologie
Inhalarea gazelor sau a particulelor nocive generează un cerc vicios în care răspunsul inflamator generează şi este întreţinut de stresul oxidativ. Inflamaţia din BPOC diferă de cea din astmul bronşic. Dacă în astm predomină formarea de eozinofile şi mastocite, inflamaţia din BPOC este mediată majoritar de neutrofile, macrofage şi limfocite T CD8+. Acestea eliberează interleukine IL-1 şi IL-8, factorul de necroză tumorală alfa şi proteinaze(3).
Inflamaţia stimulează apariţia unui dezechilibru dintre proteinaze şi antiproteinaze, datorat fie producţiei sau activităţii crescute a proteinazelor, fie scăderii formării de antiproteinaze. Consecutiv, scade capacitatea de protecţie şi apărare a plămânului. Apariţia emfizemului e favorizată de deficitul de α1‑antitripsină, o antiproteinază care inhibă fiziologic tripsina, elastaza şi alte enzime proteolitice. Deficitul de AAT conduce la degradarea pereţilor alveolari şi a parenchimului pulmonar. Stresul oxidativ provocat de expunerea la noxe promovează inflamaţia şi reduce suplimentar activitatea antiproteinazică(3).
Consecinţele acestor procese fiziopatologice sunt hipersecreţia de mucus datorată hiperplaziei glandulare, disfuncţia ciliară, îngustarea căilor aeriene, anomalii în schimburile pulmonare de gaze (cu hipoxemie şi hipercapnie). În cele din urmă apar hipertensiunea pulmonară şi alte afectări sistemice, precum complicaţii cardiovasculare (insuficienţă cardiacă dreaptă, sau cor pulmonale) şi pierderi ale masei musculare(3).
Semne şi simptome ale BPOC. Diagnosticarea BPOC. Stadializarea BPOC
Pacienţii sunt iniţial asimptomatici. De regulă, până când declinul funcţiei pulmonare nu e suficient de sever încât să producă simptome deranjante care să trimită pacientul la medic, BPOC evoluează nediagnosticată(3).
Debutul simptomelor este variabil şi nu se corelează bine cu gradul de limitare a căilor aeriene cuantificat de volumul expirator maxim pe secundă (VEMS). Simptomele iniţiale includ tusea cronică, având o durată mai mare de 3 luni, expectoraţia cronică şi dispneea de efort. Poate să apară senzaţia de greutate în piept. Pe măsură ce BPOC progresează, se instalează dispneea în repaus, iar capacitatea pacientului de a-şi desfăşura activităţile zilnice scade(3).
Examenul obiectiv arată implicarea muşchilor accesori respiratori şi hiperinflaţia pieptului, cu creşterea diametrului anteroposterior. La auscultaţie se decelează wheezingul şi alte zgomote patologice. Cianoza şi tahicardia apar în BPOC avansată; pentru a compensa lipsa de oxigenare, numărul eritrocitelor poate să crească. Insuficienţa cardiacă dreaptă (cor pulmonale) se manifestă cu distensie venoasă jugulară, edeme şi hepatomegalie.
Spirometria este necesară pentru confirmarea diagnosticului. Severitatea BPOC se poate aprecia pe baza raportului dintre VEMS şi capacitatea vitală forţată (CVF). Un raport VEMS/CVF sub 70% obţinut după administrarea de bronhodilatatoare denotă o îngustare a căilor aeriene care nu e pe deplin reversibilă.
Conform GOLD 2019, evaluarea îngustării căilor aeriene stadializează BPOC în funcţie de valoarea VEMS măsurată raportată la valoarea prezisă astfel: GOLD 1 (BPOC uşoară), VEMS ≥ 80% faţă de prezis; GOLD 2 (BPOC moderată) VEMS 50-79% faţă de valoarea prezisă; GOLD 3 (BPOC severă), VEMS 30-49% din valoarea prezisă; GOLD 4 (BPOC foarte severă), VEMS mai mic de 30% din valoarea prezisă(2).
Utile în evaluarea simptomelor şi a riscului de exacerbări sunt diferite chestionare. Cele mai folosite sunt COPD Assessment Test (CATTM) şi chestionarul Modified Medical Research Council (mMRC). Scoruri mici la aceste teste denotă o severitate mai scăzută a BPOC.
Pe baza istoricului exacerbărilor, care au valoare predictivă pentru viitoarele exacerbări, şi a scorurilor la chestionare, se construieşte o matrice (tabelul 1) care determină cu ce se iniţiază terapia.

Atenţie deosebită trebuie acordată şi comorbidităţilor prezente, deoarece acestea pot agrava prognosticul. Frecvent, pacienţii care suferă de BPOC pot avea şi boli cardiovasculare, sindrom metabolic, osteoporoză, depresie, afecţiuni psihiatrice (anxietate, depresie) şi cancer pulmonar.
Pentru toate categoriile de pacienţi, indiferent în care dintre categorii (A, B, C sau D) se află, se recomandă evitarea factorilor de risc, mai ales renunţarea la fumat. Vaccinare antigripală trebuie să se facă anual, deoarece prin imunizarea antigripală riscul de boală severă şi de deces scade cu 50%(3). Vaccinarea antipneumococică cu vaccin pneumococic polizaharidic (PPSV23, de exemplu Pneumovax 23) trebuie să se facă la toţi pacienţii cu BPOC, cu revaccinare la 5 ani de la vaccinarea iniţială sau dacă la vaccinarea iniţială aveau mai puţin de 65 de ani. Vaccinul pneumococic polizaharidic conjugat (PCV13, de exemplu Prevenar 13) se foloseşte la persoanele de peste 65 de ani nevaccinate anterior. Pentru imunizarea completă, la 6 şi 12 luni după PCV13 se face rapel cu PPSV23(3). Pacienţii trebuie sfătuiţi să facă activitate fizică regulată, în limitele impuse de severitatea afecţiunii; activitatea fizică îmbunătăţeşte circulaţia şi duce la o mai bună oxigenare a ţesuturilor, furnizează energie şi atenuează simptomele BPOC, făcând parte din intervenţiile de reabilitare pulmonară. La iniţierea tratamentului medicamentos, pacienţii trebuie învăţaţi să utilizeze corect dispozitivele inhalatorii; de altfel, corecta folosire a inhalatoarelor trebuie verificată la fiecare interacţiune dintre pacient şi medic sau farmacist.
Dacă se instalează hipoxia cronică, oxigenoterapia pe termen lung poate deveni o necesitate.
Renunţarea la fumat
Renunţarea la fumat este factorul cel mai important care poate încetini progresia BPOC. GOLD 2019 consideră că, dacă sunt acordate suficiente resurse şi timp acestui subiect, rata de renunţare susţinută în timp poate ajunge la 25%(2).
Profesioniştii în domeniul sănătăţii trebuie să verifice la fiecare întâlnire cu pacientul cu BPOC statutul de fumător şi trebuie să folosească metode eficace de persuasiune pentru a-i convinge pe fumători să renunţe.
Pentru fumătorii care încearcă să se lase de fumat, există variante farmacologice care îi pot ajuta în acest demers. Pacientul poate să renunţe treptat la ţigări, după un plan riguros stabilit, înlocuind treptat ţigările cu medicamente cu nicotină, pentru ca în final să renunţe şi la acestea. Plasturii transdermici cu nicotină (Nicorette Clear® 25 mg/16 ore sau 10 mg/16 ore, Niquitin Clear® 21 mg, 14 mg, 7 mg) sunt destinaţi a asigura concentraţii plasmatice constante, dar şi din ce în ce mai scăzute de nicotină, iar gumele de mestecat (Nicorette Freshfruit® sau Icemint®, 4 mg, 2 mg, Niquitin Mentol® 4 mg, 2 mg) şi spray-urile
(Nicorette Freshmint® 1 mg/pulverizare) asigură plusul de nicotină pe care fumătorul îl obţinea de la ţigară(4). Comprimatele de NicoferinR 1,5 mg conţin citizină, un alcaloid din plante cu structură asemănătoare nicotinei, iar acestea se iau în scheme descrescătoare de tratament, începând cu 6 compr./zi, timp de 25 de zile, fumatul trebuind oprit cel târziu în ziua a cincea de tratament(5).
Alte variante medicamentoase indicate în tratamentul dependenţei de nicotină şi pentru suportul renunţării la fumat sunt bupropiona (Zyban®, compr. elib. prel. 150 mg) şi vareniclina (Champix®, compr. film. 0,5 mg şi 1 mg). Bupropiona este un inhibitor selectiv al recaptării neuronale a noradrenalinei şi dopaminei, cu efect minim asupra recaptării serotoninei; mecanismul exact prin care contribuie la renunţarea la fumat nu se cunoaşte. Tratamentul se începe cu 150 mg/zi, timp de 7 zile, apoi se continuă cu 150 mg de 2 ori/zi; durata tratamentului este de 7-9 săptămâni. Bupropiona este contraindicată în antecedente convulsive, în prezenţa tumorilor la nivelul SNC, în bulimie sau anorexie nervoasă, la pacienţii cu ciroză hepatică severă şi la pacienţii cu tulburare bipolară. Vareniclina este un agonist parţial al unor receptori nicotinici neuronali. Dozele se cresc treptat, 0,5 mg o dată/zi în primele 3 zile, apoi de două ori/zi în zilele 4-7, pentru ca din ziua a opta să se administreze 1 mg de 2 ori/zi; durata tratamentului este de 12 săptămâni. Pentru ambele substanţe, renunţarea la fumat se recomandă a se face în a doua săptămână de tratament(4).
Iniţierea tratamentului medicamentos
Tratamentul de fond al BPOC este un tratament cronic. Scopurile terapiei BPOC stabile sunt reducerea simptomelor, reducerea frecvenţei şi severităţii exacerbărilor, creşterea toleranţei la efort, prevenirea progresiei bolii şi îmbunătăţirea generală a stării de sănătate(2).
Tratamentul medicamentos trebuie să fie individualizat, fiind ghidat de severitatea simptomelor şi riscul de exacerbări, de contraindicaţiile, precauţiile şi potenţialele reacţii adverse ale medicamentelor, disponibilitatea şi preţul medicamentelor, precum şi preferinţele şi abilitatea pacientului de a folosi una sau altele din alternativele terapeutice. Importanţa aderenţei la tratament trebuie mereu adusă în atenţia pacientului, precum şi corecta utilizare a dispozitivului inhalator(2).
Tratamentul medicamentos se iniţiază în funcţie de categoria (A, B, C sau D) în care se află pacientul, conform tabelului 2.

Continuarea tratamentului medicamentos
Deciziile privind continuarea aceluiaşi tratament sau modificarea lui trebuie să se ia pe baza controlului simptomelor şi succesului în prevenirea exacerbărilor furnizate de terapia în curs.
La evaluările de control se verifică severitatea simptomelor, numărul şi severitatea exacerbărilor (de maxim interes cele soldate cu spitalizări), corecta folosire a inhalatoarelor, aderenţa la tratament şi statusul imunizărilor.
Decizia privind introducerea sau întreruperea administrării de ICS se ia pe baza severităţii simptomelor, dar mai ales pe baza numărului de eozinofile prezente în sânge. GOLD 2019 încurajează folosirea numărului de eozinofile ca biomarker pentru a ghida terapia cu ICS. Niveluri mai scăzute de eozinofile sangvine (de exemplu, sub 100 celule/microL) denotă o probabilitate scăzută de răspuns la tratamentul cu ICS şi posibil un risc mai mare de pneumonie asociată ICS. Valori mai mari sunt asociate cu o probabilitate mai mare de răspuns la ICS, adică cu scăderea frecvenţei şi severităţii exacerbărilor, ceea ce pledează pentru introducerea, respectiv menţinerea ICS în schema de terapie când numărul eozinofilelor este mare(2).
GOLD 2019 recomandă următoarele posibilităţi de ajustare a terapiei(2):
1. În cazul simptomelor bine controlate, la pacienţi cu risc mic de exacerbare, de regulă, se menţine terapia prezentă. În cazul pacienţilor trataţi cu ICS se poate încerca scăderea dozelor sau renunţarea la acest medicament, mai ales la pacienţii cu valori scăzute ale eozinofilelor sangvine. Pacienţii cărora li se scoate din schema de terapie ICS trebuie mai frecvent monitorizaţi.
2. În cazul pacienţilor cu dispnee persistentă, dar cu risc mic de exacerbare se urmează recomandările din tabelul 3.
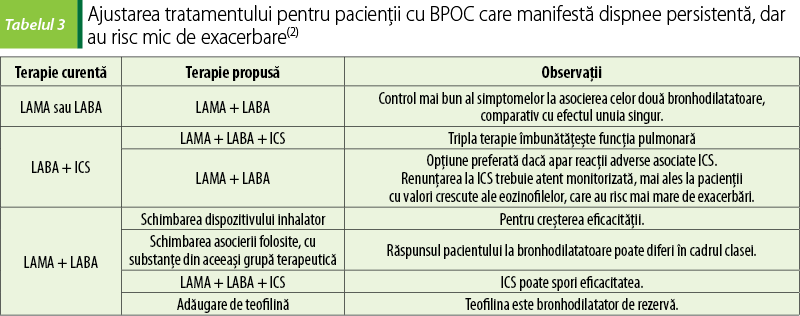
3. În cazul pacienţilor cu risc mare de exacerbare, indiferent dacă simptomele sunt sau nu bine controlate, se urmează recomandările din tabelul 4.

Oxigenoterapia pe termen lung este necesară la pacienţii la care hipoxia este severă, în ciuda tratamentului medicamentos adecvat.
Managementul exacerbărilor
Exacerbările sunt definite ca agravări ale simptomelor acute ale BPOC care conduc la nevoia de terapie suplimentară(2).
Exacerbările BPOC pot fi precipitate de mai mulţi factori, infecţiile respiratorii fiind cel mai frecvent declanşator(2).
Scopul tratamentului unei exacerbări a BPOC este minimizarea consecinţelor negative ale acutizării prezente şi prevenirea exacerbărilor ulterioare(2).
Tratamentul iniţial al exacerbărilor constă în administrare inhalatorie de SABA, cu sau fără SAMA. Exacerbările severe necesită spitalizare. Terapia de menţinere cu bronhodilatatoare cu durată lungă de acţiune trebuie iniţiată cât mai curând după externare(2).
Corticosteroizii sistemici pot îmbunătăţi funcţia pulmonară şi gradul de oxigenare şi pot scurta recuperarea şi perioada de spitalizare. Se folosesc doze zilnice de 40 mg de prednison sau prednisolon. Nu se recomandă terapie sistemică cu corticosteroizi mai mult de 5-7 zile(2).


Antibioticele sunt indicate în prezenţa infecţiilor, deoarece scurtează perioada de recuperare şi de spitalizare şi reduc riscul de recădere şi de eşec al terapiei. Durata recomandată de administrare este de 5-7 zile(2).
Aproximativ 50% din exacerbări sunt cauzate de infecţii bacteriene. Cei mai frecvenţi patogeni bacterieni izolaţi în timpul exacerbărilor BPOC sunt Haemophilus influenzae, Streptococcus pneumonia şi Moraxella catarrhalis. Infecţiile cu Haemophilus influenzae şi Streptococcus pneumonia răspund bine la administrare de ampicilină sau amoxicilină, asociate cu un inhibitor de beta-lactamază. Infecţiile cu Moraxella catarrhalis se tratează cu azitromicină, claritromicină, doxiciclină, cefalosporine de a treia generaţie, levofloxacină sau moxifloxacină. Infecţiile cu Pseudomonas aeruginosa se tratează cu ciprofloxacină sau levofloxacină, cu piperacilină – tazobactam sau ticarcilină – clavulanat, cu cefepimă sau ceftazidimă, cu meropenem, imipenem – cilistatină sau doripenem sau cu gentamicină, tobramicină sau amikacină. Infecţiile cu Staphylococcus aureus meticilino-rezistent (MRSA) se tratează cu vancomicină sau linezolid(3).
Antibioticele reduc mortalitatea pe termen scurt şi scad ratele de eşec al tratamentului, mai ales în cazul pacienţilor cu spută purulentă sau cu expectoraţie ori dispnee severă, precum şi la cei care necesită ventilaţie mecanică.
Metilxantinele nu sunt recomandate din cauza profilului farmacotoxicologic nefavorabil(2) sau se păstrează ca medicaţie de rezervă, destinată mai ales pacienţilor critici care nu au răspuns la bronhodilatatoarele standard(3).
Dacă se instalează insuficienţa respiratorie, pacientul trebuie ventilat mecanic(2).

Clasificarea severităţii exacerbărilor se face în funcţie de măsurile terapeutice luate pentru gestionarea exacerbărilor. Exacerbările uşoare sunt tratate numai cu bronhodilatatoare cu durată scurtă de acţiune. Exacerbările moderate necesită bronhodilatatoare cu durată scurtă şi antibiotice şi/sau corticosteroizi orali. Exacerbările severe necesită spitalizare sau vizită în departamentul de urgenţe, frecvent fiind asociate cu insuficienţă respiratorie acută(2).
Medicamente folosite în tratamentul BPOC
β2-adrenomimetice
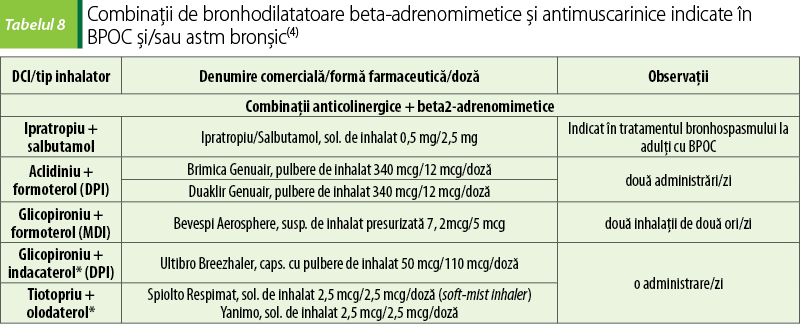
Produc relaxarea musculaturii netede prin stimularea adenilatclazei, cu creşterea formării de adenozin monofosfat ciclic (AMPc). Pot îmbunătăţi transportul mucociliar. β2-adrenomimeticele sunt disponibile în forme farmaceutice cu administrare inhalatorie (cea mai folosită, datorită efectelor adverse mai puţine şi livrării substanţei direct la locul de acţiune), orală şi parenterală(3).
Salbutamolul este un β2-adrenomimetic cu durată scurtă, folosit ca medicaţie de salvare, pentru atenuarea simptomelor acute. Pentru tratamentul de fond al BPOC se folosesc β2-adrenomimeticele cu durată lungă (formoterol, salmeterol), administrate în două prize zilnice, sau cu durată ultralungă (indacaterol, olodaterol, vilanterol), care se administrează o singură dată pe zi(3).
Efectele adverse ale β2-agoniştilor sunt dependente de doză şi includ palpitaţii, tahicardie, hipokaliemie şi tremor, tulburări de somn(3).
Anticolinergice
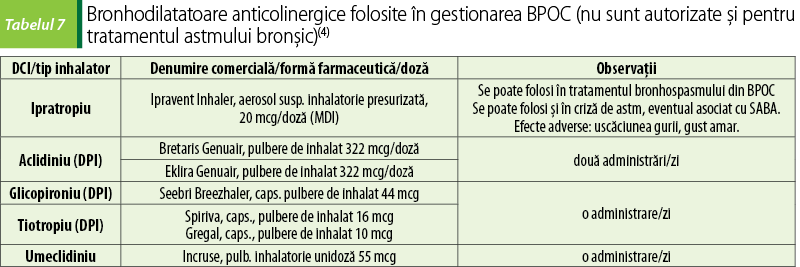
Ipratropiu, tiotropiu, aclidiniu, glicopironiu şi umeclidiniu se folosesc, sub formă de bromură, în administrarea inhalatorie, în tratamentul BPOC. Produc bronhodilataţie prin blocarea competitivă a receptorilor muscarinici în muşchii netezi bronşici. Pot scădea şi secreţia de mucus. Tiotropiu, glicopironiu şi umeclidiniu au timp de înjumătăţire lung, care permite administrarea în doză zilnică unică. Aclidiniul are latenţă mai scurtă decât tiotropiul, dar un timp de înjumătăţire mai scurt, necesitând administrare de două ori pe zi. Ipratropiul are un timp de înjumătăţire prin eliminare de aproximativ două ore, necesitând dozare la fiecare 6-8 ore. Din cauza unui debut mai lung de acţiune (latenţă de aproximativ 15 minute), ipratropiu nu este de obicei recomandat ca medicaţie de salvare, mai ales la pacienţii care au dezvoltat tahifilaxie la agoniştii β2-adrenergici(3).
Pacienţii care folosesc anticolinergice în tratamentul cronic al BPOC trebuie să aibă la dispoziţie medicamente cu salbutamol, ca medicaţie de salvare, pentru atenuarea simptomelor.
Anticolinergicele administrate inhalator sunt bine tolerate. Cel mai frecvent efect advers este gura uscată. Ocazional, a fost raportat gustul metalic, cel mai frecvent pentru ipratropiu. Alte efecte adverse anticolinergice includ constipaţie, tahicardie, vedere înceţoşată şi precipitarea simptomelor glaucomului cu unghi îngust. Poate apărea eetenţia urinară, în special la pacienţii cu obstrucţie concomitentă a vezicii urinare(3).


Corticosteroizii
Corticosteroizii inhalatori îmbunătăţesc simptomele, funcţia pulmonară, calitatea vieţii şi scad frecvenţa exacerbărilor la pacienţii cu VEMS mai mic de 60% din valoarea prezisă(2). Monoterapia cu ICS este mai puţin eficace decât terapia combinată ICS + LAMA şi de aceea nu este recomandată.
Cele mai frecvente efecte adverse ale ICS includ candidoză orofaringiană şi voce răguşită. Acestea pot fi minimizate prin clătirea gurii după utilizare şi prin utilizarea unui dispozitiv de tip spacer cu inhalatoare de tip MDI. Mai pot apărea vânătăi, scăderea densităţii osoase şi incidenţă crescută a pneumoniei. Folosirea sistemică creşte riscul apariţiei reacţiilor adverse(3).
Combinaţiile medicamentoase
Deoarece pacienţii insuficient controlaţi cu monoterapie sau biterapie obţin de multe ori rezultate mai bune când li se mai adaugă un medicament, au fost dezvoltate forme farmaceutice inhalatorii care conţin asocieri de două, respectiv trei substanţe active. Acest lucru duce la o mai bună aderenţă la medicaţie, prin simplificarea regimului medicamentos.
Bronhodilatatoare musculotrope
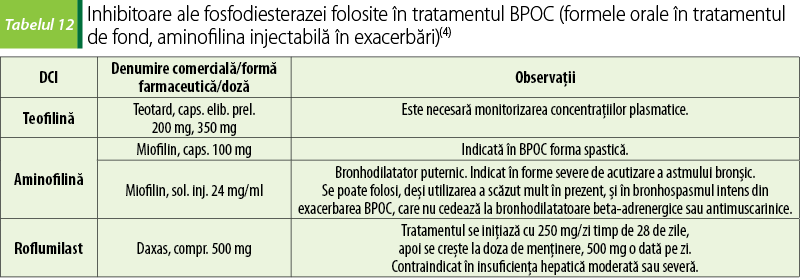
Metilxantinele teofilină şi aminofilină sunt bronhodilatatoare musculotrope cu mecanism complex de acţiune. Inhibă relativ neselectiv fosfodiesteraza, enzimă care catalizează degradarea AMPc, crescând consecutiv concentraţia de AMPc (mecanism favorizat de dozele mari)(6). Sunt şi antagonişti ai adenozinei, mediatorul sistemului purinergic, la nivelul receptorilor P1-A1, conducând la creşterea concentraţiei de AMPc (la doze mai mici)(6).
Teofilina este unul dintre cele mai vechi bronhodilatatoare, fiind folosită în tratamentul bolilor obstructive expiratorii de mai mult de 80 de ani. În prezent, teofilina este considerată a treia linie de bronhodilatatoare de folosit în BPOC, după antimuscarinice şi beta-adrenomimetice inhalatorii, mai ales din cauza reacţiilor adverse numeroase şi necesităţii monitorizării farmacoterapiei prin dozarea concentraţiilor plasmatice. Însă date recente care susţin efectul antiinflamator al teofilinei în formele severe de BPOC şi faptul că poate chiar reversa rezistenţa la corticosteroizi readuc în interes teofilina. Mecanismul propus pentru acest efect este recrutarea de către teofilină a histon-deacetilazelor, cu modificarea transcripţiei unor gene implicate în inflamaţie. Acest efect apare la concentraţii plasmatice mici de teofilină (optim 5 mg/L) şi este independent de inhibarea fosfodiesterazelor şi de antagonismul purinergic(7).
Titrarea teofilinei se face prin monitorizarea concentraţiilor plasmatice ale acesteia, concentraţia-ţintă aflându-se în intervalul 5-15 mcg/mL. Determinările se fac la 1-2 săptămâni după iniţierea tratamentului sau după orice ajustare a dozei, dozându-se nivelul dinaintea administrării (trough levels). Nu este necesară dozarea de rutină a concentraţiilor plasmatice dacă nu apar semne de toxicitate sau dacă nu se suspectează ineficacitatea terapeutică(3).
Aminofilina este derivatul hidrosolubil al teofilinei, cu absorbţie orală mai bună şi care permite obţinerea unor forme farmaceutice destinate administrării intravenoase, pentru situaţii de urgenţă(6).
În administrare orală, aminofilina este contraindicată în: infarct miocardic acut, tahicardie acută, hipersensibilitate la derivaţi xantinici şi administrare concomitentă cu alţi derivaţi xantinici, inclusiv ceai sau cafea, porfirie acută; nu se foloseşte la copii cu vârsta sub 6 ani(4). Suplimentar, administrarea intravenoasă a aminofilinei este contraindicată în hemoragii cerebrale, nefrită acută şi epilepsie; ulcerul gastroduodenal reprezintă o contraindicaţie relativă. Fiolele de Miofilin® nu se folosesc intramuscular, deoarece medicamentul este iritant tisular.
Roflumilastul este un inhibitor selectiv de fosfodiesterază 4, enzimă localizată în celulele structurale şi inflamatoare importante pentru patogeneza BPOC. Roflumilastul este folosit în tratamentul de întreţinere al formelor severe de BPOC (VEMS postbronhodilatator mai mic de 50% din valoarea estimată) însoţite de bronşită cronică la adulţi cu exacerbări frecvente în antecedente, ca terapie adăugată la tratamentul bronhodilatator(4).
Alte medicamente sau intervenţii terapeutice în BPOC
Azitromicina administrată în tratament cronic profilactic, 250 mg zilnic, pe durată lungă (până la un an) îşi manifestă efectul antiinflamator, conducând la scăderea ratei exacerbărilor la anumiţi pacienţi(8). Afectarea auzului, prelungirea intervalului QT cu risc de morbiditate cardiovasculară şi potenţialul de a genera rezistenţă bacteriană limitează folosirea curentă a azitromicinei(3).
Mucoliticele reduc vâscozitatea sputei şi îmbunătăţesc evacuarea secreţiilor. N-acetilcisteina administrată oral are efecte antioxidante şi proprietăţi mucokinetice. Diminuează tusea şi disconfortul toracic, dar favorizează bronhospasmul şi nu ameliorează dispneea sau funcţia pulmonară. Când se foloseşte inhalator, N-acetilcisteinei trebuie să i se asocieze un SABA, pentru a contracara bronhospasmul(3).
Antitusivele nu sunt de folosit în BPOC, deoarece scad eliminarea sputei(3).
Opioidele pot fi folosite pentru a gestiona dispneea, mai ales la pacienţii în stadiu terminal(3).
Cercetări recente arată că beta-blocantele nu doar că nu agravează statusul respirator în BPOC, dar pot fi chiar utile în prevenirea exacerbărilor şi scăderea mortalităţii, probabil prin efectele lor la nivel cardiovascular şi prin up-reglarea pe care o produc la nivelul receptorilor beta-adrenergici, crescând astfel eficacitatea β2-adrenomimeticelor administrate inhalator(9).
Pacienţii cu deficit de α1-antitripsină şi cu obstrucţie respiratorie moderată pot beneficia de terapie de augmentare cu α1-antitripsină, prin transfuzii săptămânale de α1-antitripsină colectată de la donatori umani(3).
Pacienţii spitalizaţi pentru exacerbări ale BPOC trebuie să primească terapie profilactică antitrombotică, dat fiind riscul mare de tromboembolism(3).
Toate celelalte comorbidităţi prezente la un pacient cu BPOC trebuie atent gestionate.
Mesajul-cheie care trebuie transmis pacienţilor care suferă de BPOC este că aceasta este o boală tratabilă. De maximă importanţă este renunţarea la fumat. Gestionarea adecvată a BPOC, atât cu mijloace farmacologice cât şi nefarmacologice, permite un bun control al simptomelor şi menţinerea calităţii vieţii.
Bibliografie
- WHO. The top 10 causes of death. [accesat 2019 Nov 8]. https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death
- Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. 2020 [accesat 2019 Nov 8]. www.goldcopd.org
- Whetsel TR, Wietholter JP. Chronic Obstructive Pulmonary Disease. In: Chisholm-Burns M, Schwinghammer T, Wells B, Malone P, DiPiro J. Pharmacotherapy Principles and Practice. McGraw-Hill; 2016. p. 261–73.
- Marineci CD, Chiriţă C. Agenda medicală. Ediţia de buzunar. Bucureşti: Editura Medicală; 2019.
- ANMDMR. Nicoferin compr. 1,5 mg. Rezumatul Caracteristicilor Produsului. Ultima actualizare ianuarie 2018.
- Cristea A. Medicaţia aparatului respirator. Antiastmatice. In: Tratat de Farmacologie Ediţia I. Bucureşti: Editura Medicală; 2005. p. 321–54.
- Barnes PJ. Theophylline for COPD. Thorax. 2006 Sep;61(9):742–4.
- Albert RK, Connett J, Bailey WC, Casaburi R, Cooper JAD, Criner GJ, et al. Azithromycin for Prevention of Exacerbations of COPD. N Engl J Med. 2011 Aug 25;365(8):689–98.
- Short PM, Lipworth SIW, Elder DHJ, Schembri S, Lipworth BJ. Effect of blockers in treatment of chronic obstructive pulmonary disease: a retrospective cohort study. BMJ. 2011 May 10;342:d2549–d2549.
Articole din ediţiile anterioare
Conceptul de harm reduction ca stil de viaţă
Reducerea daunelor este o strategie de sănătate publică bazată pe conceptul că, deşi o persoană nu poate opri un comportament cu risc ridicat, exis...