Preeclampsia is a multi-systemic disease which affects 4-5% of pregnancies, being one of the main causes often leading to death for both the mother and the baby, the death rate going up to 50,000-60,000 cases on an annual basis, which occurs in countries where the income is low or average. Although preeclampsia is considered one of the medical disorders that are still uncertain, recent research raises the question of the endothelial dysfunction, thus the imbalance between pro-angiogenic and anti-angiogenic factors is taken into consideration both as a means to diagnose and prognosticate it. Furthermore, the biomarkers play a key role regarding the disease, being subject to accurate interpretation. Measurements of the IP of the uterine blood vessels through Doppler interpretation during the second term of the pregnancy might bring further evidence in support of identifying preeclampsia features, which emphasize the role of the biomarkers in predicting the development of the disease.
Asocierea biomarkerilor serici cu valorile Doppler ale arterelor uterine în predicţia preeclampsiei
Serum biomarkers combined with uterine artery Doppler in prediction of preeclampsia
First published: 22 mai 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.16.2.2017.760
Abstract
Rezumat
Preeclampsia este o boală multisistemică ce afectează 4-5% dintre sarcini. Este una dintre principalele cauze ale morbidităţii şi mortalităţii materne şi perinatale, la nivel global înregistrându-se 50000-60000 de decese anual, cu o predominanţă în ţările cu venituri mici şi medii. Preeclampsia rămâne una dintre patologiile cu etiologie incertă, în ultima perioadă acceptându-se ipoteza disfuncţiei endoteliale, astfel dezechilibrul dintre factorii angiogenici vs. anti-angiogenici fiind luaţi în calcul atât din punct de vedere diagnostic, cât şi prognostic. În plus, biomarkerii sunt reproductibili, legaţi de boală şi, mai presus de toate, sunt uşor de interpretat. Măsurarea indicelui de pulsatilitate al arterelor uterine cu examinare Doppler în al doilea trimestru poate aduce informaţii suplimentare pentru predicţia preeclampsiei, astfel crescând specificitatea şi sensibilitatea valorilor biomarkerilor în predicţia acesteia.
Definiţie - patogenză
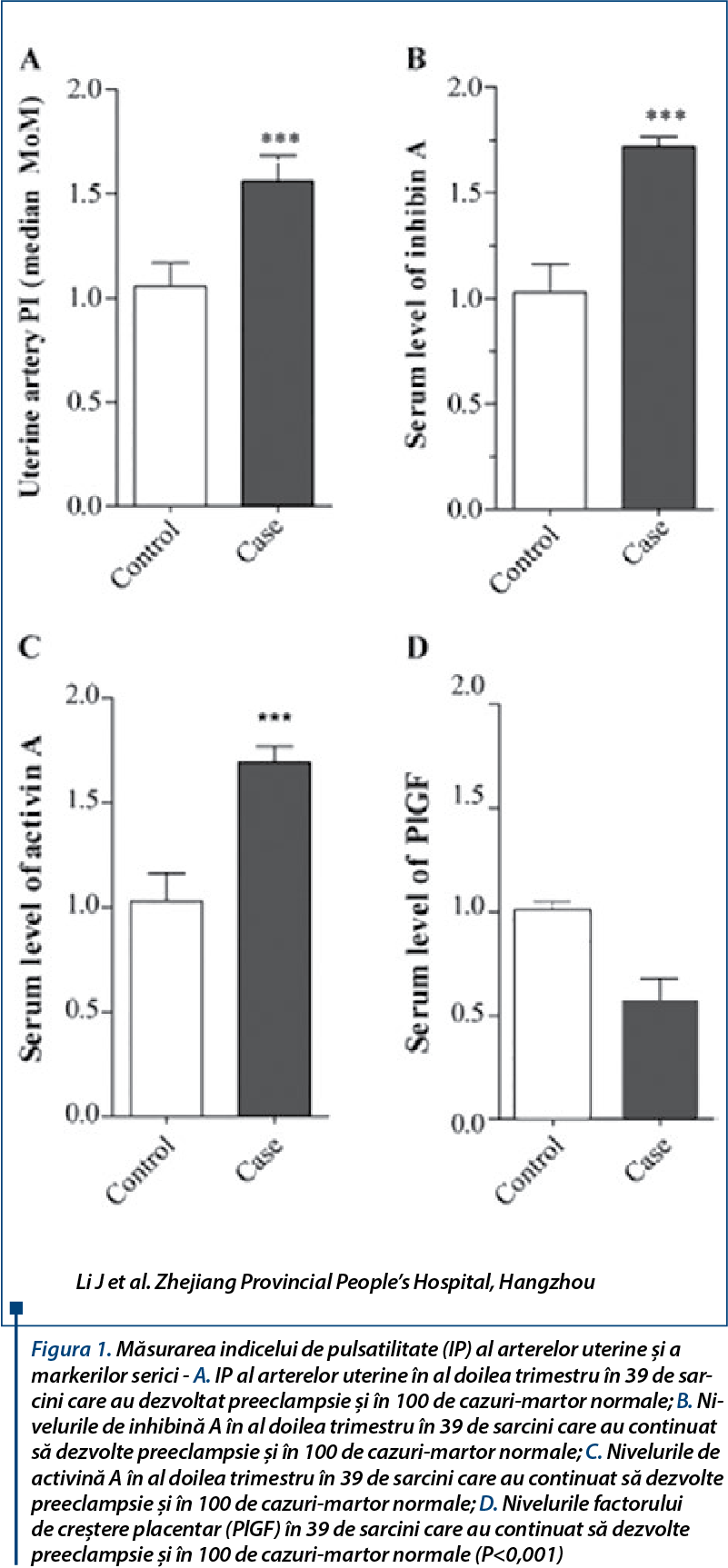
Preeclampsia (CPE) este una dintre principalele cauze ale mortalităţii materne, provocând aproximativ 50000-60000 de decese anual la nivel mondial(1). Aceasta este caracterizată prin apariţia hipertensiunii cu presiune arterială sistolică ≥140 mmHg sau presiune arterială diastolică ≥90 mmHg, măsurată de două ori, la un interval de cel puţin patru ore, şi proteinurie >0,3 g la 24 de ore sau ≥1+ proteinurie, detectată de bandeleta urinară după 20 de săptămâni de sarcină sau, în absenţa proteinuriei, apariţia hipertensiunii cu un nou debut al oricăreia dintre următoarele: trombocitopenie (număr de trombocite <100.000/µl), insuficienţă renală (concentraţie creatinină serică >1,1 mg/dl sau o dublare a concentraţiei creatininei serice în absenţa altor boli renale), insuficienţă hepatică (concentraţii crescute ale transaminazelor hepatice, duble faţă de concentraţiile normale), edem pulmonar sau probleme cerebrale ori de vedere(1). Etiologia preeclampsiei este incertă, în ultima perioadă fiind acceptată ipoteza vasculară, astfel preeclampsia rezultând din remodelarea defectuoasă a arterei spiralate, ceea ce duce la ischemie celulară în placentă, care, la rândul său, conduce la un dezechilibru între factorii antiangiogenici şi cei proangiogenici. În funcţie de momentul recunoaşterii şi de debutul bolii, se clasifică în PE cu debut tardiv (după 34 de săptămâni) şi PE precoce (semnele clinice apar înainte de săptămâna a 33-a de gestaţie)(2). Principala caracteristică patologică a PE cu debut precoce este transformarea incompletă a arterelor spiralate, rezultând hipoperfuzia placentei şi reducerea aportului de nutrienţi la făt, fiind una dintre principalele cauze de nou-născuţi mici pentru vârsta gestaţională(3), în timp ce în PE cu debut tardiv nu există nicio modificare superficială a arterelor spiralate, ceea ce duce în unele cazuri la hiperperfuzie placentară(4-5). În ciuda deceniilor de cercetare, patogeneza şi fiziopatologia PE sunt încă foarte puţin sau incomplet înţelese(4). Procesul patogen al PE începe în timpul primului trimestru de sarcină, cu mult înainte ca semnele clinice să fie evidente. Prin urmare, este dificilă identificarea timpurie a biomarkerilor.
Factorii proangiogenici şi antiangiogenici în preeclampsie
Factori proangiogenici - FCEV, FCT şi TGF-β
Factorul de creştere a endoteliului vascular (FCEV) şi factorul de creştere a trombocitelor (FCT) secretate de celulele trofoblaste joacă un rol principal în angiogeneza placentară. FCEV este considerat a fi esenţial pentru integritatea celulelor endoteliale materne(6). Un studiu longitudinal (Taylor şi colab.) a demonstrat că valorile concentraţiilor serice de FCT au crescut de la 15-19 pg/ml până la săptămâna 21-25 de gestaţie şi au atins valoarea maximă în săptămânile 27-30 în sarcinile fără complicaţii, la femeile cu nou-născuţi mici pentru vârsta gestaţională (SGA)(20) şi PE cu nou-născuţi cu greutate normală, iar ulterior nivelurile au scăzut înspre săptămânile 35-36(7). Cu toate acestea, în PE complicată de SGA, valoarea maximă a survenit în săptămânile 21-25 de gestaţie, dar în orice moment nivelurile au fost mai mici decât la femeile doar cu PE(7).
Factori antiangiogenici - sFlt-1 şi sEng
Factorii antiangiogenici sunt receptori FCEV (FCEV1 şi FCEV2), iar FCEV1 Eng este, de asemenea, cunoscut ca kinaza-1 tirozină (Flt-1), care este legată de membrană, în timp ce FCEV2 este cunoscut sub numele de receptor inserţie kinază (RIK)(8,9). Venkatesha şi colab. au constatat că expresia mRNA Eng a fost semnificativ amplificată în ţesutul placentar (obţinut la naştere), în special în sincitiotrofoblaste în PE în săptămânile a 25-a şi a 40-a de gestaţie, comparativ cu sarcinile de control al vârstei potrivite(10).
Dezechilibrul în starea angiogenică şi antiangiogenică în PE
Există tot mai multe dovezi care sugerează un dezechilibru între factorii proangiogenici şi cei antiangiogenici care sunt responsabili pentru efectele patofiziologice observate în PE(11,12), iar acestea apar înainte ca semnele clinice să fie vizibile(13). Cu toate acestea, nu se ştie exact de ce unele femei dezvoltă PE, în timp ce altele, cu caracteristici similare, cum ar fi ischemia placentară şi disfuncţia endotelială, au dat naştere doar la nou-născuţi SGA fără semnele clinice clasice ale afecţiunii(14).
Un studiu longitudinal (Romero şi colab.) a arătat că pacientele cu nou-născuţi SGA au avut concentraţii plasmatice sEng semnificativ mai mari pe tot parcursul sarcinii, dar la cele care au dezvoltat PE atât cu debut precoce, cât şi cu debut tardiv, nivelurile au fost semnificativ mai mari în săptămânile a 23-a şi, respectiv, a 30-a de gestaţie, comparativ cu sarcinile normale(14). În cazul nivelurilor plasmei sFlt-1, PE cu debut precoce şi cea cu debut tardiv au fost mai ridicate în săptămânile a 26-a şi, respectiv, a 29-a de gestaţie, comparativ cu sarcinile normale(14). Cu toate acestea, atât cele cu debut precoce sau tardiv, cât şi cele cu nou-născuţi SGA au avut niveluri mai mici de FCT pe tot parcursul sarcinii, comparativ cu probele-martor(14). Alte studii arată rezultate similare(15,16). În plus, s-a raportat că nivelurile plasmei sFlt-1 erau crescute la pacientele cu preeclampsie comparativ cu sarcini normale la 6-10 săptămâni şi mai mare la 2-5 săptămâni înainte de dezvoltarea unui diagnostic clinic. Se consideră că nivelurile excesive de factori antiangiogenici, precum sEng şi sFlt-1, şi factori proangiogenici, cum ar fi FCEV, FCT şi TGFb, provoacă disfuncţii endoteliale materne generalizate, ceea ce duce la hipertensiune, endotelioză renală şi coagularea sângelui.
Alţi biomarkeri utilizaţi
Inhibina A a fost raportată ca un marker precoce în predicţia preeclampsiei. Roes şi colab. au prelevat probe de sânge în sarcină la 7-13 săptămâni de la 90 de femei gravide, 30 care au dezvoltat ulterior preeclampsie şi 60 de martori, şi a constatat că nivelul inhibinei A era de 5 ori mai mare la femeile cu preeclampsie(17). Un alt studiu (Roes şi colab.)(17) a raportat o sensibilitate a inhibinei A în predicţia preeclampsiei de 32% la o specificitate de 90%, ajungând la concluzia că sensibilitatea inhibinei A era prea mică pentru a fi utilă ca marker pentru a prezice preeclampsia, dar, coroborată cu alţi markeri, ar putea juca un rol important.
Activina A a fost, de asemenea, propusă ca marker pentru a prezice preeclampsia. Nivelul a fost ridicat la 10-14 săptămâni de gestaţie la femeile cu preeclampsie stabilită(18). Într-un studiu caz-martor, sensibilitatea a fost de 82%, la o specificitate de 91%(18).
Examinarea doppler a arterlor uterine
Recent, examinarea Doppler s-a dovedit promiţătoare. Campbell este cel care a introdus prima dată ecografia Doppler color pentru a investiga circulaţia uteroplacentară. Indicele de pulsatilitate (IP) al arterelor uterine a fost folosit ca marker al preeclampsiei şi SGA, în prezenţa cărora IP creşte ca urmare a elevaţiei impedanţei arterelor uterine.
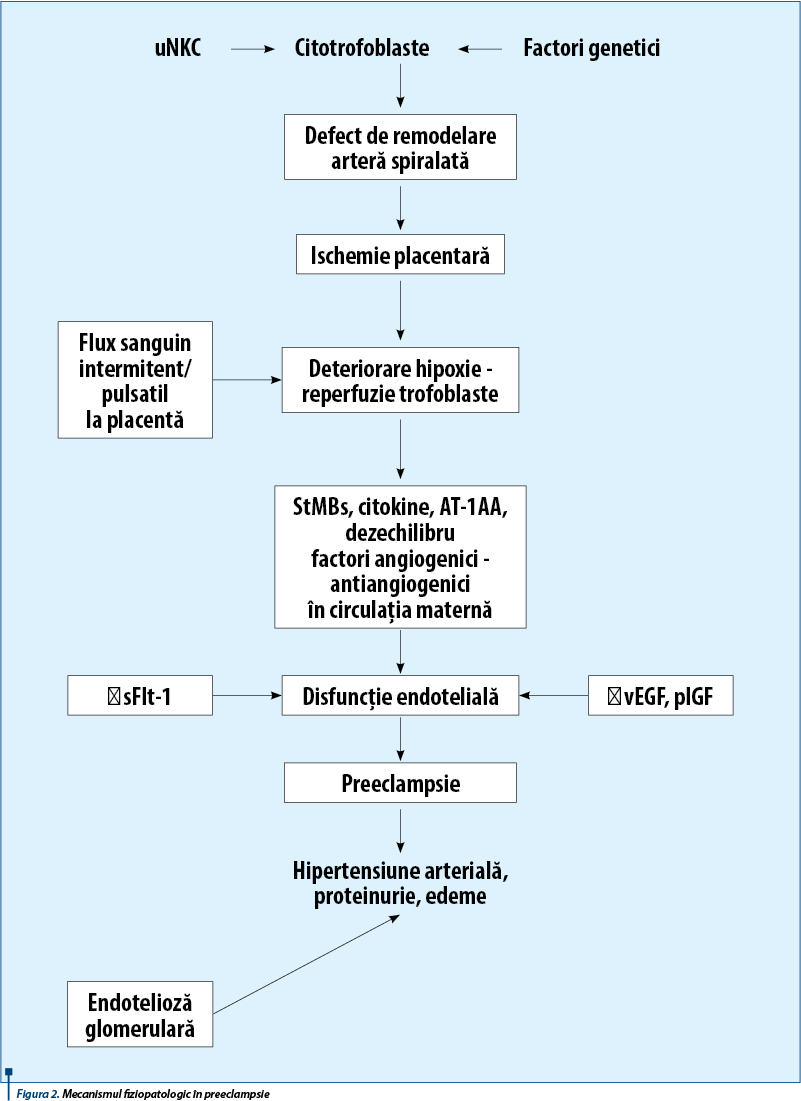
Într-un studiu realizat de Lijie Li şi colab.(19), analizând măsurarea inhibinei A, a activinei A şi a factorului de creştere placentar (PlGF) în limfa maternă, în gestaţia de trei până la patru luni cu indicele de pulsatilitate al arterelor uterine în al doilea trimestru, pe 800 de gravide, 38 de femei au dezvoltat preeclampsie, oferind o incidenţă de 5,2%. La sarcinile care au dezvoltat preeclampsie, IP al arterelor uterine a fost crescut (1,61 ± 0,047 vs. 1,02 ± 0,049, P<0,001; figura 1A), la fel ca nivelul de inhibină A (1,72 ± 0,023 vs. 1,03 ± 0,063, P <0,001; figura 1B) şi nivelul de activină A, în comparaţie cu martorii (1,68 ± 0,38 vs. 1,06 ± 0,42, P<0,001; figura 1C). În schimb, nivelul de PlGF a fost scăzut la femeile gravide care au dezvoltat preeclampsie, comparativ cu martorii (0,69 ± 0,23 vs. 1,00 ± 0,26, P<0,001; figura 1D).
Concluzii
Etiologia exactă a PE rămâne neelucidată, dar o mare parte din fiziopatologie a fost explicată. Teoria actuală este una de dezechilibru între factorii angiogenici şi cei antiangiogenici. Măsurarea proteinelor angiogenice şi antiangiogenice ca biomarkeri ar putea indica, eventual, disfuncţia placentară şi diferenţierea PE de alte tulburări, cum ar fi hipertensiunea gestaţională şi glomerulonefrita cronică. În plus, biomarkerii sunt reproductibili, legaţi de boală şi, mai presus de toate, sunt uşor de interpretat. Măsurarea IP al arterelor uterine cu examinare Doppler în al doilea trimestru poate oferi informaţii suplimentare pentru predicţia preeclampsiei. Coroborarea markerilor serici cu IP al arterelor uterine prin examinare Doppler are cea mai mare valoare de predicţie pentru preeclampsie.
Bibliografie
2. Staff AC, Benton SJ, von Dadelszen P, et al. Redefining preeclampsia using placenta-derived biomarkers.Hypertension, 2013;61(5):932–42.
3. Romero R, Chaiworapongsa T. Preeclampsia: a link between tropho-blast dysregulation and an anti-angiogenic state. J Clin Invest, 2013;123(7):2775–7.
4. Sohlberg S, Mulic-Lutvica A, Lindgren P, Ortiz-Nieto F, Wikstrom AK, Wikstrom J. Placental perfusion in normal pregnancy and early and late preeclampsia: a magnetic resonance imaging study. Placenta, 2014;35(3):202–6.
5. Zhong Y, Tuuli M, Odibo AO. First-trimester assessment of placenta function and the prediction of preeclampsia and intrauterine growth restriction. Prenatal Diagn, 2010;30(4):293–308.
6. Alon T, Hemo I, Itin A, Pe’er J, Stone J, Keshet E. Vascular endothelial growth factor acts as a survival factor for newly formed retinal vessels and has implications for retinopathy of prematurity. Nature Med, 1995;1(10):1024–8.
7. Taylor RN, Grimwood J, Taylor RS, McMaster MT, Fisher SJ, North RA. Longitudinal serum concentrations of placental growth factor: evidence for abnormal placental angiogenesis in pathologic pregnancies. Am J Obstet Gynecol 2003;188(1):177–82.
8. Bdolah Y, Karumanchi SA, Sachs BP. Recent advances in understanding of preeclampsia. Croatian Med J, 2005;46(5):728–36.
9. Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J, 1999; 13(1):9–22.
10. Venkatesha S, Toporsian M, Lam C, et al. Soluble endoglin contributes to the pathogenesis of preeclampsia. Nature Med, 2006;12(6):642–9.
11. Bdolah Y, Sukhatme VP, Karumanchi SA. Angiogenic imbalance in the pathophysiology of preeclampsia: newer insights. Seminars Nephrol 2004;24(6):548–56.
12. Maynard SE, Karumanchi SA. Angiogenic factors and preeclampsia. Seminars Nephrol 2011; 31(1):33–46.
13. Cîrstoiu M, Gunescu DC, Bodean OM, Munteanu O, Vlădăreanu S. Rolul determinării factorilor angiogenici placentari în evaluarea periodică a riscului de preeclampsie. Ginecologia.ro, 2015; 3(8):18-20.
14. Romero R, Nien JK, Espinoza J, et al. A longitudinal study of angio-genic (placental growth factor) and anti-angiogenic (soluble endoglin and soluble vascular endothelial growth factor receptor-1) factors in normal pregnancy and patients destined to develop preeclampsia and deliver a small for gestational age neonate. J Matern Fetal Neonatal Med 2008; 21(1):9–23.
15. Erez O, Romero R, Espinoza J, et al. The change in concentrations of angiogenic and anti-angiogenic factors in maternal plasma between the first and second trimesters in risk assessment for the subsequent development of preeclampsia and small-for-gestational age. J Matern Fetal Neonatal Med, 2008;21(5):279–87.
16. Vatten LJ, Asvold BO, Eskild A. Angiogenic factors in maternal circulation and preeclampsia with or without fetal growth restriction. Acta Obstet Gynecol Scandin 2012; 91(12):1388–94.
17. Roes EM, Gaytant MA, Thomas CM, Raijmakers MT, Zusterzeel PL, Peters WH and Steegers EA. First trimester inhibin-A concentrations and later development of preeclampsia. Acta Obstet Gynecol Scand, 2004;83:117.
18. Ong CY, Liao AW, Munim S, Spencer K, Nicolaides KH: First-trimester maternal serum activin A in pre-eclampsia and fetal growth restriction. J Matern Fetal Neonatal Med, 2004;15:176-180.
19. Li L, Zheng Y, Zhu Y, Li J. Serum biomarkers combined with uterine artery Doppler in prediction of preeclampsia. Exp Ther Med, 2016;12(4): 2515–20.
20. Bohîlţea RE, Cîrstoiu M, Berceanu C, Brătilă E, Turcan N, Mehedinţu C, Vlădăreanu S. Restricţia de creştere intrauterină - o nouă abordare. Ginecologia.ro, 2017;5(15):28-33.
Articole din ediţiile anterioare
Modificări în incidenţa hipertensiunii induse de sarcină în 2007 versus 2017 în Spitalul Clinic de Obstetrică şi Ginecologie „Prof. Dr. Panait Sîrbu” Bucureşti
Hipertensiunea indusă de sarcină este o patologie frecvent întâlnită, cu efecte importante în morbiditatea şi mortalitatea materno-fetală. Studiu...
Corelaţii anatomoclinice şi ecografice în hipertensiunea arterială indusă de sarcină
Hipertensiunea arterială indusă de sarcină este diagnosticată prin creşterea tensiunii arteriale sistolice peste 140 mmHg şi a celei diastolice...
Diabetul şi hipertensiunea arterială gestaţională - impactul asupra nou-născuţilor
Diabetul gestaţional este o complicaţie frecventă în ultimii ani, asociată cu greutate excesivă sau obezitate. Pe de altă parte, hipertensiunea ge...
Particularităţi ale evoluţiei materno-fetale la pacientele cu diabet gestaţional
Studiul elaborat a avut ca obiectiv identificarea complicaţiilor, a factorilor de risc şi a altor particularităţi asociate diabetului gestaţional.