Congenital infections are a well-known cause of intrauterine fetal death and also of peri- and postnatal morbidity. Also, the malformative potential is well documented. Trans-placental infection of viruses, even in a subclinical phase of the maternal infection, can determine sever congenital syndroms. Even non-specific echographic anomalies may indicate a congenital infection. However, some echographic anomalies are specific for congenital syndromes. This is why establishig a fast and correct diagnosis of congenital infection is a dezideratum of the modern obstetrician. Ultrasound assessment is a key element in establishing the diagnosis and in follow-up of patients with congenital infections.
Evaluarea ecografică - element-cheie în stabilirea diagnosticului de infecţie congenitală
Ultrasound assessment - a key element in establishing the diagnosis of congenital infection
First published: 15 martie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Infecţiile congenitale sunt o cauză bine cunoscută de moarte fetală intrauterină, precum şi de morbiditate perişi postnatală. De asemenea, este bine documentat potenţialul malformativ al infecţiilor congenitale materne asupra produsului de concepţie. Transmiterea transplacentară a infecţiilor virale, chiar şi în faza subclinică a infecţiei materne, poate duce la sindroame congenitale severe. Anomaliile ecografice, chiar nespecifice, pot indica infecţii congenitale. Totuşi, anumite anomalii ecografice pot fi patognomonice pentru un anumit sindrom congenital. Din aceste considerente, stabilirea rapidă şi corectă a diagnosticului reprezintă deziderate ale obstetricianului modern. Evaluarea ecografică joacă un rol esenţial în detectarea şi urmărirea infecţiilor intrauterine.
Introducere
Complexul TORCHES CLAP cuprinde infecţiile cu Toxoplasma gondii, Treponema Pallidum, virusul rubeolic, cu citomegalovirus (CMV), cu herpes simplex (HSV), virusul hepatitic, cu virusul imunodeficienţei umane (HIV), cu virusul varicelo-zosterian (VZV), precum şi cu parvovirusul B19(1). Infecţiile perinatale reprezintă 2-3% din toate anomaliile congenitale. Infecţiile TORCH sunt unele dintre cele mai frecvente infecţii asociate cu anomalii congenitale. Majoritatea cauzează morbiditate maternă moderată, dar la nivelul fătului consecinţele sunt severe. Recunoaşterea patologiei materne şi monitorizarea fetală odată ce boala este diagnosticată sunt importante pentru toţi clinicienii. Conştientizarea caracterelor clinice predominante ale complexului TORCH, precum şi ale altor infecţii intrauterine/perinatale este crucială pentru stabilirea precoce a diagnosticului şi iniţierea tratamentului adecvat(2).
Primoinfecţia are frecvent efecte mai severe asupra fătului decât infecţia recurentă şi poate cauza avorturi spontane, moarte fetală in utero, anomalii congenitale, retard psihic, naştere prematură şi nou-născuţi cu semne evidente de boală(3).
Protecţia fătului în raport cu infecţiile mamei se realizează prin 3 mecanisme: imunitatea mamei, bariera fetoplacentară şi imunitatea fătului(7).
Prevalenţa la nivel mondial este diferită, astfel: 201.000 de persoane sunt infectate cu Toxoplasma, 36,4 milioane cu Treponema pallidum, 2,4 milioane cu virusul hepatitic B, 130-150 milioane cu virusul hepatitic C şi 35,3 milioane cu HIV(1).
Prasoona şi colab. au demonstrat că pot exista anumiţi factori de risc în infecţiile congenitale. Astfel, vârsta maternă mai mică de 25 de ani, primiparitatea şi consangvinitatea contribuie la creşterea agresivităţii majorităţii infecţiilor congenitale şi asociază malformaţii complexe(4).
Infecţia cu CMV
Cea mai frecventă cauză infecţioasă de dizabilitate în ţările dezvoltate şi probabil la nivel mondial o reprezintă infecţia cu citomegalovirus, afectând 0,2-2,2% din naşteri(5). Riscul de primoinfecţie în timpul sarcinii este de 2%, cu o proporţie de 30-42% în primul trimestru şi de 38-42% în cel de-al doilea trimestru(6). Transmiterea materno-fetală a CMV poate fi prenatală - CMV este teratogen, determinând malformaţii congenitale severe (microcefalie, retard psihomotor, chorioretinită şi malformaţii oasoase), perinatală - determină boala cu incluzii citomegalice a nou-născutului (hepatosplenomegalie, icter, anemie hemolitică) sau postnatală - asimptomatică. Diagnosticul pozitiv se realizează prin cultură shell vial cu evidenţiere Ag virale timpurii prin imunofluorescenţă(7).
Ultrasonografic pot fi evidenţiate anomalii la nivel cerebral, abdominal şi cardiac. La nivel cerebral se evidenţiază ventriculomegalie moderată spre severă - hiperecogenitate periventriculară anormală şi adeziuni intraventriculare, focare intraparenchimatoase hiperecogene periventriculare, corticale sau la nivelul ganglionilor bazali, reprezentând calcificări la acest nivel (figura 1)(8). Feţii prezintă frecvent microcefalie (figura 1), displazie corticală, anomalii cerebeloase (hipoplazie vermiană) şi semne de vasculopatie lenticulostriată. Deşi anomaliile intraabdominale (ex.: hepatosplenomegalie) şi cardiace (cardiomiopatie) sunt frecvent asociate, nu sunt specifice. Ecografic se mai evidenţiază restricţie de creştere intrauterină şi hidrops non-imun. De asemenea, sunt citate câteva cazuri de nou-născuţi cu infecţie congenitală cu CMV la care nu au fost decelate anomalii ecografice(8).
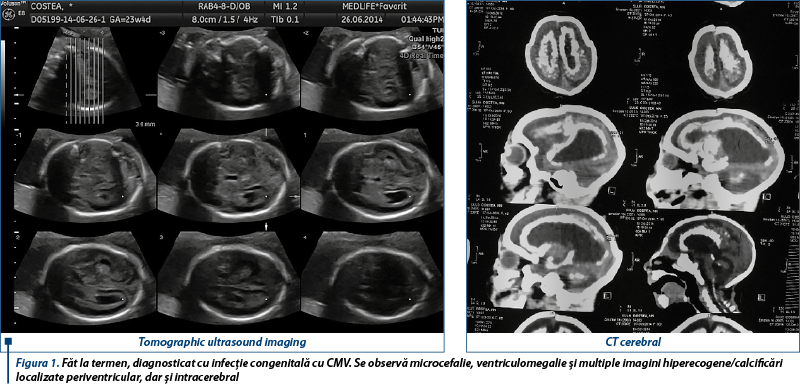
Infecţia cu Parvovirus B19
Incidenţa infecţiei cu parvovirusul B19 în sarcină este de 1-2%. Aproximativ 35-55% dintre gravide nu sunt imune la parvovirus. Transmiterea verticală este de aproximativ 35%.
Infecţia fetală are loc prin transmitere transplacentară la 1-3 săptămâni după infecţia mamei, în timpul peak-ului de viremie maternă(9).
Diagnosticul de infecţie fetală se realizează prin PCR din lichid amniotic şi diagnosticul de infecţie acută maternă se realizează serologic (dozarea IgM specifice)(10). După confirmarea infecţiei acute sunt necesare monitorizarea ecografică a fătului şi luarea unei decizii obstetricale adecvate(7).
Ecografic se pot observa următoarele modificări: ascită - cea mai frecventă anomalie, insuficienţă cardiacă secundară anemiei fetale severe, progresia către hidrops în cazurile severe, placentomegalie şi hidramnios (figura 2)(11).
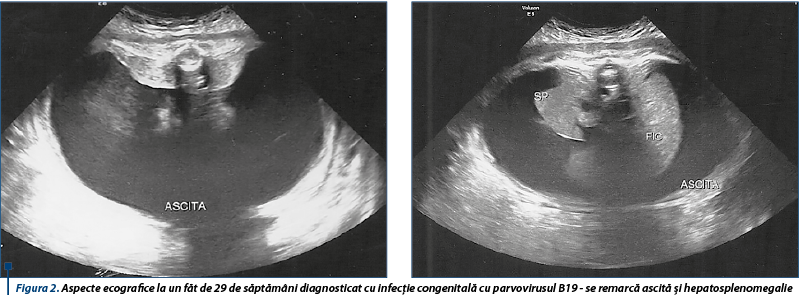
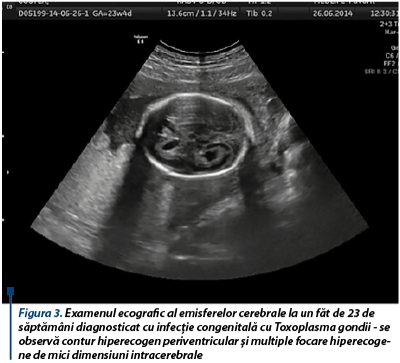
Infecţia cu Toxoplasma gondii
Infecţia cu Toxoplasma gondii se realizează prin trei căi: ingestia de carne inadecvat preparată, ingestia de oocişti din apă sau sol contaminat şi transplacentar. Prevalenţa infecţiilor congenitale variază între 0,01 şi 0,1/1000 de naşteri şi este în scădere, prin instituirea unor măsuri adecvate de screening(12). Diagnosticul de toxoplasmoză congenitală se stabileşte imagistic - ecografic şi genetic - prin PCR din lichidul amniotic.
Ecografic se evidenţiază imagini hiperecogene (calcificări) intrahepatice şi intracerebrale - cele din urmă pot fi localizate periventricular, dar şi în restul emisferelor cerebrale, şi de obicei sunt de mici dimensiuni, astfel pot fi uşor de ratat (figura 3)(13). Tot ecografic se evidenţiază restricţie de creştere intrauterină, chisturi la nivelul fosei posterioare, ventriculomegalie şi hiperecogenitate intestinală(13).
Infecţia cu virusul varicelo-zosterian
Varicela congenitală reprezintă o complicaţie rară a primoinfecţiei materne cu virusul varicelo-zosterian, ce apare la 2% dintre nou-născuţii din femeile infectate între săptămânile 7 şi 28 de gestaţie. Manifestările clinice tipice includ leziuni cutanate cu dispoziţie metamerică, afectare neurologică, anomalii oculare, hipoplazie la nivelul membrelor şi greutate scăzută la naştere(14). Transmiterea maternofetală se realizează antenatal, perinatal sau postnatal. Antenatal, transmiterea este consecinţa viremiei materne, transmiţându-se transplacentar(15). Diagnosticul de varicelă congenitală se stabileşte prin PCR din ADN lichid amniotic(15).
Ecografic se decelează imagini hiperecogene (calcificări) intrahepatice şi intracerebrale, hidramnios din cauza afectării neurologice a înghiţitului, hipoplazie a membrelor şi contractură şi mişcare diafragmatică paradoxală din cauza paraliziei unilaterale. Se recomandă ecografie lunară pentru evaluarea anomaliilor tardive ale sindromului congenital(16).
Discuţii
Ecografia are un rol esenţial în detectarea şi urmărirea infecţiilor intrauterine. Transmiterea transplacentară a infecţiilor virale, chiar şi în faza subclinică a infecţiei materne, poate duce la sindroame congenitale severe(17). Detecţia prenatală a infecţiei virale se realizează prin decelarea anomaliilor ecografice şi a PCR din lichidul amniotic(17). Anomaliile ecografice, chiar nespecifice, pot indica infecţii congenitale. Acestea pot fi: restricţie de creştere intrauterină, hidrops, ventriculomegalie, calcificări intracerebrale, hidrocefalie, microcefalie, anomalii cardiace, hepatosplenomegalie, intestin hiperecogen, placentomegalie şi lichid amniotic cu volum inadecvat. Anumite anomalii ecografice pot fi patognomonice pentru un anumit sindrom congenital(17).
Infecţia cu Toxoplasma gondii
Între săptămânile 12 şi 24 de gestaţie, frecvent se poate pune diagnosticul de ventriculomegalie. Infecţiile congenitale asociate cu ventriculomegalie sunt cu Toxoplasma gondii, virusul rubeolic şi CMV. Gábor şi colab. afirmă că Toxoplasma este agentul care se asociază cel mai frecvent cu ventriculomegalia importantă(18). Gay‐Andrieu şi colab. au demonstrat că cel mai important semn ecografic în stabilirea diagnosticului de infecţie congenitală cu Toxoplasma gondii este hidrocefalia(19). De asemenea, acest grup de studiu afirmă că ecografia lunară este obligatorie, în pofida rezultatului amniocentezei care poate fi negativ(19). Şi Abboud şi colab. au demonstrat că cea mai frecventă anomalie detectată ecografic este hidrocefalia(20).
Virkola şi colab. au demonstrat că, ecografic, în infecţia congenitală cu Toxoplasma gondii se pot identifica imagini hiperecogene (calcificări) cerebrale, semnul lumânării (imagine hiperecogenă a arterelor striotalamice) şi ascită cu hepatosplenomegalie(21). Aceste semne asociate cu nivelurile anticorpilor specifici materni pot indica severitatea infecţiei(21).
Infecţia cu CMV
Definiţia de vasculopatie lenticulostriată se bazează pe leziuni vizibile ecografic - benzi sau puncte hiperecogene pe traiectul artrelor care vascularizează talamusul şi ganglionii bazali(22). Hong şi colab. au demonstrat că severitatea vasculopatiei lenticulostriate se asociază cu severitatea infecţiei cu CMV(23). De asemenea, rezultatele studiului realizat de aceştia confirmă importanţa examenului ecografic în diagnosticul infecţiei cu CMV - hiperecogenitate talamică sau la nivelul ganglionilor bazali, ventriculomegalie şi leziuni cerebrale distructive - chisturi cerebrale localizate în orice nivel lob al emisferelor cerebrale(23).
Benoist şi colab. au demonstrat că cea mai frecventă anomalie identificată în cadrul examinării ecografice este ventriculomegalia, urmată de calcificări periventriculare şi microcefalie(24).
Guerra şi colab. au demonstrat pe un lot de 154 de feţi diagnosticaţi cu infecţie congenitală cu CMV că examenul ecografic are o rată de predicţie pozitivă de 78,3%(25).
Benoist şi colab. au demonstrat că imaginile hiperecogene (calcificările) sunt cea mai tipică leziune cerebrală pentru infecţia congenitală cu CMV şi pot fi depistate cu uşurinţă ecografic(24).
Infecţia cu parvovirusul B19
Kyeong şi colab. au demonstrat că cele mai reprezentative caracteristici ale infecţiei cu parvovirusul B19 sunt hidropsul fetal şi decesul intrauterin, fiind tipice în săptămânile 17-28 de gestaţie(26).
Totuşi, Chauvet şi colab. au demonstrat că semnele cel mai frecvent depistate ecografic sunt ascita şi efuziunea pericardică. De asemenea, au mai fost frecvent evidenţiate edem subcutanat, placentomegalie, efuziune pleurală şi cardiomegalie(27). Au mai fost raportate cazuri cu oligoamnios sau hidramnios, dar cel mai frecvent lichidul amniotic era în cantitate normală(27).
Infecţia cu virusul varicelo-zosterian (VZV)
Moolla şi colab. au demonstrat că examinarea ecografică a gravidelor cu factori de risc pentru infecţia cu VZV trebuie să se îndrepte către calcificările miliare şi evaluarea placentei şi a cantităţii de lichid amniotic(28). Deoarece microcalcificările multiorgan sunt rare, existenţa acestora trebuie să se îndrepte întotdeauna către un diagnostic de infecţie cu VZV, chiar dacă nu sunt modificări tipice la nivelul membrelor(28).
Meyberg-Solomayer şi colab. au demonstrat că evaluarea ecografică are un rol esenţial în stabilirea infecţiei congenitale cu VZV(29). Astfel, leziunile scheletale, contracturile şi calcificările de ţesuturi moi sunt vizibile la 4-5 săptămâni după infecţia fetală, în timp ce anomaliile cerebrale sunt vizibile mult mai târziu(29).
Concluzii
Infecţiile congenitale sunt o cauză bine cunoscută de moarte fetală intrauterină, precum şi de morbiditate peri- şi postnatală. De asemenea, este bine documentat potenţialul malformativ al infecţiilor congenitale materne asupra produsului de concepţie.
Din aceste considerente, stabilirea rapidă şi corectă a diagnosticului reprezintă deziderate ale obstetricianului modern.
Evaluarea ecografică joacă un rol esenţial în stabilirea diagnosticului de infecţie congenitală.
Bibliografie
2. Stegmann BJ, Carey JC. TORCH Infections. Toxoplasmosis, Other (syphilis, varicella-zoster, parvovirus B19), Rubella, Cytomegalovirus (CMV), and Herpes infections. Curr Wom Health Repor; 2002 2(4):253-258.
3. Maruyama Y, Sameshima H, Kamitomo M. Fetal manifestations and poor outcomes of congenital cytomegalovirusinfections: possible candidates for intrauterine antiviral treatments. J Obstet Gynaecol; 2007 - 33(5):619–23.
4. Prasoona KR. Seroprevalence and Influence of Torch Infections in High Risk Pregnant Women: A Large Study from South India.J Obstet Gynecol India; 2015 – 65(5):301-309.
5. Swanson EC, Schleiss MR. Congenital cytomegalovirus infection: new prospects for prevention and therapy. Pediatr Clin North Am; 2013 – 60:335–349.
6. Enders G, Daiminger A, Bäder U. Intrauterine transmission and clinical outcome of 248 pregnancies with primary cytomegalovirus infection in relation to gestational age.J Clin Virol; 2011 - 52:244–6.
7. Cernescu C. Virusologie medicală. Ed. Medicală, Bucureşti, 1998: 341-350.
8. Amir J, Atias J, Linder N, Pardo J. Follow-up of infants with congenital cytomegalovirus and normal fetal imaging. Archives of Disease in Childhood-Fetal and Neonatal Edition; 2016 - fetalneonatal-2015.
9. American Academy of Pediatrics. Parvovirus. In: Pickering LK, editor. Red book: 2012 report of the Committee on Infectious Disease. 29th edition. Elk GroveVillage (IL): American Academy of Pediatrics; 2012:539–41.
10. Hudson A, Montegudo A, Steele R. Congenital human parvovirus B19 infection with persistent viremia. Clin Pediatr; 2015 54(5):409-13.
11. Anna A. Toxoplasma, parvovirus and cytomegalovirus infections during pregnancy.Duodecim; 2009 – 126(2):159-166.
12. Pappas G, Roussos N, Falagas ME. Toxoplasmosis snapshots: global status of Toxoplasma gondii seroprevalence and implications for pregnancy and congenital toxoplasmosis. Internat J Parasit; 2009 – 39(12):1385-1394.
13. Beke A. Comparison of prevalence of toxoplasma and cytomegalovirus infection in cases with fetal ultrasound markers in the second trimester of pregnancy. Prenat Diagnos; 2011 –31(10):945-948.
14. Seema S, Vipin S. Fetal Varicella Syndrome - A case report. Curr Pediatr Res; 2012 - 16:5–8.
15. Tan MP, Koren G. Chickenpox in pregnancy: revisited. Reprod Toxic; 2006 – 21(4):410-420.
16. Tongsong T, Srisupundit K, Traisrisilp K. Prenatal sonographic diagnosis of congenital varicella syndrome. J Clin Ultrasound; 2012 – 40(3):176-178.
17. Degani S. Ultrasound in the evaluation of intrauterine infection during pregnancy. Harefuah; 2009 – 148(7):460-4.
18. Gábor JJ. Etiology, prenatal diagnostics and outcome of ventriculomegaly in 230 cases. Fetal Diagn Therap; 2008 – 24(3):254-263.
19. Gay-Andrieu F, Marty P, Pialat J, Sournies G, de Laforte TD, Peyron F. Fetal toxoplasmosis and negative amniocentesis: necessity of an ultrasound follow-up. Prenat Diagn; 2003 - 23(7):558-560.
20. Abboud P. Signes échographiques de la fœtopathie toxoplasmique: revue de la littérature.J. Gynécol Obstét Biol Reprod; 1995 – 24(7):733-738.
21. Virkola K, Lappalainen M, Valanne L, Koskiniemi M. Radiological signs in newborns exposed to primary Toxoplasma infection in utero. Pediat Radio; 1997 -27(2):133-138.
22. Đuranović V, Krakar G, Mejaški-Bošnjak V, Lujić L, Gojmerac T, Marn B. Lenticulostriatal Vasculopathy–a Marker for Congenital Cytomegalovirus Infection?. Collegium antropologicum; 2011 - 35(1):149-153.
23. Hong SY, Yang JJ, Li SY, Lee IC. Lenticulostriate Vasculopathy in Brain Ultrasonography is Associated with Cytomegalovirus Infection in Newborns. Pediat & Neonat; 2015 -56(6):408-414.
24. Benoist G, Salomon LJ, Mohlo M, Suarez B, Jacquemard F, Ville Y. Cytomegalovirus-related fetal brain lesions: comparison between targeted ultrasound examination and magnetic resonance imaging. Ultrasound Obstet Gynecol; 2008 -32(7):900-905.
25. Guerra B, Simonazzi G, Puccetti C, Lanari M, Farina A,Lazzarotto T, Rizzo N. Ultrasound prediction of symptomatic congenital cytomegalovirus infection.Am J Obstet Gynecol; 2008,198:.e1 – 7.
26. Kyeong Ks Won HS, Lee MY, Shim JY, Lee PR, Kim A. Clinical features of 10 fetuses with prenatally diagnosed parvovirus B19 infection and fetal hydrops. Fetal Pediat Pathol; 2015 -34(1):49-56.
27. Chauvet A, Dewilde A, Thomas D, Joriot S, Vaast P, Houfflin-Debarge V, Subtil D. Ultrasound diagnosis, management and prognosis in a consecutive series of 27 cases of fetal hydrops following maternal parvovirus B19 infection. Fetal DiagnTherapy; 2011 - 30(1):41-47.
28. Hofmeyr GJ, Moolla S, Lawrie T. Prenatal sonographic diagnosis of congenital varicella infection - a case report. Prenat Diag; 1996-16:1148-1151.
29. Meyberg-Solomayer GC, Fehm T, Müller-Hansen I, Enders G, Poets C, Wallwiener D, Solomayer EF. Prenatal ultrasound diagnosis, follow-up, and outcome of congenital varicella syndrome. Fetal Diagn Therapy; 2006 -21(3):296-301.
Articole din ediţiile anterioare
Managementul infecţiei acute cu Toxoplasma gondii în sarcină – review de literatură
Toxoplasmoza este o infecţie parazitară cauzată de Toxoplasma gondii. Atunci când infecţia primară acută are loc în timpul sarcinii, aceasta poa...