At the moment, neonatal septicemia is one of the most frequent causes for neonatal morbidity and mortality. Recent data show a neonatal septicemia incidence of approximately 30 at 1000 live newborns, so 3 live newborns out of 100 develop a systemic infection in the neonatal period, with a 19% mortality rate. Each year the patology is responsible for 3.3 million deaths worldwide; most of them (over 90%) appear in Asia and Africa. In third world countries, neonatal septicemia is the main cause of death in the first 3 days of life, followed by perinatal asphyxia and congenital malformations. The diagnosis of neonatal sepsis is usually delayed, because blood cultures – gold standard procedure - are available only after 24-72 hours. Although blood cultures are efficient for the diagnosis, the tehnique requires a lot of time and a well equiped laboratory. An ideal diagnosis test for neonatal septicemia mainly needs to have a very high sensibility and sensitivity. It should also be cheap, easy to do, and quick. Neonatologists have a critic need for laboratory tests to help them in making a quick and efficient diagnosis, leading to a faster begining of treatment which can significantly improve prognosis. The present paper presents the actual stage in clinical transition to usefull markers in hasty diagnosis of neonatal sepsis.
Markeri de diagnostic precoce al septicemiei neonatale
Markers for quick diagnosis of neonatal septicemia
First published: 22 martie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.19.1.2018.1515
Abstract
Rezumat
În prezent, septicemia neonatală este una dintre cele mai frecvente cauze ale morbidităţii şi mortalităţii neonatale. Datele recente arată că incidenţa sepsisului neonatal este de 30 la 1.000 de nou-născuţi vii, adică la 3 din 100 de nou-născuţi se dezvoltă în perioada neonatală o infecţie sistemică cu un impact de 19% asupra deceselor neonatale totale. În fiecare an, din această cauză există 3,3 milioane de decese la nivel mondial; cele mai multe dintre acestea (peste 90%) apar în ţările sărace din Asia şi Africa. În ţările în curs de dezvoltare, septicemia neonatală este principala cauză a morbidităţii şi mortalităţii în primele trei zile de viaţă, urmată de asfixia perinatală şi malformaţiile congenitale. Diagnosticul sepsisului neonatal este adesea întârziat, deoarece rezultatele culturii sângelui, considerate astăzi drept standardul de aur în diagnostic, sunt disponibile numai după 24 până la 72 de ore. Deşi culturile de sânge sunt eficiente pentru diagnosticul sepsisului neonatal, tehnicile consumă mult timp şi necesită un laborator bine echipat. Un test de diagnostic ideal pentru septicemia neonatală trebuie să aibă cea mai mare sensibilitate şi specificitate. Testul ar trebui să fie ieftin, uşor de realizat şi să aibă o disponibilitate rapidă. Medicii neonatologi au o nevoie critică de teste de laborator pentru a ajuta la diagnosticarea rapidă şi precoce a sepsisului neonatal, pentru introducerea promptă a terapiei antimicrobiene, care poate îmbunătăţi semnificativ starea copiilor prematuri. Din această perspectivă, lucrarea prezintă stadiul actual al translaţiei clinice a unor markeri utili în diagnosticul precoce al sepsisului neonatal.
În prezent, sepsisul neonatal reprezintă una dintre cele mai frecvente cauze de morbiditate şi mortalitate neonatală. Date recente arată că incidenţa sepsisului neonatal este de 30 la mia de nou-născuţi vii, adică 3 din 100 de nou-născuţi vii dezvoltă în perioada neonatală o infecţie sistemică cu un impact de 19% asupra totalului deceselor neonatale(1). Aceste cifre se referă la sepsisul neonatal în general, dar, dacă ne referim strict la categoria cea mai vulnerabilă, respectiv nou-născutul prematur, sepsisul neonatal reprezintă cea mai importantă cauză de deces neonatal. Această realitate este explicată de numeroasele comorbidităţi care se asociază sepsisului neonatal, precum şi faptului că prematurii „încarcă” cel mai frecvent unităţile de terapie intensivă neonatală în toată lumea.
Pe plan mondial, în fiecare an se produc 3,3 milioane de decese din cauza acestui fapt; majoritatea acestora (peste 90%) se produc în ţările sărace din Asia şi Africa(2,3). În ţările în curs de dezvoltare, sepsisul neonatal reprezintă principala cauză de morbiditate şi mortalitate în primele trei zile de viaţă, fiind urmat de asfixia perinatală şi malformaţiile congenitale(4).
Creşterea incidenţei naşterilor premature şi mai ales a prematurităţii extreme se explică şi prin progresele remarcabile ale neonatologiei, graţie cărora procentul şi calitatea recuperării acestei prematurităţi sunt în creştere, inclusiv în ţara noastră.
Se poate spune însă că şi progresul are un „preţ”, deoarece această categorie este şi cea mai expusă sepsisului neonatal.
Studii populaţionale mari privind incidenţa sepsisului neonatal la prematuri sunt puţine, în special în ţările în curs de dezvoltare, cu rezultate variabile de la o regiune la alta. Ceea ce este evident vizează creşterea incidenţei sepsisului neonatal în toate unităţile de terapie intensivă neonatală indiferent de îmbunătăţirea calităţii asistenţei neonatale(5). Prematuritatea extremă (sub 32 de săptămâni de gestaţie) reprezintă categoria dominantă şi cea mai vulnerabilă faţă de infecţie, sepsis, morbiditate şi mortalitate(6). Marea vulnerabilitate a acestei categorii se datorează unor cauze multiple, dar cele mai importante sunt(7):
- Absenţa tuturor „barierelor naturale” de apărare antiinfecţioasă, prematurul extrem având deschise toate „intrările” în organism pentru agenţii infecţioşi.
- Deficienţa imunitară globală vizând atât imunitatea umorală de transfer de la mamă (aproape absentă), cât şi imunitatea celulară, care este slab responsivă sau chiar nonresponsivă faţă de agresiunea infecţioasă.
- Răspunsul întârziat, deficitar sau absent al organelor limfoide faţă de agresiunea infecţioasă atât în viaţa intrauterină, cât şi (mai ales) după naştere.
- Absenţa alimentaţiei enterale în condiţiile unei alimentaţii parenterale totale prelungite, iar în cadrul acesteia, absenţa alimentaţiei enterale cu laptele propriei mame ca unic donator natural de imunitate după naştere.
- Multitudinea de manevre şi proceduri la care este supus prematurul în unitatea de terapie intensivă neonatală, manevre atât de necesare pentru supravieţuire, dar cu un grad mare de fragilizare sau deosebit de invazive (ventilaţia mecanică, cateterizările, prelevările de produse biologice, monitorizările diverşilor parametri vitali cu utilizarea unor electrozi etc.).
- Durata de spitalizare foarte mare, ceea ce face ca prematurul să fie expus pentru o perioadă foarte lungă (săptămâni sau luni) riscului infecţios cu germeni de spital rezistenţi sau multirezistenţi.
Din cauza faptului că părăseşte foarte devreme mediul intrauterin protector, prematurul nu a putut dezvolta nicio producţie de anticorpi, deoarece nu a avut contacte cu agenţi infecţioşi în uter. În general, după a 32-a săptămână gestaţională, fătul în uter obţine pentru fiecare săptămână de viaţă un grad tot mai mare de maturitate şi o capacitate tot mai bună de a localiza infecţia şi de a o anihila la nivelul „porţii de intrare”. Din aceste motive, prematurul cu vârsta de gestaţie cuprinsă între 32 şi 37 de săptămâni este mai puţin expus riscului unei infecţii sistemice deoarece are mijloace de apărare antiinfecţioasă aproape la fel de performante ca ale nou-născutului la termen, matur.
Prin comparaţie, prematurul extrem, adică cel cu vârstă de gestaţie sub 32 de săptămâni, este cu atât mai vulnerabil, cu cât vârsta de gestaţie este mai mică, iar, practic, orice infecţie iniţial localizată a acestuia devine rapid sistemică prin invadarea sistemului circulator, diseminare generalizată şi metastazare septică. Această realitate se regăseşte în toate unităţile de terapie intensivă neonatală din ţara noastră şi din lume, diferenţele dintre ele fiind date de gradul de anticipare sau suspicionare a infecţiei, de rapiditatea stabilirii etiologiei şi de promptitudinea instituirii măsurilor terapeutice în conformitate cu etiologia.
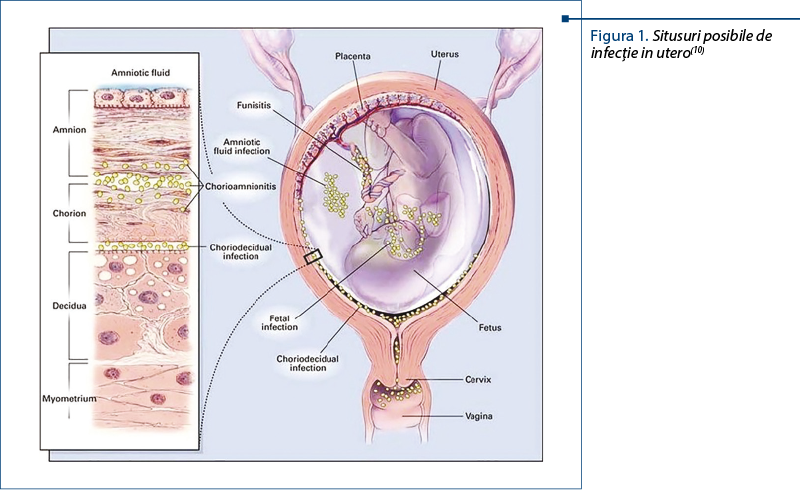
În ţara noastră – şi, implicit, în clinica noastră – s-au realizat progrese remarcabile în ultimii ani în ceea ce priveşte supravieţuirea, recuperarea şi calitatea recuperării pentru prematuritatea extremă cu vârstă gestaţională cuprinsă între 24 şi 32 de săptămâni. Desigur că aceste progrese aduc cu ele o augmentare a riscului infecţios şi de aici preocuparea pentru patologia infecţioasă a acestui prematur devine o adevărată piatră de temelie pentru managementul neonatal.
Cu toate că nou-născuţii prematuri reprezintă categoria cea mai vulnerabilă faţă de patologia infecţioasă, un număr important de nou-născuţi la termen rămân susceptibili de a dezvolta sepsis neonatal(8).
Expunerea limitată la antigene din cursul vieţii intrauterine are drept consecinţă reducerea inducţiei imunităţii adaptative, motiv pentru care nou-născuţii depind în mare măsură de imunitatea înnăscută pentru a-i proteja împotriva infecţiilor(8,9). Sistemul imun înnăscut reprezintă prima linie de prevenire a invaziei microbiene şi de apărare în cazul producerii unei infecţii, indiferent de poarta de intrare. El oferă o protecţie adecvată pentru majoritatea nou-născuţilor la termen, dar nu protejează şi prematurul (figura 1).
Infecţiile provocate de bacteriile intrauterine sunt considerate a fi cauza principală a infecţiilor asociate prematurităţii. Deşi cavitatea amniotică este considerată sterilă, mai puţin de 1% dintre femeile în travaliu la termen vor avea bacterii în lichidul amniotic. Prin urmare, izolarea bacteriilor din lichidul amniotic este patologică, fiind definită ca o invazie microbiană a cavităţii amniotice. Cele mai multe dintre aceste infecţii sunt subclinice şi nu pot fi detectate fără analiza lichidului amniotic. Frecvenţa acestor infecţii depinde de forma clinică şi de vârsta gestaţională. La mamele cu travaliu prematur cu membrane intacte, rata de culturi pozitive din lichidul amniotic este de 12,8%(10). La femeile cu ruptură prematură a membranelor la internare, rata de culturi pozitive din lichidul amniotic este de 32,4%. O observaţie interesantă şi consistentă este aceea că, cu cât este mai mică vârsta gestaţională la prezentare (travaliu prematur cu membrane intacte), cu atât mai mare este frecvenţa de culturi pozitive din lichidul amniotic(11). Aceasta s-ar putea traduce şi ca o vulnerabilitate mai mare a membranelor amniotice, invers proporţională cu vârsta de gestaţie.
Diagnosticul de sepsis neonatal este adesea întârziat, deoarece rezultatele culturilor din sânge, considerate astăzi standardul de aur în diagnosticare, sunt disponibile doar după 24-72 de ore. Deşi culturile din sânge sunt eficiente pentru diagnosticul de sepsis neonatal, tehnicile sunt consumatoare de timp şi necesită un laborator bine dotat. Un test ideal de diagnostic pentru sepsis neonatal ar trebui să aibă sensibilitate şi specificitate maximă. Testul ar trebui să fie ieftin, uşor de realizat şi să aibă o disponibilitate rapidă. Medicii neonatologi au o nevoie critică de teste de laborator care să ajute la diagnosticarea rapidă şi precoce a sepsisului neonatal pentru instituirea promptă a terapiei antimicrobiene, care poate îmbunătăţi semnificativ starea prematurilor(12,13).
Date fiind toate aceste condiţii, apare ca prioritară preocuparea cercetătorilor şi clinicienilor de a descoperi cât mai precoce markerii de predictibilitate pentru sepsisul neonatal. Un marker ideal de predicţie a sepsisului neonatal cât mai devreme posibil nu s-a descoperit încă. Un astfel de marker nu poate fi căutat decât fie în lichidul amniotic considerat mediul de viaţă fetal (cu membrane amniotice intacte sau rupte), fie în sângele cordonului ombilical. Atât sângele placentar de partea fetală, cât şi cel al cordonului ombilical reprezintă un „martor” important al unei infecţii neonatale contractate înainte de naştere sau în timpul travaliului, chiar dacă la aceasta nu se asociază şi o corioamnionită. Până în prezent se cunosc numeroşi markeri, grupaţi în(13):
- Teste hematologice
- Reactanţi (proteine) de fază acută şi alte proteine
- Componente ale sistemului complement
- Chemokine, citokine şi molecule de adeziune
- Markeri de suprafaţă celulară
- Alţii.
În continuare este prezentată o actualizare a celor mai importanţi markeri de diagnostic precoce ale căror sensibilitate şi specificitate se apropie cel mai mult de dezideratul ideal.
Testele hematologice. Hemoleucograma completă precoce are o contribuţie redusă la evaluarea clinică a nou-născuţilor, fie simptomatici, fie asimptomatici, cu suspiciune de infecţie bacteriană şi risc de sepsis neonatal. Studii comparative efectuate pe probe-pereche de sânge din cordonul ombilical şi de la nou-născut, după naştere, au arătat că nu există diferenţe semnificative între valorile indicilor hematologici ca markeri de infecţie neonatală.
S-a observat o corelaţie moderată până la înaltă pentru leucocite, neutrofile, limfocite, euzinofile, MCH, MPV şi RDW. Corelaţie mai scăzută s-a observat între trombocite, hematocrit, hemoglobină, MCHC, monocite şi bazofile. Valorile leucocitelor, hemoglobinei şi hematocritului au fost semnificativ mai scăzute în sângele cordonului ombilical versus sângele periferic. Trombocitele au fost statistic semnificativ mai crescute în sângele din cordonul ombilical versus sângele periferic al nou-născutului(14).
Recent, factorul de stimulare a coloniilor granulocitare, un mediator produs de măduva osoasă pentru a facilita proliferarea şi diferenţierea neutrofilelor, a fost propus ca marker cert de infecţie pentru diagnosticul de sepsis neonatal. Utilizând o valoare de referinţă de 200 pg/ml, acesta a avut o sensibilitate mare (95%) şi o valoare predictivă negativă foarte mare (99%) pentru infecţiile neonatale bacteriene şi fungice. Ceilalţi factori sunt utili pentru nou-născuţii septici care dezvoltă complicaţii hemoragice şi trombotice, iar aceştia fac parte de obicei din categoria nou-născuţilor prematuri cu infecţie severă(13). Testele hematologice normale la nou-născuţii cu semne clinice de sepsis nu trebuie să reprezinte un motiv pentru amânarea iniţierii antibioterapiei. Până la excluderea infecţiei prin alte metode, nou-născuţii simptomatici trebuie trataţi cu antibiotice. Nou-născuţii asimptomatici care prezintă multipli factori de risc pentru sepsis neonatal necesită evaluare completă şi tratament empiric până la apariţia rezultatelor care certifică sau infirmă boala(13,14).
Stimulii inflamatori de orice tip (infecţie, traume sau ischemie) determină marginalizarea, extravazarea şi activarea granulocitelor şi monocitelor, cu eliberarea citokinelor proinflamatorii ca IL-1B, IL-6, IL-8 şi TNF-α. Aceşti mediatori stimulează rapid producţia de către ficat a unor proteine, cunoscute sub numele de reactanţi de fază acută.
Dintre ei, cei mai studiaţi în ultimele trei decenii au fost Proteina C Reactivă (PCR) şi Procalcitonina (PCT). De asemenea, celelalte proteine de fază acută au fost evaluate în relaţie cu sepsisul neonatal. Cu toate că în infecţiile neonatale creşte semnificativ concentraţia acestor markeri, ei nu au intrat în uzul clinic din cauza, pe de o parte, a limitelor în diagnostic şi, pe de altă parte, a dificultăţilor tehnice de efectuare şi a preţului crescut(15).
Proteina C Reactivă (PCR). PCR este o proteină serică produsă de ficat şi a cărei producţie este iniţiată şi stimulată de IL-6, eliberată de granulocitele activate. PCR produsă este eliberată în circulaţie în faza acută a inflamaţiilor de cauză infecţioasă (proteină de fază acută). Ea formează un complex insolubil cu polizaharidul C al Streptococcus pneumoniae, de unde şi denumirea de PCR. Limitele valorilor serice de referinţă ale acesteia sunt cuprinse între 0,2 şi 95 mg/ml. Ca răspuns la o infecţie bacteriană, dar şi la alte afecţiuni inflamatorii, nivelul ei circulant poate creşte de 100-1.000 de ori.
La nou-născuţii cu infecţii tratate, nivelul seric al PCR începe să crească după 6-8 ore de la debutul infecţiei şi atinge valoarea maximă după 2-3 zile de evoluţie a ei. Din cauza acestui răspuns întârziat, sensibilitatea creşterii nivelului seric al PCR la momentul evaluării pentru suspiciune de sepsis neonatal este mică, mai ales în sepsisul precoce. Pentru majoritatea studiilor, limita medie a valorilor PCR a fost de 17 mg/ml, cu o sensibilitate medie de 66% şi o specificitate medie de 86%. PCR este cel mai studiat marker de diagnostic al sepsisului neonatal. Studiile efectuate arată că sensibilitatea şi specificitatea optimă a PCR au fost obţinute în intervalul 24-48 de ore de la debutul simptomatologiei la cazurile simptomatice.
Din cauza faptului că mulţi nou-născuţi cu sepsis neonatal precoce nu sunt identificaţi prin măsurarea PCR, valoarea acestui marker în diagnosticul precoce este mică. În schimb, acest marker este mai valoros în monitorizarea terapiei cu antibiotice şi determinarea duratei acesteia. Astfel, valori serice seriate normale ale PCR, în absenţa unor semne clinice sugestive pentru infecţie, ar putea indica întreruperea în siguranţă a antibioterapiei empirice(16,17,18), deşi aceasta nu presupune abandonarea eforturilor de stabilire a etiologiei infecţiei. Niveluri serice ridicate ale PCR la una sau mai multe determinări nu ar trebui să constituie o indicaţie unică de iniţiere şi continuare a antibioterapiei empirice. În concluzie, putem afirma că, izolat, PCR este un marker de fază tardivă pentru diagnostic şi monitorizare terapeutică. Contrar limitării sale, din cauza faptului că apare târziu şi persistă o lungă perioadă, PCR a fost utilizat ca standard de măsurare a potenţialului şi eficienţei markerilor noi.
Procalcitonina (PCT). Este o proteină de fază acută produsă de ficat şi macrofage. Limitele valorilor serice de referinţă ale acesteia sunt cuprinse între 0,34 şi 100 ng/ml. PCT s-a dovedit a fi un marker mult mai relevant decât PCR în dignosticul sepsisului bacterian în stadiile incipiente, având o sensibilitate medie de 77,93%, o specificitate medie de 81,84% şi o valoare medie de 8,92 mg/ml. Nivelurile sale serice cresc după 4-6 ore de la expunerea la produşii bacterieni, ceea ce face din acest marker o alternativă cu valoare practică deosebită pentru detectarea sepsisului neonatal precoce.
PCT poate creşte în mod fiziologic la nou-născuţii neinfectaţi, asimptomatici; aceste valori au fost atribuite stresului perinatal şi adaptării neonatale.
Chiar limita maximă a valorii fiziologice a PCT este utilă în diagnosticul şi monitorizarea nou-născuţilor cu risc de infecţie. Stările infecţioase materne nu au avut niciun efect asupra concentraţiei PCT, ceea ce sugerează faptul că PCT nu traversează placenta, ci este rezultatul sintezei endogene fetale(19).
Valorile normale ale concentraţiei plasmatice a PCT nu depăşesc 0,05 mg/ml. În sepsisul neonatal, în funcţie de severitate acestuia, valorile-prag pot creşte de 10 până la 1000 de ori. În mod obişnuit, concentraţiile mai mari de 0,5 mg/ml sunt interpretate ca sugestive pentru sindromul septic(20).
PCT poate creşte şi ca răspuns la complicaţiile neinfecţioase ale nou-născutului (detresa respiratorie, asfixia, hemoragia cerebrală), punând în discuţie specificitatea sa în diagnosticul sepsisului neonatal. Cum aceste complicaţii sunt apanajul aproape exclusiv al prematurităţii, asocierea ei nu îi ştirbeşte valoarea de marker al sepsisului bacterian. Concentraţia PCT creşte în ser de 2-3 ori la debutul infecţiei, realizează un maxim la 6-12 ore şi revine la concentraţii normale la două zile de la debutul infecţiei. Revenirea la concentraţia iniţială este de obicei rapidă. Din aceste motive, PCT este un marker valoros pentru sepsisul neonatal precoce, atât pentru diagnostic, cât şi pentru monitorizarea prognosticului şi răspunsului la tratament. Revenirea la valorile normale şi menţinerea în limitele acestora reprezintă un semn de prognostic favorabil(21).
Interleukina-6 (IL-6). Expunerea la bacterii determină o creştere rapidă a concentraţiei IL-6. În sângele cordonului ombilical, IL-6 s-a dovedit a fi un marker sensibil pentru diagnosticul sepsisului neonatal precoce, având o sensibilitate de 87-100% şi valori predictive în 93-100% din cazuri(22). În comparaţie cu alţi markeri, IL-6 are cea mai mare sensibilitate şi valoare predictivă la debutul infecţiei, deoarece concentraţiile sale scad rapid, putând deveni nedetectabile după 24 de ore. Timpul de înjumătăţire scurt al IL-6 duce la o normalizare rapidă a valorilor sale serice, chiar dacă infecţia persistă(23). S-a demonstrat că nou-născuţii din secţiile de terapie intensivă neonatală cu evidenţe clinice şi/sau microbiologice de infecţie prezintă niveluri serice crescute ale IL-6 comparativ cu cei fără aceste evidenţe(24). De asemenea, valorile serice sunt semnificativ mai crescute la nou-născuţii prematuri comparativ cu cei la termen(25). Aceasta face ca în primele 24-48 de ore de viaţă valoarea predictivă a IL-6 pentru sepsisul neonatal precoce la prematuri să fie relevantă, cu atât mai mult cu cât infecţia reprezintă una din cauzele majore de rupere prematură a membranelor amniotice şi de naştere prematură(19). O analiză sistematică a 65 de lucrări relevante din ultimele trei decenii a arătat o valoare medie limită de 76,49 pg/ml, o valoare medie a sensibilităţii la momentul zero de 77,87% şi o specificitate medie de 78,61%(13).
Interleukina-8 (IL-8). IL-8 este considerată un marker de mare precizie, cu sensibilitate variind între 80% şi 91% şi o specificitate între 76% şi 100%(26). Analiza sistematică a 65 de lucrări relevante din ultimele trei decenii a arătat o valoare medie de referinţă de 220,53 pg/ml, o sensibilitate medie de 72,48% şi o specificitate medie de 80,57%(13). Asocierea IL-8 cu PCR creşte semnificativ valoarea diagnostică în sepsisul neonatal precoce şi reduce semnificativ antibioterapia empirică(27). IL-8 a fost descrisă ca având variaţii în raport cu vârsta gestaţională, adică prezentând valori mai crescute la prematuri faţă de nou-născuţii la termen, atât în sângele cordonului ombilical, cât şi în cel recoltat în zilele 2-5 postnatal(28).
TNF-α. Alături de IL-6 şi IL-8, TNF-α este o citokină proinflamatoare, care stimulează producerea de IL-6 şi a cărei valoare serică este semnificativ mai crescută la nou-născuţii care dezvoltă sepsis neonatal precoce faţă de cei sănătoşi. O metaanaliză care a cuprins 347 de studii realizate în perioada 1994-2013 a arătat că TNF-α oferă o precizie moderată în diagnosticul de sepsis neonatal atât precoce, cât şi în cel tardiv. 65 de lucrări relevante din ultimele trei decenii au arătat pentru TNF-α o sensibilitate medie de 78,72% şi o specificitate de 81,4%.
Cu toate acestea, TNF-α rămâne un marker valoros pentru sepsisul neonatal precoce, chiar în sângele cordonului ombilical(29).TNF-α are caracteristici şi proprietăţi asemănătoare cu IL-6 şi IL-8, astfel că utilizarea sa ca marker de diagnostic în sepsisul neonatal precoce nu s-a demonstrat a fi comparabil mai bună(30).
Antigenele (markerii) de suprafaţă. Specific celulare, sunt exprimate în cantităţi substanţiale după ce celulele inflamatorii sunt activate de bacterii sau de produsele celulare ale acestora. Dintre markerii de suprafaţă studiaţi, CD11b şi CD64 par a fi cei mai predictivi pentru sepsisul neonatal. Expresia CD11b creşte semnificativ la câteva minute de la contactul celulelor inflamatorii cu bacteriile şi endotoxinele(31). Sensibilitatea şi specificitatea pentru diagnosticul precoce de sepsis neonatal sunt de 86-100%, respectiv 100% pentru CD11b, iar pentru CD6y sensibilitatea variază între 78% şi 96%(32). Cu toate că par promiţătoare, aceste teste sunt limitate de necesitatea unui echipament sofisticat şi de prelucrarea rapidă a probelor înainte ca neutrofilele să fie distruse prin apoptoză sau ca antigenele de suprafaţă să scadă(33).
În prezent, niciunul dintre markerii actuali de diagnostic descrişi nu este destul de sensibil şi specific pentru a influenţa decizia terapeutică. În ciuda referinţelor favorabile ale multor studii, costurile ridicate, disponibilitatea limitată a testelor la momentul oportun, complexitatea metodelor de analiză, timpul lung din laborator, fiabilitatea scăzută a determinărilor, mărimea relativ mică a eşantionului şi lipsa valorilor de referinţă clare pentru mai mulţi markeri limitează aplicabilitatea clinică a majorităţii markerilor de diagnostic. O discuţie pertinentă rezultă din analiza sistematică a 65 de lucrări relevante din ultimele trei decenii(13).
Există mai multe explicaţii pentru tranziţia lentă a biomarkerilor din stadiul de cercetare de laborator la utilizarea lor în practica clinică. Cauza principală este heterogenitatea protocoalelor de cercetare, iar diferenţele constau în valorile-prag folosite pentru a defini pozitivitatea.
În unele studii, valori-prag diferite au fost folosite pentru acelaşi marker, bazându-se pe durata bolii la momentul recoltării sângelui. Aceasta este o abordare necorespunzătoare pentru a fi implementată în practica clinică. Definirea „momentului zero” este un element important pentru a stabili un marker ca fiind detector al infecţiei în stadiu incipient sau tardiv. Această definiţie este diferită de la studiu la studiu şi de cele mai multe ori s-a decis în funcţie de momentul recoltării sângelui, foarte puţine studii luând în considerare momentul de debut al simptomatologiei clinice. Diagnosticul precoce al sepsisului neonatal nu este o preocupare de rutină în ţările în curs de dezvoltare, unde strategiile de investigare sunt scăzute şi copiii sunt nediagnosticaţi sau diagnosticaţi într-un stadiu sever al bolii. De asemenea, definiţia sepsisului este diferită de la studiu la studiu. În majoritatea studiilor, sepsisul a fost definit având la bază un algoritm clinic, dar şi acest algoritm a fost variat. Mai mult decât atât, au existat studii în care au fost luate în considerare doar cazurile de sepsis confirmate prin culturi. Aceasta este o provocare: dacă luăm în considerare ca fiind pozitive toate cazurile suspectate clinic de sepsis, riscăm să pierdem cazurile reale de sepsis; dacă nu luăm în considerare aspectele clinice, putem trece cu vederea o infecţie care nu este surprinsă în hemocultură. Peste 90% din studii provin din ţări dezvoltate (mai mult de 50% din Europa), deci avem foarte puţine date din ţările în curs de dezvoltare, unde populaţia este diferită din multe puncte de vedere: expunerea la agenţii microbieni; etiologia infecţiilor; statusul nutriţional; măsurile de prevenţie şi diagnosticul precoce(34).
În ultima vreme există o preocupare constantă de combinare a mai multor markeri pentru a îmbunătăţi precizia diagnosticului. Rezultate semnificative au fost obţinute din combinaţia unor markeri cu sensibilitate precoce precum PCT, IL-6, IL-8, CD11b şi CD64. Aceste combinaţii au condus la creşterea sensibilităţii, la valori cuprinse între 90% şi 100% în majoritatea studiilor.
Concluzii
- Din articolele relevante ale ultimelor decenii rezultă faptul că PCR-ul este cel mai studiat marker, fiind urmat în ordine de: IL-6, PCT, TNF-α, IL-8 şi markerii de suprafaţă celulară CD11b şi CD64.
- Inducerea întârziată a sintezei hepatice a PCR în timpul răspunsului inflamator la infecţie scade sensibilitatea acesteia în fazele timpurii ale sepsisului neonatal, determinări seriate la 24-48 de ore de debutul simptomelor îmbunătăţind evident precizia diagnosticului.
- PCR oferă cea mai mare precizie de diagnostic combinat cu cel puţin unul din markerii cu sensibilitate precoce, respectiv PCT, IL-6 şi IL-8, această combinaţie compensând slăbiciunea sa.
- Diagnosticul precoce al sepsisului neonatal trebuie să devină o preocupare de rutină şi în ţările în curs de dezvoltare, chiar dacă cercetarea biomarkerilor are multe limitări.
-
Pentru a facilita utilizarea biomarkerilor ca metodă de diagnostic precoce al sepsisului neonatal sunt necesari următorii paşi:
- un studiu multicentric naţional şi/sau multinaţional care să utilizeze un protocol de identificare a celor mai utilizaţi şi de perspectivă markeri;
- un protocol comun de definire a momentului zero de determinare a concentraţiei serice a markerilor, de monitorizare a concentraţiei acestora şi de definire a utilităţii lor;
- un protocol comun de îngrijire şi tratament al sepsisului neonatal care să valideze clinic rezultatele cercetării şi să le disemineze.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Blackburn R, Verlander N, Heath P, Muller-Pebody B. The changing antibiotic susceptibility of bloodstream infections in the first month of life: informing antibiotic policies for early-and late-onset neonatal sepsis. Epidemiol Infect. 2014;142(04):803-11.
- Upadhyay RP, Krishnan A, Rai SK, Chinnakali P, Odukoya O. Need to focus beyond the medical causes: a systematic review of the social factors affecting neonatal deaths. Paediatric and perinatal epidemiology. 2014;28(2):127-37.
- Meem M, Modak JK, Mortuza R, Morshed M, Islam MS, Saha SK. Biomarkers for diagnosis of neonatal infections: A systematic analysis of their potential as a point-of-care diagnostics. J Glob Health. 2011;1(2):201-9.
- Lawn JE, Kerber K, Enweronu-Laryea C, Massee Bateman O. Newborn survival in low resource settings-are we delivering? BJOG. 2009;116(Suppl 1):49-59.
- Sucilathangam G, Amuthavalli K, Velvizhi G, Ashihabegum M, Jeyamurugan T, Palaniappan N. Early Diagnostic Markers for Neonatal Sepsis: Comparing Procalcitonin (PCT) and C-Reactive Protein (CRP). J Clin Diag Res. 2012;6:627-31.
- Dima M, Ilie C, Boia M, Iacob D, Manea A, Ionita N, Sipos S, Chiru D, Iacob RE. Prevalence of infection in low birth weight infants. Jurnalul pediatrului. 2013;XVI(61-62):107-10.
- Dima MA. Patternul imunologic al nou-născutului prematur, factor de risc major în infecţiile neonatale sistemice. Teză de Doctorat, Timişoara. 2014;6-16,24-41,83-121.
- Prabhu Das M, Adkins B, Gans H, et al. Challenges in infant immunity: implications for responses to infection and vaccines. Nat Immunol. 2011;12(3):189-95.
- Vasilcan G. Infecţii neonatale. Aspecte epidemiologice, de diagnostic, evoluţie şi tratament. Teză de Doctorat, Iaşi. 2012;63-80.
- Goldenberg RL, Hauth JC, Andrews WW. Intrauterine infection and preterm delivery. N Engl J Med. 2000;342:1500-7.
- Romero R, Hassan SS, Gajer P, Tarca AL, Fadrosh DW, Nikita L, et al. The composition and stability of the vaginal microbiota of normal pregnant women is different from that of non-pregnant women. Microbiome. 2014;2(1):4.
- Ince Z. Diagnosis of neonatal sepsis: what the clinician expects, what the laboratory tells. Clinic Biochem. 2014;47(9):754-5.
- NgP.: Diagnostic markers of infection in neonates. Achi Dis Child Fetal Neonatal, Ed. 2004;229-35.
- Benitz WE. Adjunct laboratory tests in the diagnosis of early-onset neonatal sepsis. Clin Perinatol. 2010;37:421-38.
- Dollner H. Inflamatory Mediators in Perinatal Infectio; Troudheim, Thesis. 2001.
- Pourcyrous M, Bada HS, Korones SB, et al. Significance of serial C-reactive protein responses in neonatal infection and other disorders. Pediatrics. 1993; 92(3):431-5.
- Benitz WE, Han MY, Madan A, et al. Serial serum C-reactive protein levels in thediagnosis of neonatal infection. Pediatrics. 1998;102(4):E41.n.
- Nora Hofer et al. An uptade on the use of c-reactive protein in early-onset neonatal sepsis: curent insights and new tasks. Neonatology. 2012;102:25-36.
- Naher BS, Mannan MA, Noor K, Shahiddullah M. Role of serum procalcitonin and C-reactive protein in the diagnosis of neonatal sepsis. Bangladesh Med Res Coun Bull. 2011;37(2):40-6.
- Sakha K, Husseini MB, Seyyedsadri N. The role of the procalcitonin in diagnosis of neonatal sepsis and correlation between procalcitonin and C-reactive protein in these patients. Pakistan journal of biological sciences: PJBS. 2008;11(14):1785-90.
- Koksal N, Harmanci R, Cetinkaya M, Hacimustafaoglu M. Role of procalcitonin and CRP in diagnosis and follow-up of neonatal sepsis. Turkish J Pediatr. 2007;49(1):21-9.
- Dima M, Ilie C, Boia M, Iacob D, Iacob RE, Manea A, Ion N. Acute phase reactants and cytokines in the evaluation of neonatal sepsis. Jurnalul pediatrului. 2012;XV(59-60):27-30.
- Procianoy RS, Silveira RC. The role of sample collection timing on interleukin-6 levels in early-onset neonatal sepsis. Jornal de pediatria. 2004;80(5):4.
- Panero A, Pacifico L, Rossi N, Mancuso G,Stegagno M, Chiesa C. Interleukin 6 in neonateswith early and late onset infection. Pediatr Infect Dis J. 1997; 16:370-375.
- Schollin J. Interleukin-8 in neonatal sepsis. Acta paediatr. 2001;90(9):961-2.
- Chiesa C, Signore F, Assumma M, Buffone E, Tramontozzi P, Osborn JF, et al. Serial measurements of Creactive protein and interleukin-6 in the immediate postnatal period: reference intervals and analysis of maternaland perinatal confounders. Clin Chem. 2001;47:1016-22.
- Franz AR, Bauer K, Schalk A, Garland SM, Bowman ED, Rex K, et al. Measurement of interleukin 8 in combination with C-reactive protein reduced unnecessary antibiotic therapy in newborn infants: a multicenter, randomized, controlled trial. Pediatrics. 2004;114(1):1-8.
- Matoba N, Yu Y, Mestan K, Pearson C, OrtizK, Porta N, et al. Differential patterns of 27 cord blood immune biomarkers across gestationalage. Pediatrics. 2009;123:1320-8.
- Lv B, Huang J, Yuan H, Yan W, Hu G, Wang J. Tumor necrosis factor-alpha as a diagnostic marker for neonatal sepsis: a meta-analysis. Sci World J. 2014;2014:471463.
- Malik A, Hui CPS, Pennie RA, Kirpalani H. Beyond the complete blood cell count and Creactiv-protein: a systematic review of modern diagnostic tests for neonatal sepsis. Arch Pediatr Adolesc Med. 2003; 157:511-6.
- Lehr HA, Krombach F, Münzing S, Bodlaj R,Glaubitt SI, Seiffge D, et al. In vitro effects ofoxidized low density lipoprotein on CD11b/CD18 and L-selectin presentation on neutrophils and monocytes with relevance for the in vivo situation. Am J Pathol. 1995; 146:218-27.
- Ng PC, Li G, Chui KM, Chu WCW, Li K,Wong RPO, et al. Neutrophil CD64 is a sensitive diagnostic marker for early onset neonatal infection. Pediatr Res. 2004; 56:796-803.
- Haque KN. Neonatal sepsis in the very low birth weight preterm infants. 2. Review of definition, diagnosis and management. J Med Sci. 2010;1:11-7.
Articole din ediţiile anterioare
Provocările terapeutice ale sindromului de detresă respiratorie a nou-născutului – prezentare de caz
Insuficienţa respiratorie este frecvent observată la nou-născuţii cu asfixie perinatală severă. Aceasta reprezintă rezultatul afecţiunilor sub...
Modificări metabolice şi riscul de naştere prematură
Statusul gravidic implică, în mod fiziologic, modificări metabolice menite să permită susţinerea şi dezvoltarea sarcinii. Momentul trecerii de ...
Prematuritatea şi riscul asociat infecţiei cu virusul papilomatozei umane
Prematuritatea este o cauză importantă de morbiditate şi mortalitate în perioada neonatală. Studiile recente arată că infecţia cu papilomavirusu...
Retinopatia de prematuritate - actualizare de screening şi management
a dezvoltării vaselor sangvine retiniene la nou-născuţii prematuri. Este una din cele mai frecvente complicaţii ale prematurităţii, în special la p...