Pneumocystis jirovecii is an opportunistic microorganism whose name is associated with HIV /AIDS and continues to be a challenge. It is the most common opportunistic infection in people infected with HIV. Multiple immune deficiencies of the host allow the uncontrolled multiplication of the microorganism and the occurrence of the disease, and the category of seropositive patients benefit from prophylaxis and treatment for Pneumocystis jirovecii infection. Instead, a challenge comes from immunocompromised and seronegative patients, their symptoms being different, higher aggressiveness of the disease and more severe progression, with a 50% mortality rate unchanged over time. The aim of the study was to analyze the latest information on the way in which the infection is manifested in seropositive patients, while at the same time making a comparison with immunocompromised and seronegative patients. Further, differential diagnosis poses problems, especially in the case of seronegative individuals whose infection does not follow the usual pattern. Pulmonary ultrasound could be part of the standard set of investigations due to its benefits (non-invasive and cost-effective method). An optimistic note comes from new methods of prophylaxis that could include a vaccine for the future.
Pneumocistoza în infecţia HIV/SIDA
Pneumocystosis in HIV / AIDS infection
First published: 30 decembrie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Inf.56.4.2018.2191
Abstract
Rezumat
Pneumocystis jirovecii este un microorganism oportunist al cărui nume este asociat cu infecţia HIV/SIDA şi continuă să fie o provocare. Este cea mai frecventă infecţie oportunistă la persoanele infectate HIV. Deficienţele imune multiple ale gazdei permit înmulţirea necontrolată a microorganismului şi apariţia bolii, iar pacienţii seropozitivi beneficiază de profilaxie şi tratament pentru infecţia cu Pneumocystis jirovecii. În schimb, o provocare vine din partea pacienţilor imunocompromişi seronegativi, simptomatologia acestora fiind diferită, agresivitatea bolii mai mare şi evoluţia mai severă, cu rata mortalităţii de 50%, rămasă neschimbată de-a lungul timpului. Scopul studiului a fost de a analiza cele mai recente informaţii legate de modul de manifestare a infecţiei la pacienţii seropozitivi, realizând în acelaşi timp şi o comparaţie cu pacienţii imunocompromişi seronegativi. În continuare, ridică probleme diagnosticul diferenţial, mai ales în cazul persoanelor seronegative a căror infecţie nu urmează patternul obişnuit. Ecografia pulmonară ar putea face parte din setul de investigaţii-standard datorită avantajelor sale (metodă neinvazivă şi cost-eficientă). O notă optimistă vine din partea noilor metode de profilaxie care ar putea include în viitor şi vaccinarea.
Introducere
Pneumonia cu Pneumocystis jirovecii (PJP), cunoscută în trecut drept pneumonia cu Pneumocystis carinii, este una dintre cele mai frecvente infecţii oportuniste la pacienţii infectaţi HIV care nu primesc tratament profilactic, în special la cei la care numărul limfocitelor CD4+ scade sub pragul de 200 celule/µL şi este însoţită de o mortalitate crescută dacă nu se administrează tratament(1,2).
Pneumonia cu P. jirovecii continuă să fie o provocare pentru pacienţii seropozitivi. Introducerea terapiei antiretrovirale şi a profilaxiei a scăzut incidenţa bolii, însă numărul bolnavilor se menţine crescut din cauza ratei înalte de infectare, a diagnosticului dificil şi a eşecului terapeutic, mai ales în ţările în curs de dezvoltare(3).
Epidemiologie
S-a observat că în cadrul infecţiei predomină sexul masculin (81,3%), iar vârsta pacienţilor este cuprinsă în intervalul 20-39 de ani într-un procent de 59,2%, dintre care 48,6% sunt heterosexuali. Nu ştiau de existenţa bolii 62,2%, iar 76,2% dintre pacienţi erau fără tratament. La momentul diagnosticului, 72% dintre pacienţi aveau candidoză orofaringiană severă, cu viremie crescută şi cu CD<200 celule/µL (factori de risc asociaţi cu apariţia PJP), 55,1% pneumonie cu P. jirovecii, iar 13,1% au decedat în decursul internării(4).
În trecut, PJP prezenta o mortalitate extrem de mare, dar în ultimele două decenii ratele mortalităţii au scăzut datorită diagnosticului şi tratamentului precoce. Mortalitatea prin PJP se încadrează între 10% şi 30%, uneori chiar mai mult, în funcţie de populaţia din care provine pacientul, de comorbidităţile acestuia şi, mai ales, de momentul diagnosticului(5).
PJP are un prognostic şi mai nefavorabil la pacienţii fără infecţie HIV, cu rata mortalităţii peste 50%. În general, ratele mortalităţii sunt mult mai înalte când se suprapune şi o patologie pulmonară preexistentă şi la pacienţii care necesită ventilaţie mecanică(6,7).
Datele epidemiologice indică pentru majoritatea populaţiei expunerea şi infecţia tranzitorie în copilărie. Expunerea la P. jirovecii este comună, majoritatea indivizilor prezentând serologie pozitivă pentru antigenele P. jirovecii până la vârsta de 4 ani(8). Totuşi aceste date nu reuşesc să cuprindă întreaga arie de interes, existând zone în care lipsesc laboratoare corespunzător utilate pentru diagnosticul P. jirovecii (Africa Sub-Sahariană, Asia, America de Sud etc.). Aplicându-se metodele de diagnostic molecular pentru cazurile de pneumonie gravă la copiii sub 5 ani dintr-un spital din Mozambic, 7% dintre aceştia au prezentat P. jirovecii ca agent etiologic(9).
Factori de risc pentru PJP
Următoarele grupe de pacienţi prezintă risc pentru PJP:
-
Persoane cu infecţie HIV la care numărul de celule CD4+ scade sub 200/µL şi care nu primesc tratament profilactic.
-
Persoane cu imunodeficienţă primară, inclusiv anumite forme de hipogamaglobulinemie şi imunodeficienţă severă mixtă.
-
Persoane care primesc tratament îndelungat cu imunosupresoare pentru tulburări tisulare asociate, vasculite sau transplant de organe solide.
-
Persoane cu boli maligne hematologice şi nonhematologice, cum ar fi tumori solide şi limfoame.
-
Persoane cu malnutriţie severă(2,10).
Din categoria pacienţilor seronegativi, dar imunocompromişi fac parte cei cu boli autoimune care suferă complicaţii sau care urmează tratamente imunosupresoare, pacienţii post-transplant (înainte de aplicarea pe scara largă a profilaxiei pentru PJP, frecvenţa infecţiei cu P. jirovecii la pacienţii cu transplant pulmonar era de 88%)(11).
Douăzeci la sută din cazurile de P. jirovecii apar la pacienţii cu boli infiltrative, dintre care fac parte: poliarterita nodoasă, granulomatoza cu poliangeită, dermato/polimiozita, afectarea interstiţială la pacienţii cu poliartrită reumatoidă(11).
La risc crescut de a dezvolta o pneumonie cu P. jirovecii sunt şi cei care urmează tratament imunosupresor sau imunomodulator (corticosteroizi, ciclofosfamidă, metotrexat, vincristin, citarabina, fludarabina, rituximab sau ibrutinib)(11).
Diagnostic
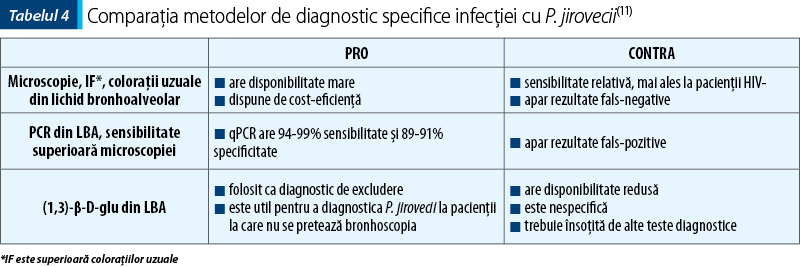
Diagnosticul PJP reprezintă o provocare, având în vedere simptomele nespecifice, coinfecţiile şi imposibilitatea cultivării microorganismului. Identificarea directă prin microscopie a P. jirovecii din probele de spută (specificitate 30-90%), lavaj bronho-alveolar (LBA) (specificitate 90-95%) sau biopsie pulmonară (specificitate 95-100%) reprezintă gold standard-ul pentru diagnostic. Metodele moleculare însă, comparativ cu vizualizarea microscopică directă, s-au impus prin superioritatea sensibilităţii şi specificităţii, prezentând şi avantajul limitării probabilităţii de contaminare. Bronhoscopia este o procedură care, în anumite cazuri, cum ar fi insuficienţa respiratorie deja instalată, poate ridica probleme. S-a demonstrat în cazul unor pacienţi cu rezultate pozitive pentru probele din spută şi negative pentru cele din lichidul de lavaj bronho-alveolar, ambele prin metode moleculare, precum reacţia de polimerizare în lanţ (Polymerase Chain Reaction, PCR), că aceştia erau clinic infectaţi, răspunzând la tratamentul specific PJP. Deşi necesită investigaţii amănunţite, testarea PCR a probelor provenind din sputa pacientului ar putea reprezenta o alternativă pentru testele invazive(12).
Diagnosticul pneumocistozei este multifactorial şi poate include suspiciunea clinică, factorii de risc, testele de laborator, radiografia toracică, tomografia computerizată (CT) a toracelui, examenul microbiologic al sputei, evaluarea lichidului LBA sau biopsie pulmonară. Modificările testelor de laborator pot fi nespecifice(13) pentru PJP şi cea mai notabilă modificare este nivelul seric crescut al lactat-dehidrogenazei (LDH) la pacienţii infectaţi HIV. Indivizii imunocompromişi, fără HIV, pot avea, de asemenea, nivelul seric de LDH ridicat din alte motive, astfel că LDH nu este un instrument diagnostic valoros în această populaţie de pacienţi. Gazometria arterială ar trebui efectuată la pacienţii care sunt hipoxici, cu tahicardie şi semne de detresă respiratorie pentru a evalua severitatea bolii, iar rezultatele vor arăta un gradient ridicat alveolo-arterial de oxigen la stabilirea PJP(13).
Investigaţii
Conform Centrului de Control şi Prevenţie a Bolilor (Centers for Disease Control and Prevention, CDC), aproximativ 50% din populaţia Statelor Unite diagnosticată HIV are vârsta de 50 de ani sau mai mult, această categorie de pacienţi fiind însoţită de prognosticul cel mai nefavorabil, cu numărul limfocitelor CD4+ scăzut la diagnostic, poate chiar <50 cel/µL, boală avansată şi un risc mai mare de infecţii oportuniste definitorii SIDA, precum PJP sau tuberculoza, fapt ce se datorează scăderii imunităţii nu doar din cauza prezenţei HIV, ci şi înaintării în vârstă(14). Anamneza devine esenţială în cadrul acestei grupe de vârstă, infecţia HIV şi infecţiile oportuniste asociate putând fi uşor omise în cadrul diagnosticului diferenţial (poate rămâne în fază latentă timp îndelungat, până spre 15 ani, fără simptome specifice). Medicii nu abordează sau abordează cu dificultate subiectul istoricului sexual al pacienţilor, presupunând că activitatea sexuală se reduce după această vârstă, neconsiderând astfel că ar fi la risc pentru infecţia HIV. Istoricul transfuziilor de sânge poate ridica suspiciunea infecţiei HIV în cadrul orientării diagnosticului, omiterea acestuia putând duce la întârzierea diagnosticului; dacă pacientul s-ar cunoaşte pozitiv pentru infecţia HIV, acesta ar putea evita o eventuală infecţie cu P. jirovecii prin instituirea tratamentului profilactic. Astfel, pacienţii nu vor fi testaţi de rutină pentru infecţia HIV, ceea ce va duce la întârzierea diagnosticului. Pacienţii vor fi diagnosticaţi, în general, într-un stadiu avansat de boală, prezentând un tablou clinic sărac şi o mortalitate ridicată(15).
Tablou clinic
Simptomele PJP sunt nespecifice, mai ales în cazul pacienţilor cu HIV, la care, spre deosebire de populaţia sănătoasă, infecţia survine pe un teren patologic imunodeprimat, pneumonia având o evoluţie subacută şi tinzând să se manifeste mai târziu, adesea după mai multe săptămâni de boală(16).
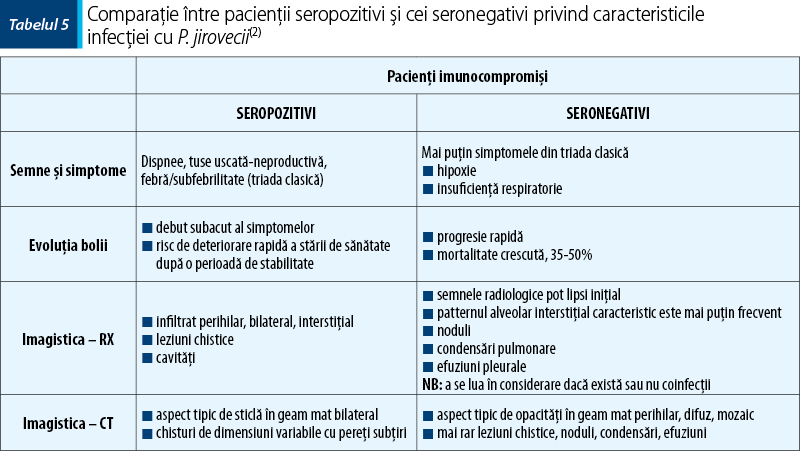
Triada clasică a pneumoniei P. jirovecii cuprinde: dispnee, tuse uscată-neproductivă, febră/subfebrilitate(2).
Alte simptomele ale PJP pot fi: dispnee progresivă în 95% din cazuri, febră în mai mult de 85% din cazuri, tuse neproductivă în 95% din cazuri, frisoane, disconfort în epigastru, scădere ponderală, frisoane, rareori hemoptizie. Examenul fizic obiectiv este nespecific şi include: febră, tahipnee, tahicardie; examenul pulmonar poate fi normal în mai mult de jumătate din cazuri. În cazul copiilor cu boală severă pot apărea cianoză şi retracţie intercostală(16).
Explorări paraclinice
Radiografia toraco-pulmonară este o investigaţie obligatorie pentru toţi pacienţii imunodeprimaţi cu febră sau semne şi simptome de afectare pulmonară(17). Radiografia toracică va detecta infiltrate bilaterale difuze, extinse din zona perihilară la majoritatea pacienţilor cu P. jirovecii. Aceste modificări devin din ce în ce mai omogene în progresia bolii. Alte modificări radiografice pot include noduli multipli sau solitari, care pot progresa spre leziuni cavitare, infiltrate lobare ca leziuni lobare superioare la pacienţii care au o medicaţie specifică antimicrobiană şi pneumotorax în anumite cazuri. Mai puţin frecvente sunt infiltratele asimetrice şi pneumotoraxul(16).
Computer tomografia de înaltă rezoluţie (High-Resolution Computed Tomography, HRCT) este utilă atunci când radiografia toraco-pulmonară nu poate orienta diagnosticul. HRCT prezintă sensibilitate de 95% pentru pneumonia din infecţia cu P. jirovecii, în cazul pacienţilor cu HIV, diagnosticul fiind orientat de aspectul radiologic în „geam mat” care debutează perihilar şi evoluează spre periferie cu arii de accentuare interstiţială în benzi fine şi aspect în „fagure de miere(16).
Imagistica CT reprezintă gold standard-ul pentru diagnostic, iar aspecte precum îngroşări ale septurilor alveolare, condensări pulmonare, noduli, chisturi, pneumotorax pot fi sugestive pentru diagnosticul de PJP(1).
Recent, s-a descoperit că ecografia poate fi o investigaţie utilă în managementul de zi cu zi al pacienţilor seropozitivi, mai ales în centrele cu resurse limitate(1).
În zonele cu resurse materiale limitate, unde cazurile de pacienţi seropozitivi sunt mai frecvente, riscul de P. jirovecii este mai crescut, iar CT-ul şi bronhoscopia sunt în general greu accesibile sau indisponibile. Ecografia pulmonară poate fi o alternativă extrem de utilă, ieftină şi eficientă în diagnosticul acestei afecţiuni(1).
Diagnosticul de laborator
Testarea pentru diagnosticul de PJP necesită examinarea microscopică a sputei şi LBA, aceste probe trebuind obţinute când pacientul este stabil. Diagnosticul cert de PJP nu este întotdeauna posibil. De exemplu, pacienţii cu HIV/SIDA vor avea un număr scăzut de neutrofile şi un număr ridicat de microorganisme prezente în spută şi LBA, făcând diagnosticul mai uşor. În contrast, pacienţii imunodeprimaţi, fără HIV, vor avea culturi mai slab reprezentate în probele de spută şi lichid de lavaj bronhoalveolar, astfel încât diagnosticul va fi mai dificil. Indiferent dacă e doar o suspiciune clinică pentru PJP la un pacient din grupa de risc, medicul trebuie să demareze tratamentul empiric cât mai precoce(2).
Testele serologice şi radiografia toraco-pulmonară nu sunt patognomonice, din cauza imposibilităţii de izolare a germenului. Sputa indusă şi LBA rămân metodele de elecţie prin care se realizează diagnosticul specific de laborator prin identificare citopatologică a P. jirovecii. În situaţii excepţionale, când cele două tehnici menţionate mai sus nu pot fi folosite, se recurge la biopsie transbronşică sau biopsie pulmonară deschisă. Sputa emisă spontan are o sensibilitate foarte scăzută şi nu poate avea valoare diagnostică(16).
Dozarea LDH-ului este indicată în cazul infecţiei cu P. jirovecii la un pacient HIV-pozitiv, fiind de obicei crescută (peste 220 U/L), aceasta corelându-se cu gradul de injurie pulmonară. În PJP, aproximativ 90% dintre pacienţi sunt seropozitivi. Dozarea LDH-ului prezintă o sensibilitate destul de înaltă, 78-100%, dar specificitate relativ scăzută din cauza corelării altor situaţii patologice cu un nivel crescut al LDH. De asemenea, nivelurile serice constant crescute ale LDH-ului în timpul terapiei pot indica rezistenţă la tratament(16).
Deoarece P. jirovecii nu poate fi crescut în cultură, diagnosticul definitiv necesită detectarea şi identificarea organismului prin PCR, coloraţii specifice sau marcarea cu anticorpi fluorescenţi. PCR-ul cantitativ (quantitative PCR, qPRC ) este o metodă alternativă cu specificitate şi sensibilitate foarte crescute prin care se poate diferenţia dacă un pacient este doar purtător sau prezintă infecţie activă, dar, din păcate, nu este valabilă încă pentru utilizarea de rutină în clinică(18).
b-D-Glucanul (BDG) reprezintă un element prezent constant în peretele celular la o mare parte din fungi şi reprezintă un test sensibil pentru detectarea pneumoniei cu P. jirovecii(19).
Identificare citologică
Coloraţiile Giemsa, Diff-Quick şi Wright pot detecta atât forma cistică, cât şi pe cea trofică, dar nu pot colora peretele cistic, acesta din urmă putând fi evidenţiat prin coloraţiile Grocott-Gomori, metenamin-argint, Gram-Weigert, violet cresyl şi albastru de toluidină.
Diagnosticul PJP ar trebui să ia în considerare testarea HIV şi alte evaluări serologice ale limfocitelor şi anticorpilor(16).
Alte teste noninvazive
Testele pulmonare funcţionale efectuate la pacienţii suspecţi pentru infecţie cu P. jirovecii pot reflecta o capacitate de difuziune scăzută a monoxidului de carbon (Diffusing Capacity for Carbon Monoxide (CO), DLCO) de mai puţin de 75%, DLCO având o sensibilitate de 89-100%, dar specificitatea este scăzută, 53%. Pulsoximetria, un test care ar trebui să fie obligatoriu pentru toţi pacienţii, atât în repaus, cât şi la efort, saturaţia oxigenului sub 90% impunând efectuarea gazelor sangvine arteriale, pentru a evalua necesitatea administrării corticosteroizilor(16).
Diagnostic diferenţial
Diagnosticul diferenţial se face cu sindromul de detresă respiratorie, infecţia cu citomegalovirus, infecţiile cu Mycoplasma spp., Legionella spp., pneumonia virală, tuberculoza şi tromboembolismul pulmonar(16).
O situaţie specială o reprezintă concomitenţa PJP şi a emboliei pulmonare care prezintă examen pulmonar anormal şi simptome similare precum tusea, dispneea, tahicardia, hipoxemia, punând în dificultate stabilirea diagnosticului. În cadrul unui grup de pacienţi cu HIV şi boală tromboembolică, 50% din aceştia au prezentat embolie pulmonară(20). De asemenea, coexistenţa celor două patologii în cazul unui pacient nou diagnosticat cu HIV propune o nouă direcţie de cercetare – PJP ca factor de risc independent în cadrul complicaţiilor tromboembolice(21).
Tratamentul/managementul pacientului
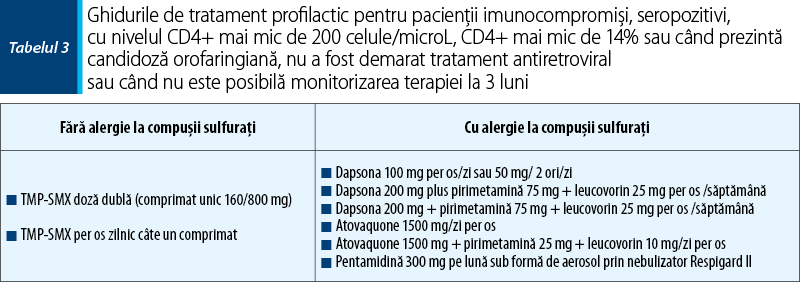
Tratamentul pentru PJP nu poate fi amânat pentru măsurile diagnostice în aşteptare. Tratamentul trebuie iniţiat la pacienţii cu factorii de risc cunoscuţi şi când există suspiciune clinică pentru infecţie. Majoritatea studiilor pentru tratamentul PJP au fost efectuate pe loturi de pacienţi seropozitivi comparativ cu cei seronegativi (tabelul 1). Tratamentul cazurilor uşoare poate fi efectuat pe cale orală în ambulatoriu, cu excepţia celor care nu pot tolera terapia pe cale orală, de gravitate moderată sau severă care necesită corticosterioizi, când pacientul necesită administrarea intravenoasă a medicaţiei(6,22,13).

La pacienţii cu alergii severe pentru TMP-SMX (tabelul 2), desensibilizarea nu este recomandată şi trebuie aleasă o altă schemă de tratament. Primaquine poate fi administrat numai pe cale orală, iar la cei care nu pot tolera medicaţia orală ar trebui substituit cu Pentamidine intravenos, dar trebuie folosit cu atenţie, din cauza toxicităţii crescute şi a efectelor adverse mai numeroase comparativ cu Primaquine.

O atenţie deosebită trebuie acordată pacienţilor cu deficienţă de glucozo-6-fosfat dehidrogenază (G6PD) dat fiind faptul că cei care folosesc în schema lor de tratament Dapson şi Primaquine au un risc crescut de a dezvolta anemie hemolitică. Recomandările actuale sugerează adăugarea glucocorticoizilor la schema de tratament la pacienţii seropozitivi cu boală moderat-severă, asociind o mai bună stare clinică şi scăderea mortalităţii. Pacienţii seropozitivi cu presiunea oxigenului mai mică de 70 mmHg la gazometria arterială şi la care gradientul alveolo-arterial este mai mare sau egal cu 35 mmHg sau care au hipoxie folosind pulsoximetrul trebuie să primească corticosteroizi. Corticosteroizii de asemenea pot fi recomandaţi pacienţilor seropozitivi cu PJP din cauza potenţialului letal şi a formei clinice fulminante a patologiei, însă sunt prea puţine studii despre beneficiile sau scăderea mortalităţii intraspitaliceşti.
Tratamentul cu prednison trebuie început cât mai rapid sau în primele 72 ore de la începerea tratamentului pentru PJP după cum urmează: 40 mg pe cale orală de 2 ori/zi în zilele 1-5, 40 mg o dată pe zi în zilele 6-10 şi 20 mg oral/zi în zilele 11-21. Metilprednison administrat i.v. poate fi redus la 75% din doza de prednison dacă terapia orală nu poate fi tolerată. Pacienţii seropozitivi care nu au iniţiat încă terapia antiretrovirală ar trebui să îl înceapă în primele două săptămâni ale tratamentului anti-PJP sau când pacientul este suficient de stabil pentru a începe tratamentul. În zilele 3-4, pacienţii, de obicei, vor prezenta o uşoară înrăutăţire a stării generale şi a tabloului clinic ca urmare a răspunsului inflamator al gazdei la distrugerea microorganismelor, cu o ulterioară îmbunătăţire(23).
Prognosticul tratamentului depinde de mai mulţi factori, inclusiv gradul de hipoxie la prezentare, vârstă, PJP în antecedente, nivelul crescut de LDH, numărul scăzut de CD4+, cât şi de prezenţa altor infecţii oportuniste, precum infecţia cu CMV. Prezenţa oricărui factor mai sus menţionat creşte rata de mortalitate sau a unui prognostic rezervat. Forma uşor-moderată a bolii are o rată globală de mortalitate de 65%. Pacienţii cu boală severă sau insuficienţă respiratorie care necesită ventilaţie mecanică şi internare în terapie intensivă au o rată de mortalitate de 84%(23).
Pacienţii trebuie monitorizaţi pentru efectele adverse şi semnele de ineficienţă a medicaţiei antimicrobiene. Monitorizarea trebuie să includă semnele vitale (cel mai important ar fi saturaţia cu oxigen), teste de laborator ca hemoleucogramă, enzimele hepatice, funcţia renală, glucoza şi electroliţii. Tratamentul este considerat eşuat dacă pacientul nu prezintă îmbunătăţire a semnelor clinice după 4-8 zile. Nu există studii despre eficienţa ghidurilor pentru managementul tratamentului eşuat, dar majoritatea studiilor consideră ca combinaţia Primaquină plus Clindamicină ca fiind terapia de salvare a acestor cazuri. Este important, de asemenea, să căutăm infecţiile concurente care cauzează boli pe lângă PJP şi să le tratăm corespunzător(24).
Complicaţii/Manifestări atipice
Manifestările atipice în PJP cuprind leziuni pulmonare chistice 10-34%, leziuni nodulare 3-5%, noduli limfatici cu dimensiuni mari 18% sau formaţiuni mass-like (observate la pacienţii seropozitivi, dar şi la cei seronegativi) miliare, manifestări extrapulmonare 2-3%(25).
Manifestările extrapulmonare sunt rareori cauzate de infecţia cu P. jirovecii. Ele pot apărea chiar în absenţa implicării pulmonare. Acestea pot fi întâlnite în cazul pacienţilor care primesc aerosoli cu pentamidină în scop profilactic sau în cazul pacienţilor infectaţi HIV care nu primesc tratament profilactic. Infecţia cu P. jirovecii poate afecta mai multe organe, după cum urmează: sistemul nervos central, măduva osoasă, având ca rezultat pancitopenia consecutivă necrozei, ganglionii limfatici cu limfadenopatie, ochiul, tiroida cu hipertrofia masivă şi accelerată a glandei sau tractul gastrointestinal(25).
O explicaţie pentru apariţia maselor ar fi că acestea sunt cauzate de glicoproteinele de pe învelişul extern al microorganismului şi de absenţa anticorpilor de tip IgA(25).
S-a mai observat că apariţia nodulilor sau formaţiunilor mass-like este asociată cu pacienţii a căror imunitate a fost crescută ulterior prin tratament antiretroviral sau care au încetat administrarea corticosteroizilor(25).
Apariţia nodulilor şi a formaţiunilor mass-like pune în dificultate şi diagnosticul afecţiunii, deoarece nu se pot detecta microorganismele în LBA sau în spută din cauza prezenţei acestora în granulomul format, şi nu în alveole. Mai mult, este greu de făcut diagnosticul diferenţial cu limfomul sau infecţia cu Aspergillus spp., Cryptococcus spp. sau Nocardia spp.(25)
Nivelul mortalităţii cauzate de P. jirovecii la pacienţii imunocompromişi, seronegativi, nu a suferit modificări de-a lungul timpului. O îmbunătăţire semnificativă s-a înregistrat doar la pacienţii seropozitivi, probabil datorită profilaxiei, şi este dată de progresia rapidă a bolii şi de diagnosticarea dificilă(25).
Vaccin împotriva Pneumocystis jirovecii – noi direcţii
În prezent nu există un vaccin pentru P. jirovecii; există o serie de studii în stadiul preclinic. Incapacitatea cultivării microorganismului face dificilă studierea amănunţită a geneticii P. jirovecii. Fiind vorba despre un germen oportunist, vaccinul anti P. jirovecii trebuie să ofere protecţie unei gazde cu status imun supresat, cum este şi cazul infecţiei HIV/SIDA. Unele studii pe şoareci de laborator au utilizat anticorpi specifici tocmai pentru a scădea numărul de limfocitele T CD4+ şi a induce o stare de imunosupresie(26,27).
În 2016, un studiu realizat pe maimuţe coinfectate HIV – P. jirovecii a ridicat ipoteza unei posibile strategii de vaccinare împotriva P. jirovecii având la bază memoria imunologică. Rezultatele au demonstrat un titru înalt al anticorpilor şi o protecţie de aproximativ 36 de săptămâni împotriva PJP după inducerea stării de imunosupresie şi expunerea la P. jirovecii(28).
Concluzii
Terapia şi profilaxia P. jirovecii au determinat scăderea incidenţei PJP, dar se fac progrese pentru descoperirea unui vaccin. Ecografia pulmonară poate fi o metodă utilă şi cost-eficientă pentru diagnosticul infecţiei cu P. jirovecii. Rata mortalităţii a scăzut în cazul pacienţilor seropozitivi, fiind de 10-30% în cazul acestora, dar s-a menţinut la valori crescute în cazul pacienţilor seronegativi. Este utilă introducerea profilaxiei în cazul pacienţilor seronegativi care prezintă factori de risc pentru infecţia cu P. jirovecii.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Cooper AS, Norris H, Lander-Roe J, Alleyne G. Successful Prevention of Perinatal HIV Transmission Utilizing Direct Observation Therapy in the Setting of Acquired Immunodeficiency Syndrome (AIDS) and Progressive Multifocal Leukoencephalopathy. ID Cases. 2018; e00454.
- Giordani MT, Tamarozzi F, Kaminstein D, Brunetti E, Heller T. Point of care lung ultrasound for diagnosis of Pneumocystis jirovecii pneumonia: notes from the field. Crit Ultrasound J. 2018; 10:8.
- Lowe DM, Rangaka MX, Gordon F, James CD, Miller RF. Pneumocystis jirovecii Pneumonia in Tropical and Low and Middle Income Countries: A Systematic Review and Meta-Regression. PLoS One. 2013;8(8):e69969.
- Grilo V, Pereira A. Pneumocystis Pneumonia in 107 HIV Infected Patients Admitted to the Department of Infectious Diseases at Santa Maria Hospital, Lisbon (2002-2013) Pneumonia por Pneumocystis em 107 Doentes com Infecçao por VIH Internados no Serviço de Doenças Infeccio. Acta Medica Portuguesa. 2016; 29(10):639-650.
- Thomas Jr CFT, Limper AH. Current insights into the biology and pathogenesis of Pneumocystis pneumonia. Nature. 2007;5:298-308.
- Newberry L, O’Hare B, Kennedy N, et al. Early use of corticosteroids in infants with a clinical diagnosis of Pneumocystis jiroveci pneumonia in Malawi: a double-blind, randomised clinical trial. Paediatr Int Child Health. 2017; 37(2):121-128.
- Williams KM, Ahn KW, Chen M, et al. The incidence, mortality and timing of Pneumocystis jiroveci pneumonia after hematopoietic cell transplantation: A CIBMTR analysis. Bone Marrow Transplant. 2016; 51(4):573-580.
- Respaldiza N, Medrano FJ, Varela JM, et al. High seroprevalence of Pneumocystis infection in Spanish children. Clin. Microbiol. Infect. 2004; 10:1029-1031.
- Lanaspa M, Callaghan-Gordo CO, Machevo S, et al. High prevalence of Pneumocystis jirovecii pneumonia among Mozambican children <5 years of age admitted to hospital with clinical severe pneumonia. Clin Microbiol Infect. 2015; 21:1018.e9-1018.e15.
- Limper AH. In search of clinical factors that predict risk for Pneumocystis jirovecii pneumonia in patients without HIV/AIDS. Am J Respir Crit Care Med. 2018 Aug 10.
- Salzer HJF. Clinical, Diagnostic, and Treatment Disparities between HIV-Infected and Non-HIV-Infected Immunocompromised Patients with Pneumocystis jirovecii Pneumonia. Respiration. 2018; 96(1):1-14
- Pennington K, Wilson J, Limper AH, Escalante P. Positive Pneumocystis jirovecii Sputum PCR Results with Negative Bronchoscopic PCR Results in Suspected Pneumocystis Pneumonia. Canadian Respiratory Journal. 2018; 2018:5.
- Park JW, Curtis JR, Moon J, Song YW, Kim S, Lee EB. Prophylactic effect of trimethoprim-sulfamethoxazole for pneumocystis pneumonia in patients with rheumatic diseases exposed to prolonged high-dose glucocorticoids. Annals of the Rheumatic Diseases 2018;77:644-649.
- Metcalfe R, Schofield J, Milosevic C. HIV diagnosis in older adults. Int J STD AIDS. 2017; 28(10):1028-1033.
- Arshad V, Saleem HA, Irfan M, et al. Case of undiagnosed pneumocystis pneumonia. BMJ Case Reports. 2017; 2017:bcr-2017-221871.
- Nicholas JB, Pranatharthi HC. Pneumocystis jiroveci Pneumonia (PJP) Overview of Pneumocystis jiroveci Pneumonia. Medscape. [Internet] Available from: https://emedicine.medscape.com/article/225976-overview
- DeLorenzo LJ, Huang CT, Maguire GP, Stone DJ. Roentgenographic patterns of Pneumocystis carinii pneumonia in 104 patients with AIDS. Chest. 1987; 91(3):323-327.
- Botterel F, Cabaret O, Foulet F, Cordonnier C, Costa JM, Bretagne S. Clinical significance of quantifying Pneumocystis jirovecii DNA by using real-time PCR in bronchoalveolar lavage fluid from immunocompromised patients. J Clin Microbiol. 2012; 50(2):227-231.
- Onishi A, Sugiyama D, Kogata Y, et al. Diagnostic accuracy of serum 1,3-β-D-glucan for Pneumocystis jiroveci pneumonia, invasive candidiasis, and invasive aspergillosis: Systematic review and meta-analysis. J Clin Microbiol. 2012; 50(1):7-15.
- Restrepo CS, Diethelm L, Lemos JA, Velasquez E, Ovella TA, Martinez S, Carrillo J, Lemos DF. Cardiovascular Complications of Human Immunodeficiency. Radio Graph. 2006; 26(1):213-232.
- Olanipekun T, Effoe VS, Medhane KA, Fransua M. Pneumocystis pneumonia and acute pulmonary embolism in Human Immunodeficiency Virus/Acquired Immunodeficiency Syndrome. A rare co-occurrence. Infectious Disease in Clinical Practice. 2018; 26(5):2017-2019.
- Singh R, Bemelman FJ, Hodiamont CJ, Idu MM, Ten Berge IJM, Geerlings SE. The impact of trimethoprim-sulfamethoxazole as Pneumocystis jiroveci pneumonia prophylaxis on the occurrence of asymptomatic bacteriuria and urinary tract infections among renal allograft recipients: A retrospective before-after study. BMC Infect Dis. 2016; 16(1):1-10.
- Likurgos K, Spyros AP, Demosthenes B. Pneumocystis jirovecii pneumonia prophylaxis in non-HIV pulmonary patients on chronic corticosteroid therapy: Make a virtue of necessity? Pneumon. 2015; 28(1):28-30.
- Jain SB, Wig N, Nagpal SJS, et al. Evaluation of the current management protocols for prophylaxis against Pneumocystis jiroveci pneumonia and other opportunistic infections in patients living with HIV/AIDS. AIDS Care – Psychol Socio-Medical Asp AIDS/HIV. 2011; 23(7):846-850.
- Kim B, Kim J, Paik SS, Pai H. Atypical Presentation of Pneumocystis jirovecii Infection in HIV Infected Patients: Three Different Manifestations. J Korean Med Sci. 2018; 33(15):1-6.
- Tesini BL, Wright TW, Malone JE, et al. Immunization with Pneumocystis Cross-Reactive Antigen 1 (Pca1) Protects Mice against Pneumocystis Pneumonia and Generates Antibody to Pneumocystis jirovecii. Infect Immun. 2017; 85(4).
- Garvy BA. Overcoming hurdles to development of a vaccine against Pneumocystis jirovecii. Infect Immun. 2017; 85(4):e00035-17.
- Ayala-Nunez NV, Hoornweg TE, van de Pol DPII, et al. Vaccine-induced Immunogenicity and Protection against Pneumocystis pneumonia in Nonhuman Primate Model of HIV-Pneumocystis Co-Infection. J Inf Dis. 2016; 213(10):1586–1595.
Articole din ediţiile anterioare
Interacţiuni în coinfecţia HIV și Mycobacterium tuberculosis
Coinfecția cu Mycobacterium tuberculosis este o importantă cauză de mortalitate la pacienții infectați cu HIV-1. Infecția virală reprezintă cel mai...
Siguranţa și răspunsul imun obţinut după administrarea vaccinului anti‑HIV 1 la voluntari sănătoşiț
Datorită situaţiei epidemiologice actuale, un deziderat important rămâne realizarea unui vaccin eficient și sigur. În studiile clinice s-a utilizat...
Importanţa testării în infecţia cu HIV
Cu toate că, la nivel mondial, au fost implementate măsuri de prevenție, numărul cazurilor de infecție cu HIV rămâne crescut.
Factori legaţi de stigmatizarea percepută de persoanele infectate cu HIV
Emergența epidemiei HIV/SIDA în 1980, cu afectarea în special a anumitor grupuri populaționale – precum homosexualii, utilizatorii de droguri injec...