The rate of death in a curable disease, when diagnosed early, has prompted specialists to try to improve diagnosis, improve treatment, understand pathogenic mechanisms or genetic determinations, hoping to improve survival and quality of life for patients. All these involve a complex team consisting of family doctor, gastroenterologist, anatomo-pathologist radiologist, surgeon, oncologist, radiotherapist, and palliative care specialist. The presence of a family physician in this team involves primary prevention, early diagnosis, patient follow-up at all stages of treatment, as well as palliative care.
Cancerul gastric - abordare diagnostică şi terapeutică în echipă. Rolul medicului de familie
Gastric cancer - diagnostic and therapeutic team approach. The role of family physician
First published: 25 octombrie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/MED.119.5.2017.1151
Abstract
Rezumat
Rata de deces ridicată într-o boală curabilă, atunci când diagnosticul este pus precoce, a determinat specialiștii să încerce ameliorarea diagnosticului, îmbunătățirea tratamentului, înțelegerea mecanismelor patogenice sau determinarea genetică, în speranța îmbunătățirii supraviețuirii și calității vieții pacienților. Tot acest demers presupune o echipă complexă, formată din medicul de familie, gastroenterolog, anatomopatolog, imagist, chirurg, oncolog, radioterapeut și specialist în îngrijiri paliative. Prezența medicului de familie în echipă presupune prevenție primară, diagnostic precoce, urmărirea pacientului în toate etapele tratamentului, precum și în paliație.
Introducere
Deși cu o incidență în scădere la nivel global, cancerul gastric rămâne încă una dintre cele mai frecvente cauze de deces prin cancer. Diagnosticat în stadii timpurii, este curabil, dar, din păcate, cele mai multe cazuri sunt identificate tardiv, în stadii avansate. Conform Societății Europene de Oncologie Medicală, au fost raportate, în 2012, aproximativ 1 milion de cazuri noi şi circa 700000 de decese. Dintre acestea, în jur de 140000 de cazuri au fost în Europa, cu aproximativ 104000 de decese.Incidența cea mai crescută este în decada a 7-a de viață, iar boala este de două ori mai frecventă la bărbați decât la femei. Rata cea mai mare este în Asia, America de Sud şi Europa de Est, iar cea mai scăzută, în vestul Europei şi SUA.
Factorii de risc sunt:
- alimentația - prepararea prin sărare şi afumare (nitrați convertiți în nitriți carcinogeni);
- infecția cu Helicobacter pylori (HP);
- gastritele atrofice;
- gastrectomia parțială;
- boala Menetrier;
- anemia pernicioasă (risc în curs de evaluare prin noi cercetări);
- predispoziţia genetică, prin mutaţia unei gene - CDH1, care codifică o proteină de adeziune celulară numită E-caderină (autozomal-dominantă);
- consumul de alcool, asociat cu o creștere semnificativă a riscului de cancere digestive în general;
- fumatul;
- expunerea prelungită la antagoniști de receptori histaminici H2 (rol neconcludent, în curs de evaluare).
Patogenie
Cascada sugerată de P. Correea este propusă ca explicaţie patogenică: după dezvoltarea unei gastrite cronice - inițiată și promovată de infecția cu HP, apar atrofia, metaplazia intestinală, displazia și apoi cancerul. Leziunea inițială este reprezentată de displazia epitelială severă.Aproximativ 85-90% din cancerele gastrice sunt adenocarcinoame, restul fiind limfoame (MALT - din țesutul limfatic) și o mică proporţie (1-3%) leiomiosarcoame (GIST - tumori stromale, din țesutul conjunctiv al peretelui gastric) şi tumori carcinoide (neuroendocrine). La 10% din cazuri s-a observat o agregare familială (cancer gastric difuz ereditar, adenocarcinom gastric, polipoză gastrică proximală, cancer colorectal ereditar non-polipozic, polipoză adenomatoasă familială şi sindrom Peutz-Jeghers), iar la 1-3% din cazuri s-a observat o predispoziție genetică.
Clasificarea histologică Lauren împarte adenocarcinoamele în difuze (nediferențiate) şi intestinale (bine diferențiate). Cancerul difuz apare mai frecvent la pacienții tineri, se dezvoltă în întreg stomacul, determinând pierderea distensibilităţii peretelui gastric, şi au prognostic mai nefavorabil.
Din punct de vedere macroscopic, există două tipuri de tumori:
- superficiale - limitate la mucoasă şi submucoasă, în care apare modificarea culorii şi texturii mucoasei pe o zonă mică, iar leziunile pot fi: reliefate, plate sau erozive. În acest stadiu, după excizia chirurgicală, supraviețuirea este foarte mare, de aproximativ 95%;
- infiltrante - care seamănă la debut cu ulcerele, cu pierdere de substanță profundă și care pot avea aspect vegetant, ulcerat sau de linită plastică.
- prin creștere progresivă în volum și invazia cardiei (cu apariția disfagiei) și a pilorului (cu producerea stenozelor);
- prin invazie în profunzime și apoi a organelor învecinate - pancreas, ficat, colon, peritoneu;
- pe cale limfatică, spre ganglionii stomacului, ganglionul Troisier, supraclavicular stâng, Wirchow şi ganglionul periombilical (Sister Mary Joseph);
- pe cale sangvină, când se produc metastaze hepatice, pulmonare, suprarenale, cerebrale;
- pe cale peritoneală, când se produce carcinomatoză cu ascită şi invazie ovariană (tumora Krukenberg).
Diagnostic pozitiv
Sunt importante recunoașterea semnelor de alarmă pentru patologia gastrică şi trimiterea rapidă pentru endoscopie a pacientului cu aceste semne, având ca factori de risc asociaţi vârsta peste 50 de ani sau antecedente familiale de cancer gastrointestinal.1. semne digestive:
- epigastralgii, disfagie, odinofagie, balonare, eructații, vărsături, saţietate precoce, plenitudine postprandială, sângerări digestive.
- anorexie, inapetență, scădere în greutate, anemie, icter, limfadenopatie.
- flebite superficiale sau profunde, keratoză seboreică, acantosis nigricans (rară, dar specifică cancerului gastric).
Diagnosticul se pune endoscopic, pe baza vizualizării masei tumorale şi prin confirmarea histologică a cel puțin şase biopsii din tumoră și din țesuturile adiacente.
Ecoendoscopia se folosește pentru stadializarea T a tumorilor.
Imunohistochimia şi/sau testul FISH pentru HER-2 pot ajuta la alegerea tratamentului ţintit - transtuzumab, adăugat chimioterapiei.
- Rezultatul: 0 sau 1+ semnifică tumoră HER-2 negativă;
- 2+ înseamnă status incert şi recomandare de test FISH pentru precizarea statusului;
- 3+ reprezintă status pozitiv, iar pacientul va primi tratament cu transtuzumab.
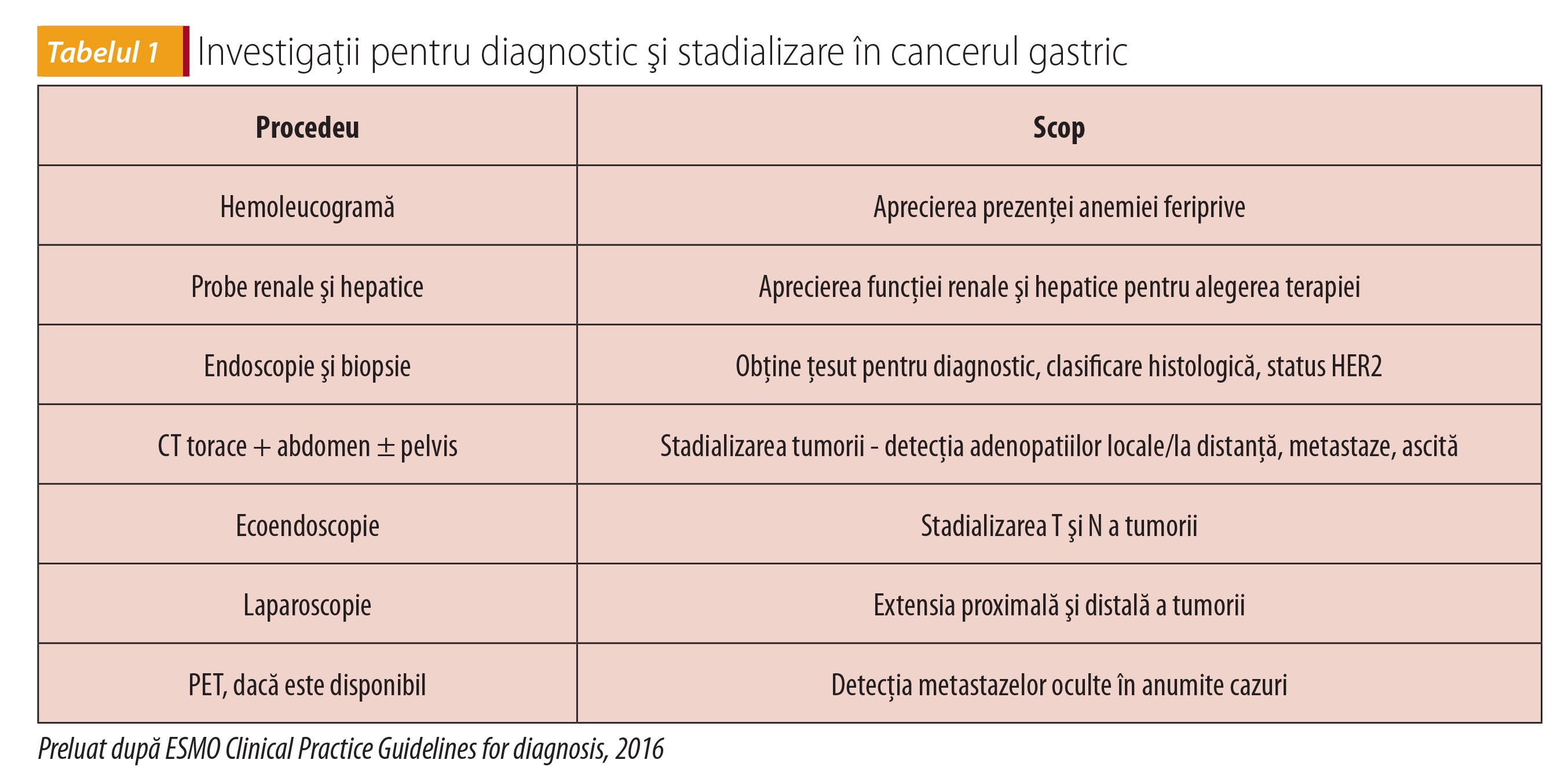
Bilanţul extensiei tumorii decide tipul de tratament şi presupune evaluare prin: examen cu bariu cu dublu contrast (din ce în ce mai rar folosit), tomografie toracică şi abdomino-pelviană, MRI, PET scan, eventual laparoscopie şi bilanț biochimic (HLG, sânge ocult în fecale, funcție hepatică, renală, coagulogramă etc.).
În ceea ce priveşte markerii tumorali, antigenul carcino-embrionar (ACE) este crescut în 40-50% din cazuri (util în urmărirea pacienţilor, nu însă şi în screening), iar alfa-fetoproteina (AFP) şi CA19.9 sunt crescute la aproximativ 30% dintre pacienţii cu cancer gastric.
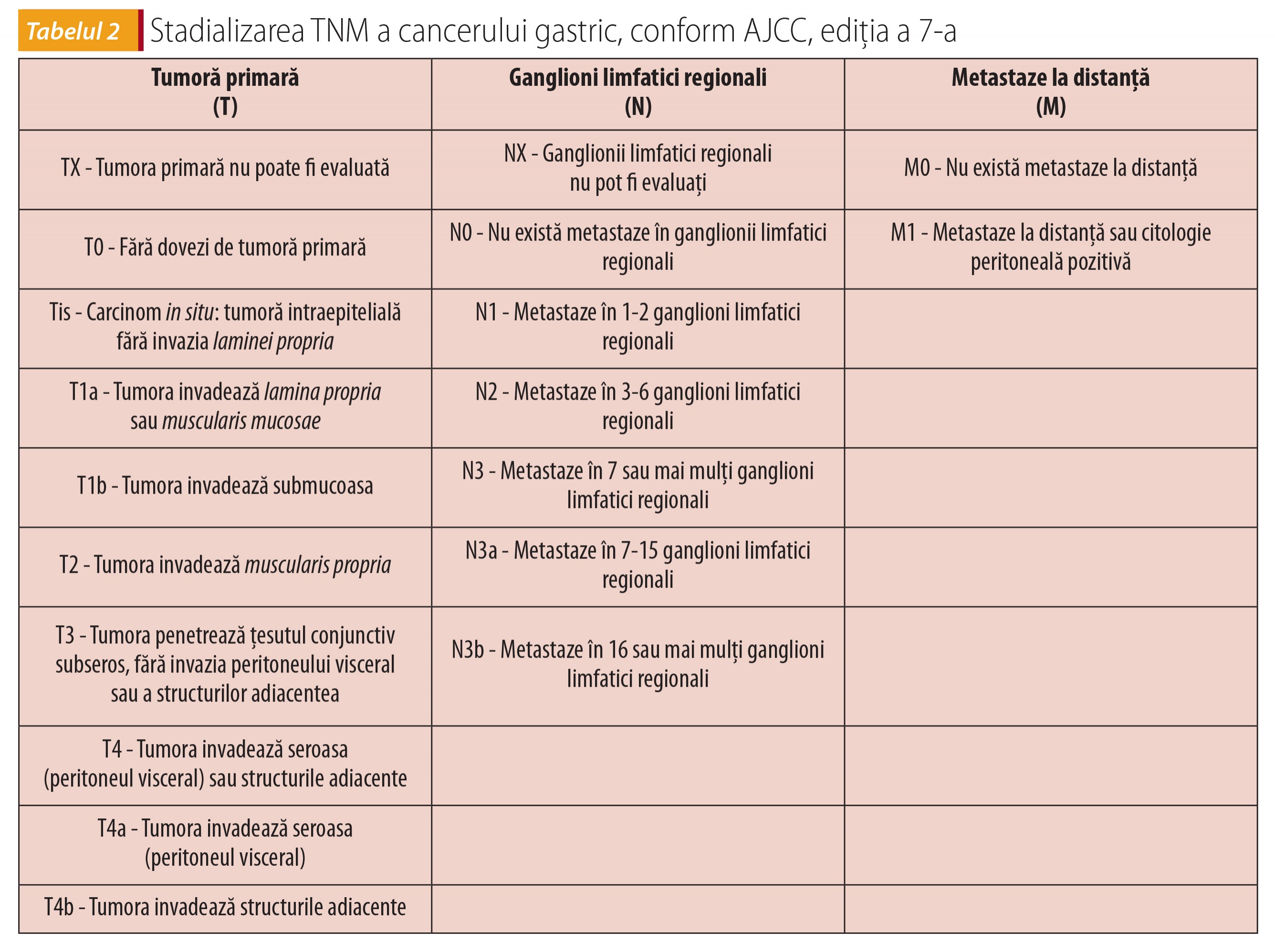
Tratamentul este curativ sau paliativ şi se decide în funcție de stadializarea corectă (tabelul 2) şi de evaluarea preoperatorie completă (vârsta biologică, comorbidități, funcție cardiovasculară, pulmonară). Decizia trebuie să aparțină echipei alcătuite din gastroenterolog, chirurg, anatomopatolog, oncolog şi radioterapeut, care împreună cu pacientul informat hotărăsc strategia terapeutică.
Tratamentul curativ presupune îndepărtarea tumorii și a ganglionilor limfatici adiacenți și se face prin gastrectomie subtotală când tumora este în jumătatea inferioară a stomacului și gastrectomie totală, urmată de anastomoză eso-jejunală, în alte localizări. Tipul de intervenție se decide în funcție de tipul tumorii, extensia ei și comorbidități. Toți pacienții cu stadiul IA (T1N0M0) au recomandare de rezecție chirurgicală sau endoscopică, iar cei cu stadiile II-III, de intervenție chirurgicală, după chimioterapie în perioada preoperatorie.
Tratamentul paliativ este chirurgical și medical. În caz de stenoză antrală sau pilorică se poate face gastrectomie parțială pentru reducerea volumului tumoral.
Chimioterapia se face cu combinaţii de diverse chimioterapice, conform ghidurilor în vigoare (cisplatin-epirubicin, cisplatin-docetaxel, PEV cu 5-fluorouracil sau irinotecan, platinum şi fluoropyrimidine, capecitabină etc.), cu răspuns parțial, trecător și remisiuni complete rare.
Efectele adverse ale chimioterapiei sunt fatigabilitate, greață, vărsături, neuropatie și febră (uneori, unica manifestare a sepsisului neutropenic, care trebuie recunoscut la nivelul asistenței primare). Combinată perioperator cu radioterapia, chimioterapia reduce rata recurenței și prelungește supraviețuirea.
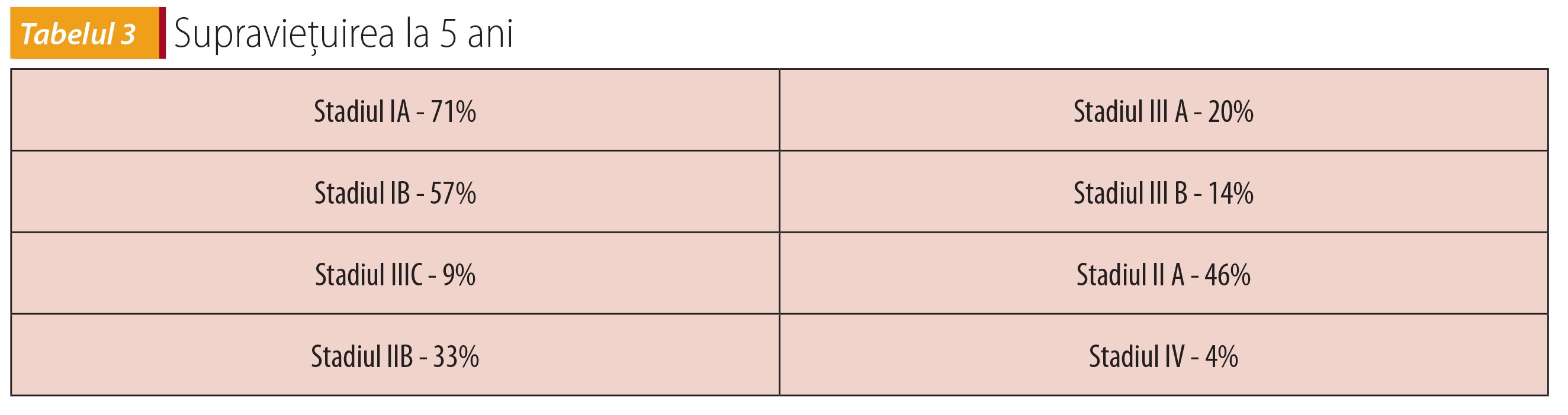
Supraviețuirea la 5 ani a crescut gradual în ultimii 30 de ani, conform datelor publicate de National Cancer Institute în 2010, în Staging Manual-AJCC, prezentate în tabelul 3.
Monitorizare postterapeutică
Nu există dovezi care să arate că monitorizarea intensivă conduce la ameliorarea prognosticului. În majoritatea cazurilor se recomandă ca reevaluarea să se realizeze în caz de simptomatologie sugestivă. În aceste situaţii ar trebui să se efectueze anamneză, examinare fizică şi analize sangvine, eventual imagistică.
Îngrijiri paliative în formele avansate de boală
Controlul durerii şi înlăturarea simptomelor reprezintă responsabilitatea echipei de îngrijiri medicale, o parte importantă din paliație revenindu-i medicului de familie care, ținând cont de perspectivele biologice ale pacientului, de factorii sociali și personali, poate decide tratamentul potrivit.Pacientul cu cancer avansat poate avea numeroase simptome digestive: halitoză - datorată stazei gastrice, xerostomie, stomatită, anorexie și sațietate rapidă (post-gastrectomie), disfagie, dispepsie cu tulburări de motilitate, stază gastrică, greață, vomă, obstrucție intestinală, constipație, ascită. La acestea se pot adăuga alte simptome produse de cancer în sine, de tratament sau comorbidități.
Terapia durerii poate fi inițiată de oncolog și continuată de medicul de familie sau inițiată direct de către medicul de familie. Durerea este produsă de cancer, de chimioterapie sau de bolile concomitente. Controlul durerii se poate face prin mijloace nemedicamentoase şi prin tratament medicamentos, folosind scala OMS de control al durerii sau tratamentul individualizat. Utilizând abordarea multidisciplinară adecvată, putem obține înlăturarea sau scăderea intensității simptomelor. Colaborarea cu echipa de îngrijiri paliative - acolo unde există - este în beneficiul pacientului, care are nevoie de supraveghere. Medicația necesară se poate obține de la oncolog și de la echipa de îngrijire primară.
Prevenţia în cancerul gastric
European Helicobacter Study Group (EHSG), în Maastricht IV, susține atitudinea societăților științifice asiatice în prevenție, prin următoarele afirmații:- Infecția cu Helicobacter pylori reprezintă cel mai important factor de risc pentru cancerul gastric. Eliminarea ei este cea mai bună strategie de scădere a incidenței cancerului gastric (dovadă nivel: 1a).
- Riscul de cancer gastric poate fi redus când tratamentul de eradicare se face înaintea apariției leziunilor preneoplazice (dovadă nivel: 1a).
- Eradicarea Helicobacter pylori pentru prevenţia cancerului gastric trebuie considerată la populațiile cu risc crescut (dovadă nivel: 1c).
Numeroase studii sugerează că eradicarea HP este eficace în prevenirea și scăderea riscului de cancer gastric, atunci când se face înainte de apariția leziunilor premaligne. După apariția displaziei, eradicarea nu mai are rol în prevenire.
Renunțarea la fumat, alcool și o alimentație sănătoasă, cu multe fructe și legume, în defavoarea alimentelor conservate, sărate și afumate, reprezintă o parte importantă a prevenției.
Strategii de viitor
Îmbunătățirea ratei de diagnostic endoscopic se face prin tehnici noi de cromoendoscopie (cu spray colorat), endoscopie cu magnificaţie, tehnica de narrow band imaging sau de autofluorescenţă.
Ameliorarea tratamentului vizează tehnicile chirurgicale aplicate, iar din cauza răspunsului slab la chimioterapie se caută profilul farmacogenetic pentru selectarea tratamentului individualizat optim.
Screeningul nu este fezabil decât în regiunile cu incidenţă crescută. Specialiştii evaluează un Gastro Panel serologic pentru pepsinogen I şi II, gastrina-17 și anticorpi anti-HP prin care să identifice și să urmărească pacienții la risc să dezvolte cancer gastric.
Rolul medicului de familie
- identificarea pacienților cu risc crescut;
- testarea și tratamentul infecției cu HP;
- diagnostic precoce prin trimiterea la endoscopie în prezența semnelor de alarmă și a factorilor de risc asociați;
- reevaluarea tratamentului cronic cu IPP, în absența endoscopiei;
- orientarea pacientului cu simptome tipice și diagnostic endoscopic de cancer gastric către echipa oncolog-chirurg;
- recunoașterea și tratarea efectelor adverse ale chimioterapiei, în colaborare cu oncologul;
- participarea la îngrijirile paliative.
- Cancerele gastrice nu au o simptomatologie particulară, de unde și întârzierea în diagnostic.
- Diagnosticul se pune prin endoscopie și biopsie.
- Prognosticul depinde de extensia tumorii.
- Doar chirurgia are valențe terapeutice.
- Rata de supraviețuire la 5 ani este de 10-15% pentru majoritatea cazurilor și în jur de 36% pentru cei operați.
Bibliografie
2. D. Longo, A. Fauci. Harrison Gastroenterologie şi Hepatologie, ediţia a doua - Adenocarcinomul gastric, pp. 520-523.
3. Sri. G. Thrumurthy. Diagnosticul şi managementul cancerului gastric, BMJ2013;347:f6367doi:10.1136/bmj.f6367.
4. Marta Correia, José Carlos Machado, and Ari Ristima. Basic Aspects of Gastric Cancer - Helicobacter ISSN 1523-5378.
5. Khay-Guan Yeoh, REVIEW, How do we improve outcomes for gastric cancer?doi:10.1111/j.1440-1746.2007.04956.x.
6. I.C. Roberts-Thomson, W.J. Butler. Polymorphism and gastric cancer, Journal of Gastroenterology and Hepatology (2005) 20, 793-794 DOI: 10.1111/j.1400-1746.2005.03938x.
7. R.M. Genta and M. Rugge - Rewiew article - Pre-neoplastic states of the gastric mucosa - a practical approach for the perplex clinician, Aliment Farmacol Ther 2001;15 suplim. 1,43-50.
8. K.M. Fock. Review article: the epidemiology and prevention of gastric cancer Alimentary Pharmacology and Therapeutics, 2014; 40: 250-260.
9. Tahara T., Shibata T., Nakamura M., et al. Gastric mucosal pattern by using magnifying narrow-band imaging endoscopy clearly distinguishes histological and serological severity of chronic gastritis. Gastrointest Endosc 2009; 70: 246-53.
10. World Cancer Research Fund/American Institute for Cancer Research. Food, Nutrition, Physical Activity and the Prevention of Cancer: A Global Perspective World Cancer Research Fund. Washington, DC: American Institute for Cancer Research, 2007.
11. O. Dinis-Ribeiro M., Areia M., de Vries A.C., et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED). Endoscopy 2012; 44: 74–94.
12. M. Grigorescu, O. Pascu. Tratat de Gastroenterologie Clinică, vol. 1 - Cancerul gastric, pp. 362-382.
13. R. Twycross, A. Wilcock. Controlul simptomelor în cancerul avansat - Simptome digestive, Ed. Lux Libris, 2007, pp. 56-104.