Antibiotics have selective toxicity against bacteria. This is possible because these drugs bind to certain protein and inhibit their activity, proteins that exist only at the level of bacteria and not at the level of the macroorganism, and on the other hand, these structures are of vital importance for the bacteria. Being of protein nature, these structures are genetically determined. This makes an antibiotic effective only against bacteria that have such genes, the other bacteria being resistant to the antibiotic. This type of bacterial resistance to antibiotics is called natural resistance. But there is also an acquired resistance of bacteria to antibiotic that refers to the fact that some bacteria were initially sensitive or even very sensitive to a particular antibiotic, but later developed resistant strains. The acquired resistance is also genetically coded and occurs through genetic mutations. When the resistance-encoding gene is located at the chromosome level, we talk about chromosomal resistance, and when it is located outside the chromosomes, extracromosomal resistance is discussed. Chromosomal resistance is transmitted only within the same bacterial strain and disappears with the disappearance of that strain. Extracromosomial resistance can also be transmitted between bacteria belonging to different strains or species. Microbial resistance to antibiotics is more common when the antibiotic is older and more commonly used. This makes the antibiotic resistance of microbes vary from one geographic area to another. Generally, in rural areas there are fewer strains of resistant microbes to antibiotic than in urban environments. Most resistant strains are found in the hospital environment where many antibiotics are used. There are also antibiotic resistance differences between different countries depending on how antibiotics were used in each country. The most effective way to preserve the efficacy of antibiotics in the treatment of infectious diseases is a national policy of rational use of antibiotics.
Rezistenţa microbilor la antibiotice
Microbial resistance to antibiotics
First published: 22 mai 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/MED.129.3.2019.2388
Abstract
Rezumat
Antibioticele prezintă toxicitate selectivă faţă de bacterii. Aceasta este posibilă deoarece medicamentele se fixează de anumite structuri proteice, pe care le inhibă şi care, pe de o parte, există numai la nivelul bacteriilor, nu şi la nivelul macroorganismului, iar pe de altă parte, aceste structuri au importanţă vitală pentru bacterii. Fiind de natură proteică, aceste structuri sunt determinate genetic. Aceasta face ca un anume antibiotic să fie eficace numai faţă de bacteriile care au asemenea gene, celelalte bacterii fiind rezistente la antibioticul respectiv. Acest gen de rezistenţă a bacteriilor la antibiotice se numeşte rezistenţă naturală. Există însă şi o rezistenţă dobândită a bacteriilor la antibiotice, care se referă la faptul că anumite bacterii au fost iniţial sensibile, sau chiar foarte sensibile la un anume antibiotic, dar ulterior au dezvoltat tulpini rezistente. Şi rezistenţa dobândită este codificată genetic şi apare prin mutaţii genetice. Când gena care codifică rezistenţa este situată la nivelul cromozomilor bacterieni, se vorbeşte despre rezistenţă cromozomială, iar când aceasta este situată în afara cromozomilor, se vorbeşte despre rezistenţă extracromozomială. Rezistenţa cromozomială se transmite numai în cadrul aceleiaşi tulpini bacteriene şi dispare odată cu dispariţia acelei tulpini. Rezistenţa extracromozomială se poate transmite şi între bacterii aparţinând de tulpini sau de specii diferite. Rezistenţa microbilor la antibiotice este cu atât mai frecventă cu cât antibioticul este mai vechi şi a fost mai frecvent utilizat. Aceasta face ca rezistenţa microbilor la antibiotice să difere de la o zonă geografică la alta. În general, în mediul rural sunt mai puţine tulpini de microbi rezistente le antibiotice decât în mediile orăşeneşti. Cele mai multe tulpini rezistente sunt întâlnite în mediul spitalicesc, în care se utilizează foarte multe antibiotice. Există şi diferenţe de rezistenţă a microbilor la antibiotice între diferite ţări, în funcţie de modul în care au fost utilizate antibioticele în fiecare ţară în parte. Cea mai eficientă modalitate de prezervare a eficacităţii antibioticelor în tratamentul bolilor infecţioase este o politică naţională de utilizare raţională a antibioticelor.
Antibioticele, în sensul larg al cuvântului, indiferent dacă sunt substanţe de origine naturală produse de microbi în cadrul procesului de antibioză sau dacă sunt substanţe care nu există ca atare în natură, sunt medicamente care prezintă toxicitate selectivă faţă de bacterii. În acord cu Paul Erlich, ele se comportă ca nişte gloanţe fermecate, adică trec pe lângă celulele macroorganismului fără să le afecteze, găsesc bacteriile şi numai pe acestea le omoară.
Pentru a-şi îndeplini această misiune, antibioticele se fixează de anumite structuri biologice care îndeplinesc două condiţii. Pe de o parte, aceste structuri există numai la nivelul bacteriilor sensibile la antibioticul respectiv, nu şi la nivelul celulelor macroorganismului, iar pe de altă parte, aceste structuri au importanţă vitală pentru bacteriile sensibile la acel antibiotic.
Deşi există un aforism în biologie care spune că între o bacterie şi un elefant nu există decât o diferenţă de mărime, asemenea structuri există practic la toate nivelurile de organizare a unei bacterii.
Unele antibiotice – cum sunt, de exemplu, penicilinele şi cefalosporinele – se fixează de anumite proteine implicate în sinteza peretelui bacterian (numite proteine care leagă penicilinele sau, în limba engleză, proteins binding penicillins; PBP) şi inhibă astfel sinteza acestei structuri. Întrucât mediul intracelular al bacteriei este hiperton, are loc un influx de apă care determină la nivelul bacteriilor lipsite de perete bacterian o liză a acestora. Specificitatea de acţiune este asigurată de faptul că celulele macroorganismului sunt lipsite de perete bacterian.
Alte antibiotice, cum sunt antibioticele polienice, pătrund în membrana celulară şi creează o serie de pori prin intermediul cărora bacteriile pierd în mediul extracelular componente vitale şi, în felul acesta, bacteriile sunt distruse. Specificitatea de acţiune este asigurată de faptul că antibioticele se fixează numai de anumite membrane celulare cu o anume componenţă fosfolipidică şi care, pe de o parte, permite fixarea antibioticului, iar pe de altă parte, această compoziţie fosfolipidică a membranelor bacteriilor sensibile este diferită de compoziţia fosfolipidică a membranelor celulelor macroorganismului.
Alte antibiotice acţionează la nivelul ribozomilor bacterieni, fixându-se fie de subunitatea de 50 S, fie de subunitatea de 30 S. Unele din acestea, cum sunt aminoglicozidele, se fixează ireversibil, împiedică definitiv sinteza proteinelor bacteriene şi determină producerea unor proteine toxice pentru bacterie, în felul acesta omoarându-le. Altele, cum sunt tetraciclinele, cloramfenicolul, macrolidele, lincomicina, clindamicina ş.a., se fixează reversibil de ribozomi, perturbă sinteza proteinelor bacteriene şi în felul acesta bacteriile nu se mai pot multiplica. Specificitatea de acţiune a acestor medicamente este asigurată de faptul că la nivelul ribozomilor bacterieni există anumite zone a căror conformaţie sterică se potriveşte în oglindă cu conformaţia sterică a antibioticului, permiţând în acest fel fixarea antibioticelor de ribozomi, asemenea zone neexistând însă la nivelul ribozomilor celulelor macroorganismului.
Există şi antibiotice care acţionează la nivelul genomului bacterian.
Rifampicina, de exemplu, inhibă ARN-polimeraza ADN-dependentă, împiedicând astfel sinteza proteinelor bacteriene şi provocând moartea bacteriilor. Specificitatea de acţiune este asigurată de faptul că ARN-polimeraza ADN-dependentă bacteriană şi ARN-polimeraza ADN-dependentă umană sunt izoenzime, astfel încât rifampicina se fixează numai de enzima bacteriană.
Un alt exemplu este cel al chinolonelor halogenate. Acestea sunt medicamente care inhibă specific giraza, o enzimă care asigură conformaţia sterică a ADN-ului bacterian, astfel încât acesta să ocupe un spaţiu minim în interiorul celulei bacteriene. Această girază este esenţială pentru bacterii, care sunt celule procariote, adică lipsite de nucleu celular, ea asigurând o conformaţie sterică a ADN-ului bacterian de asemenea natură, încât acesta să ocupe un spaţiu minim în interiorul celulei bacteriene. Prin inhibarea girazei, ADN-ul bacterian se derulează în citoplasmă, este profund perturbată sinteza de proteine şi bacteriile sunt omorâte. Specificitatea de acţiune este asigurată de faptul că celulele macroorganismului, fiind eucariote (adică au nucleu celular), nu au girază.
Există şi antibiotice care influenţează direct metabolismul bacteriilor. Un exemplu îl reprezintă sulfamidele, a căror structură chimică este foarte asemănătoare acidului paraaminobenzoic, un precursor al acidului folic, element esenţial în sinteza unor baze azotate. Din cauza acestei asemănări chimice, bacteriile nu îşi mai sintetizează acid folic, plecând de la acidul paraaminobenzoic, ci un analog al acestuia, plecând de la sulfamide, analog care este inactiv metabolic. Nu se mai sintetizează baze azotate şi bacteriile nu se mai pot înmulţi. Specificitatea de acţiune este asigurată de faptul că celulele macroorganismului nu îşi sintetizează acid folic. Pentru macroorganisme, acidul folic este o vitamină din grupul B pe care macroorganismul şi-o procură din alimente.
Tot asupra metabolismului acidului folic acţionează un alt antibiotic, numit trimetoprim. Acesta inhibă folatreductaza, o enzimă care transformă acidul folic în acid tetrahidrofolic, forma activă metabolic a acidului folic. La fel ca în cazul sulfamidelor, bacteriile lipsite de acid folic activ nu îşi mai pot sintetiza baze azotate şi nu se mai pot multiplica. Specificitatea de acţiune este asigurată de faptul că folatreductaza bacteriană şi folatreductaza umană sunt izoenzime, folatreductaza bacteriană fiind de 100000 de ori mai sensibilă la trimetoprim decât cea umană.
Foarte interesantă este asocierea sulfamidelor cu trimetoprimul. Cele două tipuri de antibiotice inhibă metabolismul acidului folic în etape diferite, astfel încât, dacă se asociază între ele, perturbarea acestui metabolism este atât de mare, încât bacteriile sunt omorâte, nu numai împiedicate să se multiplice. Din considerente de ordin farmacocinetic, trimetoprimul se asociază de obicei cu sulfamida numită sulfametoxazol. Această asociere este larg utilizată astăzi sub diverse denumiri comerciale, cum ar fi biseptol, cotrimoxazol, septrin, sumetrolim etc.
După cum se poate constata, toate antibioticele acţionează ca urmare a fixării lor de anumite structuri bacteriene de natură proteică. Aceste proteine există în celula bacteriană deoarece ADN-ul bacterian conţine genele necesare sintezei acestor proteine. Rezultă de aici că un anume antibiotic nu acţionează decât asupra bacteriilor care conţin proteinele necesare acţiunii lui. Celelalte bacterii sunt, prin definiţie, rezistente la acel antibiotic. Această rezistenţă a bacteriilor la antibiotice se numeşte rezistenţă naturală.
Rezistenţa naturală a bacteriilor la antibiotice derivă din însuşi mecanismul de acţiune al antibioticului. De exemplu, dacă penicilinele inhibă proteinele implicate în sinteza peretelui bacterian şi în acest fel omoară bacteriile sensibile, este evident că aceste antibiotice nu au cum să acţioneze asupra bacteriilor care sunt lipsite de peretele bacterian, cum sunt chlamidiile, rickaettsiile şi mycoplasmele. Dacă sulfamidele împiedică sinteza acidului folic prin competiţie cu acidul paraaminobenzoic, şi astfel le împiedică multiplicarea, ele nu au cum să acţioneze asupra bacteriilor care nu îşi sintetizează acid folic, plecând de la acidul paraaminobenzoic.
În afară de această rezistenţă naturală, există şi un al doilea tip de rezistenţă a microbilor la antibiotice, numită rezistenţă dobândită. Aceasta se referă la faptul că unele specii bacteriene erau iniţial sensibile, sau chiar foarte sensibile la un anume antibiotic, dar pe parcursul timpului au devenit rezistente la acel antibiotic. Această rezistenţă dobândită poate fi uneori extrem de importantă. De exemplu, stafilococul auriu era iniţial foarte sensibil la penicilina G. Alexander Fleming a descoperit penicilina chiar pe o cultură de stafilococ auriu. Astăzi, în peste 90% din cazuri, stafilococul auriu este rezistent la penicilina G.
Ca şi rezistenţa naturală, şi rezistenţa dobândită este tot determinată genetic, apărând prin mutaţii genetice ale microbilor în cursul multiplicării lor extrem de rapide.
Uneori, în cursul tratamentului cu un anumit antibiotic la un anumit bolnav, prin mutaţii genetice apar microbi rezistenţi la antibioticul cu care se face tratamentul. În continuare, antibioticul realizează o presiune de selecţie a bacteriilor rezistente, deoarece, prin omorârea bacteriilor sensibile, înlătură concurenţa pentru hrană a bacteriilor rezistente. Bolnavul se poate vindeca, dar, dacă va transmite boala unei alte persoane, noul bolnav va fi infectat cu o tulpină rezistentă la antibioticul cu care a fost tratat primul bolnav. Acest mod de instalare a rezistenţei se numeşte instalare într-un singur pas (single step). Se instalează în acest fel, de exemplu, rezistenţa microbilor la aminoglicozide.
Alteori, în cursul tratamentului unui bolnav cu un anumit antibiotic, prin mutaţii genetice apar microbi toleranţi la antibioticul cu care se face tratamentul. Dacă tratamentul antibiotic este incorect realizat (fie dozele sunt prea mici, fie intervalul între administrări este prea lung, fie durata tratamentului este prea scurtă), microbii toleranţi persistă în organismul bolnavului. La fel ca în cazul precedent, bolnavul se poate vindeca, dar, dacă transmite boala unei alte persoane, noul bolnav va fi infectat cu microbi toleranţi. Dacă şi noul bolnav este tratat incorect cu acelaşi antibiotic, toleranţa microbilor poate să crească. În acest fel, de la un bolnav la altul, toleranţa microbilor creşte până când aceştia devin rezistenţi. Acest mod de instalare a rezistenţei se numeşte în mai mulţi paşi (multi step). De remarcat faptul că, în cazul instalării rezistenţei în mai mulţi paşi, este de o importanţă covârşitoare corectitudinea tratamentului antibiotic. Dacă tratamentul ar fi fost corect realizat, antibioticul ar fi omorât şi bacteriile tolerante şi nu ar mai fi apărut rezistenţa. O instalare a rezistenţei de acest fel dezvoltă în special penicilinele.
Uneori, gena care codifică rezistenţa microbilor la un anumit antibiotic este situată la nivelul cromozomilor bacterieni. Acest gen de rezistenţă se numeşte rezistenţă cromozomială. O bacterie-mamă care prezintă rezistenţă cromozomială la un anume antibiotic, prin diviziune, generează două bacterii-fiice rezistente la antibioticul respectiv. În acest fel, prin diviziuni multiple ia naştere o colonie de bacterii rezistente. Rezistenţa cromozomială nu se transmite însă la bacterii din colonii diferite. Ea dispare odată cu moartea coloniei de bacterii rezistente. Aceasta face ca, uneori, să existe antibiotice care dezvoltă frecvent rezistenţă cromozomială, dar această rezistenţă să nu fie foarte larg răspândită. Este cazul chinolonelor halogenate.
Alteori, gena care codifică rezistenţa este situată extracromozomial, de exemplu la nivelul plasmidelor, care sunt fragmente de material genetic libere în citoplasma bacteriilor. Acest gen de rezistenţă se numeşte rezistenţă extracromozomială. Şi bacteriile care dezvoltă rezistenţă extracromozomială la un anume antibiotic dezvoltă colonii de bacterii rezistente la antibioticul respectiv. Rezistenţa extracromozomială se poate transmite însă şi între bacterii din colonii diferite, iar uneori chiar între bacterii aparţinând unor specii diferite.
O modalitate de transmitere a rezistenţei extracromozomiale este conjugarea. În această situaţie, două bacterii se apropie una de alta, una din aceste bacterii trimite către cealaltă o prelungire numită pil sexual şi prin aceasta una din bacterii transmite celeilalte o plasmidă. Dacă această plasmidă conţine o genă responsabilă de rezistenţa la un anume antibiotic, bacteria care a primit plasmida devine şi ea rezistentă la antibioticul respectiv. Gena care codifică rezistenţa la un anume antibiotic este numită factorul R. Gena care codifică formarea pilului sexual este numită factor de transfer al rezistenţei (RTF). Pentru a putea fi transmisă rezistenţa, este necesară prezenţa ambilor factori, atât R, cât şi RTF. Există situaţii în care un factor RTF este cuplat cu mai mulţi factori R, un factor R1, care codifică rezistenţa la un anume antibiotic, un factor R2, care codifică rezistenţa la un alt antibiotic etc. Pot să apară în acest fel bacterii rezistente la mai multe antibiotice, cu mecanisme de acţiune diferite şi cu care bacteriile nu au venit niciodată în contact. Acest fenomen se numeşte polirezistenţă sau multirezistenţă.
O altă modalitate de transmitere a rezistenţei extracromozomiale este transducţia. Aceasta presupune transmiterea genei care codifică rezistenţa la un anume antibiotic prin intermediul bacteriofagilor. Bacteriofagii sunt virusuri care îmbolnăvesc bacteriile şi se multiplică în interiorul bacteriilor folosind bagajul enzimatic al acestora. Atunci când se formează capsida unui nou virion, pe lângă genomul viral, aceasta poate îngloba şi o genă care codifică rezistenţa la un anume antibiotic. Dacă acest virion va infecta o altă bacterie, noua bacterie va deveni rezistentă la antibioticul respectiv. Acest gen de transmitere a rezistenţei este posibil însă numai pentru rezistenţe codificate de gene de dimensiuni mici, cum este de exemplu cazul rezistenţei la peniciline.
O a treia modalitate de transmitere a rezistenţei extracromozomiale este transformarea. În această situaţie, bacteriile înglobează material genetic liber în mediul lor înconjurător provenit, de exemplu, de la alte bacterii moarte. Dacă materialul genetic înglobat codifică rezistenţa la un anume antibiotic, bacteria care a înglobat acel material devine rezistentă la antibioticul respectiv. Acest mod de transmitere a rezistenţei este posibil în cazul infecţiilor masive, când există multe bacterii moarte care au eliberat cantităţi mari de material genetic în mediul respectiv.
Genele responsabile de rezistenţa microbilor la antibiotice codifică mecanisme diverse de realizare a acestei rezistenţe.
Uneori este împiedicată pătrunderea antibioticului în interiorul celulelor bacteriene. De exemplu, aminoglicozidele sunt substanţe polare (hidrosolubile) şi pătrund în interiorul bacteriilor prin intermediul unor pori apoşi existenţi în membranele acestora şi numiţi porine. Prin mutaţii genetice s-au dezvoltat tulpini de bacterii în membrana cărora densitatea acestor porine este foarte mică, aminoglicozidele nu mai pot pătrunde în interiorul bacteriei, iar bacteriile au devenit rezistente la aminoglicozide.
Alteori, prin mutaţii genetice au apărut tulpini bacteriene care au dezvoltat mecanisme de expulzare a antibioticului din interiorul celulelor. Acesta este, de exemplu, cazul bacilului tuberculos.
Există situaţii în care bacteriile, prin mutaţii genetice, produc enzime care distrug antibioticul şi astfel devin rezistente. De exemplu, penicilinele pot fi distruse de o enzimă numită penicilinază, cefalosporinele pot fi distruse de o enzimă numită cefalosporinază, aminoglicozidele pot fi distruse şi ele de o serie de alte enzime.
Există şi situaţii în care, prin mutaţii genetice, se modifică conformaţia sterică a proteinelor de care se fixează antibioticele (conformaţia sterică a locului de acţiune) şi în acest fel antibioticele nu se mai pot fixa de structura respectivă. Astfel se întâmplă cu antibioticele care se fixează la nivelul ribozomilor bacterieni. Un alt exemplu este cel al stafilococului auriu rezistent la meticilină, o penicilină rezistentă la acţiunea penicilinazei. Acest stafilococ a dezvoltat prin mutaţii genetice o proteină care leagă penicilina de dimensiuni mai mari şi care are o afinitate foarte mică pentru meticilină.
Este interesant şi mecanismul rezistenţei la sulfamide. După cum am amintit, sulfamidele, prin competiţie cu acidul paraaminobenzoic, împiedică sinteza acidului folic. Prin mutaţii genetice au apărut bacterii care îşi sintetizează acid paraaminobenzoic, nu mai depind de acidul paraaminobenzoic din exterior şi au devenit, astfel, rezistente la sulfamide.
După cum se poate constata, rezistenţa microbilor la antibiotice se realizează prin anumite mecanisme determinate genetic. Frecvent, un mecanism de realizare a rezistenţei nu interesează un singur antibiotic, ci mai multe antibiotice, care se constituie într-o grupă bine definită. Rezistenţa realizată prin producerea de penicilinază interesează mai multe peniciline, desigur, cu excepţia penicilinelor penicilinazorezistente. La fel este situaţia rezistenţei realizate prin producerea de cefalosporinază, rezistenţa la sulfamide etc.
Întrucât această rezistenţă se produce prin mutaţii genetice, riscul de producere este cu atât mai mare cu cât s-au produs mai multe mutaţii genetice, deci cu cât antibioticul a fost utilizat o perioadă mai lungă.
La nivel social, aceasta se exprimă prin faptul că frecvenţa rezistenţei microbilor la antibiotice este cu atât mai mare, cu cât antibioticul este mai vechi şi mai frecvent utilizat. În cazul aminoglicozidelor, cele mai multe tulpini rezistente s-au dezvoltat la aminoglicozidele din grupa streptomicinei, primul antibiotic aminoglicozidic descoperit, mai puţine tulpini rezistente s-au dezvoltat la aminoglicozidele din grupa kanamicinei, a doua grupă de aminoglicozide descoperite, şi mai puţine tulpini rezistente s-au dezvoltat la aminoglicozidele din grupa gentamicinei, cea mai recentă grupă de aminoglicozide descoperite.
La nivel de individ, riscul de dezvoltare a rezistenţei este cu atât mai mare cu cât durata tratamentului este mai lungă, de exemplu în tuberculoză. Acest risc poate fi evitat dacă tratamentul antibiotic de lungă durată se face cu mai multe antibiotice cu mecanisme de acţiune diferite, administrate în asociere. În principiu, dacă microbul dezvoltă rezistenţă la unul din antibioticele cu care se face tratamentul, el poate fi omorât de un alt antibiotic administrat concomitent, dar care acţionează printr-un alt mecanism. În felul acesta, chiar dacă apar microbi mutanţi rezistenţi la unul din antibiotice, ei nu se pot dezvolta în organismul bolnavului.
Rezistenţa microbilor la antibiotice nu apare numai la microbii care au venit în contact cu antibioticul respectiv, ci şi la microbi care au venit în contact nu cu antibioticul, ci cu microbi rezistenţi la acel antibiotic, rezistenţa în acest caz fiind transmisă extracromozomial. Aceasta face ca rezistenţa să difere de la o zonă geografică la alta, în funcţie de frecvenţa cu care un antibiotic a fost utilizat în zona geografică respectivă. În general, microbii din zonele rurale au dezvoltat mai puţine tulpini rezistente la antibiotice decât microbii din zonele urbane. Cele mai multe tulpini rezistente le au în general microbii din zonele spitaliceşti, zone în care se utilizează foarte frecvent antibioticele.
Există chiar şi diferenţe între unele ţări privind rezistenţa microbilor la antibiotice, în funcţie de modul în care se utilizează antibioticele în ţara respectivă. De exemplu, în România a existat întotdeauna o politică de utilizare limitată a cloramfenicolului, deoarece acest medicament produce foarte rar (2-4 cazuri la 100.000 de bolnavi trataţi) aplazie medulară, o reacţie adversă foarte gravă. Din aceste considerente, în România există puţine tulpini de microbi rezistente la cloramfenicol, fenomen de care beneficiază neurologii şi neurochirurgii care utilizează cloramfenicolul în tratamentul abceselor cerebrale. Spre deosebire de România, în Bulgaria, cloramfenicolul a fost larg utilizat şi a dezvoltat foarte multe tulpini rezistente. Un alt exemplu este cel al cefalosporinelor. Până în 1989 în România nu se utilizau cefalosporine. Când, după 1989, au pătruns cefalosporinele şi la noi, acestea erau extraordinar de eficace. Astăzi, după circa 30 de ani de utilizare, eficacitatea lor clinică a scăzut prin dezvoltarea de tulpini rezistente.
Întrucât rezistenţa dobândită apare prin mutaţii genetice, dacă un antibiotic nu mai este utilizat o perioadă lungă de timp într-o anume zonă geografică, tulpinile de microbi rezistenţi pot să dispară şi, odată cu ele, şi rezistenţa microbilor la antibiotice. În asemenea condiţii, în cazul unui bolnav infectat cu un microb polirezistent, medicul terapeut are, în general, la dispoziţie două posibilităţi: fie utilizează un antibiotic foarte nou, care nu a mai fost utilizat în zona geografică respectivă şi deci nu a dezvoltat tulpini rezistente, fie utilizează un antibiotic vechi, dar care nu a mai fost folosit de multă vreme în zona geografică respectivă şi prin aceasta a dispărut rezistenţa. Un exemplu pentru cea de-a doua situaţie este utilizare vancomicinei, un antibiotic vechi, dar puţin utilizat în tratamentul infecţiilor cu Clostridium difficile.
O modalitate foarte eficientă de prezervare a eficacităţii antibioticelor este realizarea unei politici naţionale de utilizare raţională a antibioticelor. O asemenea politică ar trebui să pornească de la realizarea unei hărţi a rezistenţei microbilor la antibiotice în ţara respectivă. În funcţie de sensibilitatea microbilor la antibiotice, aceste medicamente ar trebui clasificate în antibiotice de primă alegere, antibiotice de a doua alegere şi antibiotice de rezervă.
Antibioticele de primă alegere ar trebui să fie foarte eficace pe microbii din zona geografică respectivă, dar şi foarte bine tolerate de bolnavi (adică să prezinte foarte puţine reacţii adverse). Antibioticele celelalte, prin neutilizare, ar rămâne în continuare foarte eficace faţă de microbii care au dezvoltat rezistenţă la antibioticele de primă alegere.
Din păcate, în România nu există o asemenea politică decât în unele situaţii specifice cum sunt tuberculoza, lepra şi, poate, febra tifoidă, în care medicamentul de primă alegere este cloramfenicolul, iar medicamentul de a doua alegere este ampicilina.
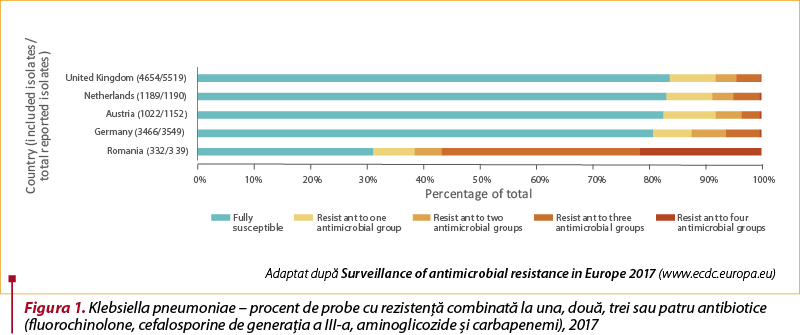
Lipsa unei politici naţionale de utilizare raţională a antibioticelor face ca în România frecvenţa rezistenţei microbilor la antibiotice să fie mai mare decât în alte ţări europene. În raportul de supraveghere a rezistenţei antimicrobiene în Europa publicat în anul 2017 de ECDC (European Center for Disease Prevention and Control) se poate constata că în România numai aproximativ 30% dintre izolatele de Klebsiella pneumoniae au fost sensibile la toate antibioticele testate, celelalte fiind rezistente la una sau mai multe din clasele de antibiotice evaluate (fluorochinolone, cefalosporine de generaţia a treia, aminoglicozide şi carbapenemi). În comparaţie, în ţări precum cele nordice, Olanda, Austria, Germania şi Anglia, frecvenţa izolatelor sensibile la toate antibioticele testate depăşeşte în general 70%.
Există şi posibilitatea realizării unor politici regionale sau zonale de utilizare raţională a antibioticelor. Chiar şi în România există centre spitaliceşti foarte mari în care serviciile de epidemiologie analizează periodic, de mai multe ori pe an, sensibilitatea la antibiotice a microbilor care circulă în aceste zone, iar datele sunt puse la dispoziţia întregului personal medical din centrul spitalicesc respectiv.
Bibliografie
- Clark AM, Finkel R, Rey AJ, Whalen K. Lippincott’s Illustrated Reviews. Pharmacology, 5th Edition, Ed. Wolters Kluwer/Lippincott Williams &Wilkins, 2012.
- Fulga I, Farmacologie, ediţia a II-a revizuită şi adăugită. Ed. Med. Buc. 2015.
- Fulga IG. Antibiotice, antibioză, antibioterapie, Ed. Med. Buc. 1989.
- Golan ED, Armstrong J. Principles of Pharmacology. The pathophysiologic basis of drug therapy. 4th Edition, Wolters Kluwer, 2017.
- Goodman & Gilman’s. The Pharmacological Basis of Therapeutics, Twelfth Edition, Ed. Mc Graw Hill Medical, 2011.
- Katzung GB, Trevor AJ. Basic and Clinical Pharmacology, 13th Edition, McGraw Hill Education, 2015.
- Katzung GB, Masters BS, Trevor JA. Basic and Clinical Pharmacology, 11th Edition, Ed. Mc Mc Graw Hill Medical, 2009.
- Waldman SA, Terzic A. Pharmacology and Therapeutics - Principals to Practice, Ed. Saunders Elsevier, 2009.
- Whittlesea W. Clinical Pharmacy and Therapeutic, Fifth Edition, Ed. Churchill Livingstone, 2012.
- *** ECDC (European Center for Disease Prevention and Control). Surveillance Report. Surveillance of Antimicrobial Resistance in Europe, 2017.
Articole din ediţiile anterioare
Antibioticele şi sarcina
Medicul de familie și, în principal, specialiștii în obstetrică-ginecologie se confruntă în permanență cu utilizarea antibioticelor în timpul sa...
Intervenţia în autism trebuie să fie timpurie, intensivă și să implice activ familia
Tulburările pervazive de dezvoltare sunt caracterizate printr-o deteriorare calitativă, severă şi omniprezentă în diverse arii de dezvoltare: aptit...
Macrolidele şi riscurile administrării lor la pacienţii cu diverse afecţiuni
Macrolidele sunt antibiotice bacteriostatice, cu un spectru larg de activitate, utilizate pe scară largă pentru combaterea infecţiilor tractului...
Bacterii „superbug” şi impactul lor asupra sănătăţii umane
Bacteriile „superbug” sunt acele bacterii cu rezistenţă multiplă la antibiotice. Ele pot cauza infecţii severe, pentru care antibioticele au deve...