Viral C hepatitis affects 3% of the globe population and associates multiple immunological abnormalities, such as autoimmune hepatitis, autoimmune thyroiditis, and disorders of humoral immunity, which may increase during antiviral treatment. That’s why we considered it necessary to evaluate the immunological manifestations in patients with viral hepatitis C, by performing a retrospective and prospective study, between 2009 and 2017, of 62 children with viral hepatitis C, admitted in Clinic II Pediatrics, ”St. Mary” Hospital, Iaşi.
Aspecte imunologice în hepatita virală C la copii
Immunological aspects in viral hepatitis C in children
First published: 28 martie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.53.1.2019.2347
Abstract
Rezumat
Hepatita virală C afecteză 3% din populaţia globului şi asociază multiple anomalii imunologice, cum ar fi hepatita autoimună, tiroidita autoimună, dar şi tulburări ale imunităţii umorale, care se pot accentua pe durata tratamentului antiviral. De aceea am considerat necesară evaluarea manifestărilor imunologice la pacienţii cu hepatită virală C, realizând un studiu retrospectiv şi prospectiv, în perioada 2009-2017, la 62 de copii cu hepatită virală C, internaţi în Clinica II Pediatrie, Spitalul „Sfânta Maria”, Iaşi.
Introducere
Conform celor mai recente date, mai mult de 185 de milioane de persoane la nivel global sunt infectate cu virusul hepatitic C.
Virusul hepatitei C (VHC) reprezintă una dintre cele mai frecvente cauze ale bolii hepatice progresive, având un impact semnificativ asupra sănătăţii umane la nivel mondial. Impactul infecţiei virale asupra ţesutului hepatic variază de la leziuni histologice minime până la fibroză intensă şi ciroză, cu apariţia carcinomului hepatocelular(1).
VHC posedă o mare variabilitate genetică deoarece virusul are o rată înaltă de replicare, iar ARN polimeraza VHC este predispusă la erori. Există minimum 6 genotipuri; în Europa, genotipul prevalent este 1b în 47% din cazuri, urmat de 1a în 17% şi de genotipul 3 în 6% din cazuri. Cercetări recente au arătat că genotipul 1b realizează niveluri crescute ale viremiei, este asociat riscului crescut de cronicizare, răspunde prost la interferon (IFN) şi evoluează spre ciroză hepatică, respectiv carcinom hepatocelular.
Infecţia cronică se datorează răspunsului inadecvat al imunităţii înnăscute, deficienţelor mecanismului imun adaptativ, producerii de cvasispecii virale şi imunotoleranţei organismului infectat(2).
Riscurile infectării la copil ţin de anumiţi factori principali:
-
comorbidităţi care necesită administrări de produse biologice şi transfuzii;
-
mamă infectată cu VHC, mai ales dacă asociază diverse deficite imune;
-
proceduri chirurgicale, transplant de organe, dializă;
-
conduită de viaţă la risc(3).
Transmiterea perinatală:
-
frecventă la sugari şi copii, circa 7.500 de cazuri;
-
în ultima decadă este mai frecventă în cazul mamelor ARN-VHC pozitive, riscul fiind de 5%, iar la mamele cu VHC asociată cu infecţia HIV, riscul creşte la 20%;
-
operaţia cezariană nu reduce riscul de transmitere;
-
alimentaţia naturală nu este contraindicată;
-
diagnosticul timpuriu al infecţiei la nou-născut necesită testarea ARN-VHC, întrucât anticorpii anti-VHC sunt transferaţi pasiv de la mamă;
-
patogeneza hepatitei virale C pe durata sarcinii este dominată de tulburările imunologice asociate cu sarcina şi toleranţa materno-fetală, aspect care duce la încărcătură virală VHC crescută în al treilea trimestru de sarcină risc mare de transmitere VHC la făt(4).
În aceste condiţii, este explicabil de ce riscul transmiterii variază atât de mult după studiile diverşilor autori. Când are loc transmiterea de la mamă la copil, relaţia virus-gazdă are un rol-cheie în situaţia în care mama este infectată cu un tip VHC adaptat să evadeze prin intermediul schimbărilor din secvenţa nucleotidică.
Nou-născutul are 50% din alelele MHC materne, diferenţa de 50%, sau setul „nou”, fiind moştenită de la tată. Există încă multe necunoscute referitoare la modul cum va răspunde sistemul imun în formare, al copilului, în diversele etape de dezvoltare în cazul infecţiei cronice.
Studiul lui Gibb (2000), care a urmărit 441 de perechi mamă-copil din Irlanda şi Marea Britanie, a aratat că rata transmiterii perinatale a fost de 6,7%, fiind chiar de 3,8 ori mai crescută la mamele coinfectate cu HIV (fără cotransmiterea infecţiei cu HIV).
Sunt şi factori speciali în evaluarea riscului transmiterii, iar aceştia sunt încă cercetaţi prin studii actuale. Astfel, transmiterea verticală este chiar de două ori mai posibilă la fete decât la băieţi. Preponderenţa fetelor este aparent surprinzătoare, având o posibilă asociere cu diferenţele genetice în ceea ce priveşte răspunsul la infecţie(5).
Spectaculoase sunt constatările studiului recent al lui Bevilacqua. Sunt recunoscuţi factorii genetici determinanţi ai evoluţiei infecţiei VHC (M BL2, HLA-DRB1, TNF-, IL-10 şi IFN-) şi progresiei bolii hepatice (TGF-1 şi HFE). Acest studiu a fost realizat pe un lot care a inclus 384 de subiecţi de origine italiană, la care a fost urmărită corelaţia parametrilor genetici materni cu riscul de transmitere a infecţiei. S-a identificat că HLA-DRB1*04 matern a fost corelat cu protecţia crescută pentru transmiterea mamă-copil (p=0,023). În schimb, HLA-DRB1*10 la nou-născut a fost considerat factor de risc pentru transmitere (p=0,036). Interesant a fost că neconcordanţa locusului HLA-DRB1 dintre mamă şi copil a fost considerată un factor protectiv, arătând că răspunsurile imune alloreactive pot fi implicate în prevenţia transmiterii verticale a VHC.
Unităţile structurale ale placentei sunt vilozităţile corionice care „plutesc” în sângele matern. Vilozităţile sunt compuse dintr-un miez stromal cu vase de sânge, înconjurat de celule precursoare citotrofoblaste. Ca parte a acestora în programul de diferenţiere, invadează peretele uterin, iar celulele sinciţiotrofoblaste care acoperă vilozităţile corionice mediază schimburile de substanţe şi transferul pasiv de IgG din sângele matern către făt. Transmiterea VHC la făt poate să apară în cursul transcitozei virale peste celulele trofoblaste şi ar putea fi mediată de receptorii VHC exprimaţi la suprafaţa celulelor placentare sau ar putea rezulta printr-o injurie directă sau indirectă care compromite integritatea barierei placentare.
În contrast cu situaţia infecţiei materne cu HIV, nu sunt bine stabilite măsurile de prevenire a transmiterii VHC de la mamă la nou-născut. Terapia antivirală bazată pe interferon şi ribavirină are eficacitate limitată şi efecte secundare severe atât pentru mamă, cât şi pentru copil. Situaţia s-a schimbat radical odată cu disponibilitatea noilor opţiuni terapeutice aprobate recent. Schemele de tratament care includ DAA suprimă replicarea virală în câteva zile de tratament şi rata de vindecare poate fi atinsă la peste 90% din cazuri(6).
Cu toate acestea, siguranţa şi eficacitatea DAA în timpul sarcinii nu au fost încă bine studiate. Efecte dăunătoare asupra fătului în timpul tratamentului cu sofosbuvir sau ledipasvir nu au fost observate pe modele animale, în consecinţă tratamentul poate deveni disponibil în timpul sarcinii imediat ce este dovedit ca sigur şi eficient în studiile clinice. În Europa, ambele medicamente rămân contraindicate în prezent la femeile însărcinate şi care alăptează.
Răspunsul imun umoral este slab şi inconstant, anticorpii evidenţiindu-se la 5-6 săptămâni postinfecţie, cu o activitate protectoare greu de evaluat. Răspunsul imun celular se realizează prin intervenţia limfocitelor T CD8+ citotoxice care pot recunoaşte VHC, fiind stimulate de clonele T CD4+. Un procent însemnat de persoane infectate cu VHC au o evoluţie cronică, răspunsul imun fiind incapabil să realizeze eliminarea virusului.
Afecţiunile tiroidiene sunt mai frecvente la pacienţii cu infecţie cronică VHC, decât în populaţia generală. Aproximativ 13% din pacienţii infectaţi cu VHC au hipotiroidism şi până la 25% prezintă anticorpi antitiroidă.
Pe de altă parte, s-a evidenţiat că tratamentul cu interferon poate creşte riscul apariţiei afecţiunilor tiroidiene sau poate să scoată la iveală sindroame autoimune (tiroidita Hashimoto, boala Graves). În plus, unele studii sugerează că tulburările tiroidiene autoimune sunt prezente în mod semnificativ la pacienţii cu hepatită cronică C pe durata tratamentului cu interferon, dar nu şi anterior acesteia. Prezenţa anticorpilor antitiroidă, cu sau fără manifestări clinice semnificative, creşte riscul apariţiei unei tiroidite manifeste pe durata tratamentului antiviral, impunând monitorizarea funcţiei tiroidiene în perioada tratamentului.
Legătura dintre infecţia cu VHC, scăderea factorului de creştere insulin-like (IGF-1) şi insuficienţa hormonului de creştere (GH) trebuie investigată în continuare. Scăderea secreţiei GH se poate datora unui efect inhibitor direct dat de infecţia VHC la nivelul hipofizei(7).
Materiale şi metodă
Studiu retrospectiv şi prospectiv, în perioada 2009-2017, pe 62 de copii, cu vârsta cuprinsă între 6 şi 18 ani, diagnosticaţi cu hepatită virală C, internaţi în Clinica II Pediatrie, Spitalul „Sfânta Maria” din Iaşi. Studiul a inclus două loturi de pacienţi, lotul I cuprinzând 28 de pacienţi care au primit monoterapie (interferon), iar lotul II, 34 de copii care au primit terapie combinată (interferon+ribavirină). Au fost urmăriţi parametrii imunologici la debutul tratamentului, la 4 săptămâni, la 24 de săptămâni şi la finalizarea terapiei antivirale, la 48 de săptămâni. În cadrul studiului efectuat, analiza statistică şi reprezentările grafice au fost realizate în programul SPSS.
Rezultate
Am inclus în studiu 62 de pacienţi cu hepatită virală C, care au urmat tratament antiviral în perioada studiată.
Lotul I, pacienţii care au primit monoterapie (interferon)
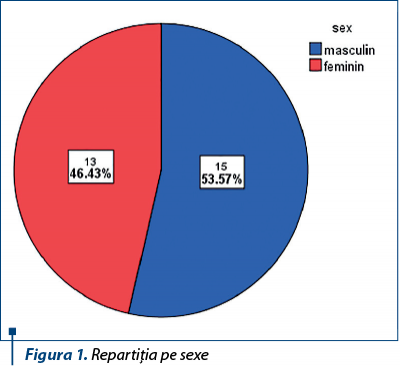
Acest lot a cuprins 28 de pacienţi cu vârsta între 6 şi 17 ani, vârsta medie fiind 11,85 ±3,65 ani. 15 (53,5%) au fost băieţi, iar 13 (46,4%), fete (figura 1).
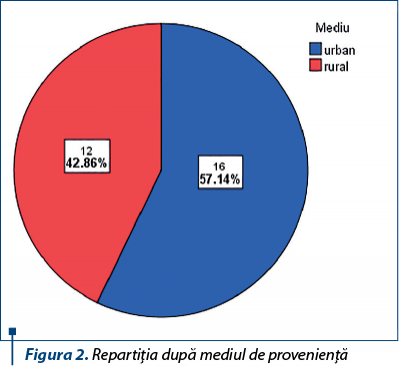
Referitor la mediul de provenienţă, 16 pacienţi (57,1%) sunt din mediul urban, iar 12 pacienţi (42,8%), din mediul rural (figura 2).
Dintre parametrii hematologici urmăriţi, menţionăm IgA, IgG şi IgM. A fost urmărită funcţia tiroidiană şi s-a efectuat screening pentru depistarea tiroiditei autoimune.
Deficitul de IgA este un deficit imun, cu incidenţă mare la copil. Valoarile medii ale IgA au fost scăzute la iniţierea terapiei antivirale atât la sexul masculin, 79,5 mg/dL, cât şi la sexul feminin, 64,6 mg/dL (p=0,002) (figura 3). La pacienţii de sex masculin, valorile IgA s-au normalizat pe durata terapiei antivirale, rata creşterii valorilor fiind constantă, iar la paciente, valorile IgA s-au menţinut scăzute.
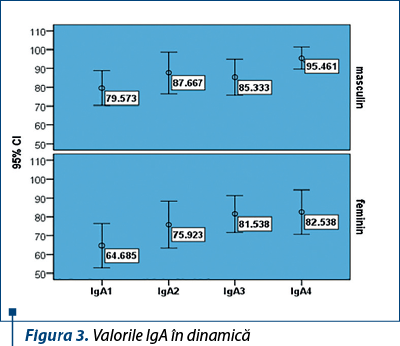
A existat un deficit imun umoral tranzitoriu, dar la majoritatea pacienţilor valorile IgA au crescut ca o reacţie imună umorală secundară după iniţierea terapiei cu interferon.
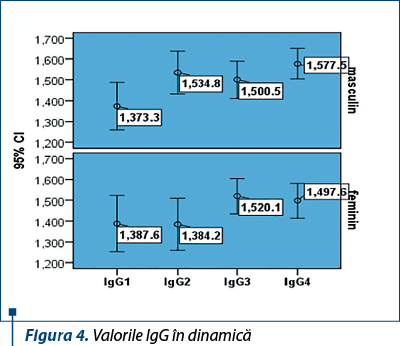
Creşterea valorilor medii ale IgG a fost evidenţiată atât la iniţierea, cât şi pe durata terapiei antivirale, este asociată cu efectul imunologic şi a fost similară la sexul masculin şi feminin, nefiind diferenţe semnificative ale valorilor medii între cele două grupuri de pacienţi (figura 4).
Valorile medii ale IgM s-au menţinut cvasiconstante pe durata terapiei antivirale, atât la sexul masculin, cât şi la sexul feminin (figura 5).

Interferonul are proprietăţi imunomodulatorii şi astfel tratamentul poate induce fenomene autoimune, tiroidita autoimună fiind raportată la 27,9% din pacienţi. În majoritatea cazurilor, tiroidita produce iniţial hipertiroidism, care ulterior se transformă în hipotiroidism.
Prezenţa autoanticorpilor tiroidieni cu sau fără manifestări clinice semnificative creşte riscul apariţiei unei tiroidite manifeste pe perioada tratamentului antiviral, cauzată chiar de virusul hepatitic C, impunând monitorizarea funcţiei tiroidiene pe parcursul tratamentului.
Proteinele VHC pot include secvenţe aminoacidice similare celor din antigenele tiroidiene, deci pacienţii infectaţi cu virusul hepatitic C ar putea avea o predispoziţie pentru astfel de reacţii autoimune apărute prin mecanism de mimetism molecular, chiar dacă nu a fost evidenţiată o reactivitate încrucişată între antigenele tiroidiene şi anticorpii VHC.
Evaluarea funcţiei tiroidiene a arătat că nu au fost pacienţi cu disfuncţii tiroidiene. Valorile TSH-ului, Ft4 şi Ac anti-TPO nu au prezentat variaţii majore pe durata tratamentului antiviral (figurile 6, 7 şi 8).
Lotul II, pacienţii care au primit terapie combinată (interferon+ribavirină)
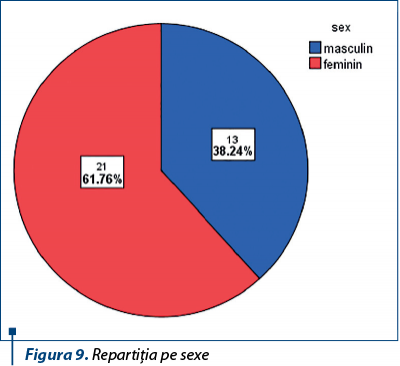
Acest lot a cuprins 34 de pacienţi, cu vârsta între 6 şi 18 ani, vârsta medie fiind 11,5±3,1 ani. 21 (61,7%) au fost fete, iar 13 (38,2%), băieţi (figura 9). Referitor la mediul de provenienţă, 23 de pacienţi (67,6%) sunt din mediul urban, iar 11 pacienţi (32,3%), din mediul rural (figura 10).
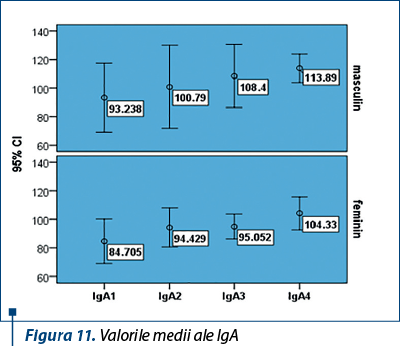
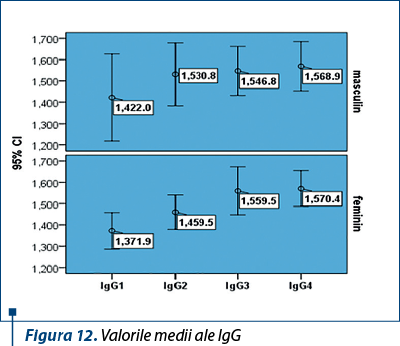
În lotul pacienţilor care au primit terapie combinată se arată că valorile medii ale IgA au fost mai mari la sexul masculin, 93,2 mg/dL, comparativ cu sexul feminin, 84,7 mg/dL, (p=0,267) (figura 11), la ambele sexe, valorile fiind în creştere pe durata terapiei antivirale. Valorile medii ale IgG au prezentat o curbă ascendentă la ambele grupuri de pacienţi pe durata celor 48 de săptămâni de tratament antiviral (figura 12) şi scădere lentă după terapie.
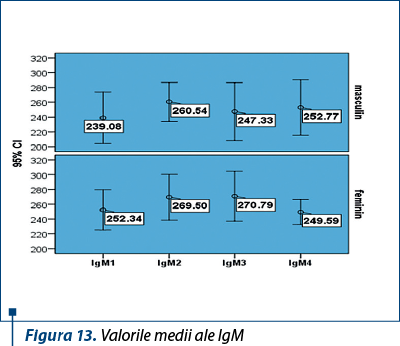
Valorile medii ale IgM au fost 239,08 mg/dL la sexul masculin, respectiv 252,3 mg/dL la sexul feminin, valori care au prezentat oscilaţii uşoare sub tratament antiviral (figura 13).
Analiza funcţiei tiroidiene la pacienţii care au primit terapie combinată a arătat că valorile TSH-ului, Ft4 şi Ac anti-TPO nu au prezentat variaţii majore pe durata tratamentului antiviral (figurile 14, 15 şi 16).
Discuţii
Analizând datele epidemiologice, am constatat că în lotul I au predominat pacienţii de sex masculin, iar în lotul II, persoanele de sex feminin.
Afecţiunile tiroidiene constituie o reacţie adversă relativ frecventă a tratamentului cu interferon, cu un mecanism incomplet elucidat. Totuşi, ca şi în cazul celorlalte efecte secundare ale acestei terapii, disfuncţia tiroidiană pare a fi consecinţa activării sistemului imun, indusă de interferon(8). Este bine cunoscută capacitatea interferonului de a creşte expresia moleculelor HLA de clasa I şi a moleculelor de adeziune celulară, amplificând astfel răspunsul imun de tip 1, ce are un rol important în rezoluţia infecţiei virale, dar şi în patogenia multor afecţiuni autoimune(9). Răspunsul imun de tip 1 pare a fi dominant la pacienţii ce evoluează cu hipotiroidism, în timp ce reacţiile de tip 2 au fost corelate cu apariţia bolii Graves(10).
În lotul I, valorile TSH, Ft4 şi ale Ac anti-TPO au fost în limite normale atât înaintea iniţierii terapiei antivirale, cât şi pe durata acesteia, iar în lotul II, 2,8% dintre pacienţi au fost diagnosticaţi cu tiroidită autoimună anterior iniţierii terapiei antivirale şi au necesitat urmărire riguroasă a hormonilor tiroidieni, cu ajustarea dozelor de Euthyrox®.
Concluzii
Manifestările imunologice reprezintă aspecte importante în hepatita virală C, iar disfuncţia tiroidiană poate fi consecinţa activării sistemului imun indusă de interferon.
În infecţia cu VHC la copil, statusul imun umoral şi cel celular sunt afectate, în lotul I valorile medii ale IgA fiind scăzute la ambele grupuri de pacienţi.
Rata extrem de ridicată a cronicizării infecţiei cu virus hepatitic C sugerează un răspuns imun ineficient, aspect demonstrat prin evidenţierea deficitului de IgA.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Jhaveri R. Diagnosis and management of hepatitis C virus-infected children. Pediatr Infect Dis J. 2011;30:983-985.
- El-Raziky MS, El-Hawary M, Esmat G, Abouzied AM, El-Koofy N, Mohsen N, et al. Prevalence and risk factors of asymptomatic hepatitis C virus infection in Egyptian children. World J Gastroenterol. 2007;13:1828-1832.
- Rehermann B. Hepatitis C virus versus innate and adaptive immune responses: a tale of coevolutionand coexistence. J Clin Invest. 2009; 119:1745-1754. [PubMed: 19587449].
- Huang MJ, Wu SS, Liaw YF. Thyroid abnormalities in patients with chronic viral hepatitis. Hepatology. 1994;20:1651-1652. doi: 10.1002/ hep.1840200650.
- Quaranta JF, Tran A, Regnier D, et al. High prevalence of antibodies to hepatitis C virus (HCV) in patients with anti-thyroid autoantibodies. J Hepatol. 1993;18:136-138.doi: 10.1016/S0168-8278(05)80022-4.
- Huang MJ, Tsai SL, Huang BY, Sheen IS, Yeh CT, Liaw YF. Prevalence and significance of thyroid autoantibodies in patients with chronic hepatitis C virus infection: a prospective controlled study. Clin Endocrinol (Oxf). 1999;50:503-509. doi: 10.1046/j.1365-2265.1999.00686.x.
- Tran A, Quaranta JF, Benzaken S, et al. High prevalence of thyroid autoantibodies in a prospective series of patients with chronic hepatitis C before interferon therapy. Hepatology. 1993;18:253-257. doi: 10.1002/ hep.1840180205.
- Pawlotsky JM, Ben Yahia M, Andre C, et al. Immunological disorders in C virus chronic active hepatitis: a prospective case-control study. Hepatology. 1994; 19: 841-848. doi: 10.1002/hep.1840190407.
- Boadas J, Rodriguez-Espinosa J, Enriquez J, et al. Prevalence of thyroid autoantibodies is not increased in blood donors with hepatitis C virus infection. J Hepatol. 1995; 22: 611-615. doi: 10.1016/0168- 8278(95)80216-9.
- Zeisel MB, Barth H, Schuster C, Baumert TF. Hepatitis C virus entry: molecular mechanisms and targets for antiviral therapy. Front Biosci (Landmark Ed). 2009;14:3274-3285.