The objective of this article is challenging, supporting the fact that the role of ibuprofen in pain and fever, as well as of other nonsteroidal anti-inflammatory drugs (NSAIDs) should be reassessed in order to outline the endocannabinoid involvement. In this process, NSAIDs involve the endocannabinoid (ECB) system as part of their analgesic effect, and recent studies suggest that this can be achieved within the known mechanism of action of these compounds on COX. The design of COX inhibitors that activate the endocannabinoid system and dual (synergistic) action inhibitors of FAAH/COX may pave the way for new drugs that target important medical needs, pain therapy without serious gastrointestinal and cardiovascular effects. In addition, other known effects of the ECBs on appetite regulation may be beneficial for patients with nutritional disturbances and especially children. We will convey these essential messages responding to pertinent questions arising from practical needs and the need to prioritize therapeutic recommendations in guidelines for treating pain and fever.
Endocanabinoizii şi antiinflamatoarele nesteroidiene (ibuprofen) în patologie. Relaţii utile
Endocannabinoids and nonsteroidal anti-inflammatory drugs (ibuprofen) in pathology. Useful interactions
First published: 28 martie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.53.1.2019.2344
Abstract
Rezumat
Obiectivul acestui articol este provocator, sugerând faptul că tratamentul cu ibuprofen în durere şi febră, ca şi cel cu antiinflamatoare nesteroidiene (AINS), ar trebui să fie regândit pentru a preciza şi implicarea endocanabinoidă a acestei clase de medicamente. AINS implică sistemul endocanabinoid (ECB) ca parte a efectului lor analgezic, iar studiile recente sugerează că acest lucru se poate realiza în cadrul mecanismului cunoscut de acţiune al acestor compuşi asupra ciclooxigenazei (COX). Proiectarea inhibitorilor de COX care activează sistemul endocanabinoid şi inhibitorii FAAH/COX cu acţiune dublă (sinergică) poate deschide calea pentru noi medicamente care vizează o necesitate medicală – durerea –, fără a avea efecte grave gastrointestinale şi cardiovasculare. În plus, alte efecte cunoscute ale ECB în reglarea apetitului pot fi benefice pentru pacienţii cu perturbări nutriţionale, în special la copii. Vom transmite aceste mesaje esenţiale în etape, răspunzând la întrebări pertinente care derivă din necesităţi practice şi din nevoia de prioritizare a recomandărilor terapeutice în ghiduri, în acest caz în durere şi febră.
Complexitatea utilizării canabinoizilor în scopuri medicale preocupă experţii de câteva decenii, în special în domeniul algeziologiei, dar nu numai. Intervenţiile lor metabolice, endocrine şi infracelulare reprezintă o bază solidă pentru aplicarea terapeutică, utilizarea şi cunoaşterea sinergismelor şi antagonismelor cu alte medicaţii, aspecte ce pot fi aplicate în practica obişnuită, la diverşi pacienţi, în scop benefic şi în siguranţă.
Potenţialul terapeutic al canabinoizilor este de actualitate în multe specialităţi şi în pediatrie, unde controlul inflamaţiei a devenit preocupant atât pentru faza acută, cât şi pentru combaterea inflamaţiei cronice, prin prisma relaţiei acesteia cu patologii implicate în mortalitate la vârsta de adult.
Organismul deţine un complex sistem endocanabinoid endogen care are roluri esenţiale în numeroase domenii de control metabolic, imunologic, inflamator, comportamental, procese cognitive, apetit, saţietate şi afect. Sistemul canabinoid controlează major procesele apoptotice celulare, funcţia mitocondrială şi cerebrală.
Sunt preocupante în acest moment următoarele probleme:
-
Cum intervine sistemul endocanabinoid şi care sunt mecanismele şi corelaţiile în procesul patologic al durerii acute şi cronice?
-
Există relaţii între intervenţia sistemului endocanabinoid şi acţiunea antiinflamatoarelor nesteroidiene (AINS)?
-
AINS sunt medicamente care inhibă sau stimulează endocanabinoidele endogene la locul de acţiune?
-
Care sunt considerentele ştiinţifice care pot justifica aplicarea de măsuri terapeutice practice?
Enzimele-ţintă ale AINS, sintetaza 1 şi 2, denumite în mod obişnuit COX-1 şi COX-2, sunt enzimele care catalizează producerea de prostaglandine din acid arahidonic(1). COX-1 şi COX-2 sunt astfel sediul principal asupra căruia acţionează compuşi din clasa AINS, cum ar fi ibuprofenul şi naproxenul, în timp ce COX-2 este vizat de compuşii celecoxib şi L745337. Deşi blocarea producţiei de prostaglandine este asociată inextricabil cu efectele antinociceptice, antiinflamatorii şi antipiretice ale AINS(2), prostaglandinele sunt utile deoarece exercită acţiuni importante de menţinere a homeostaziei organismului.
Utilizarea AINS este asociată cu un risc crescut de evenimente gastrointestinale şi cardiovasculare(3). Strategiile de evitare a acestor probleme au inclus căutarea de donori de oxid de azot, inhibitori ai COX şi compuşi care vizează atât receptorii COX-2, cât şi receptorii tromboxan A2(4).
Ibuprofenul intervine cu eficienţă în analgezie, are acţiune antipiretică şi antiinflamatoare. Acestea sunt atribuite unei acţiuni metabolice comune de diminuare a sintezei prostaglandinelor ca urmare a inhibării ciclooxigenazei, enzimă ce catalizează ciclizarea oxidativă a acidului arahidonic, cu formarea endoperoxizilor ciclici, care sunt substanţe precursoare ale prostaglandinelor, tromboxanilor şi prostaciclinei.
Inhibarea ciclooxigenazei se face prin competiţia între antiinflamatorul nesteroidian şi acidul arahidonic pentru enzimă (figura 1).
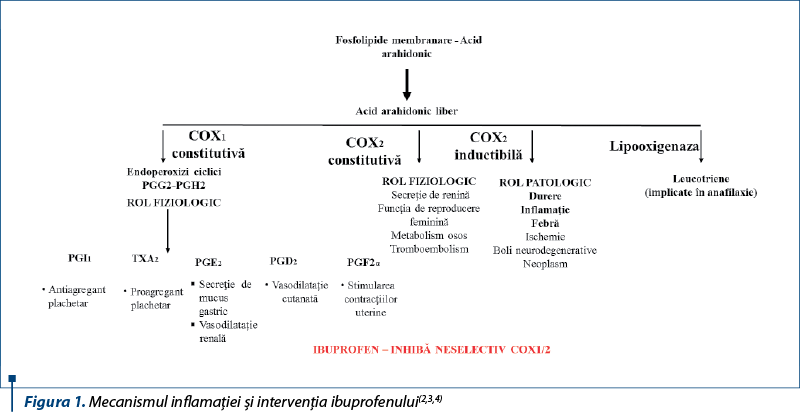
Efectul antiinflamator al AINS este proporţional cu capacitatea lor de inhibare a ciclooxigenzei. Prin inhibarea ciclooxigenazei, antiinflamatoarele nesteroidiene împiedică şi formarea de peroxizi intermediari, iar prin inhibarea activităţii celulelor inflamatorii este împiedicată formarea de radicali liberi. De asemenea, se consideră că prostaglandinele E şi F ar intensifica efectul altor mediatori ai inflamaţiei (în special al bradikininei).
Intervenţia analgezică are constant o participare a canabinoizilor, partea unui sistem complex de substanţe, receptori şi liganzi de mare sensibilitate şi specificitate şi cu interrelaţii de mare complexitate.
Canabinoizii şi endocanabinoizii
Problema utilizării canabinoizilor în scopuri medicale a constituit o preocupare pentru experţii în domeniu de câteva decenii, în special în domeniul algeziologiei, dar şi în alte ramuri de specialitate.
Potenţialul terapeutic al canabinoizilor şi posibilitatea descoperirii unor ţinte terapeutice eficiente sunt mereu în actualitate. Organismul uman deţine un sistem complex de tip endocanabinoid endogen, care are roluri esenţiale în numeroase domenii de control metabolic, imunologic, inflamator, comportamental (procese cognitive, apetit, saţietate, afect). Astfel, sistemul endocanabinoid ajunge să controleze procesele apoptotice, funcţia mitocondrială şi funcţiile cerebrale.
Canabinoizii pot fi clasificaţi în funcţie de originea lor în: fitocanabinoizi, endocanabinoizi şi canabinoizi sintetici. Sistemul canabinoid endogen este un mecanism fiziologic important implicat în stabilirea şi menţinerea sănătăţii umane. Din punct de vedere chimic, reprezintă un sistem lipidergic cu numeroase substanţe implicate în metabolizarea precursorilor, de tip enzime, efectori, produşi finali de metabolism. Astfel, sistemul endocanabinoid uman include receptorii canabinoizi, substanţele endocanabinoide, enzimele şi cofactorii corespunzători activităţii optime a acestora. Efectele funcţionării acestui sistem se manifestă începând de la nivel celular şi până la nivel comportamental.
Endocanabinoizii acţionează prin intermediul receptorilor specifici. Aceşti receptori sunt diseminaţi în tot organismul uman: creier, organe, ţesut conjunctiv, glande şi celule imune efectorii. Pentru fiecare sediu enumerat, sistemul canabinoid îndeplineşte un rol bine definit, specific pentru menţinerea homeostaziei mediului intern şi asigurarea unei stabilităţi în multitudinea fluctuaţiilor create de contactul cu mediul extern şi cu alţi numeroşi factori de perturbare. Sistemul endocanabinoid uman are intervenţii precise în majoritatea funcţiilor fiziologice protective privind homeostazia.
Receptorii canabinoizi CB1 şi CB2 modulează activitatea endocanabinoidelor, din clasa cărora fac parte anandamida, 2-arahidonoilglicerolul şi virodamina. Rolurile centrale ale receptorilor canabinoizi şi liganzilor endogeni sunt plasticitatea neuronală şi regenerarea neurală, nocicepţia şi semnalizarea algică, corijarea profilului cognitiv-mnezic şi psihoemoţional, activitatea metabolică şi comportamentul alimentar, controlul inflamator şi imunologic, ameliorarea somnului şi motricităţii, precum şi efecte protectoare în unele neoplazii.
Primii receptori specifici ai canabinoizilor, denumiţi CB1 („cannabinoid binding”), au fost descrişi în 1988 de echipa lui William Devane şi Allyn Howlet (SUA), iar CB2 au fost descoperiţi în 1993 de Sean Munro şi colaboratorii (Marea Britanie). Apariţia filogenetică a receptorilor şi sistemului endocanabinoid la nevertebratele deuterostomiene (stele-de-mare) are o vechime de 600 de milioane de ani, după cum există dovezi în literatura de specialitate(4). Aceşti receptori sunt unici, astfel că pot cupla doar substanţe din grupul fitocanabinoidelor, endocanabinoidelor şi analogilor sintetici.
Din punct de vedere funcţional, aceştia aparţin superfamiliei A de receptori, cuplaţi la proteina G, specific către grupul Gi/o (Gi 1, 2, 3; Go 1, 2), cu 7 domenii transmembranare, având capătul -NH2 situat extracelular şi -COOH intracelular. Similitudinea receptorilor CB1 şi CB2 este de 44% în total şi de 68% între domeniile transmembranare, fiind echivalenţi în proporţie de 97-99% la şoareci şi om, ceea ce a permis studii experimentale relevante pe modele murine.
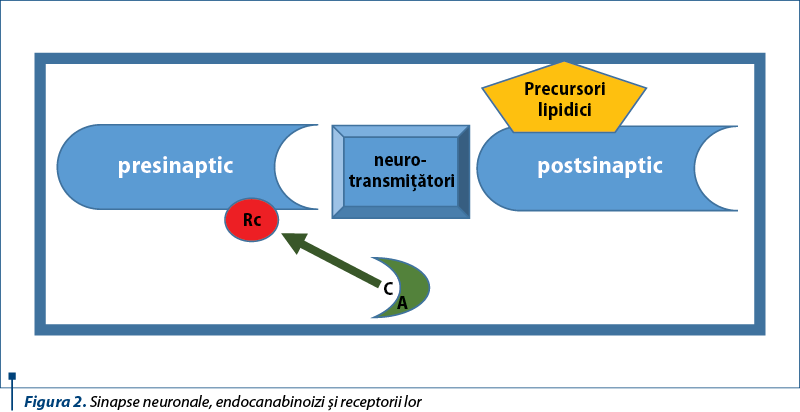
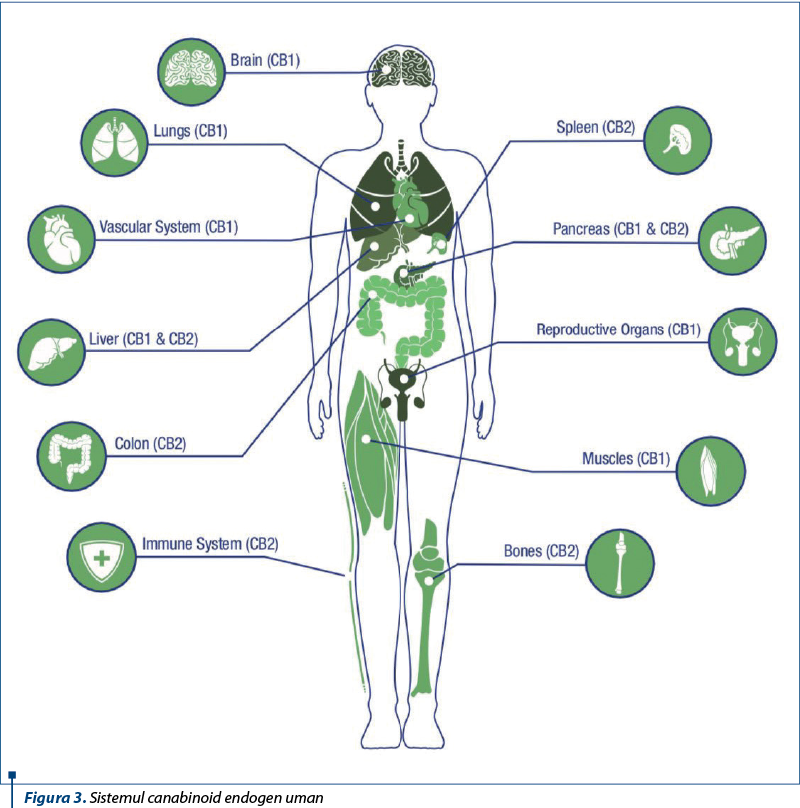
Receptorii CB1 sunt localizaţi preponderent în sistemul nervos central şi periferic şi se consideră ca fiind în proporţia cea mai mare cuplaţi la proteina G din creier, în comparaţie cu receptorii opiozi µ, dopaminergici D2 sau cu alţii similari. Regiunile encefalice în care se depistează receptorul CB1 în cantităţi substanţiale sunt: substantia nigra, globus pallidus, girusul dentat, hipocampusul, cortexul cerebral (în special regiunea frontală, cingulusul anterior, regiunea occipitală, arhitectonic în lamina I şi VI), striatumul (nucleul caudat, putamen), cerebelul, amigdala, talamusul, hipotalamusul, iar periferic este exprimat în neuronii senzitivi ai rădăcinilor posterioare ganglionare şi în substanţa periapeductală. Receptorul CB1 se găseşte în cantităţi variabile, mai mici, în neuronii periferici sau în inimă, plămâni, ficat, rinichi, testicul, prostată, ovar, uter, tractul gastrointestinal, oase, măduva osoasă, timus. În celulele neuronale, receptorul se află cu precădere presinaptic în terminaţiile axonale, corespunzător neuronilor GABA-ergici, glutamatergici, colinergici şi dopaminergici, în porţiunea somatodendritică fiind minim detectabil (figura 2).
Mecanismele de acţiune
Activarea receptorului CB1 prin intermediul proteinei G produce inhibiţia canalelor de Ca2+ tip N-, P/ Q şi L-, activarea canalelor de K+ (GIRK), inclusiv de tip I M şi I A, stimularea sistemului proteinkinazei mitogen-activate (MAPK), kinazei de adeziune focală (FAK), fosfatidil-inozotol-3-kinazei (PI3K), stimularea fosfolipazei A şi C şi a producţiei de oxid nitric.
Receptorul CB1 inhibă adenilatciclaza, însă poate activa formarea de AMPc la cuplarea supraadăugată cu proteina Gs, când, în acelaşi timp, este activată ataşarea obişnuită la o proteină de tipul Gi/o, fenomen cunoscut drept heterodimerizare. Activitatea receptorului CB1 controlează transmiterea impulsurilor nervoase, plasticitatea sinaptică şi remodelarea circuitelor neuronale, proliferarea şi regenerarea celulară, care se transpun în efecte corelate cu nocicepţia, motricitatea şi locomoţia, profilul psihoemoţional şi cognitiv-mnezic, rata de activitate metabolică şi imunologică, controlul inflamaţiei şi ischemiei, dar şi în alte efecte cu aplicaţii terapeutice.
Receptorul CB2 se întâlneşte în special în ţesuturile şi celulele imune, în amigdalele palatine, splină, timus, măduva osoasă, limfocite B, limfocite NK, macrofage, neutrofile, limfocite T (CD8+, CD4+) şi, cu toate că este definit ca receptor periferic, a fost depistat şi în celulele microgliale din SNC.
Mecanismul semnalului celular este, în mare parte, similar receptorului central CB1. Astfel, la activarea receptorului CB2, se inhibă eliberarea de citokine T-helper 1, precum interleukina 2 (IL-2), interferonul gama (IFN-), factorul de necroză tumorală (TNF-); în acelaşi timp, creşte eliberarea citokinelor Th2, de tip IL-4, IL-5, IL-10, având şi alte acţiuni de modulare în procesele inflamatorii şi imune. Efectele receptorului CB2, intrinseci sau condiţionate de alţi factori, cum ar fi coactivarea receptorului CB1 sau implicarea endocanabinoidelor, ţin de aspectul protectiv tisular şi antiinflamator, regenerativ şi antioxidant. Acţiunea medicamentelor poate potenţa, proteja sau inhiba aceste relaţii bine definite. Modularea benefică a activităţii receptorilor canabinoizi şi modificarea funcţiilor celulare în aproape toate ţesuturile şi organele va permite implementarea unor noi posibilităţi terapeutice în toate patologiile evocate.
Liganzii endogeni ai sistemului endocanabinoid sunt substanţe elaborate în organismul uman, care acţionează asupra receptorilor canabinoizi, cu implicaţii în multe procese fiziologice. În anul 1992 s-a descoperit anandamida (cuvântul sanscrit ananda având semnificaţia de beatitudine, fericire), cu denumirea chimică de N-arahidonoiletanolamină (AEA). Anandamida este un agonist parţial al receptorilor CB1 şi CB2 şi mimează efectele Δ9 -THC, însă pe durată mai scurtă şi cu o potenţă mai mică. Al doilea endocanabinoid, descoperit în 1995 în timusul canin şi creierul de şobolan, este 2-arahidonoilglicerol (2-AG), fiind ligandul fiziologic primar pentru ambii receptori canabinoizi, ca un agonist total. AEA şi 2-AG, care sunt lipofile, nu se depozitează în vezicule, dar se eliberează la creşterea influxului de Ca2+ intracelular sau activarea fosfolipazei C, fiind, de asemenea, substanţe proprii sistemului endocanabinoid.
După sintetizare, aceste substanţe sunt eliberate în spaţiul extracelular, unde acţionează asupra receptorilor canabinoizi CB1 şi CB2, dar şi asupra canalelor ionice. Ulterior, acestea sunt preluate intracelular prin difuzie pasivă sau prin intermediul transportatorului membranar de endocanabinoide. Endocanabinoidele sunt eliberate de celula postsinaptică, iar la cuplarea cu receptorul CB1 de pe celula presinaptică induc inhibarea eliberării de neurotransmiţător, excitator (ex.: glutamat) sau inhibitor (ex.: GABA). În acest fel, endocanabinoidele acţionează şi ca mesageri retrograzi, cu implicaţie în plasticitatea sinaptică de durată scurtă sau lungă, în mecanisme de supresie a neurotransmiterii inhibitorii sau excitatorii induse la depolarizare (DSE şi DSI), dar şi în controlul depresiei şi al altor stări patologice.
Anandamida (sub acţiunea enzimatică a FAAH – amid-hidrolaza acidului gras) este metabolizată şi clivată în acid arahidonic şi etanolamină sau, respectiv, glicerol. Cu toate acestea, s-a arătat că 2-AG este inactivat preferenţial de MGL. Enzima COX-2 oxidează AEA şi 2-AG în precursori prostaglandinici (prostamide, prostaglandin-gliceril esteri), iar LOX, în precursori leucotrienici (B4). Produşii rezultaţi din inactivarea prin FAAH şi MGL (monoacil-glicerol lipaza) a endocanabinoidelor intră repetat în componenţa membranei celulare şi astfel regenerează membrana sau servesc din nou în calitate de precursori pentru formarea liganzilor canabinoizi endogeni.
Funcţiile endocanabinoizilor, în special AEA şi 2-AG, includ: implicarea în prelucrarea senzaţiei durerii acute şi cronice, modularea motivaţiei, a plăcerii şi a comportamentului alimentar, participare în ameliorarea mnezică şi calitatea somnului, semnalarea controlului inflamator şi imun.
Implicaţiile în menţinerea homeostaziei sunt majore şi complexe, de la sisteme subcelulare până la ecosisteme şi interrelaţiile lor. Selecţia celulară pentru autofagia fiziologică şi/sau moartea programată sunt, de asemenea, sub influenţa sistemului endocanabinoid, ca şi sinteza, degradarea şi reciclarea materialului biologic.
Endocanabinoidele şi canabinoidele au rol major la interfaţa dintre diferitele sisteme ale organismului, permiţând comunicarea şi coordonarea între diversele tipuri de celule.
La locul unei leziuni, de exemplu, canabinoidele pot diminua eliberarea de activatori şi sensibilizatori tisulari lezionali, modulând celula nervoasă pentru controlul distrucţiei tisulare şi celulele imune pentru a preveni eliberarea de substanţe proinflamatorii, pentru minimizarea durerii şi pentru a tempera răspunsurile postlezionale datorate injuriei inflamatorii(5).
Acţiunile hiperfagice ale THC (tetrahidrocanabinoid) au fost ulterior asociate cu anandamida endocanabinoidelor, 2-AG şi cu agonistul CB1 endogen, eter de noladină. Aceste substanţe cresc aportul alimentar la rozătoare după injectare sistemică sau centrală, iar acţiunile lor sunt blocate de rimonabant. Este important ca anandamida şi 2-AG să promoveze hiperfagia atunci când sunt administrate în regiuni ale creierului asociate cu motivaţia alimentării, inclusiv nucleele hipotalamice şi coaja nucleului accumbens. Prin urmare, aceste date susţin cu fermitate un rol esenţial al endocanabinoidelor în modularea, reglarea şi exercitarea apetitului(5).
Antagoniştii sau perturbatorii CB1, pe de altă parte, sunt anorexigeni şi antrenează o pierdere în greutate semnificativă la modelele experimentale(5). Aceste efecte deschid noi căi de tratament pentru anorexie şi stări catabolice asociate infecţiilor. De asemenea, efectul antiemetic este un argument pentru utilizarea agoniştilor CB1 în chimioterapie sau în tratamentul infecţiei cu HIV.
Au existat preocupări privind modul în care se comportă AINS în acest important mecanism de intervenţie în analgezie şi în reglarea apetitului, cu consecinţe asupra masei corporale. S-a demonstrat prin studii de specialitate că perturbările semnalelor sistemului endocanabinoid pot determina apariţia unor grave perturbări de control al alimentaţiei.
AINS, şi în special ibuprofenul, pe lângă efectele lor asupra sintezei prostaglandinelor, inhibă căile de metabolizare a endocanabinoidelor, 2-arahidonilglicerolului (2-AG) şi anandamidei (AEA) prin ciclooxigenaza-2 (COX-2) şi amid-hidrolaza acidului gras (FAAH). S-a investigat dacă aceste efecte asupra metabolismului endocanabinoid sunt similare principalilor metaboliţi ai ibuprofenului şi flurbiprofenului. S-a remarcat faptul că atât copiii, cât şi adulţii suferă modificări ale apetitului în timpul infecţiei, fiind astfel importantă minimizarea efectelor digestive şi anorexigene ale medicaţiei utilizate în analgezie.
Studiile extensive(4,5,6-9) au demonstrat că mai multe AINS au inhibat FAAH şi că, astfel, potenţialul inhibitor al compuşilor a fost crescut semnificativ. Efectul asupra pH-ului este unul important, având în vedere că pH-ul este redus după inflamaţie, iar studiile efectuate la celule intacte au demonstrat că, de fapt, este redus pH-ul extracelular la 6,2 pentru a creşte de 5-10 ori potenţa inhibării ibuprofenului şi flurbiprofenului din hidroliza AEA.
Ipoteza că AINS, în plus faţă de inhibarea producţiei de prostaglandine, blochează şi activitatea FAAH, determinând astfel o activitate crescută a sistemul endocanabinoid, este una reală. În modelul durerii persistente la formalină, ibuprofenul administrat local şi AEA produc efecte sinergice asupra scorului durerii compuse. Efectele indometacinei şi ale inhibitorului FAAH URB597 asupra edemului indus de caragenină la şoarece sunt ambele blocate de receptorul antagonist CB2/agonistul invers SR144528. Astfel, inhibarea mediată de AINS pentru FAAH poate contribui la efectele ibuprofenului. În 2009, Prusakiewicz et al. au raportat studii potrivit cărora ibuprofenul şi acidul mefenamic au fost inhibitori mai buni ai ciclooxigenării catalizate de COX-2 şi a 2-AG decât a acidului arahidonic. Studiile ulterioare au arătat că aceasta este o proprietate a mai multor AINS, incluzând naproxenul, care blochează 50 mM 2-AG, precum şi ciclooxigenarea acidului arahidonic cu COX-2.
Ibuprofenul este, de asemenea, un inhibitor mai bun al COX-2-ciclooxigenării AEA decât a ciclooxigenării acidului arahidonic. Condiţiile structurale pentru ciclooxigenarea AEA şi 2-AG de către COX-2 sunt diferite de cele pentru acidul arahidonic, având şi o potenţă mai mare decât cea a ibuprofenului.
Duggan şi colab. au investigat efectul AINS de tip R-flurbiprofen, naproxen şi ibuprofen. Cei trei compuşi (R-flurbiprofen, R-ibuprofen şi R-naproxen) nu au avut efect asupra producerii de prostaglandine, în concordanţă cu potenţialul inhibitor al COX al acestor enantiomeri. Totuşi, compuşii au redus producţia atât a etanolamidelor de prostaglandină, cât şi a esterilor de gliceril de prostaglandină şi au crescut nivelul AEA şi al 2-AG, dar nu şi pe cel al acidul arahidonic. Autorii au sugerat, pe baza acestor date, faptul că în ţesutul inflamat, COX-2 indusă determină epuizarea semnificativă a nivelurilor endocanabinoidelor şi că R-profenii normalizează acest lucru prin prevenirea ciclooxigenării lor.
Activarea EC şi a CB1 la nivel hipotalamic stimulează foamea şi creşte apetitul. Prin stimularea sistemului endocanabinoid se promovează suplimentar homeostazia, se reduce senzaţia de durere şi scade inflamaţia.
Mesajele practice ale acestor cercetări recente sunt următoarele:
1. Sinergismul de acţiune între ibuprofen şi sistemul endocanabinoid reprezintă o garanţie a efectului analgezic şi antiinflamator.
2. Ibuprofenul permite efectele de semnalizare, modulare a endorfinelor şi receptorilor endocanabinoizi, obţinând astfel păstrarea apetitului în timpul bolii, un beneficiu enorm pentru copil.
Conflict of interests: The author declares no conflict of interests.
Bibliografie
- Pertwee RG, Howlett AC, Abood ME, et al. International Union of Basic and Clinical Pharmacology LXXIX. Cannabinoid receptors and their ligands: beyond CB1 and CB2. Pharmacol Rev. 2010;62(4):588-631.
- Guindon J, Hohmann AG. Cannabinoid CB2 receptors: a therapeutic target for the treatment of inflamatory and neuropathic pain. Br J Pharm. 2008;153:319-334.
- Busquets Garcia A, Soria-Gomez E, Bellocchio L, Marsicano G. Cannabinoid receptor type-1: breaking the dogmas. Res. 2016;5:990.
- Verty ANA, Evetts MJ, Crouch GJ, McGregor IS, Stefanidis A, Oldfield BJ. The Cannabinoid Receptor Agonist THC Attenuates Weight Loss in a Rodent Model of Activity-Based Anorexia. Neuropsychopharmacology. 2011 Jun; 36(7):1349-1358.
- Pertwee RG. Pharmacological actions of cannabinoids. Handb Exp Pharmacol. 2005:1-51.
- Berry EM, Mechoulam R. Tetrahydrocannabinol and endocannabinoids in feeding and appetite. Pharmacol Ther. 2002;95:185-188.
- Toczek M, Malinowska B. Enhanced endocannabinoid tone as a potential target of pharmacotherapy, Life Sci. 2018 Jul 1;204:20-45.
- Cippitelli, G. Astarita, A. Duranti, G. Caprioli, M. Ubaldi, S. Stopponi, M. Kallupi, G. Sagratini, F. Rodrìguez de Fonseca, D. Piomelli, R. Ciccocioppo. Endocannabinoid regulation of acute and protracted nicotine withdrawal: effect of FAAH inhibition, PLoS One 6. 2011; (11) e28142.
- Naidu PS, Booker L, Cravatt BF, Lichtman AH. Synergy between enzyme inhibitors of fatty acid amide hydrolase and cyclooxygenase in visceral nociception. J Pharmacol Exp Ther. 2009 Apr;329(1):48-56.
Articole din ediţiile anterioare
Ibuprofen: eficacitate şi siguranţă pentru pacientul pediatric
Ibuprofenul este principalul antiinflamator nesteroidian (AINS) cu efect analgezic şi antipiretic recomandat copiilor, în cazul unei game de afecţi...
Medicaţia antitermică şi astmul bronşic la copil
Utilizarea medicaţiei antitermice la pacienţii cu astm bronşic a generat unele controverse, cunoscute fiind din literatură interferenţele cu patoge...