The immune system is faced with multiple infectious challenges during childhood. Most often inefficient, in time is acquired the adaptive immunity, conferring protection. This period of vulnerability can benefit from non-specific immune interventions that prove effective through studies and mechanisms currently decoded.
Intervenţii actuale eficiente în imunitatea copilului
Current effective interventions in child's immunity
First published: 04 aprilie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.45.1.2017.550
Abstract
Rezumat
Sistemul imunitar este confruntat cu multiple provocări infecţioase la vârstă mică. De cele mai multe ori ineficient, în timp se dobândeşte imunitatea adaptativă care conferă protecţie. Această perioadă de vulnerabilitate poate beneficia de intervenţiile imune nespecifice, care se dovedesc eficiente, prin studii şi mecanisme descifrate în prezent.
Dezvoltarea sistemului imunitar presupune o serie de etape esenţiale în modulările imune ulterioare. Vârsta copilului reprezintă o perioadă pe cât de vulnerabilă, pe atât de spectaculoasă din punctul de vedere al acestor transformări. Există o relaţie specială cu „zestrea” genetică, dar în acelaşi timp factorii de mediu determină finalitatea acestor transformări.
S-a demonstrat că, în copilărie, expunerea la antigene microbiene determină scăderea riscului de atopie(1).
Teoria igienei, emisă de Strachan(2), explică faptul că este necesar contactul între gazdă şi antigenele din mediu pentru dezvoltarea unui sistem imun competent şi eficient. Creşterea expunerii copiilor în momentul dezvoltării sistemului imun la antigene de suprafaţă ale agenţilor patogeni scade riscul de atopie şi de alergii ulterioare. Totodată, consumul de probiotice în timpul sarcinii şi continuarea administrării acestora în perioada postnatală sunt elemente care scad riscul de dermatită atopică şi sensibilizare alimentară la vârste mai mari(3).
Tractul respirator la copil are mai multe linii de apărare, care se modifică odată cu vârsta. Prima linie este reprezentată de bariera mecanică - epiteliu respirator ciliat şi mucus, care conţine IgA secretorii şi macrofage. La adulţi, mucusul este îmbogăţit cu proteine antibacteriene (defensine, lizozim, IgA), imunomodulatoare (secretoglobine, citokine) şi proteine protectoare. La copii, acestea nu se dezvoltă până la vârsta de 5-7 ani.
Imaturitatea apărării respiratorii la copil se datorează răspunsului inflamator înnăscut, expresiei scăzute a toll-like receptorilor (TLR2 şi TLR4) pe celulele membranare epiteliale, comparativ cu adulţii, şi spectrului scăzut de recunoaştere a microorganismelor.
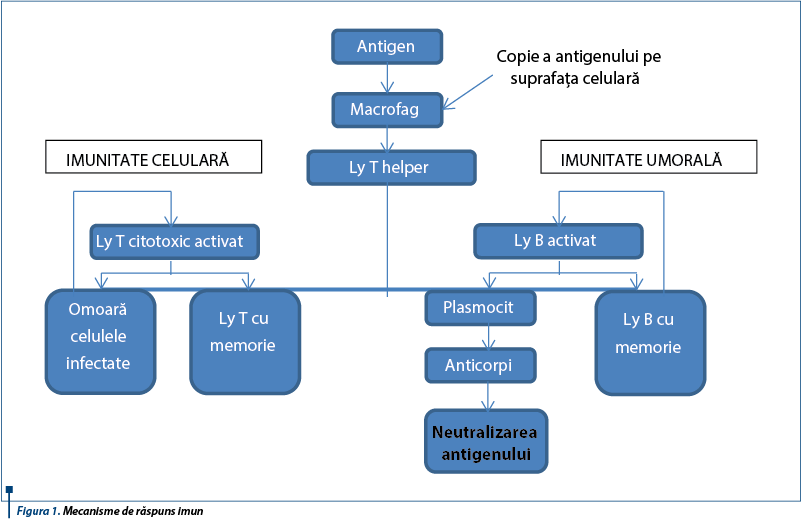
Suportul imunităţii nespecifice şi adaptative îl reprezintă mecanismele intime de interacţiune a antigenului cu celulele inflamatorii ale gazdei. Mecanismele înnăscute sunt susţinute de un pool de limfocite, macrofage şi celule dendritice = BALT (bronchus-associated lymphoid tissue). Proliferarea şi activarea acestora se amplifică repede, datorită expunerii crescute la antigenele bacteriene (astfel, TLR au rol deosebit). Imunitatea celulară înnăscută deficitară rezultă din scăderea producţiei citokinelor proinflamatorii şi reducerea macrofagelor (chemotaxie, adeziune, migrare, fagocitoză). Imunitatea umorală se bazează pe anticorpi, a căror concentraţie creşte continuu în copilărie, iar principala clasă de imunoglobuline protectoare ale căilor respiratorii este IgA.
Intervenţiile corectoare ale sistemului imun se bazează pe stimularea sau inhibarea funcţiilor celulelor imunocompetente, dar sunt necesare studii minuţioase în acest sens. Există mai multe noţiuni ce trebuie clarificate:
- Imunoterapia influenţează activ sistemul imunitar, având ca scop normalizarea stării funcţionale a acestuia. Este necesară atât în dereglările ereditare, cât şi în cele dobândite ale sistemului imunitar. Corecţia se realizează prin preparate speciale, obţinute prin extragerea lor din elemente ale sistemului imunitar sau din analogii sintetici ai produselor sistemului imunitar (imunoglobuline, interleukine, interferoni etc.).
- Imunostimularea poate fi selectivă (specifică) sau nespecifică şi reprezintă stimularea componentelor inhibate ale sistemului imunitar (timomimeticele, aditivele ş.a.).
- Imunosupresia reprezintă deprimarea hiperactivităţii componenţilor sistemului imunitar, în cazul în care această scădere a activităţii imune se impune.
- Imunomodularea presupune o acţiune asupra sistemului imunitar care duce simultan la micşorarea hiperactivităţii şi la stimularea componentelor suprimate ale acestuia.
- Imunocorecţia implică o acţiune asupra sistemului imunitar ce duce la lichidarea defectelor lui şi la restabilirea funcţiilor normale.
- Imunoprofilaxia se referă la administrarea preparatelor (vaccinurilor etc.) pentru stimularea sistemului imunitar şi creşterea rezistenţei la diverşi agenţi infecţioşi.
- Imunoreabilitarea este un complex de acţiuni imunotrope îndreptate spre restabilirea până la normal a parametrilor sistemului imunitar.
Sistemul imunitar funcţionează ca o balanţă: când apare o tulburare într-un sens sau altul, are loc o modulare a întregului sistem. Imunomodulatorul poate acţiona selectiv asupra unuia sau altui component al imunităţii, dar rezultatul final al acţiunii sale va fi întotdeauna multidirecţionat.
Imunostimularea cu lizate bacteriene
Lizatele bacteriene reprezintă particule fracţionate mecanic sau celule liofilizate degradate chimic derivate din tulpini patogene responsabile de infecţii ale tractului respirator. Există diverse specii bacteriene folosite în prepararea lizatelor, dar 8 dintre acestea sunt cele mai utilizate: Staphylococcus aureus, Streptococcus viridans, Streptococcus pyogenes, Diplococcus pneumoniae, Klebsiella pneumoniae, Klebsiella ozaenae, Neisseria catarrhalis, Haemophilus influenzae.
Lizatele bacteriene pot fi administrate oral, intranazal sau sublingual. În cazul celor administrate intranazal şi sublingual, se activează atât răspunsurile imune la nivelul mucoasei, cât şi la nivelul submucoasei respiratorii.
Lizatele bacteriene s-au folosit pentru a scădea recurenţa infecţiilor respiratorii la copii şi la adulţi cu BPOC (boală pulmonară obstructivă cronică). Ingestia orală a lizatelor bacteriene s-a dovedit a scădea şi numărul de episoade de wheezing induse de virusuri la copiii cu astm bronşic(4).
Totodată, aceste preparate s-au demonstrat a avea şi efect preventiv asupra sensibilizărilor alimentare şi a eczemei atopice la copii(5).
Lizatele bacteriene administrate oral sunt absorbite la nivelul tractului gastrointestinal şi prezentate ţesutului limfoid asociat intestinului (GALT), respectiv foliculilor limfoizi din plăcile Peyer. Aici are loc contactul antigenelor bacteriene cu celulele dendritice, urmând generarea limfocitelor T antigen-specifice care modulează izotipul limfocitelor B, ce la rândul lor stimulează producţia de IgA şi secreţia de citokine (TGF-b, membri ai familiilor TNF). Limfocitele, limfoblaştii şi celulele dendritice activate migrează în nodulii limfatici mezenterici pentru maturare, apoi sunt trimise în circulaţia sistemică şi limfatică, de unde sunt depozitate în ţesutul limfoid asociat mucoaselor (MALT). Astfel, plasmocitele producătoare de IgA la nivelul mucoaselor conferă protecţie împotriva patogenilor respiratori, după cum arată unele studii în acest sens, atât pe model animal, cât şi uman.
Administrarea orală a ribozomilor bacterieni şi a proteoglicanilor a dus la creşterea limfocitelor B şi a plasmocitelor la nivelul amigdalelor palatine şi la creşterea concentraţiei salivare de IgA solubil (sIgA) specific determinanţilor antigenici.
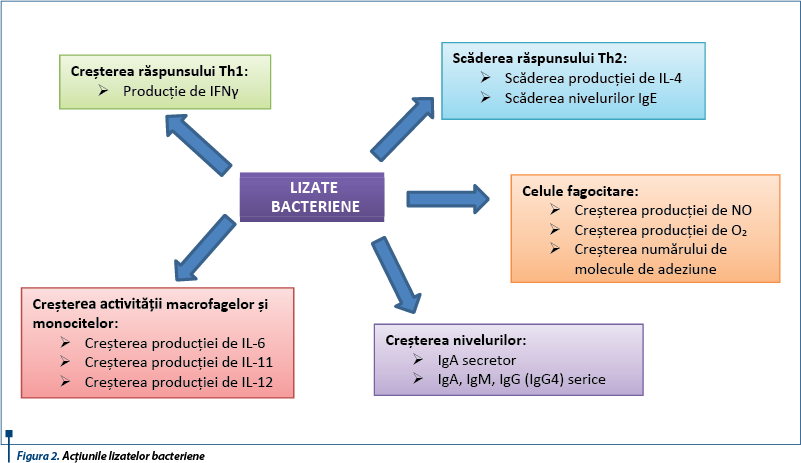
O altă proprietate interesantă a imunostimulării utilizând lizate bacteriene o reprezintă capacitatea acestora de a induce un răspuns imunoreglator la nivelul MALT, efect mediat de celulele dendritice. Administrarea componentelor bacteriene duce la creşterea expresiei celulelor T reglatorii CD4+CD25+Foxp3+ şi la supresia celulelor T helper TH2 şi TH17.
Imunostimularea nespecifică prin betaglucani
Betaglucanii din drojdia brutarului au efecte imunomodulatoare şi reduc incidenţa infecţiilor respiratorii superioare la adulţi. Studiile la vârsta pediatrică sunt mai puţin numeroase, dar efectele betaglucanilor par a fi benefice şi la copii.
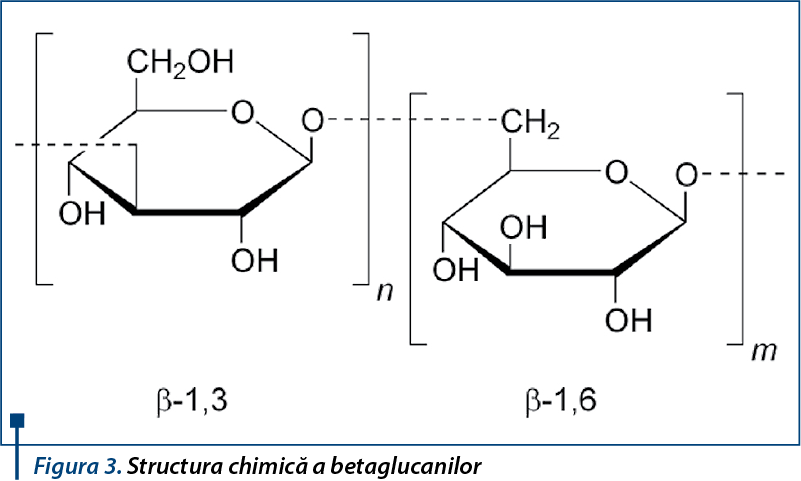
Betaglucanii reprezintă structuri purificate din peretele celular al Saccharomyces cerevisiae, aprobate pentru utilizare în Asia, Europa, America de Nord şi de Sud, ca ingrediente şi suplimente alimentare. Structura chimică corespunde unor derivaţi de b-D-glucoză, cu proprietăţi imunomodulatoare şi a căror utilizare scade incidenţa infecţiilor de tract respirator atât la adulţi, cât şi la copii.
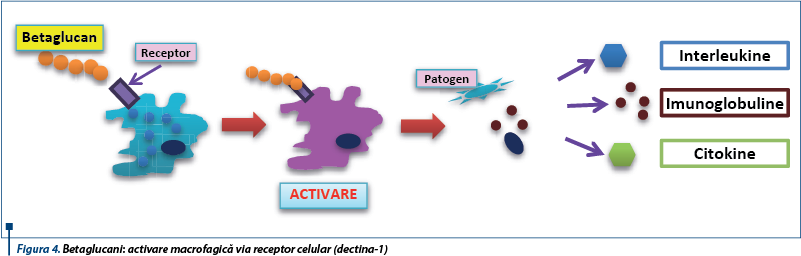
Dectina-1 (cunoscută şi ca CLEC7A) este un receptor celular al fagocitelor (macrofage, celule dendritice, neutrofile), care detectează betaglucanii şi declanşează răspunsuri antimicrobiene directe (fagocitoză, producerea de specii reactive de oxigen etc.).
Spre deosebire de răspunsurile imune stimulate de detectarea liganzilor solubili de către TLR, mecanismele în care sunt implicaţi betaglucanii sunt bazate pe contactul direct cu agenţii patogeni. Astfel, dectina-1 devine „sinapsă fagocitară”, descriindu-se un nou model al răspunsului imun înnăscut prin care receptorii pot detecta direct patogenii. Iniţierea răspunsurilor directe antimicrobiene se realizează doar atunci când acestea sunt necesare. Stimularea macrofagelor cu betaglucani duce la activarea dectinei-1 şi induce producţia de CD45 şi CD148, beta-glucanii fiind astfel inductori macrofagici şi polinucleari(6).
Se realizează astfel o stimulare imunitară nespecifică, cu efecte benefice atât la nivel local, cât şi la nivel sistemic. Betaglucanii reprezintă unul din tiparele moleculare microbiene (MAMPs = microbe associated molecular patterns) care sunt recunoscute de anumiţi receptori imuni, iar această recunoaştere duce la răspunsuri imune eficiente. În ultima perioadă, betaglucanii sunt în atenţia cercetărilor tocmai pentru aceste efecte benefice, fiind chiar numiţi „noile prebiotice”.
Un studiu randomizat, dublu-orb, controlat placebo, a fost realizat în 2016, de Meng şi colab., în China, pe un număr de 174 de copii cu vârste cuprinse între 1 şi 4 ani. Durata studiului a fost de 12 săptămâni, timp în care populaţia de studiu a primit suplimente cu betaglucani. Autorii au observat că administrarea de betaglucani a fost bine tolerată, iar pacienţii care au primit betaglucani au prezentat mai puţine episoade de infecţii respiratorii comparativ cu populaţia placebo (p<0,0001). Totodată, betaglucanii scad semnificativ durata episodului infecţios şi numărul de episoade infecţioase respiratorii acute per copil(7).
Colostrul bovin
Colostrul bovin reprezintă o sursă bogată de imunoglobuline G. Acesta provine de la animale hiperimunizate - vaccinate anterior antigripal A/Puerto Rico/8/34 (PR8). Ulterior, IgG şi F(ab’)2 purificate au fost administrate la şoareci cu 7 zile anterior infectării cu virus gripal. S-a observat că, în comparaţie cu placebo, şoarecii care au primit ser hiperimun din colostru bovin au supravieţuit. Se demonstrează, astfel, rolul protectiv al colostrului imun împotriva infecţiei cu virus gripal, constituindu-se într-o intervenţie imună nespecifică eficientă(8).
Zincul
Suplimentarea cu zinc scade incidenţa infecţiilor respiratorii la copil, după cum susţine un studiu efectuat pe 609 copii în India. Administrarea de 10 mg zinc elemental pe zi, timp de 6 luni, comparativ cu placebo, a scăzut semnificativ episoadele respiratorii acute atât la copii mici, cât şi la preşcolari, concluzionându-se că suplimentarea zilnică cu zinc duce la o reducere semnificativă a morbidităţii respiratorii(9).
Vitamina D şi sistemul imunitar
Deficitul de vitamină D este asociat cu astm bronşic, boli autoimune, diabet zaharat, alături de clasicul rol în patogenia rahitismului carenţial. Există o legătură bine cunoscută între nivelurile circulante ale vitaminei D şi infecţiile respiratorii.
Vitamina D are efect direct pe sistemul imunitar adaptativ, realizând intervenţii imune eficiente la vârstă mică. Este supresor al producţiei de IL-12 şi promotor al diferenţierii celulelor dendritice. Mecanismele imune sunt încă în curs de descifrare, dar legăturile dintre vitamina D, infecţii şi rolurile imunologice ale acesteia indică noi potenţiale terapii care implică suplimentarea vitaminei D în infecţiile respiratorii.
Concluzii
Modularea imună nespecifică joacă un rol deosebit de important în prevenţia infecţiilor virale şi bacteriene la copii. La o vârstă la care sistemul imunitar poate beneficia de orice intervenţie ajutătoare din exterior, noi agenţi aflaţi în atenţia cercetătorilor îşi demonstrează eficienţa şi beneficiile.
Bibliografie
2. Strachan DP. Hay fever, hygiene, and household size. BMJ. 1989; 299:1259e1260.
3. Pfefferle PI, Prescott SL, Kopp M. Microbial influence on tolerance and opportunities for intervention with prebiotics/probiotics and bacterial lysates. J Allergy Clin Immunol. 2013; 131:1453e1463.
4. Razi CH, Harmanci K, Abaci A, et al. The immunostimulant OM-85 BV prevents wheezing attacks in preschool children. J Allergy Clin Immunol. 2010; 126:763e769.
5. Lau S. Bacterial lysates in food allergy prevention. Curr Opin Allergy Clin Immunol. 2013; 13:293e295. Lau S, Gerhold K, Zimmermann K, et al. Oral application of bacterial lysate in infancy decreases the risk of atopic dermatitis in children with 1 atopic parent in a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2012;129:1040e1047.
6. Goodridge HS, Reyes CN, Becker CA, Katsumoto TR, Ma J, Wolf AJ, Bose N, Chan AS, Magee AS, Danielson ME, Weiss A, Vasilakos JP, Underhill DM. Activation of the innate immune receptor Dectin-1 upon formation of a 'phagocytic synapse'. Nature 472, 471–475 (28 April 2011).
7. Meng F (2016) Baker’s Yeast Beta-Glucan Decreases Episodes of Common Childhood Illness In 1 to 4 Year Old Children during Cold Season in China. J Nutr Food Sci 6: 518.
8. Ng WC, Wong V, Muller B, Rawlin G, Brown LE. Prevention and treatment of influenza with hyperimmune bovine colostrum antibody. PLoS One. 2010 Oct 26;5(10):e13622. doi: 10.1371/journal.pone.0013622.
9. Sazawal S, Black RE, Jalla S, Mazumdar S, Sinha A, Bhan MK. Zinc supplementation reduces the incidence of acute lower respiratory infections in infants and preschool children: a double-blind, controlled trial. Pediatrics. 1998 Jul;102(1 Pt 1):1-5.
Articole din ediţiile anterioare
Aportul de vitamină D şi starea greutăţii la copiii preşcolari
Ghidul privind evaluarea şi terapia deficitului de vitamină D la gravide, nou-născuţi şi la copiii preşcolari subliniază importanţa abordării per...