Myxomatous mitral valve disease (MMVD; degenerative valvular disease, endocardiosis, chronic valvular disease) is one of the most common acquired cardiac disease of dogs (75-80% from the cardiac diseases), characterized by mitral valve insufficiency. Pathologically, it is characterized by myxomatous degeneration of leaflets which does not have a congenital aspect, and that can progress to prolapse of one or both leaflets toward the left atrium during systole, and severe heart failure. It seems that the diseases is age and breed dependent. In most of the cases, MMVD occurs in dogs older than 5-8 years old and progresses as the dogs get older. The most predispose breed is Cavalier King Charles Spaniel, followed by Poodle (miniature and toy), Bichon, Lhassa Apso, Shih Tzu, Miniature Schnauzer, Cocker Spaniel, Chihuahua, Fox Terrier, Beagle, Pekinese, Dachshund, Yorkshire Terrier and Boston Terrier. This study aims to correlate the clinical and paraclinical examinations with the changes found in the echocardiographic examination.
Corelaţii clinico-imagistice la câinii cu mixomatoză valvulară mitrală
Clinical-imagistic correlations in dogs with myxomatous mitral valve disease
First published: 19 aprilie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.30.1.2018.1588
Abstract
Rezumat
Boala mixomatoasă valvulară (boală degenerativă valvulară, endocardioză, boală cronică valvulară) este una dintre cele mai întâlnite boli cardiovasculare la câini (75-80% dintre afecţiunile cardiace) fiind caracterizată prin insuficienţă valvulară mitrală. În ceea ce priveşte patologia, apare o degenerescenţă mixomatoasă a cuspidelor valvulare mitrale, fără a avea un aspect congenital, care are drept consecinţe prolapsul unei cuspide sau al ambelor în atriul stâng în timpul sistolei şi insuficienţă cardiacă congestivă severă. Acest tip de afecţiune este dependent de vârsta animalului şi de rasă. În cele mai multe cazuri, boala mixomatoasă valvulară apare la animalele de peste 5-8 ani şi progresează pe măsură ce înaintează în vârstă. Rasa cea mai predispusă este Cavalier King Charles Spaniel, urmată de Poodle (varianta pitic şi toy), Schnautzer pitic, Cocker Spaniel, Chihuahua, Fox Terrier, Beagle, Pekinez, Dachshund şi Boston Terrier. Acest studiu îşi propune o corelare a examenului clinic şi paraclinic cu modificările depistate la examenul ecocardiografic.
Scopul lucrării
Scopul lucrării a fost de a stabili dacă în cazul degenerescenţei valvulare mitrale există o corelaţie între examenul clinic şi paraclinic cu examenul ecocardiografic.
Examenul ecocardiografic este examenul de bază pentru confirmarea diagnosticului, evaluarea severităţii, a complicaţiilor şi a prognosticului, prin evaluarea funcţiei sistolice şi diastolice a ventriculului stâng, precum şi a remodelărilor cardiace.
Evaluarea clinică are ca scop principal diagnosticul pozitiv şi, în măsura în care este posibil, diagnosticul etiologic. Evaluarea clinică are la bază două etape obligatorii:
- Anamneza, prin care se urmăreşte precizarea debutului afecţiunii, evoluţia, complicaţiile survenite pe parcursul acesteia, tratamentele urmate de pacient până la momentul actual şi efectele secundare ale acestora. O anamneză corectă poate sugera dacă etiologia afecţiunii valvulare este congenitală sau dobândită.
- Examenul fizic se face prin: inspecţie (oferă detalii importante despre aspectul mucoaselor, timpul de reumplere capilară, prezenţa sau nu a edemelor declive etc.), auscultaţia cordului (depistarea suflurilor caracteristice, diferite aritmii şi sunete supradăugate), auscultaţia pulmonilor (ralurile de stază sau abolirea murmurului vezical), evaluarea pulsului periferic, determinarea tensiunii arteriale, evaluarea abdomenului (hepatomegalie, reflux hepatojugular, ascită).
- Evaluarea paraclinică cuprinde o serie de explorări care contribuie la confirmarea diagnosticului şi/sau a complicaţiilor apărute. Din aceasta fac parte: examenul electrocardiografic, examenul radiologic toracic, examenul de laborator (determinarea proteinei C reactive, biomarkerilor BNP şi cTnI, metaloproteinazelor 2 şi 9).
Materiale şi metode/discuţii
Endocardioza mitrală (boala valvulară cronică sau boala degenerativă a valvei mitrale) este cardiomiopatia cel mai frecvent întâlnită la câinii adulţi. Deoarece poate afecta peste 60% dintre câinii de peste 9 ani are o importanţă deosebită în practica veterinară. Această afecţiune este cu atât mai importantă, cu cât se poate complica cu ruptura cordajelor tendinoase şi prolapsul cuspidelor mitrale
Anamneza. Principalele motive pentru care proprietarii solicită examinarea animalelor lor sunt dispneea respiratorie şi tusea persistentă, determinate, în principal, de edemul pulmonar sau de compresia bronhiilor principale de către dilataţia severă a atriului stâng. Din anamneză reiese că animalele prezentate la control nu se pot odihni în timpul nopţii, sunt agitate, refuză poziţia decubitală sau preferă decubitul sternal. În plus, sunt slăbite şi prezintă intoleranţă la efort, sincope ocazionale, au un apetit capricios şi un indice corporal scăzut. Există şi situaţii când animalele sunt asimptomatice şi sunt diagnosticate întâmplător la un control de rutină.
Examenul clinic. Examenul clinic constă din coroborarea mai multor date care implică statusul animalului, culoarea mucoaselor, timpul de reumplere capilară, evaluarea pulsului (inclusiv a celui jugular, şocul precordial), palparea abdomenului şi un examen complet al aparatului cardiovascular şi pulmonar. În funcţie de semnele clinice prezentate la examenul clinic şi de gradul de toleranţă al animalului la efort, se face o clasificare a insuficienţei cardiace conform International Small Animal Cardiac Health Council (ISACHC) (tabelul 1).
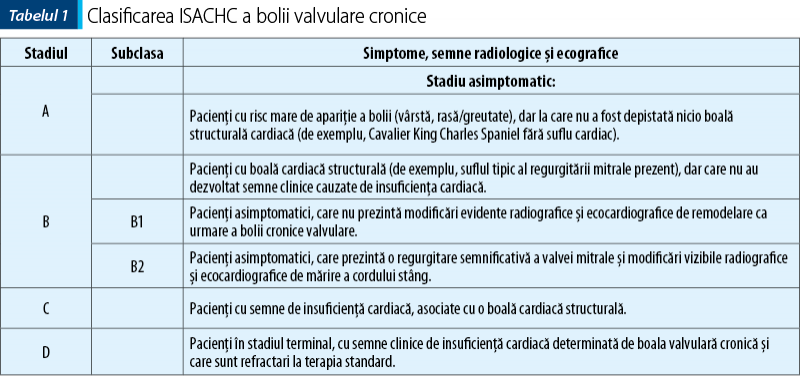
La examenul clinic, cel mai frecvent (74% dintre cazuri) este este suflul sistolic apexian stâng (spaţiul 5-6 intercostal între stern şi articulaţia costo-condrală), care poate radia şi pe focarul tricuspidian de pe partea dreaptă, în funcţie de severitatea bolii. Intensitatea suflului sistolic este un indicator al severităţii bolii şi constituie un semn clinic caracteristic refluxului mitral, dar nu este un semn patognomonic al unei afecţiuni valvulare mitrale degenerative. De aceea, se va lua în considerare numai împreună cu vârsta şi cu rasa animalului respectiv, chiar dacă acesta este asimptomatic sau cu insuficienţă cardiacă congestivă. Tot la auscultaţie, în caz de edem pulmonar se pot auzi şi raluri pulmonare crepitante.
Examinarea tensiunii arteriale
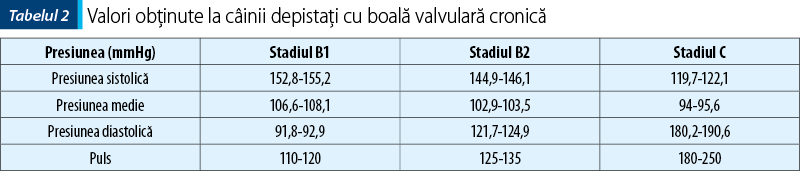
Determinarea tensiunii arteriale a fost realizată cu un Vet HDO Monitor (S+B MedVet, GmbH), cu ajutorul unei manşete neonatale plasate pe baza cozii, fiind obţinute valorile din tabelul 2.
Examinarea radiologică a toracelui
Examinarea radiologică a toracelui se face în incidenţa laterală stângă şi dorsoventrală, permiţând astfel aprecierea dimensiunii şi formei siluetei cardiace, evaluarea corectă a poziţiei cordului în torace şi raporturile acestuia cu alte structuri din cavitatea toracică (diafragm, trahee, stern). De asemenea, poate fi evaluată şi dimensiunea principalelor artere de la nivel cardiac (aorta şi trunchiul pulmonar). În plus, permite evaluarea parenchimului pulmonar din punctul de vedere al opacităţii, împreună cu evaluarea bronhiilor şi a vaselor de sânge de la acest nivel. Examenul radiologic este necesar pentru observarea consecinţelor hemodinamice ale endocardiozei mitrale, modificări care depind de severitatea afecţiunii valvei mitrale. Pentru aceasta sunt necesare cel puţin două proiecţii ortogonale: o incidenţă latero-laterală stângă şi una dorsoventrală sau ventrodorsală. În formele uşoare de endocardioză mitrală, în majoritatea cazurilor nu se întâlnesc modificări, iar dacă sunt totuşi prezente, sunt reprezentate de dilataţia atriului şi ventriculului stâng. În incidenţa laterală, semnele dilataţiei atriale şi ventriculare stângi sunt reprezentate de modificarea marginii caudale a cordului, creşterea dimensiunii atriului stâng şi deplasarea dorsală a bifurcaţiei traheo-bronşice, compresia şi deplasarea dorsală a bronhiei stângi a lobului caudal stâng, o creştere a contactului dintre cord şi diafragm, dilataţia venelor pulmonare ventrale şi mediale în raport cu bronhiile şi semnele de insuficienţă cardiacă congestivă şi mărirea indicelui Buchanan (scorul vertebral). În cazul distensiei venelor pulmonare, diametrul acestora îl poate depăşi pe cel al arterelor şi devin mai tortuoase, fiind astfel un indicator al congestiei pulmonare. În incidenţa dorsoventrală sau ventrodorsală se observă o rotunjire a cordului stâng, în formă de „D“ inversat, creşterea dimensiunilor atriului stâng, caracterizate prin bombarea marginii craniale stângi (între ora 2 şi ora 3), o rotunjire a apexului, o deplasare a apexului spre dreapta şi o mărire a diametrului aortei. În fazele de debut ale afecţiunii se observă un pattern de tip interstiţial caracterizat printr-o creştere a opacităţii pulmonare în regiunea hilară, care poate progresa spre lobii caudali şi accesorii, determinând o mascare a conturului cardiac şi a vaselor pulmonare. În cazurile grave de endocardioză valvulară apare un epanşament pleural, ascită, hepatomegalie şi splenomegalie.
Auscultaţia
Auscultaţia pulmonului. În formele avansate ale insuficienţei cardiace apare tahipneea şi sunt decelate crepitaţii inspiratorii la auscultaţia pulmonului. În caz de edem pulmonar interstiţial, aceste crepitaţii au o intensitate mai slabă.
Auscultaţia cordului – analiza zgomotelor şi a suflurilor cardiace. Aproximativ 60-70% dintre câinii cu insuficienţă mitrală prezintă o frecvenţă cardiacă normală, în timp ce restul de 30-40% pot prezenta o tahicardie ca urmare a creşterii catecolaminelor din circulaţie, cu sau fără ritm de galop (ca semn de insuficienţă cardiacă stângă). Aceste sufluri sunt asociate cu raluri de stază pulmonară, hipotensiune arterială, semne de vasoconstricţie periferică. Aceste catecolamine, prin acţiunea lor prelungită, vor avea un efect direct asupra organizării miofibrilelor cardiace, determinând în final o insuficienţă cardiacă.
În unele cazuri incipiente de endocardioză mitrală este auzit uneori la auscultaţie clicul sistolic, un zgomot supraadăugat, în special la mijlocul sistolei, fiind determinat de prolapsul valvei mitrale. În mare parte, depistarea acestui zgomot depinde şi de experienţa examinatorului.
Regurgitarea mitrală este responsabilă de o turbulenţă a sângelui, din cauza jetului regurgitant mitral, şi se caracterizează prin apariţia unui suflu sistolic apexian pe partea stângă a toracelui, între spaţiul intercostal 4-6, sub articulaţia costo-condrală, audibil pe toată perioada sistolei ventriculare. Energia cinetică a jetului regurgitant este transformată în vibraţii în cavitatea atriului stâng. Aceste vibraţii se propagă sub forma unor secvenţe de unde care alternează cu variaţii ale presiunii la nivelul peretelui toracic, unde acestea sunt percepute sub formă de sufluri. Acest suflu stă la baza diagnosticului de endocardioză a valvei mitrale. Există cazuri în care cuspidele mitrale vibrează extrem de rapid, determinând un suflu caracteristic de intensitate mare, denumit „suflu muzical“. În formele incipiente, suflul sistolic este mai aspru, cu accentuare spre sfârşitul sistolei, şi are caracter crescendo-descrescendo comparativ cu formele severe (cronice).
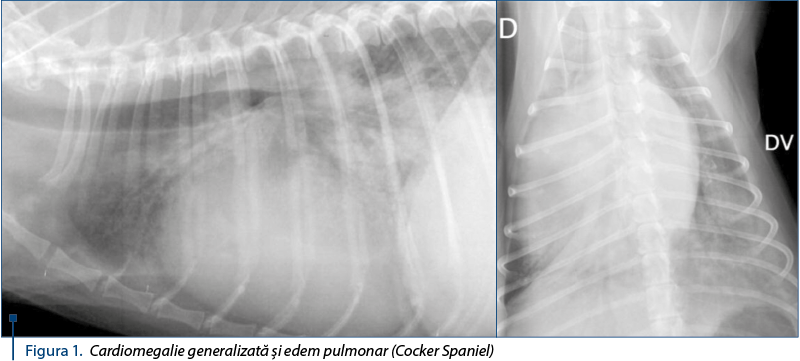
Suflurile sistolice apexiene stângi sunt clasificate în 6 clase (tabelul 3). Suflurile din clasele 1 şi 2 sunt clasificate în sufluri de intensitate slabă, suflurile din clasele 3 şi 4 în sufluri de intensitate moderată, iar suflurile din clasele 5 şi 6 în sufluri de intensitate mare.
În prezenţa unui epanşament pleural şi/sau a unei tamponade cardiace, suflul sau intensitatea acestuia pot fi foarte uşor subapreciate.
Examenul fonocardiografic permite măsurarea intervalelor şi a intensităţii sonore. Acest examen a fost dezvoltat de către Häggström şi colab. şi a constat din înregistrarea a trei zgomote cardiace: Z1, a cărui intensitate este determinată de viteza de închidere a valvei mitrale, Z2, determinat de închiderea valvelor semilunare ale aortei, şi Z3, inconstant şi mai dificil de auzit, care corespunde decelerării fluxului sangvin când ventriculul stâng rezistă la supraîncărcarea de volum.
Auscultaţia cordului şi pulmonului s-a efectuat cu un stetoscop electronic Jabes, iar înregistrarea sunetelor cardiace şi a suflurilor a fost examinată cu ajutorul programului cu care a fost livrat stetoscopul (figura 2).
Intervalul de timp dintre Z1 şi Z2 depinde de frecvenţa cardiacă. În caz de insuficienţă cardiacă, s-a observat o scurtare a intervalului dintre unda Q de pe electrocardiogramă şi Z2 (durata sistolei) şi a intervalului dintre Z1 şi Z2, ca urmare a golirii rapide a ventriculului stâng din cauza fluxului de regurgitare spre atriul stâng. De asemenea, s-a observat că raportul dintre amplitudinile Z1 şi Z2 (Z1/Z2) este corelat direct proporţional cu raportul dintre atriul stâng şi aortă (Ao/AS), dar şi cu diametrul ventriculului stâng. Frecvenţa Z3 creşte cu gradul insuficienţei valvulare.
Examenul electrocardiografic
Examenul electrocardiografic permite aprecierea ritmului şi a modificărilor de dimensiune ale atriilor şi ventriculelor. Cele mai frecvente modificări electrocardiografice sunt tulburările de ritm supraventricular, tahicardiile sinusale, extrasistolele supraventriculare, tahicardiile supraventriculare sau fibrilaţia atrială. În formele uşoare, iniţial apare aritmia sinusală, iar în formele avansate aceasta este înlocuită de tahicardia sinusală. În formele de remodelare cardiacă cu dilataţia severă a ventriculului stâng apar aritmii ventriculare (extrasistole, tahicardie şi fibrilaţie ventriculară), fibrilaţie atrială sau blocuri atrioventriculare de gradul II sau III. La formele grave, fibrilaţia atrială este însoţită de obicei de o alterare a stării generale a animalului. Dilataţia atrială stângă severă se caracterizează prin apariţia pe electrocardiogramă a unor unde P cu durată mare (>40 msec la câine) cu un aspect bifid, cunoscute şi sub denumirea de unde P mitrale. Hipertrofia excentrică a ventriculului stâng este caracterizată prin unde R cu o amplitudine mai mare de 3 mV în derivaţiile DII, DIII, aVF, V2 şi V4 şi cu o durată mai mare de 70 msec. Orice creştere a duratei complexului QRS sau modificare a porţiunii descendente a undei R, împreună cu modificări ale segmentului ST în raport cu linia izoelectrică (supradenivelare, subdenivelare) reflectă o alterare a funcţiei miocardice. Axa electrică rămâne normală (+40 – +100) sau poate apărea rar deviată spre stânga.
Examenul radiologic permite precizarea originii tusei cronice. Semnele clinice care determină tusea cardiogenă faţă de cea pulmonară sunt: cardiomegalia stângă, şi nu cea dreaptă, distensia venelor pulmonare, şi nu a arterelor pulmonare sau a bronhiilor, prezenţa edemului pulmonar, absenţa colapsului traheal sau a altor afecţiuni ale tractului respirator.
Examenul de laborator – biomarkeri cardiaci, metoloproteinazele şi proteina C reactivă
Proteina C reactivă (CRP) este o proteină neglicozilată, care migrează electroforetic în apropierea zonei gamma. Este un reactant de fază acută care creşte rapid, dar nespecific, ca răspuns la leziuni tisulare determinate de remodelarea cardiacă (după Bozkurt şi colab., 1998) şi la modificări inflamatorii de la nivelul cuspidelor mitrale la câinii cu boală valvulară cronică dobândită (Laforcade şi colab., 2003; Mow şi Pedersen, 1999).
Rolul fiziologic al CRP este complex: printr-un mecanism dependent de calciu se leagă de reziduurile de fosforil-colină ale multor fosfolipide şi în special ale polizaharidului C pneumococic (de unde îi provine şi numele); se leagă de cromatină şi histone, având rol în clearance-ul detritusurilor celulare; este un factor major de opsonizare – se leagă de fagocite şi accelerează fagocitarea antigenelor şi microorganismelor; se leagă de fracţiunea C1q a complementului, determinând activarea complementului pe calea clasică.
CRP este un trigger proinflamator în sine, deoarece stimulează producţia monocitară de IL-1, IL-6 şi TNF-α. Deşi principala sursă de CRP este ficatul, date recente indică faptul că ţesutul arterial poate produce atât CRP, cât şi proteine aparţinând sistemului complementului. Nivelul CRP poate înregistra creşteri foarte mari (de 100 ori sau chiar mai mult) după traumatisme severe, infecţii bacteriene, inflamaţii, intervenţii chirurgicale sau proliferări neoplazice.
Din această cauză, CRP este folosit în medicina umană ca un predictor al insuficienţei cardiace şi al stadializării acesteia. Stimularea proteinei C reactive de către mediatorii inflamatori determină o creştere a remodelării ventriculului stâng la câinii la care s-a indus artificial o insuficienţă cardiacă. În medicina umană, faţă de cea veterinară, concentraţia de CRP este în relaţie directă cu severitatea insuficienţei cardiace, în special pentru formele acute.
Pentru determinarea CRP s-au folosit teste rapide FASTest CRP Canine (Megacor), iar determinarea CRP la câinii luaţi în studiu a avut rezultate inconstante, indiferent de severitatea bolii cardiace valvulare.
Biomarkerii cardiaci
Semnificaţia clinică a peptidelor natriuretice a fost de mult timp demonstrată. Acestea reprezintă o familie de molecule ce include ANP (peptid natriuretic de tip A sau atrial), BNP (peptid natriuretic de tip B sau cerebral) şi CNP (peptid natriuretic de tip C), cu rol în menţinerea homeostaziei circulatorii. ANP şi BNP, prin proprietăţile lor natriuretice, diuretice, precum şi de antagonişti ai sistemului renină-angiotensină-aldosteron, influenţează balanţa hidroelectrolitică din organism. ANP este eliberat rapid în circulaţie, în timp ce BNP este sintetizat sub forma unor precursori (pre-pro-BNP şi pro-BNP) şi eliberat din miocardul ventricular în circulaţie, ca urmare a stresului parietal prelungit.
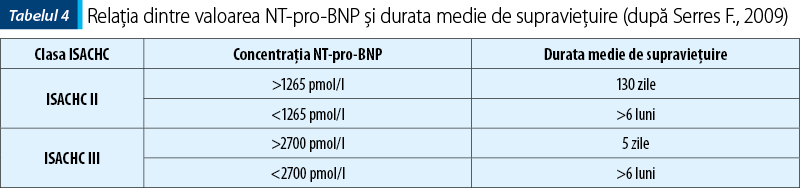
S-a constatat că nivelurile serice ale BNP (şi respectiv ale NT-proBNP) se corelează foarte bine cu severitatea disfuncţiei ventriculare stângi şi respectiv cu clasele ISACHC ale câinilor cu boală valvulară cronică (tabelul 4). Extrapolând din medicina umană, ghidul ESC recomandă peptidele natriuretice, inclusiv NT-proBNP, ca test iniţial pentru excluderea insuficienţei cardiace la pacienţii cu dispnee, care se prezintă fie în condiţii de urgenţă, fie în ambulatoriu. Conform unor studii recente, se poate face o diferenţă clară între câinii cu o regurgitare mitrală uşoară (fracţie de regurgitare <30%) şi câinii cu regurgitare mitrală moderată/severă (fracţie de regurgitare >30%). De asemenea, este posibilă diferenţierea câinilor în fază preclinică de cei aflaţi în insuficienţă cardiacă. S-a putut stabili şi o corelaţie între concentraţia de NT-pro-BNP la câinii cu endocardioză fără insuficienţă cardiacă asociată şi riscul de decompensare cardiacă în următoarele 12 luni. Astfel, câinii cu o valoare a concentraţiei de NT-pro-BNP >466 pmol/l sunt susceptibili de a prezenta o decompensare cardiacă în următoarele 12 luni.
Metaloproteinazele 2 şi 9
Pornind de la funcţiile metaloproteinazelor matriceale – molecule indispensabile proceselor de reparare, remodelare şi restructurare a arhitecturii tisulare – şi de la ipoteza implicării lor în procesele de remodelare cardiacă din formele severe ale bolii cronice valvulare, s-a propus investigarea relevanţei acestora în răspunsul cardiac de remodelare a cordului.
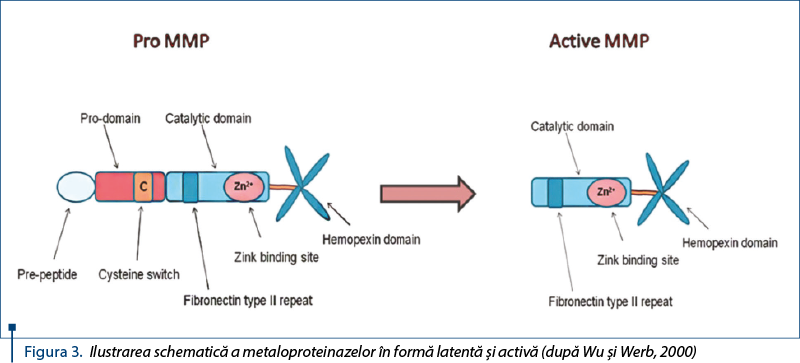
Numeroase studii clinice au demonstrat implicarea unor enzime proteolitice zinc-dependente în degradarea matricei extracelulare şi a endoteliului membranei bazale. Metaloproteinazele (MMP) sunt secretate în spaţiul extracelular într-o formă latentă (pro-MMP) care, din punct de vedere enzimatic, sunt inactive până când dispare o propeptidă aminoterminală şi devin capabile de a degrada componentele matricei extracelulare (figura 3).
Metaloproteinazele 2 şi 9 au fost determinate la un număr mic de câini, din cauza costurilor crescute şi a numărului mic de laboratoare unde se pot determina. Tehnica de identificare a lor este una de electroforeză (zimografie).
Examenul ecocardiografic
Ecocardiografia permite diagnosticarea mixomatozei valvulare mitrale prin decelarea modificărilor directe ale cuspidelor mitrale. Din punct de vedere ecocardiografic, acestea apar hiperecogene şi îngroşate, cu prezenţa unor formaţiuni nodulare, în special pe cuspida septală, în porţiunea sa distală. În plus, mai apar modificări ale muşchilor papilari şi dilataţia inelului valvular mitral. Uneori, formaţiunile nodulare se pot observa şi la nivelul cordajelor tendinoase, care din această cauză se pot rupe, având ca rezultat final prolapsul cuspidelor mitrale şi regurgitarea mitrală, dar şi exprimarea unor semne indirecte, caracterizate prin modificarea dimensiunilor ventriculelor şi atriilor, a rupturii cordajelor tendinoase, a jetului de regurgitare mitrală etc.
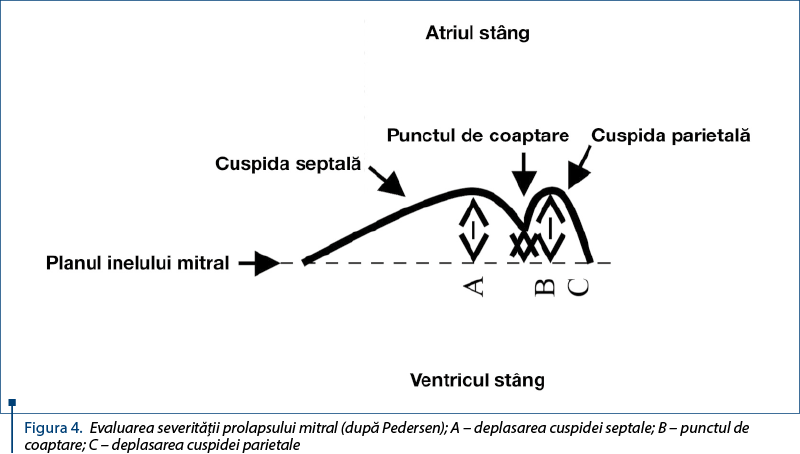
Modificările degenerative ale valvei mitrale, inclusiv ale cordajelor tendinoase asociate acestora, au ca rezultat o coaptare anormală a cuspidelor mitrale în timpul sistolei (prolaps). Prolapsul mitral reprezintă deplasarea sistolică, a uneia sau a ambelor cuspide mitrale, faţă de planul inelului mitral spre atriul stâng şi apariţia unui jet retrograd în atriul stâng. Jetul de regurgitare începe la începutul sistolei, determinând scurtarea perioadei de contracţie izovolumetrică (intervalul dintre închiderea valvelor atrioventriculare şi deschiderea valvelor semilunare). În cazurile de mixomatoză mai uşoare spre moderate, orientarea spaţială a jetului este mai centrală sau uşor laterală, la aceasta contribuind şi forma şi orientarea orificiului mitral în timpul contracţiei ventriculului stâng. Majoritatea animalelor examinate au un jet de regurgitare excentric, probabil datorită faptului că cuspida septală este mai lungă şi cu o mobilitate mai mare, comparativ cu cuspida parietală, sau datorită întinderii planului mitral, ca urmare a dilataţiei severe a atriului şi ventriculului stâng. Prolapsul este însoţit de vibraţia cuspidelor în timpul sistolei ventriculare, vizibilă în mod special în modul M pe segmentul CD al cuspidei septale. Se disting două tipuri de prolaps: un prolaps uşor, denumit şi „balonizare“, care corespunde unei bombări a cuspidelor fără ca punctul de coaptare a acestora să se deplaseze spre atriul stâng; un prolaps sever, care corespunde deplasării celor două cuspide spre atriul stâng, inclusiv a punctului de coaptare a acestora.
Pedersen, Olsen şi col. au studiat severitatea prolapsului valvular prin calcularea mediei valorilor maximale a celor trei mişcări de deplasare a cuspidelor spre atriul stâng (figura 4). Dacă valoarea calculată este între 0 şi 1 mm, prolapsul este clasificat ca uşor, iar dacă este peste 1 mm, atunci este clasificat ca fiind sever.
Dimensiunea atriului stâng este cuantificată prin raportarea la diametrul aortei (raport AS/Ao) în telediastolă, în fereastra parasternală dreaptă, secţiune în axul scurt la nivelul atriului stâng şi al aortei. Valoarea normală a acestui raport este de 1,2 la majoritatea raselor de talie mică predispuse la boala valvulară cronică.
În modul M, modificările asociate endocardiozei mitrale sunt: îngroşarea cuspidelor mitrale, accentuarea pantei segmentului EF, diminuarea distanţei E-sept, hiperkinezie parietală şi septală, îngroşarea sistolică a septului interventricular şi a peretelui posterior. În fazele terminale ale insuficienţei mitrale, distanţa E-sept creşte, atingând valori de peste 10 mm.
În modul Doppler, prin depistarea fluxurilor sangvine, a direcţiei şi a vitezei lor se poate aprecia şi cuantifica regurgitarea mitrală. Pentru cuantificarea regurgitării mitrale există două metode:
- O metodă se bazează pe cartografierea vitezelor fluxului de regurgitare („mapping“). Astfel, cu cât viteza fluxului de regurgitare este mai mare, cu atât culoarea mozaicului datorat turbulenţei va fi mai deschisă.
- A doua metodă este prin calcularea vitezei maximale a fluxului de regurgitare mitral.
Aria jetului regurgitant mitral se raportează procentual la aria suprafeţei atriului stâng, dar ea reprezintă mai mult evoluţia vitezei de regurgitare în funcţie de severitatea afecţiunii, decât cantitatea volumului regurgitant.
Aria zonei proximale de izovelocitate (PISA) se determină în secţiunea parasternală stângă din secţiunea apicală şi prin reglarea Dopplerului color pentru observarea fenomenului de ambiguitate (aliasing). Această zonă are forma unui semicerc localizat imediat lângă orificiul mitral de regurgitare în ventriculul stâng. Măsurarea razei acestuia şi a vitezei de regurgitare determinate de fenomenul de ambiguitate permite calcularea volumului regurgitant şi a debitului fluxului regurgitant – fracţia de regurgitare.
Evaluarea contracţiei ventriculare
Determinarea fracţiei de scurtare. Fracţia de scurtare reflectă contractilitatea miocardului ventricular şi este considerată normală dacă are valorile cuprinse între 29% şi 45%.
Complicaţii. Cele mai frecvente complicaţii sunt insuficienţa cardiacă globală, ruptura cordajelor tendinoase şi ruptura atriului stâng.
Hipertensiunea pulmonară este caracterizată prin creşterea diametrului arterei pulmonare faţă de cel al aortei, apariţia unui jet regurgitant pulmonar şi a unei regurgitări tricuspidiene secundare. Hipertensiunea este însoţită de semnele de compensare ale cordului drept, traduse prin dilataţia atriului drept, urmată de cea a ventriculului drept.
Ruptura cordajelor tendinoase cel mai bine se observă în incidenţa apicală stângă. Din cauza leziunii determinate de jetul regurgitant mitral excentric sau din cauza dilataţiei exagerate atriului stâng, acesta se poate rupe.
Ruperea peretelui posterior al atriului este responsabilă de un epanşament pericardic hemoragic şi de o tamponadă cardiacă. Într-un singur caz, ruptura atriului stâng s-a produs la nivelul septului interatrial, contribuind astfel la apariţia unei comunicări interatriale cu consecinţe mai puţin severe comparativ cu cele de la nivelul peretelui posterior.
Concluzii
La auscultaţia cardiacă este depistat intermitent un click sistolic sau o matitate a zgomotului Z1, dar acestea au tendinţa de cele mai multe ori să fie subestimate. În schimb, intensitatea suflului sistolic apexian stâng are o corelaţie direct proporţională cu modificările identificate ecocardiografic (regurgitarea mitrală, diametrul intern al atriului şi ventriculului stâng şi cu grosimea pereţilor ventriculului stâng). Această corelare pozitivă demonstrează că intensitatea suflului este un indicator al severităţii endocardiozei mitrale. Orice suflu sistolic cu intensitatea cuprinsă între 4/6 şi 6/6 este corelat cu mărirea atriului stâng.
Determinarea metaloproteinazelor nu a avut aceleaşi rezultate la câinii cu endocardioză, comparativ cu cele obţinute din medicina umană.
Modificările electrocardiografice nu sunt aşa de frecvente în cazul bolilor degenerative. Cele mai frecvente aritmii înregistrate au fost dispariţia aritmiei sinusale respiratorii şi a tahicardiei sinusale, secundară activării sistemului nervos simpatic. În fazele terminale ale bolii, ca urmare a dilataţiei severe a atriului stâng, au fost înregistrate fibrilaţii atriale. De asemenea, tulburările ritmului ventricular depistate tot în fazele terminale au apărut ca urmare a perfuziei miocardice. Prezenţa aritmiilor a determinat un prognostic mai grav, deoarece au dus mai rapid la agravarea semnelor de insuficienţă cardiacă.
Măsurarea presiunii arteriale nu a demonstrat nicio corelaţie cu severitatea bolii, probabil în mare parte ca urmare a tratamentului primit pençtru insuficienţa cardiacă, în care intră şi hipotensoarele (inhibitori de enzimă de conversie, pimobendan, furosemid, spironolactonă etc.).
Valorile NT-pro-BNP crescute la câinii cu mixomatoză valvulară se corelează cu severitatea insuficienţei cardiace din clasele B2, C şi D, inclusiv cu dimensiunile atriului stâng. De asemenea, a fost confirmat riscul de decompensare cardiacă la câinii luaţi în studiu.
Volumul regurgitant al atriului stâng depinde direct proporţional cu dimensiunea orificiului regurgitant mitral, de existenţa rupturilor cordajelor tendinoase, de gradientul presional dintre atriul şi ventriculul stâng, de forţa de contracţie a ventriculului stâng şi de rezistenţa vasculară sistemică.
Procentajul ariei ocupate de jetul regurgitant în atriul stâng este clasificat astfel:
- Insuficienţă mitrală uşoară – aria jetului regurgitant mai mică de 15%
- Insuficienţă mitrală moderată – aria jetului regurgitant cuprinsă între 15% şi 50%
- Insuficienţă mitrală severă – aria jetului regurgitant mai mare de 50%.
Fracţia de regurgitare la PISA este mai mare de 45% la animalele cu o regurgitare mitrală uşoară/moderată şi de 75% la animalele cu regurgitare mitrală severă, dar valorile obţinute sunt inconstante luate împreună cu încadrarea animalelor care prezintă semne clinice de insuficienţă cardiacă congestivă (clasele C şi D).
Fracţia de scurtare nu este corelată cu stadiul insuficienţei cardiace ISACHC sau cu gradul severităţii bolii valvulare cronice.
Hiperchinezia ventriculului stâng, întâlnită cel mai frecvent în stadiul C sau D, este caracterizată prin contractilitatea exagerată a acestuia şi apare atunci când fracţia de scurtare este crescută din cauza faptului că rezistenţa la golirea ventriculului este diminuată în urma regurgitării mitrale.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Amberger C, Glardon O, Lombard CW. Validité des examens complémentaires dans l’évaluation de l’insuffisance cardiaque par endocardiose mitrale: étude à partir de 106 cas. Prat. Med. Chir. Anim. Comp. 1995;30(6), 659-670.
- Atkins CE. Evaluation of cough in dogs with mitral valve insufficiency. Comp. Cont. Edu. Pract. Vet. 1994;16, 1547-1553.
- Beardow AW, Buchanan JW. Chronic mitral valve disease in Cavalier King-Charles Spaniels: 95 cases (1987-1991). J. Am. Vet. Med. Assoc. 1993;203(7), 1023-1029.
- Buchanan JW. Chronic valvular disease (endocardiosis) in dogs. Adv. Vet. Sci. Comp. Med. 1977;21, 75-106.
- Chetboul V, Tissier R, Villaret F, Nicolle A, Dean E, Benalloul T et al. Epidemiological, clinical, echo-doppler characteristics of mitral valve endocardiosis in Cavalier King Charles in France: a restrospective study of 451 cases (1995 – 2003). Can. Vet. J. 2004;45, 1012-1015.
- Coker ML, Doscher MA, Thomas CV, Galis ZS, Spinale FG. Matrix metalloproteinase synthesis and expression in isolated LV myocyte preparations. Am J Physiol. 1999;277(2 Pt 2), H777-87.
- Collet M. Aspects échographiques de la rupture de cordages tendineux mitraux chez le chien. Prat. Med. Chir. Anim. Comp. 1995;30(4), 499-505.
- Corcoran BM, Black A, Anderson H, McEwan JD, French A, Smith P et al. Identification of surface morphologic changes in the mitral valve leaflets and chordae tendineae of dogs with myxomatous degeneration. Am. J. Vet. Res. 2004;65(2), 198-206.
- Darke PGG. Valvular incompetence in Cavalier King-Charles Spaniels. Vet. Rec. 1987;120(15), 365-366.
- Dollery CM, McEwan JR, Henney AM Matrix metalloproteinases and cardiovascular disease. Circ Res. 1995;77(5), 863-8.
- Durand L & Pibarot P. Digital signal processing of the phonocardiogram: review of the most recent advancements. Crit Rev Biomed Eng. 1995;23(3-4), 163-219.
- Eckberg D, Gault J, Bouchard R, Karliner J, Ross JJ. Mechanics of left ventricular contraction in chronic severe mitral regurgitation. Circulation. 1973;47(6), 1252-9.
- Eggers KM, Jaffe AS, Lind L, Venge P, Lindahl B. Value of cardiac troponin I cutoff concentrations below the 99th percentile for clinical decision-making. Clin Chem. 2009;55(1), 85-92.
- Eriksson A, Hansson K, Häggström J, Jarvinen AK, Lord P. Pulmonary blood volume in mitral regurgitation in cavalier king charles spaniels. J Vet Intern Med. 2010;24(6), 1393-9.
- Feng YJ, Chen C, Fallon JT, Lai T, Chen L, Knibbs DR, Waters DD, Wu AH. Comparison of cardiac troponin I, creatine kinase-MB, and myoglobin for detection of acute ischemic myocardial injury in a swine model. Am J Clin Pathol. 1998;110(1), 70-7.
- Gould L, Ettinger S, Lyon A. Intensity of the first heart sound and arterial pulse in mitral insufficiency. Dis Chest. 1968;53(5), 545-50.
- Häggström J, Hansson K, Kvart C, Swenson L. Chronic valvular disease in the Cavalier King-Charles Spaniel in Sweden. Vet. Rec. 1992;131(24), 549-553.
- Häggström J, Hansson K, Karlberg BE, Kvart C, Olsson K. Plasma concentration of atrial natriuretic peptide in relation to severity of mitral regurgitation in Cavalier King-Charles Spaniels. Am. J. Vet. Res. 1994;55(5), 698-703.
- Häggström J, Kvart C, Hansson K. Heart sounds and murmurs: changes related to severity of chronic valvular disease in the Cavalier King-Charles Spaniel. J. Vet. Intern. Med. 1995;9(2), 75-85.
- Häggström J, Hamlin RL, Hansson K, Kvart C. Heart rate variability in relation to severity of mitral regurgitation in Cavalier King-Charles Spaniels. J. Small. Anim. Pract. 1996;37(2), 69-75.
- Hansson K, Häggström J, Kvart C, Lord P. Left atrial to aortic root indices using two-dimensional and M-mode echocardiography in Cavalier King-Charles Spaniels with and without left atrial enlargement. Vet. Radiol. and Ultrasound. 2002;43(6), 568575.
- Jacobs LD, Salgo IS, Goonewardena S, Weinert L, Coon P, Bardo D, Gerard O, Allain P, Zamorano JL, de Isla LP, Mor-Avi V, Lang RM. Rapid online quantification of left ventricular volume from real-time echocardiographic data. Eur Heart J. 2006;27(4), 460-8.
- Jernberg T, Stridsberg M, Venge P, Lindahl B. N-terminal pro brain natriuretic peptide on admission for early risk stratification of patients with chest pain and no ST-segment elevation. J Am Coll Cardiol. 2002;40(3), 437-45.
- Kerstetter KK, Sackman JE, Buchanan JW, Bright JM, Krahwinkel DJ et al. Short-term hemodynamic evaluation of circumferential mitral annuloplasty for correction of mitral valve regurgitation in dogs. Vet. Surg. 1998;27(3), 216-223.
- Kittleson MD. Myxomatous atrioventricular valvular degeneration. In: Kittleson MD, Kienle RD, editors. Small Animal Cardiovascular Medicine. 1998;Mosby, 297-318.
- Kittleson MD, Brown WA. Regurgitant fraction measured by using the proximal isovelocity surface area method in dogs with chronic myxomatous mitral valve disease. J. Vet. Intern. Med. 2003;17(1), 84-88.
- Kogure K. Pathology of chronic mitral valvular disease in the dog. Jap. J. Vet. Sci. 1980;42, 323-335.
- Kosztolich A. Ein Beitrag zur Mitralinsuffizienz des Hundes klinischdiagnostische und bildgebende Erfahrungen. Kleintierpraxis. 1996;41(10), 705-720.
- Kupferwasser I, Mohr-Kahaly S, Stahr P, Rupprecht HJ, Nixdorff U, Fenster M, Voigtlander T, Erbel R, Meyer J. Transthoracic three-dimensional echocardiographic volumetry of distorted left ventricles using rotational scanning. J Am Soc Echocardiogr. 1997;10(8), 840-52.
- Kvart C, Häggström J. Acquired valvular heart disease. In: Ettinger SJ, Feldman EC, editors. Textbook of Veterinary Internal Medicine. 5th ed. Philadelphia: WB Saunders. 2000;787-800.
- Lang RM, Mor-Avi V, Sugeng L, Nieman PS, Sahn DJ. Three-dimensional echocardiography: the benefits of the additional dimension. J Am Coll Cardiol. 2006b;48(10), 2053-69.
- Lombard CW, Spencer CP. Correlation of radiographic, echocardiographic and electrocardiographic signs of left heart enlargement in dogs with mitral regurgitation. Vet. Radiol. 1985;26(3), 89-97.
- Malik R, Hunt GB, Allan GS. Prevalence of mitral valve insufficiency in Cavalier King-Charles Spaniels. Vet. Rec. 1992;130(4), 302-303.
- Nagase, H. Activation mechanisms of matrix metalloproteinases. Biol Chem. 1997;378(3-4), 151-60.
- O’Brien PJ, Smith DE, Knechtel TJ, Marchak MA, Pruimboom-Brees I, Brees DJ, Spratt DP, Archer FJ, Butler P, Potter AN, Provost JP, Richard J, Snyder PA & Reagan WJ. Cardiac troponin I is a sensitive, specific biomarker of cardiac injury in laboratory animals. Lab Anim. 2006;40(2), 153-71.
- Olsen LH, Fredholm M, Pedersen HD. Epidemiology and inheritance of mitral valve prolapse in Dachshunds. J. Vet. Intern. Med. 1999;13(5), 448-456.
- Olsen LH, Martinussen T, Pedersen HD. Early echocardiographic predictors of myxomatous mitral valve disease in Dachshunds. Vet. Rec. 2003;152(10), 293-297.
- Oyama MA, Sisson DD. Cardiac troponin-I concentration in dogs with cardiac disease. J Vet Intern Med. 2004;18(6), 831-9.
- Pedersen HD, Kristensen BØ, Lorentzen KA, Koch J, Jensen AL, Flagstad A. Mitral valve prolapse in 3-year-old healthy Cavalier King-Charles Spaniels. An echocardiographic study. Can. J. Vet. Res. 1995;59(4), 294-298.
- Pedersen HD, Kristensen BØ, Nørby B, Lorentzen KA. Echocardiographic study of mitral valve prolapse in Dachshunds. J. Vet. Med. 1996;series A 43(2), 103-110.
- Pedersen HD, Lorentzen KA, Kristensen BØ. Observer variation in the two-dimensional echocardiographic evaluation of mitral valve prolapse in dogs. Vet. Radiol. and Ultrasound. 1996;37(5), 367-372.
- Pedersen HD, Häggström J, Falk T, Mow T, Olsen LH, Iversen L et al. Auscultation in mild mitral regurgitation in dogs: observer variation, effects of physical manoeuvers, and agreement with color Doppler echocardiography and phonocardiography. J. Vet. Intern. Med. 1999;13(1), 56-64.
- Pedersen HD, Lorentzen KA, Kristensen BØ. Echocardiographic mitral valve prolapse in Cavalier King-Charles Spaniels: epidemiology and prognostic significance for regurgitation. Vet. Rec. 1999;144(12), 315-320.
- Pelouch V, Dixon IM, Golfman L, Beamish RE, Dhalla NS. Role of extracellular matrix proteins in heart function. Mol Cell Biochem. 1993;129(2), 101-20.
- Pouchelon JL, Chetboul V. Etude de la fraction de raccourcissement chez 110 chiens insuffisants mitraux par endocardiose. Rec. Med. Vet. 1989;165(10), 801-806.
- Roux F. Echographie du Chien. Dépistage de la maladie mitrale du Cavalier King Charles. Point Vét. 2004;243(35), 72-74.
- Rush JE, Lee ND, Freeman LM, Brewer B. C-reactive protein concentration in dogs with chronic valvular disease. J Vet Intern Med. 2006;20(3), 635-9.
- Schmelting B, Niehoff M, Egner B, Korte SH & Weinbauer GF. High Definition Oscillometry: a novel technique for noninvasive blood pressure monitoring in the cynomolgus monkey (Macaca fascicularis). J Med Primatol. 2009;38(5), 293-301.
- Schneider M, Schneider I, Neu H. Vergleich der konventionellen Untersuchungsverfahren mit der Echokardiographie zur Diagnostik von kongenitalen Herzerkrankugen beim Hund. Tierärztl. Prax. 2003;31(1), 17-22.
- Sisson D, Kvart C, Darke PGG. Acquired valvular heart disease in dogs and cats. In: Fox PR, Sisson D, Moise NS, editors. Textbook of Canine and Feline Cardiology: Principles and clinical practice. 1999;2nd ed. Philadelphia: WB Saunders, 536565.
- Spratt DP, Mellanby RJ, Drury N, Archer J. Cardiac troponin I: evaluation I of a biomarker for the diagnosis of heart disease in the dog. J Small Anim Pract. 2005;46(3), 139-45.
- Takemura N, Koyama H, Sako T, Ando K, Suzuki K, Motoyoshi S et al. Atrial natriuretic peptide in the dog with mitral regurgitation. Res. Vet. Sci. 1991;50(1), 86-88.
- Tarnow I, Olsen LH, Kvart C, Höglund K, Moesgaard SG, Kamstrup TS, Pedersen HD, Häggström J. Predictive value of natriuretic peptides in dogs with mitral valve disease. Vet J. 2009;180(2), 195-201.
- Thomas W, Gaber C, Jacobs G, Kaplan P, Lombard C, Moise N, Moses B. Recommendations for standards in transthoracic two-dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. J Vet Intern Med. 1993;7(4), 247-52.
- Thrusfield MV, Aitken CGG, Darke PGG. Observations on breed and sex in relation to canine heart valve incompetence. J. Small. Anim. Pract. 1985;26, 709-717.
- Tidholm A, Ljungvall I, Höglund K, Westling AB, Häggström J. Tissue Doppler and strain imaging in dogs with myxomatous mitral valve disease in different stages of congestive heart failure. J Vet Intern Med. 2009;23(6), 1197-207.
- Uehara Y, Takahashi M. Quantitative evaluation of the severity of mitral insufficiency in dogs by the color Doppler method. J. Vet. Med. Sci. 1996;58(3), 249-253.
- Villaret F. Caractéristiques épidémiologiques, cliniques, échocardiographiques et Doppler de l’endocardiose mitrale chez le Cavalier King Charles en Ile-de-France: étude rétrospective de 451 cas. Thèse Méd. Vét. 2004;Alfort, n°46, 141p.