The interest in the study of equine gastric ulcer syndrome resides both from its negative effects on equine sport performance and from the difficulties in its diagnosis. Based on the location of the lesions, there are two distinct entities within equine gastric ulcer syndrome: equine squamous gastric disease and equine glandular gastric disease. Even though these two diseases have distinct etiopathogenesis, their clinical manifestations are similar, consisting of appetite loss, poor body conditions, bruxism, sialorrhea and abdominal pain expressed by colics of varying intensity. Therefore, the gastroscopy represents the optimal method for correctly diagnosing equine squamous gastric disease and equine glandular gastric disease, thus assuring a differentiated and efficient treatment.
Diagnosticul şi conduita terapeutică în sindromul ulcerului gastric la calul de sport
Diagnosis and therapeutic protocol in gastric ulcer syndrome in sport equine
First published: 19 aprilie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.30.1.2018.1600
Abstract
Rezumat
Interesul pentru studiul sindromului ulcerului gastric la cal rezidă atât din impactul lui negativ asupra performanţelor sportive, cât şi din dificultăţile reale în stabilirea diagnosticului. În funcţie de localizarea leziunilor, în cadrul sindromului ulcerului gastric sunt cunoscute două entităţi distincte: gastropatia scuamoasă ecvină şi gastropatia glandulară ecvină. Deşi aceste două boli au etiopatogeneze diferite, exprimarea lor clinică este asemănătoare şi constă în reducerea apetitului, slăbire, bruxism, sialoree, diaree şi dureri abdominale exprimate prin colici de intensitate variabilă. Din acest motiv, gastroscopia reprezintă metoda optimă pentru diagnosticul corect al gastropatiei scuamoase ecvine şi gastropatiei glandulare ecvine, asigurând astfel un tratament diferenţiat şi implicit eficient.
Introducere
Prin dificultăţile reale de diagnostic, sindromul ulcerului gastric la cabaline constituie una dintre provocările profesionale deosebite pentru medicii veterinari practicieni.
Exprimarea lui clinică puţin caracteristică, stereotipă şi uneori silenţioasă, contrastează cu tabloul lezional variabil ca severitate şi localizare anatomică (de exemplu, cardia, regiunea fundică, regiunea antrală sau pilorică). La nivelul mucoasei scuamoase din regiunea fundică dorsală pot fi identificate leziuni preulcerative de tip paracheratozic, în timp ce mucoasa secretorie din regiunea antrală sau pilorică este mai predispusă la leziuni de tip hiperemic, hemoragic şi fibrino-supurativ(1). În condiţiile unei similitudini topografice, ulcerele propriu-zise pot surveni ca o continuare a leziunilor preulcerative sau pot evolua ca atare de la bun început.
Conform unei rezoluţii a Colegiului European de Medicină Internă Ecvină(2), este acceptat că sindromul ulcerului gastric la cal include două entităţi morbide distincte: gastropatia scuamoasă ecvină (GSE), respectiv gastropatia glandulară ecvină (GGE). Prezentarea lor sub aceste denumiri subliniază cu prioritate localizarea anatomică a leziunilor preulcerative sau ulcerative. Patogenetic, apariţia GSE se explică prin anularea gradientului normal de pH intragastric şi expunerea repetată a mucoasei scuamoase neprotejate la conţinutul acid. Această expunere survine primar pe un tract gastrointestinal sănătos, ca efect al creşterii presiunii intraabdominale din timpul alurilor rapide de deplasare impuse de unele discipline din sportul ecvestru (de exemplu, cursele de galop, trap) sau secundar unor gastroenteropatii marcate de întârzierea evacuării stomacului(2,6). În acest context este explicabilă prevalenţa superioară a GSE primare în timpul sezonului competiţional, comparativ cu perioadele de repaus (tabelul 1).
GGE are o etiopatogeneză controversată şi încă insuficient cunoscută. Deşi sunt suspectate cauze iatrogene (de exemplu, antiinflamatoarele nesteroidiene), infecţioase (de exemplu, germeni din genul Helicobacter) şi stresul, concluziile cercetărilor în acest domeniu sunt încă departe de a oferi certitudini(3-6). În plus, trebuie precizat că vizualizarea endoscopică a regiunii glandulare este mai dificilă decât cea a regiunii aglandulare, ca urmare a prezenţei constante în această zonă a unei cantităţi variabile de conţinut fluid. La acest inconvenient se mai adaugă un aspect tehnic privind lungimea endoscopului, care trebuie să fie de minimum 2,5 m(9,15). Datele referitoare la prevalenţa GGE la caii de sport în timpul sezonului competiţional sunt redate în tabelul 2.

În ţara noastră, prevalenţa sindromului ulcerului gastric în populaţia de cai de sport activi este fără îndoială subestimată, din cauza unor simptome mai puţin caracteristice şi a unei evoluţii discrete sau chiar asimptomatice. Având în vedere că peste 50% dintre caii de sport sunt purtători asimptomatici de eroziuni sau ulceraţii gastrice(8), devine evident că acurateţea diagnosticului şi implicit epidemiologia bolii sunt dependente de mijloacele avansate de explorare paraclinică. În acest context, gastroscopia reprezintă atât metoda optimă de diagnostic, cât şi de monitorizare a eficienţei tratamentelor aplicate. Cu toate acestea, în sindromul ulcerului gastric nu există întotdeauna o corelaţie directă între severitatea leziunilor diagnosticate prin gastroscopie şi intensitatea manifestărilor clinice. În consecinţă, acurateţea diagnosticului în sindromul ulcerului gastric la cal este condiţionată de interpretarea corelativă a datelor clinice cu rezultatele gastroscopiei(2,7).
Particularităţile anatomo-fiziologice ale stomacului la calul adult
- Organ cavitar cu profilul literei „J“ pe secţiune sagitală, distingându-se orificiul cardia şi orificiul piloric reunite prin pereţii gastrici care delimitează mica şi marea curbură a stomacului.
- Volumul gastric este redus în raport cu masa corporală, fiind cuprins între 8 şi 15 litri(8).
-
Regiunea aglandulară (fundică dorsală):
- este tapetată cu epiteliu scuamos stratificat
- este destinată mixării conţinutului gastric, şi nu digestiei
- este protejată parţial (bicarbonatul salivar) împotriva acizilor graşi volatili şi a acidului clorhidric
- este separată de regiunea glandulară prin margo plicatus.
-
Regiunea glandulară (fundică ventrală, antrul piloric, pilor):
- este tapetată cu o mucoasă glandulară cu funcţie secretoare predominant exocrină (pepsinogen, acid clorhidric), dar şi endocrină (histamină, serotonină, gastrină)(8)
- este protejată de sisteme antiacide elaborate, care secretă mucus şi bicarbonat.
- Gradientul de pH scade din regiunea fundică dorsală (aproximativ 7) înspre margo plicatus (între 6 şi 3), antru piloric şi pilor (între 4 şi 1,5).
- Secreţia gastrică de pepsinogen şi acid clorhidric este continuă.
- Pasajul gastric al substratului alimentar este dependent de structura şi consistenţa acestuia (de exemplu, fluide în circa jumătate de oră, fibroase în circa 24 de ore).
Etapele diagnosticului în sindromul ulcerului gastric
Anamneza poate orienta investigaţiile clinice şi paraclinice în direcţia acestui sindrom, dacă sunt relatate cel puţin următoarele simptome:
- Performanţe sportive mediocre sau submediocre, fără identificarea unui motiv evident.
- Reducerea consumului de concentrate sau uneori chiar refuzul lor temporar.
- Toleranţă slabă la exerciţiu şi randament redus la antrenamente.
- Simptome digestive discrete sau evidente.
Examenul clinic permite identificarea unui pacient adesea asimptomatic sau prezentând simptome generale necaracteristice, cum ar fi:
- Păr mat deteriorat, lipsit de luciu.
- Decubit frecvent, inapetenţă.
- Mucoase aparente palide.
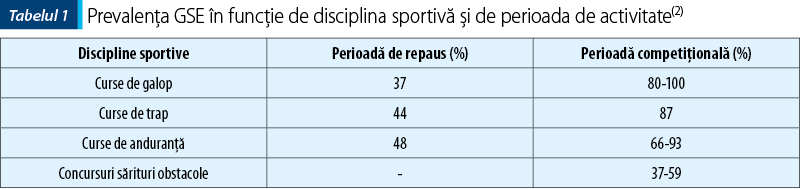
Simptomele digestive care pot fi atribuite sindromului ulcerului gastric sunt:
- Colici slabe recidivante (A).
- Bruxism, sialoree (B).
- Diaree (C).
Simptomele enumerate pot fi identificate atât la caii afectaţi de leziuni ale mucoasei glandulare, cât şi la cei cu leziuni ale mucoasei scuamoase. Totuşi, conform unui studiu recent, inapetenţa şi slăbirea ponderală pot fi atribuite leziunilor mucoasei scuamoase, în timp ce colica ar fi asociată ulceraţiilor severe de la nivelul mucoasei glandulare(16). Acelaşi autor susţine că sensibilitatea la nivelul flancurilor şi în zona de aplicare a chingii sunt simptome frecvente în sindromul ulcerului gastric la caii de sport.
Gastroscopia
Pregătirea pacientului:
- dietă alimentară de 12–24 de ore (D).
Aparatura necesară:
- endoscop flexibil cu o lungime minimă de 2,5 m (preferabil 3 m) (E).
Manopere premergătoare:
- sedare uşoară cu un α-2 agonist
- contenţie în stand.
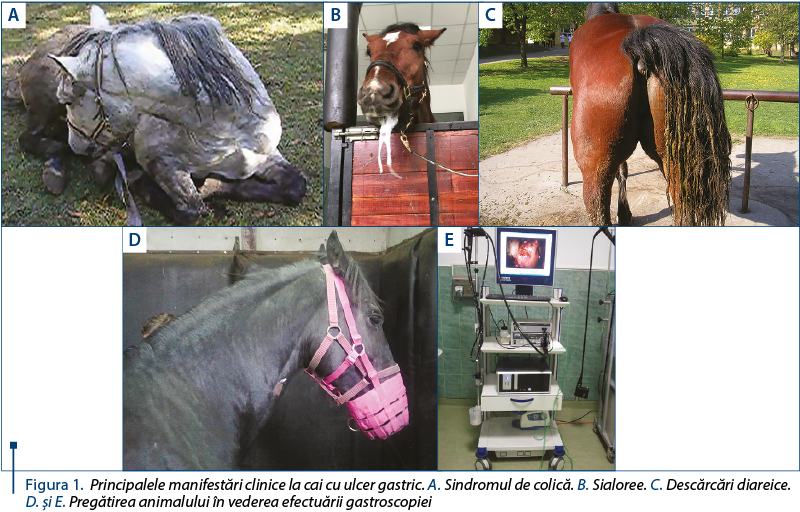
Modificările macroscopice ale mucoasei gastrice vizualizate prin gastroscopie sunt variabile ca severitate şi constituie elementele de clasificare a leziunilor din sindromului ulcerului gastric ecvin (tabelul 3).

Această stadializare a leziunilor din sindromul ulcerului gastric a fost observată la cai de sport examinaţi în cadrul Clinicii de patologie medicală a Facultăţii de Medicină Veterinară Cluj-Napoca, fiind selecţionate conform scorului lezional (tabelul 3) următoarele imagini. Se poate observa coexistenţa unor leziuni de gravitate diferită pe ambele tipuri de mucoasă (G, H).
O metodă paraclinică alternativă gastroscopiei constă în efectuarea testului de absorbţie a sucrozei. Acesta constă în administrarea pe sonda nazogastrică a unei soluţii de sucroză 10% în doză de 1 g/kg, cu restricţie de hrană în timpul derulării testului şi prelevarea probelor de sânge în minutele 45 şi 90 post-administrare. În sindromul ulcerului gastric se înregistrează o creştere semnificativă a nivelului sangvin al sucrozei la finalul testului, confirmând prezenţa leziunilor gastrice. La caii sănătoşi, testul este negativ, deoarece peretele gastric intact împiedică absorbţia sucrozei, ca efect al dimensiunilor mari ale acestei moleculei(17,19).
Tratament – obiective:
- Managementul nutriţiei şi modificarea dietei
- Limitarea stresului
- Controlul agenţilor agresivi
- Stimularea vindecării ulcerelor
- Stimularea golirii stomacului
- Antibioterapia.
Modularea conduitei terapeutice în sindromul ulcerului gastric va ţine cont în egală măsură de topografia leziunilor şi de evoluţia lor stadială, de la cele de tip preulcerativ la cele de tip ulcerativ. Controlul secreţiei acide prin măsurile igieno-dietetice, dublate de medicaţia specifică, constituie obiectivul major care condiţionează obţinerea vindecării atât în cazul GSE, cât şi în cazul GGE.
Măsurile prezentate în continuare vizează controlul secreţiei acide în aceste două entităţi morbide ale sindromului ulcerului gastric.
1. Managementul nutriţiei şi modificarea dietei:
- Evitarea perioadelor de înfometare
- Accesul liber la fân
- 25-38% din fibroase trebuie reprezentate de fân de lucernă (efect antiacid)(6,18,19)
- Reducerea concentratelor la 0,5 kg/100 kg m.c., raţie repartizată în minimum 3 reprize/zi
- Ulei de porumb – 240 ml/zi (creşte producţia de mucus în regiunea glandulară)
- Seminţe sau turte de in.
2. Controlul stresului, prin:
- Limitarea efortului
- Acces liber în exteriorul adăpostului (padocuri)
- Evitarea stabulaţiei prelungite
- Evitarea transporturilor sau reducerea frecvenţei şi a timpului necesar acestora.
3. Controlul agenţilor agresivi, prin:
-
Reducerea secreţiei acide
- Mixtură de hidroxid de aluminiu şi hidroxid de magneziu (Maalox®) 250 ml, per os(19)
- Antihistaminice H2 (Ranitidină – Zantac® 6,6 mg/kg la 8 h); (Cimetidină – Tagamet® 20-25 mg/kg la 6-8 ore)
- Inhibitori ai pompei de protoni (Omeprazol – GastroGard® 2-4 mg/kg/zi).
Deşi eficiente în supresia secreţiei, antihistaminicele H2 sunt utilizate mai puţin în comparaţie cu inhibitorii pompei de protoni, din cauza posologiei (doze, interval între administrări), care implică dezavantaje legate de costuri şi comoditatea administrării. În plus, există un consens larg în privinţa eficienţei superioare a inhibitorilor pompei de protoni în terapia sindromului de ulcer gastric comparativ cu antihistaminicele H2(2,6,7,8,19).
4. Stimularea vindecării ulcerelor are ca principii de bază creşterea cantităţii de mucus protector, intensificarea fluxului sangvin local şi accelerarea reepitelizării mucoasei lezionate. Dintre medicamentele care generează aceste efecte benefice, se remarcă următoarele:
- Misoprostolul, singur sau combinat cu omeprazolul (Gastrotec®), este un analog sintetic de prostaglandină E1 (PGE1), care în doză de 5 µg/kg, tot la 8 ore, creşte fluxul sangvin local, secreţia de mucus şi de bicarbonat.
- Sucralfatul, 20-40 mg/kg, tot la 8 ore interval(19), are ca efecte stimularea sintezei de PGE1, creşterea secreţiei de mucus protector, intensificarea fluxului sangvin local şi susţinerea reepitelizării mucoasei glandulare prin prevenirea degradării factorului de creştere al fibroblastelor(20). În plus, sucralfatul are un efect de pansament local, datorită aderenţei foarte bune la mucoasa ulcerată(2).
5. Stimularea golirii stomacului, în unele boli gastrointestinale (de exemplu, ulcere pilorice sau duodenale), care, prin efectele locale (de exemplu, edem, cicatrice retractile, stenoze), întârzie evacuarea gastrică şi induc secundar GSE. Evitarea acestei consecinţe nedorite impune administrarea unor medicamente procinetice(19,21) cum ar fi:
- Betanecolul, în doză de 0,025-0,03 mg/kg, s.c. la 3-4 ore, urmat de 0,3-0,45 mg/kg, per os la 6-8 ore interval.
- Eritromicină lactobionat, 0,1-1 mg/kg, i.v.
Trebuie totuşi subliniat că ptialismul, refluxul duodeno-gastric cu dilataţia secundară a stomacului şi descărcările diareice sunt efecte secundare posibile, care impun o monitorizare strictă a pacienţilor în timpul terapiei cu medicamentele procinetice menţionate.
6. Antibioterapia reprezintă o metodă controversată în terapia sindromului ulcerului gastric, întrucât implicarea certă a unui factor bacterian specific (de exemplu, Helicobacter pylori) în etiopatogeneza acestui sindrom nu a fost încă demonstrată. Mai mult, adăugarea unor antibiotice (de exemplu, trimetoprim-sulfadimidină) în protocolul terapeutic aplicat unor cai Pursânge Englez afectaţi de ulcere gastrice nu a condus la îmbunătăţirea procentului de vindecare(22,23).
Aplicarea obiectivelor terapeutice descrise va fi diferenţiată în funcţie de regiunea anatomică lezionată. Astfel, în GSE, tratamentul medicamentos se bazează pe omeprazol, sub diferite forme de prezentare. De obicei, se preferă omeprazolul granule gastrorezistente cu eliberare intestinală, care se administrează oral în doză de 1 mg/kg/zi. În cazul utilizării formelor neprotejate împotriva mediului gastric acid, doza va fi de 4 mg/kg/zi. O alternativă la omeprazol ar fi ranitidina în doză de 6,6 mg/kg, tot la 8 ore. Durata tratamentului va fi de 21 de zile, iar decizia întreruperii acestuia se va lua numai după reevaluarea gastroscopică a pacientului.
Terapia GGE constă în administrarea omeprazolului după posologia utilizată în cazul GSE, asociat cu sucralfatul în doză de 12 mg/kg, repetat la 12 ore. În GGE, durata tratamentului va fi de 4 săptămâni, iar decizia de oprire a terapiei va fi luată pe baza rezultatelor obiective obţinute prin gastroscopie(2).
7. Prevenirea recidivelor în sindromul ulcerului gastric la calul de sport presupune respectarea principiilor de nutriţie şi de management al antrenamentului prezentate la punctele 1 şi 2. În plus, la caii susceptibili, înaintea şi în timpul derulării unor evenimente cu potenţial stresant (de exemplu, antrenamente, competiţii, transporturi) este eficientă administrarea omeprazolului la ½ - ¼ din doza terapeutică uzuală (de exemplu, omeprazol granule gastrorezistente – 1 mg/kg/zi).
Medicamentele antiacide clasice pot fi înlocuite eficient cu produse nutraceutice pe bază de fosfat de aluminiu, carbonat de calciu, carbonat de dihidroxi-aluminiu sodic (de exemplu, Neigh-Lox®; Gastric Ulcer Transnutrient®) sau cu cele conţinând complexe de pectină-lecitină (de exemplu, Egusin®; Apolectol®), adăugând uneori hidroxid de magneziu şi probiotice levurice(24-27).
Nutraceuticele exemplificate au efect protector în ambele forme clinice ale sindromului ulcerului gastric (GSE şi GGE), cu menţiunea că efectul lor va fi întotdeauna potenţat de respectarea măsurilor dietetice şi de controlul stresului.
Conflict of interests: The author declares no conflict of interests.
Bibliografie
- Martineau H, Thompson H, Taylor D. Pathology of gastritis and gastric ulceration in the horse. Part 2: A scoring system. Equine Vet J. 2009;41:646–651.
- Sykes BW, Hewetson M, Hepburn RJ, Luthersson N, Tamzali Y. European College of Equine Internal Medicine Consensus Statement. Equine Gastric Ulcer Syndrome in Adult Horses. J Vet Intern Med. 2015;29:1288–1299.
- MacAllister CG, Morgan SJ, Borne AT, Pollet R.A. Comparison of adverse effects of phenylbutazone, flunixin meglumine and ketoprofen in horses. J Am Vet Med Assoc. 1993;202:71–77.
- Levenstein S, Rosenstock S, Jacobsen RK, Jorgensen T. Psychological stress increases risk for peptic ulcer, regardless of Helicobacter pylori infection or use of nonsteroidal anti-inflammatory drugs. Clin Gastroenterol Hepatol. 2015;13(3), 498-506.
- Husted L, Jensen TK, Olsen SN, Mølbak L. Examination of equine glandular stomach lesions for bacteria, including Helicobacter spp. by fluorescence in situ hybridisation. BMC Microbiol. 2010;10:84.
- Bezdekova B. Equine Gastric Ulcer Syndrome. Proceedings of the 13th International Congress of the World Equine Veterinary Association. 2013;Budapest, Hungary.
- Moţ T, Sărăndan H, Petruse C. Sindromul ulcerului gastric la cal: diagnostic şi terapie. Med. Vet. 2008;1: 11–13.
- Picavet MT. Equine gastric ulcer syndrome. In Proceedings of the First European Equine Nutrition & Health Congress (www. equine-congress. com/). 2002;Antwerp Zoo, Belgium.
- Bezděková B, Jahn, P, Vyskočil M, Plachý J. Prevalence of equine gastric ulceration in Standardbred racehorses in Czech Republic. Acta Vet Brno. 2005;74(1), 59-65.
- Begg LM, O’Sullivan BC. The prevalence and distribution of gastric ulceration in 345 race horses. Aust Vet J. 2003;81:199–201.
- Dionne RM, Vrins A, Doucet MY, Pare J. Gastric ulcers in standardbred race horses: prevalence, lesion description, and risk factors. J Vet Intern Med. 2003;17(2), 218-222.
- Hepburn RJ. Endoscopic examination of the squamous and glandular gastric mucosa in sport and leisure horses: 684 horses (2005–2011). In Proc 11th International Equine Colic Research Symposium. 2014;(Vol. 5).
- Tamzali Y, Marguet C, Priymenko N, Lyazrhi F. Prevalence of gastric ulcer syndrome in high‐level endurance horses. Equine Vet J. 2011;43(2), 141-144.
- Sykes BW, Jokisalo JM. Rethinking equine gastric ulcer syndrome: Part 1 – Terminology, clinical signs and diagnosis. Equine Vet Educ. 2014;26(10): 543-547.
- Murray MJ, Nout YS, Ward DL. Endoscopic findings of the gastric antrum and pylorus in horses: 162 cases (1996–2000). J Vet Intern Med. 2001;15(4), 401-406.
- Haggett E. Prevalence of equine gastric ulcer syndrome in performance horses. 2016;https://www.vettimes.co.uk.
- Hewetson M, Sykes BW, Hallowell GD, Tulamo RM. Diagnostic accuracy of blood sucrose as a screening test for equine gastric ulcer syndrome (EGUS) in adult horses. Acta Vet Scand. 2017;59(1), 15.
- Vondran S, Venner M, Vervuert I. Effects of two alfalfa preparations with different particle sizes on the gastric mucosa in weanlings: alfalfa chaff versus alfalfa pellets. BMC Vet Res. 2016;12(1), 110.
- Buchanan BR, Andrews FM. Treatment and prevention of equine gastric ulcer syndrome, Vet Clin Equine. 2003;19, 575–597.
- Hallowell G. Equine gastric squamous and glandular disease update. 2017; https://www.vettimes.co.uk
- Ringger NC, Lester GD, Neuwirth L, Merritt AM, Vetro T, Harrison J. Effect of bethanechol or erythromycin on gastric emptying in horses. Am J Vet Res. 1996;57(12), 1771-1775.
- Sykes BW, Sykes KM, Hallowell GD. Administration of trimethoprim-sulphadimidine does not improve healing of glandular gastric ulceration in horses receiving omeprazole: a randomised, blinded, clinical study. BMC Vet Res. 2014;10(1), 180.
- Andrews FM, Buchanan BR, Elliot SB, Clariday NA, Edwards LH. Gastric ulcers in horses. J. Anim. Sci. 2005;83(E. Suppl.):E18–E21.
- Sanz MG, Viljoen A, Saulez MN, Olorunju S, Andrews FM. Efficacy of a pectin-lecithin complex for treatment and prevention of gastric ulcers in horses. Vet Rec. 2014;175(6), 147-147.
- Woodward MC, Huff NK, Garza F, Keowen ML, Kearney MT, Andrews FM. Effect of pectin, lecithin, and antacid feed supplements (Egusin®) on gastric ulcer scores, gastric fluid pH and blood gas values in horses. BMC Vet Res. 2014;10(1), S4.
- Sykes BW, Sykes KM, Hallowell GD. Efficacy of a Combination of a Unique Pectin‐Lecithin Complex (Apolectol®), Live Yeast and Magnesium Hydroxide in the Prevention of EGUS and Faecal Acidosis in Thoroughbred Racehorses: A Randomised, Blinded, Placebo Controlled Clinical Trial. Equine Vet J. 2013;45(S44), 13-13.
- Sykes BW, Sykes KM, Hallowell GD. Efficacy of a combination of Apolectol®, live yeast (CNCM I-1077) and magnesium hydroxide in the management of Equine Gastric Ulcer Syndrome in thoroughbred racehorses: A randomised, blinded, placebo controlled clinical trial. J Eq Vet Sci. 2014;34, 1274-1278.
Articole din ediţiile anterioare
Sindromul de hiperostoză a bolţii craniene la câine
Hiperostoza reprezintă proliferarea excesivă, localizată sau difuză, de os nou. Obişnuit, producţia de os apare la locul de inserţie al muşchilor, ...
Pseudomonozele psitacinelor
Ordinul Psittaciformes încadrează taxonomic familiile: Loriinae (papagali Lori sau falşii peruşi), Cacatuidae (papagalii cu creastă şi peruşii n...
Sindromul ulcerului gastric ecvin
Sindromul ulcerului gastric ecvin se referă la „complexul bolilor asociate cu ulceraţia mucoasei esofagiene, gastrice sau duodenale”. Ulceraţia apa...
Prevalenţa semnelor clinice în sindromul de disfuncţie cognitivă canină
Sindromul de disfuncţie cognitivă canină (SDCC) este o boală degenerativă a parenchimului cerebral, asemănătoare bolii Alzheimer de la om (Dewey, 2...