The taxonomy of Psittaciformes Order classifies Families such as Loriidae (Lori parrots or False parrots), Cacaduidae (parrots with crest and nymphs) and Psittacidae (true parrots and parrots). The ever-increasing desire to obtain specimens with plumage and especially a spectacular chromatics has in many cases meant reproduction by repeated inbreds and very close kinship (even repetitive generations of mother-son or father-daughter matings), causing secondary changes in the metabolism and immune system of the obtained birds, characters that were transmitted to the next generations. The breeding conditions are not always correlated with the needs of these species, in many cases the knowledge about the eco-biology of captive-grown psittacins is rather poor, which leads to an increase in their sensitivity. In recent years, we are confronted in the clinic of these bird species with extremely diverse pathologies or metabolic changes that have never been described or even observed in wild parrots. Proper diagnosis using current imaging and cyto-histological methods allows for rapid therapeutic intervention and positive results. Among the pathological problems that are difficult to diagnose and treat are viral diseases, often confused with a series of diseases with extremely different etiologies.
Viroze comune ale psitacinelor
Common viral diseases of psittacines
First published: 20 noiembrie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.29.8.2017.1257
Abstract
Rezumat
Ordinul Psittaciformes încadrează taxonomic familiile: Loriide (papagali Lori sau falșii peruși), Cacaduidae (papagalii cu creastă și perușii-nimfă) și Psittacidae (papagali și peruși adevărați). Dorința tot mai accentuată de a obține exemplare cu penaj și în special cu o cromatică spectaculoasă a însemnat în multe situații reproducerea prin consangvinizare repetată și în grade de rudenie extrem de apropiate (chiar repetarea pe mai multe generații a împerecherilor mamă-fiu sau tată-fiică), determinându-se în plan secundar modificări importante în metabolismul și sistemul imunitar al produșilor obținuți, caractere care s-au transmis în generațiile următoare. Condițiile de întreținere nu sunt întotdeauna corelate cu necesitățile speciilor respective, în multe cazuri cunoștințele despre ecobiologia psitacinelor crescute în captivitate fiind destul de sărace, acestea ducând la o accentuare a sensibilității lor. În ultimii ani ne confruntăm în clinica acestor specii de păsări cu patologii extrem de diverse sau cu modificări metabolice care nu au fost niciodată descrise sau măcar observate la papagalii aflați în sălbăticie. Diagnosticarea corectă utilizând metodele imagistice și citohistologice actuale permite o intervenție terapeutică rapidă și cu rezultate pozitive. Printre problemele patologice dificile ca diagnostic și conduită terapeutică sunt bolile virale, frecvent confundate cu o serie de boli cu etiologii extrem de diferite.
Ordinul Psittaciformes încadrează taxonomic familiile: Loriide (papagali Lori sau falșii peruși), ++Cacaduidae (papagalii cu creastă și perușii-nimfă) și Psittacidae (papagali și peruși adevărați). Varietatea de forme pe care aceste specii de păsări le oferă a condus (mai ales în ultimii 50 de ani) la o adevărată nebunie printre crescătorii de păsări exotice, rezultând un interes tot mai mare de a crește și chiar de a le reproduce în captivitate. Dorința tot mai accentuată de a obține exemplare cu penaj și în special cu o cromatică spectaculoasă a însemnat în multe situații reproducerea prin consangvinizare repetată și în grade de rudenie extrem de apropiate (chiar repetarea pe mai multe generații a împerecherilor mamă-fiu sau tată-fiică). În plus, condițiile de întreținere nu sunt întotdeauna corelate cu necesitățile speciilor respective, iar în multe cazuri cunoștințele despre ecobiologia psitacinelor crescute în captivitate sunt destul de sărace. În ultimii ani ne confruntăm în clinica acestor specii de păsări cu patologii extrem de diverse sau cu modificări metabolice care nu au fost niciodată descrise sau măcar observate la papagalii aflați în sălbăticie. Diagnosticarea corectă utilizând metodele imagistice și citohistologice actuale permite o intervenție terapeutică rapidă și cu rezultate pozitive. Abordarea unui astfel de subiect este importantă, deoarece, pe de o parte, frecvența bolilor virale la păsările de colivie și volieră este într-o creștere accelerată, iar pe de altă parte, pentru că greșelile de diagnostic (implicit intervenția terapeutică) sunt tot mai dese.
O viroză care apare tot mai frecvent la psitacinele de colivie și volieră este boala Newcastle. Este o entitate morbidă aflată printre cele mai importante și distructive boli ale păsărilor, care poate cauza o mortalitate de până la 100% în populațiile susceptibile, răspândindu-se rapid în voliere și în grupurile de păsări din aceeași zonă. Virusul bolii Newcastle (NDV) a fost izolat inițial de la peste 100 de specii de păsări, dintre care 35 sunt specii de papagali, iar astăzi se consideră că prezența acestui agent patogen este posibilă la toate speciile de păsări. Cu toate acestea, boala poate fi prezentă sub diferite forme, în funcție de patogenitatea manifestată de tulpina virală implicată și de susceptibilitatea speciei de pasăre infectate. Unele specii precum palmipedele au o rezistență naturală considerabilă față de acest virus, în timp ce altele, precum găinile, porumbeii și majoritatea speciilor de papagali, sunt foarte susceptibile. Istoric, denumirea „Newcastle” se referă la localitatea Newcastle-on-Tyne, în care a avut loc un episod descris în 1926, demonstrându-se diferența dintre acest virus filtrabil și agentul patogen al gripei aviare. Un grup restrâns de păsări domestice au fost afectate în acel an, acestea fiind hrănite cu furaje aduse pe vase care făceau comerț cu Orientul Îndepărtat. O boală asemănătoare fusese descrisă în aceeași perioadă și în Java, iar pentru o perioadă lungă, în Marea Britanie, orice formă a acestei boli și a gripei aviare a fost descrisă și menționată ca „pestă aviară”. Virusul bolii Newcastle (NDV) conține ARN, având o structură elicoidală și un strat extern de natură lipidică, fiind clasificat ca un myxovirus. Această familie de virusuri este divizată mai departe în grupul virusurilor gripei, influenza virus, și grupul paramyxovirusurilor. Există nouă tipuri serologice diferite ale paramixovirusurilor aviare, NDV fiind identificat ca un paramyxovirus tip I. Preparatele izolate ale NDV sunt imposibil de distins din punct de vedere morfologic și structural, dar patogenitatea lor în cazul infectării păsărilor poate varia considerabil, determinând o varietate de forme clinice a căror severitate poate fi diferită. În cazul papagalilor care au murit în ariile de carantină au fost izolate paramixovirusuri din grupul 3. Acestor infecții li se pot asocia encefalită și rate crescute de mortalitate, iar moartea în număr mare a perușilor ondulați comuni poate fi cauzată de infecția cu grupul 5 de paramixovirusuri. Patogenitatea tulpinilor virale ale NDV poate varia. Acelea care manifestă patogenitate slabă sunt menționate ca „lentogene”, acelea care manifestă patogenitate medie sunt „mesogene”, iar tulpinile care manifestă patogenitate ridicată sunt denumite „velogene”. Cercetările realizate asupra tulpinilor virale izolate de la papagali au arătat faptul că acestea sunt velogene, iar din punct de vedere antigenic, nu diferă de cele izolate de la pui de găină.
Din punct de vedere clinic, este foarte probabil ca păsările infectate să nu prezinte niciun fel de semn clinic sau pot prezenta o serie de manifestări cu intensitate variabilă. În cazul episoadelor cu tulpini velogene ale NDV, primele semne sunt marcate de apatie, depresie, pene zburlite și pierderea bruscă a apetitului. Acestea sunt rapid însoțite de dificultăți în respirație („gâfâit” și „borborisme respiratorii”). Deseori pot apărea și simptome datorate afectării sistemului nervos, cu incoordonare, tremurături sau instabilitate a poziției capului, întoarceri bruște ale gâtului și chiar paralizie. Uneori pot apărea și scurgeri de salivă în exces, cu spumă și resturi de salivă prezente la colțurile ciocului. Un alt semn deseori întâlnit este diareea, cu consistență apoasă și de culoare verzuie, conținând o cantitate considerabilă de urați. Nu există niciun răspuns în urma aplicării tratamentului cu agenți antibacterieni, moartea survenind în mod obișnuit la 3 zile de la apariția primelor simptome. Boala Newcastle este una dintre acele boli a cărei prezență poate fi bănuită în cazul ratelor crescute de mortalitate a papagalilor. Unele semne clinice pot predomina, în funcție de tropismul tulpinii virale sau de specia de pasăre afectată. Au fost raportate cazuri în care papagalii originari din America de Sud au avut semne clinice predominant legate de sistemul nervos. Cu toate acestea, în momentul în care apar semne clinice la nivel enteric în ceea ce privește speciile din Asia de Sud-Est, acestea sunt considerate ca fiind predominante pentru diagnosticul bolii.
În mod obișnuit, în urma examinării post-mortem nu există niciun semn anormal. Cu toate acestea, carcasele pot avea un aspect septicemic, cu edem subcutanat și hemoragie, ficatul și rinichii închiși la culoare și măriți în volum, pulmonii edemațiați și splina mărită în volum. Cel mai important semn clinic specific examinării post-mortem este traheita - mucoasa traheală prezintă hemoragie difuză și în unele cazuri poate fi prezent și un exsudat sangvinolent. Pot fi observate pete de sânge și hemoragii la nivelul mucoasei proventriculului, al intestinului subțire și pe suprafețele seroase ale intestinelor. De asemenea, există posibilitatea prezenței unei enterite hemoragice, cu dilatarea peretelui intestinal, acumularea de lichid și cu îngroșarea și congestia mucoasei intestinului subțire.
În cazul multor episoade ale bolii Newcastle cu tulpini velogene, diagnosticul prezumtiv poate fi pus pe baza semnelor clinice și anamnezei. De asemenea, există acte care pot completa istoricul importului sau achiziționării de noi păsări și un istoric al apariției bruște evidente a semnelor clinice severe, cu tulburări respiratorii, incoordonare și diaree. Cu toate acestea, dacă nu există date asupra momentului achiziționării, iar semnele clinice nu sunt clar exprimate și moderate ca severitate, testele de laborator vor constitui principalul mod de stabilire a unui diagnostic. În cazul păsărilor vii, testul de inhibare a hemaglutinării (IH) unei probe de ser sangvin este cel mai des utilizat, deoarece anticorpii hemaglutinanți apar deseori la două zile de la apariția primelor semne clinice. Cu toate acestea, testul final de confirmare a bolii Newcastle este izolarea și identificarea agentului viral cauzal. NDV se dezvoltă rapid în cazul injectării de țesut infectat în alantoida embrionilor de găină în vârstă de 10 zile. Dacă tulpina virală este velogenă, embrionul va fi omorât în 48 de ore, iar virusul poate fi depistat în lichidul alantoidei. Prezența virusului hemaglutinant poate fi demonstrată prin testarea aglutinării hematiilor prelevate de la pui în prezența lichidului alantoidei, iar NDV poate fi identificat prin faptul că aglutinarea este inhibată de serul imunologic specific pentru boala Newcastle. Pentru identificarea rapidă a virusului pot fi utilizate și testele fluorescente cu anticorpi. Țesuturile corespunzătoare utilizării pentru izolarea acestui virus pot fi constituite din porțiuni de trahee, pulmon sau intestine, iar dacă nu este posibilă utilizarea unei carcase, virusul poate fi izolat prin utilizarea unor tampoane sterile care sunt utilizate pentru prelevarea unor probe din regiunea cloacală a păsărilor la care au apărut primele semne clinice. NDV se dezvoltă la fel de bine și pe culturi tisulare prelevate din linii celulare de la mamifere. Diagnosticul diferențial - în cazul unei forme moderate sau subacute a bolii Newcastle, semnele clinice pot fi slab exprimate și nespecific, păsările afectate putând manifesta depresie, tulburări respiratorii, posibil și diaree. Însă aceste semne pot fi datorate și altor boli, precum psitacoza, salmoneloza, boala Pacheco, infecțiilor cu reovirus și aspergilozei. Boala Newcastle se poate complica prin apariția unei infecții secundare cu Aspergillus spp. sau Salmonella spp.
Principala cale de transmitere a NDV este cea aeriană. Păsările infectate pot transmite virusul în perioade de 48 de ore de la expunere și înainte de orice apariție a semnelor clinice. Virusul părăsește tractusul respirator în momentul expirației, putând rezista în aer perioade îndelungate. Astfel, poate avea loc răspândirea acestui agent patogen de la un grup de păsări la altul, acestea aflându-se în vecinătate. Transmiterea pe cale verticală, de la pasăre prin ou, nu a fost demonstrată încă, dar au existat cazuri în care ouăle depuse de păsări infectate au conținut embrioni morți. Introducerea unei păsări infectate rămâne principala cale de contaminare într-un efectiv indemn. Au existat păreri care susțineau că papagalii pot fi purtători ai NDV pentru perioade lungi, fără a manifesta semne clinice specifice. Alți specialiști sunt de părere că starea de purtător perioade îndelungate nu există, iar papagalii infectați, dar care nu mor, vor fi indemni după 4 săptămâni de la dispariția semnelor clinice.
Pentru controlul bolii în Marea Britanie, principala cale este prevenirea apariției, prin controlarea importului păsărilor sau a produselor alimentare cu origine animală. Ordinul referitor la Importul Păsărilor, Puilor de Găină și Ouălor de Reproducție din 1979 interzice introducerea în țară a oricăror păsări vii fără acte și autorizație. Cu toate acestea, papagalii și alte păsări de companie pot fi adăpostiți în zone de carantină ale Ministerului Agriculturii pe o perioadă de cel puțin 35 de zile, sub supravegherea medicului veterinar. În aceeași zonă de carantină sunt plasați și pui-santinelă nevaccinați, ca metodă de verificare a prezenței acestei boli. Păsările care mor în zonele de carantină sunt trimise la Centrul de Investigații Veterinare, pentru efectuarea examinării post-mortem, care include și testarea prezenței NDV prin inocularea embrionilor de găină. Dacă se reușește izolarea acestui virus, păsările aflate în zona de carantină nu vor fi eliberate. Pe lângă aplicarea acestor măsuri de control, orice avicultor trebuie să izoleze păsările recent achiziționate cel puțin 4 săptămâni înainte de introducerea în volieră sau în alte adăposturi menite să găzduiască mai multe păsări.
O altă posibilitate de control al bolii este vaccinarea. Se pot utiliza vaccinuri vii și inactivate care și-au dovedit eficacitatea în cazul puilor. Acestea sunt utilizate pe scară largă și cu succes în majoritatea țărilor, în vederea protejării puilor. Vaccinurile vii sunt ieftine și ușor de utilizat, putând fi administrate pe cale orală, în apă, în ochi sau sub formă de picături în nas sau ca spray (aerosoli). Deoarece papagalii beau apă cu întreruperi, administrarea în apă este considerată mai puțin eficientă față de celelalte căi de aplicare pentru aceste specii. Vaccinurile vii cu tulpini lentogene, cu administrare prin spray și cu repetare la 2-3 săptămâni, ar putea da rezultate satisfăcătoare în ceea ce privește imunitatea. Cu toate acestea, pentru protejarea speciilor de cacadu și de peruși din Jurong Bird Park din Singapore, se folosește aplicarea vaccinului sub formă de spray în fiecare lună, deoarece această boală constituie o adevărată amenințare în zonă. Utilizarea vaccinurilor vii cu tulpini lentogene va crește și șansele de supraviețuire a păsărilor care nu au fost încă infectate. În cazul volierelor mari, care adăpostesc un număr mare de papagali, se pot utiliza echipamente speciale care generează picături sub formă de aerosoli, cu un diametru inițial de până la 60 µ și care vor evapora picături de chiar 3 µ, acest tratament fiind optim pentru vaccinarea papagalilor. Vaccinurile vii trebuie diluate în 500 ml de apă distilată și administrate cantitativ sub forma a 5 doze specifice puilor pentru fiecare papagal. Vaccinul trebuie administrat de-a lungul a 6-8 minute, la distanțe cuprinse între 0,5 și 1,5 m de păsări. În cazul puilor de găină, vaccinul cu tulpini virale standard în suspensie uleioasă administrat pe cale intramusculară prezintă eficacitate ridicată. Din nefericire, acest tip de vaccinuri inactivate nu este la fel de eficace în cazul papagalilor. La injectarea intramusculară a vaccinului la papagalul gri african (Psittacus erithacus) și la perușul ondulat comun (Melopsittacus undulatus) nu a fost depistată elaborarea de anticorpi inhibitori ai hemaglutinării. În cadrul aceluiași studiu, 75% dintre perușii ondulați comuni vaccinați au murit în momentul infectării cu tulpina patogenă a virusului. Utilizarea vaccinurilor împotriva bolii Newcastle în Marea Britanie depinde de legislația cu privire la controlul acesteia și dacă există vaccinuri standardizate. Când o țară este indemnă, vaccinarea psitacinelor nu mai este considerată necesară. Cu toate acestea, dacă situația este gravă și există colecții valoroase de psitacine în zonele în care posibilitatea apariției acestei boli este ridicată, vaccinarea trebuie luată în calcul.
Transportul papagalilor este considerat cel mai important factor al răspândirii bolii Newcastle, atât între diferite țări, cât și între granițele aceleiași țări. În ultimii 20 de ani, păsările crescute în sisteme industriale în diferite țări au fost puse în pericol din cauza papagalilor infectați. Există multe cazuri de izolare a NDV de la papagali importați din America de Sud și Asia de Sud-Est. Boala Newcastle este aproape sigur o boală endemică în cazul populațiilor de papagali sălbatici din acele zone. NDV a fost izolat în 54 de cazuri dintr-un total de 302 psitacine importate în Olanda, la 1,4% dintre cele 1.847 psitacine examinate în California între anii 1972 și 1973. La originea episoadelor grave ale bolii Newcastle la pui în California în 1971 a stat importul de papagali din America de Sud. Controlul acestei epizootii, în cadrul căruia au fost distruse 9 milioane de capete, a adus pierderi de 56 milioane de dolari Departamentului de Agricultură al SUA. Potențiala răspândire a bolii Newcastle de la papagalii importați a fost ilustrată foarte detaliat în 1971, în California, când un importator a distribuit 176 de păsări afectate de această boală în magazine de animale din 35 de state diferite. În Anglia, în 1975, proprietarul unui număr redus de pui de găină a importat 20 de papagali din Orientul Îndepărtat și i-a adăpostit alături de păsările deja existente. Toate păsările importate au murit, iar după câteva zile boala a fost diagnosticată și la puii de găină. Într-o săptămână au apărut alte două cazuri în vecinătate. Originea episoadelor bolii Newcastle velogene în estul Angliei în 1970 nu a fost niciodată stabilită, existând posibilitatea ca virusul să fi fost introdus în țară prin intermediul păsărilor captive. Episoadele de boală Newcastle din Olanda și Canada au fost, de asemenea, strâns legate de importul de papagali. În Marea Britanie, boala Newcastle a papagalilor este evaluată aproape de fiecare dată în cazul papagalilor în carantină. Scopul este acela ca boala să nu apară la păsările eliberate din carantină sau să apară cât mai rar posibil.
Boala Pacheco a papagalilor - sau hepatita herpetică a psitacinelor - a fost descrisă prima dată în Brazilia, în 1930, ca o boală care afecta papagalii. Nu se transmitea la șoareci și la canari, astfel părând diferită de psitacoză. Ulterior s-a demonstrat că natura sa infecțioasă era strict legată de virusul herpetic, devenind cunoscută sub denumirea de boala Pacheco a papagalilor. Caracteristicile acestei boli erau mortalitatea ridicată și rapidă, precum și leziunile necrotice specifice de la nivelul ficatului și splinei. În timpul ultimilor 50 de ani, boala Pacheco a fost raportată în multe părți ale lumii, deseori cauzând mortalitate în număr ridicat în colecțiile de papagali. Boala apare deseori la papagalii recent achiziționați sau imediat după introducerea noii păsări în volieră. O caracteristică a acestei infecții cu virusul herpesului este apariția unei infecții latente pe termen lung și a păsărilor purtătoare. Stresul provocat de modificarea bruscă a mediului din volieră sau o ușoară scădere a valorilor de temperatură pot constitui factori care accelerează manifestările clinice. O infecție cu virusul herpesului cu mortalitate ridicată și cu leziuni necrotice la nivelul ficatului a fost descrisă la porumbeii din Marea Britanie. Ulterior aceasta a fost descrisă și la păsările de pradă, existând dovezi că virusul herpesului poate fi transmis de la porumbei la păsările de pradă și ulterior la papagali. Dovezile sugerează faptul că răspândirea pe cale aeriană a virusului nu are loc, în realitate infecția apărând prin contaminarea fecală a hranei și apei, de la o pasăre la alta.
Din punct de vedere clinic, păsările afectate sunt deseori găsite moarte sau mor în câteva ore de la primul semn clinic, iar o epidemie apare deseori însoțită de moartea bruscă a unei singure păsări, după care apar cazuri multiple. Semnele clinice nu sunt evidente sau specifice, deseori luându-se în calcul anorexia, depresia și slăbirea progresivă. Ocazional, apar și diareea de culoare galbenă, ataxia și înclinarea capului. În urma examenului post-mortem, în cazurile tipice există focare necrotice bine definite la nivelul ficatului și al splinei. Acestea sunt de culoare albă sau galbenă, putând fi vizibile la suprafață sau prin parenchim. Uneori zonele necrotice din ficat devin coalescente, întreaga suprafață a organului apărând de consistență murdară. Țesutul dintre ariile necrotice este pal, cu peteșii vizibile. Uneori este prezent material gelatinos în exces în sacul pericardic, cu hemoragie la suprafața epicardului. Mucoasa intestinului subțire este de obicei de consistență densă, apărând injectată. Unii specialiști consideră că focarele necrotice de la nivelul splinei și al ficatului sunt o caracteristică invariabilă a bolii Pacheco. Într-un studiu s-a observat că singura anormalitate a fost înroșirea intensă a mucoasei intestinului subțire, iar în altele nu a existat nicio leziune de dimensiuni mari ca rezultat al examinării post-mortem.

Examinarea histologică se bazează pe examinarea la microscop a secțiunilor din leziunile efectuate de la nivel hepatic, prin intermediul preparatelor colorate cu hematoxilină și eozină, care evidențiază pierderea structurii normale datorată focarelor necrotice. Pot fi prezente unele infiltrații ale limfocitelor și histocitelor, la marginea țesutului abdominal, însoțite de diferite stadii ale degenerării hepatocitelor. Cu toate acestea, rezultatul specific în examinarea bolii Pacheco este marginalizarea cromatinei conținute în nucleii histocitelor și a corpilor de incluziune intranucleari eozinofilici și bazofilici.
Diagnosticul prin izolarea și identificarea virusului se bazează pe dezvoltarea acestuia pe embrionii de găină și pe fibroblastele acestora. Când embrionii de găină în vârstă de 10 zile sunt inoculați prin alantoidă, se produce moartea acestora în 7 zile, prezentând oprirea dezvoltării și hemoragii. Virusul herpesului determină și un efect citopatologic asupra monostraturilor fibroblastelor embrionilor de găină. Prin microscopie electronică se poate demonstra că particulele cu morfologie caracteristică virusului herpetic fac parte din cultura de țesut. Diagnosticul diferențial trebuie făcut în primul rând cu o hepatită a papagalilor asociată cu reovirusurile, ale cărei semne și leziuni post-mortem evidente sunt similare celor observate în cazul bolii Pacheco. S-a dovedit că suprainfecția cu microsporidii este în multe situații cauza mortalității ridicate a papagalilor din genul Agapornis din Marea Britanie. Principalele observații realizate ulterior examinării post-mortem au fost aspectele anormale de la nivelul ficatului și rinichiului, în unele cazuri ficatul fiind mărit în volum și având aspect murdar. O boală sistemică a acestor specii, care evoluează cu hepatomegalie și cu aspect murdar în cazul unor păsări dintre cele afectate, a fost de asemenea asociată cu infecția cu virusuri din familia Papavoviridae. Infecția cu unele tipuri de fagi ai Salmonella typhimurium poate, de asemenea, determina o hepatită cu etiologie bacteriană, cu focare de necroză. Necrozele hepatice multifocale, însoțite de corpi intranucleari de incluziune, relevate la examinarea speciei Nymphicus hollandicus, au fost asociate cu infecția cu adenovirus. Infecțiile simultane complică mult posibilitățile de diagnostic. Este demonstrat științific că orice altă infecție a papagalilor ar putea coexista cu infecția provocată de virusul herpetic, aspergiloza fiind cea mai întâlnită în cazul acesta.
Boala Pacheco nu beneficiază până în prezent de o terapie specifică, cu agenți antibacterieni sau cu vaccinuri disponibile comercial. Pentru protejarea psitacinelor de această boală, toate păsările recent achiziționate trebuie izolate cel puțin 4 săptămâni înainte de introducerea propriu-zisă în volieră. Din nefericire, ca urmare a posibilității apariției unei faze latente de lungă durată, această măsură se poate dovedi ineficientă. Stresul provocat de mutare și modificările legate de hrană și managementul achiziționării pot constitui factori declanșatori ai manifestării clinice a bolii în cazul unei păsări purtătoare. A fost sugerată ideea că fecalele papagalilor nou achiziționați ar trebui testate în vederea detecției virusului herpetic. Acest aspect ar fi consumator de timp și de resurse financiare, necesitând totodată condiții specifice de laborator, iar în majoritatea cazurilor nu poate fi pusă în practică. Cu toate acestea, o astfel de procedură poate fi luată în considerare în ceea ce privește protejarea unor specii rare și a colecțiilor valoroase de papagali.
O boală foarte asemănătoare cu boala Pacheco a fost semnalată și descrisă în ultimii ani, la baza sa stând însă o infecție cu reovirus. Această entitate morbidă a fost numită hepatita papagalilor asociată cu reovirusurile. Caracteristicile acestei stări morbide sunt reprezentate de mortalitatea ridicată și de prezența focarelor necrotice la nivelul ficatului, ca semne evidente relevate prin examinarea post-mortem. Virusurile din familia Orthoreoviridae au fost izolate în 15 din 28 de cazuri de papagali morți la doi ani după un import în Belgia. Principalele leziuni care au apărut în urma examinării post-mortem au fost enterita și congestia hepatică, asociate frecvent cu focare necrotice în ficat. Din probele de ficat prelevate de la papagalii morți importați din Zair s-a izolat o tulpină de reovirus. Păsările afectate au murit la scurt timp de la apariția primelor simptome, iar la autopsie au fost observate leziuni evidente de natură necrotică. La examinarea preparatelor din ficat pe lamă, prin colorație cu hematoxilină și eozină, nu au fost detectați corpi de incluziune care ar putea sugera boala Pacheco, iar în ceea ce privește psitacoza, la examinarea preparatelor din ficat și splină, obținute cu ajutorul colorației prin metoda Ziehl-Neelsen, nu au fost observate corpurile celulare elementare specifice. Reovirusurile pot determina frecvent boli ale ficatului la papagali. Unii specialiști au izolat un virus similar virusurilor din familia Reoviridae, de la papagali care au murit ulterior apariției primelor semne clinice ale bolii (diaree și pierderea cunoștinței) și care la examinarea post-mortem prezentau focare necrotice la nivelul ficatului. Ulterior etapei de izolare, au fost reproduse semnele clinice și leziunile post-mortem prin infectarea experimentală a altor doi papagali clinic sănătoși. Obiectivul a fost îndeplinit când s-a realizat izolarea virusului din probele recoltate de la cei doi papagali infectați experimental. Semnele clinice evidente ale acestei boli sunt depresia și anorexia. Unele dintre păsările afectate prezintă diaree apoasă și altele își pierd cunoștința rapid. Păsările afectate mor în mod normal în 5 zile de la primul semn al bolii, iar mortalitatea în colectiv este de 10-30%. Păsările care au murit în aceste condiții apar deshidratate, cu o colorație a mușchilor mai închisă și uscată. Ficatul este mărit în volum și decolorat, din cauza prezenței zonelor pale de necroză. Acestea pot fi bine definite, dar uneori se unesc și dau ficatului un aspect marmorat. Splina este în mod uzual lărgită, observându-se la nivelul intestinului subțire o îngroșare și înroșire a mucoasei. Ocazional există un exces de material gelatinos transparent în sacul pericardic și în cavitatea abdominală, observându-se și o congestie a plămânilor și aerosaculită.
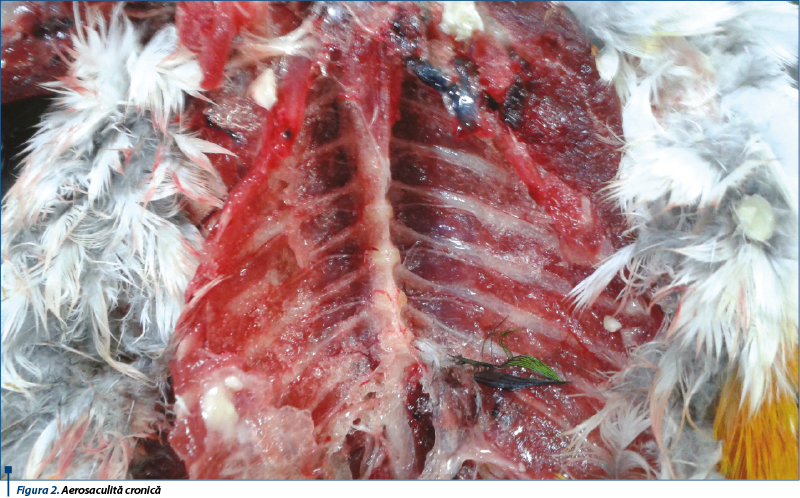
Examinarea histologică a leziunilor de la nivelul ficatului confirmă prezența zonelor necrotice distribuite în mod neregulat în parenchim. Acestea cuprind focare de hepatocite care s-au modificat în urma necrozei coagulante. Există și unele infiltrații leucocitare la nivelul zonelor cu necroză și la nivelul sinusurilor din țesutul hepatic înconjurător. În nucleii hepatocitelor nu există corpi de incluziune. Inocularea țesutului hepatic în alantoida embrionilor de găină în vârstă de 10 zile sau în sacul gălbenușului la embrionii în vârstă de 6 zile a determinat moartea acestora în 3-7 zile de la momentul inoculării. Inocularea celulelor nefrotice sau a fibroblastelor embrionilor de găină determină apariția unui efect citopatologic cu formarea de lichid sincițial la trei zile de la inoculare. Prezența particulelor cu morfologie similară reovirusurilor poate fi demonstrată în momentul examinării celulelor din țesutul infectat la microscopul electronic.
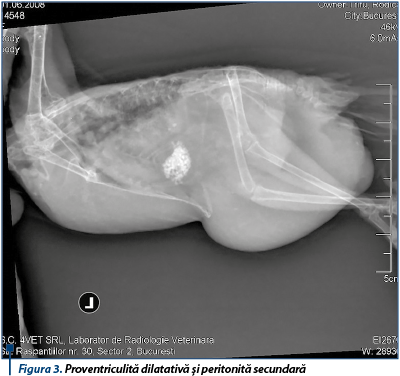
Sindromul dilatării proventriculului sau proventriculita dilatativă a papagalilor (proventricular dilatation disease - PDD, sau proventricular dilatation syndrome) este entitatea morbidă care încă generează multe dispute între specialiști, atât ca diagnostic și patogeneză, cât și ca terapie sau posibilități de intervenție medicală optime. Proventriculita dilatativă a papagalilor a fost descrisă, de peste 40 de ani, de specialiști, primind diferite denumiri: ganglioneurita mienterică, MWD - Macaw wasting disease -, boala fiind diagnosticată prima dată la juvenilii acestei specii, sindromul dilatării proventriculului sau proventriculita dilalativă a papagalilor. Boala evoluează cu focare inflamatorii localizate la nivelul nervilor unor organe-țintă, determinând în timp incapacitatea funcțională a acestuia. În cazul afectării compartimentului proventricular se constată incapacitatea enzimatică și digestivă, alimentele nedigerate (sau nepregătite pentru digestie) trec în stomacul muscular și apoi duodenal unde se produc fermentații, formându-se compuși care accelerează tranzitul. Pasărea, deși are apetit și consumă hrana, prezintă o stare de slăbire avansată, epuizare și după o perioadă relativ lungă - exitus. Proventriculul ajuns în incapacitate funcțională se dilată excesiv (vizibil radiografic) ca urmare a acumulării de alimente (acestea stagnează mai mult decât în stări clinice normale) și a dezvoltării unor procese fermentative. Uneori este posibil ca boala să evolueze direct la nivel central cu afectarea nervilor cranieni, pasărea prezentând stări convulsive, anomalii neurologice bruște, cecitate, evoluția bolii în aceste cazuri fiind mult mai scurtă, iar intervenția terapeutică - iluzorie. Conduita terapeutică folosită inițial includea obligatoriu antiinflamatoare care asigurau stoparea evoluției (pentru anumite intervale mai scurte sau mai lungi), asigurând supraviețuirea păsării cu semne clinice stabile, dar persistente.
Lărgirea spectrului de specii de psitacine întreținute în captivitate a permis constatarea că boala poate evolua la toate speciile de Ara spp., și chiar la alte specii de papagali sau chiar de peruși. Au început să fie semnalate cazuri la Psittacus erithacus, la specii de Platycercus spp. sau de Psittacula spp. Studii îndelungate au început să facă legătura între infecțiile cu bornavirusuri aviare și PDD. Bornavirusurile animale și umane erau deja studiate aprofundat pentru rozătoare (în special șobolani), pentru solipede (în special cele sălbatice sau resălbăticite), pentru primate (în special acolo unde populația umană a intervenit major în mediu), pentru suine (în special cele întreținute în captivitate) și pentru om. În anii 2000-2005 au fost demarate studii ample pentru bornavirozele aviare, în special concentrate pe speciile de păsări domestice din crescătorii și mai ales pentru găină. În 2008 au fost izolate primele bornavirusuri la papagali și s-a făcut prima dată legătura între evoluția și patogeneza infecției cu Bornavirus la păsările cu PDD. A fost avansată ipoteza că bornavirusul declanșează o reacție autoimună în urma căreia sistemul imunitar al păsării începe să atace țesutul nervos, provocând leziunile tipice. Au fost efectuate studii tot mai ample care să demonstreze etiologia virală a PDD, cercetările efectuându-se atât pentru păsările din captivitate (prin intermediul crescătoriilor de psitacine sau cabinetele veterinare specializate), cât și pentru păsări capturate din mediul natural. În mediul natural s-a constatat (evaluând câteva sute de exemplare) că păsările sunt pozitive pentru Bornavirus în procent de 22-23%, iar în cazul păsărilor din captivitate procentul este mai mare, în unele crescătorii constatându-se că peste 35% dintre păsări sunt pozitive. Analiza de laborator se face fie în scopul depistării prezenței și identificării virusului, fie în scopul depistării anticorpilor specifici. Diagnosticul de confirmare pentru bornavirus aviar pozitiv se realizează în prezent prin analiză PCR, care relevă prezența virusului în probele biologice, dar nu certifică și starea de boală. Mulți papagali testați (din diferite specii) au fost depistați cu bornavirus, fără a prezenta însă un tablou clinic sau lezional. În plus, analiza PCR relevă virusul fără a stabili genotipul exact al virusului depistat. Determinarea anticorpilor și a titrului de anticorpi înseamnă că sistemul imunitar al păsării reacționează față de virusul care a pătruns în organism. Deși s-a emis ipoteza că un titru mare de anticorpi sugerează infecția și încercarea organismului de a distruge virusul, cercetările clinice au relevat că papagalii pozitivi și cu un titru foarte ridicat de anticorpi prezintă cel mai mare risc de a dezvolta PDD (la papagalii pozitivi cu titru mic de anticorpi nu a fost diagnosticat PDD nici după mai multe luni, perioadă în care pasărea nu s-a negativat).
Studiile efectuate au demonstrat că există mai multe genotipuri de virus care afectează cu predilecție anumite specii de papagali și care determină un tablou lezional și o evoluție diferite. Până în prezent, cercetările efectuate încă nu au clarificat incidența fiecărui genotip în populațiile de papagali și nu a putut face o distincție clară între un anumit genotip și anumite specii de psitacine. Studiile statistice sunt relativ dificil de realizat, pentru că s-a constatat că același genotip poate fi izolat de la diferite specii (mai ales în cazul crescătoriilor cu mai multe specii de papagali, virusul se transmite indiferent de genotip la orice specie), iar în multe situații se izolează de la același individ două sau mai multe genotipuri. În plus, analiza de laborator relevă prezența virusului (în multe cazuri, rezultatul este redat ca Bornavirus pozitiv) fără a face referire la genotip. În prezent sunt încadrate șapte genotipuri de Bornavirus aviar care afectează diferite specii de papagali. Toate determină simptomatologie specifică și se asociază cu PDD în diferite etape și faze de evoluție. Transmiterea virusul este posibilă atât pe orizontală, cât și pe verticală. Studiile au demonstrat transmiterea fecal-orală, în special în crescătorii fiind constatată transmiterea rapidă a virusului pe această cale, fiind demonstrată infectarea păsărilor nou introduse în efectiv și confirmate ca bornaviurs negative în maximum 6 zile de la expunere. În aproximativ 18 zile de la contaminare se constată că papagalii devin eliminatori de virus, în special prin fecale. Puii sunt mai sensibili, cercetările demonstrând că, în cazul părinților pozitivi, toți puii din cuib devin pozitivi. Cercetări recente au demonstrat și posibilitatea transmiterii virusului prin ou, deși nu toate ouăle pontate, provenite de la o pasăre testată și identificat pozitiv pentru bornavirus, sunt la rândul lor purtătoare de virus, ba chiar în unele situații s-a constatat că, deși mama era pozitivă, ouăle au fost negative, sugerându-se posibilitatea ca cel mai frecvent puii să se contamineze după eclozare. A fost de asemenea stabilită și posibilitatea de contaminare prin aerosoli, deși această posibilitate este mai redusă, explicând transmisibilitatea bolii în crescătorii unde păsările testate au fost negative (la testări repetate), iar la un moment dat a apărut infecția.
Dintre genotipurile de Bornavirus, genotipul II afectează în special perușii-nimfă (Nymphicus hollandicus), generând manifestări clinice cu simptomatologie severă și o evoluție rapidă a bolii. Genotipul IV este cel mai frecvent incriminat în dezvoltarea PDD la toate speciile de psitacine, fiind și genotipul cel mai des izolat. Toate genotipurile folosesc aceeași cale de contaminare și apoi de multiplicare activă. Există diferențe de patogeneză între bornavirusurile aviare și cele mamifere. Bornavirusurile aviare pătrund într-o celulă de contact unde determină nucleul să funcționeze în sensul obținerii acizilor nucleici necesari transcrierii și replicării genomului viral. Celula-gazdă este foarte puțin afectată, astfel că sistemul imun al păsării nu reacționează. Urmează o fază de diseminare în organism în care virusul părăsește celula-gazdă și se integrează celulelor din alte țesuturi și organe, calea de migrațiune preferată fiind traseele nervoase periferice și uneori chiar sistemul nervos central (migrând pe traseul medular până în zona cerebrală). Uneori se cantonează în SNC și de acolo se va răspândi periodic în organism pentru tot restul vieții păsării. Alteori se integrează plexurilor nervoase și se cantonează în țesuturi și organe ale tractusului digestiv (în special în proventricul, mai rar în pipotă și ficat) sau în rinichi, plămâni și cord. Mulți indivizi dezvoltă PDD sau simptomatologie nervoasă și digestivă. În această fază, diagnosticul poate fi stabilit pe baza testelor de sânge (PCR pozitiv pentru Bornavirus aviar sau anticorpi antivirali specifici). Diagnosticul clinic al PDD este greu de stabilit pe baza simptomatologiei, deoarece multe simptome apar în numeroase alte boli infecțioase, parazitare sau metabolice. Diagnosticul de PDD se confirmă pe baza leziunilor digestive specifice (în special leziunile proventriculare) completate cu examene histologice pe probe recoltate din proventricul, pipotă, rinichi, creier și măduva spinării.
Este important diagnosticul diferențial față de alte boli manifestate prin sindrom digestiv sau care includ și simptomatologie digestivă. Cel mai frecvent apar enteritele bacteriene spontane datorate schimbărilor bruște alimentare sau introducerii unor verdețuri care conțin pesticide. La acestea se asociază factori de stres: transportul/relocarea, introducerea unei noi păsări în colivie sau în cameră, schimbarea programului cu care papagalul a fost învățat. De multe ori însă, factorul de stres sau cauza inițială rămân eluzive. Cele mai frecvente specii implicate în enterita bacteriană spontană a psitacinelor sunt: E. coli, Klebsiella spp., Salmonella spp., Pasteurella spp., Pseudomonas spp., Aeromonas spp., Citrobacter spp. Mai rar intervin și alte microorganisme care se regăsesc frecvent în flora digestivă a păsărilor: Enterobacter spp., Proteus spp., Serratia spp., Mycobacterium spp., Chlamydophila spp., Candida spp. Semnele clinice ale enteritei bacteriene includ diareea, deshidratarea, anorexia, scăderea în greutate, septicemia și uneori decesul subit. Diagnosticul se bazează pe istoric, semne clinice și cultură cloacală. Diagnosticul diferențial include indigestia alimentară, hepatita virală și chlamydioza.
Bibliografie
2. Kaliner G., 1975. Intranuclear hepatic inclusion bodies in an African Grey Parrot. Avian Diseases. vol. 19, nr. 3, p. 640-642.
3. Kaleta E.F., Brinkmann M.B. 1993. An outbreak of Pacheco’s parrot disease in a psittacine bird collection and an attempt to control it by vaccination. Avian Pathology, vol. 22, nr. 4, p. 785-789.
4. Cross G.M. 1991. Newcastle disease. Veterinary Clinics of North America. Small Animal Practice, vol. 21, nr. 6, p. 1231-1239.
5. Capua I., Liberti L., Gough R.E., Casaccia C., Asdrubali G. 1995. Isolation and characterization of an adenovirus associated with inclusion body hepatitis in psittacine birds. Avian Pathology, vol. 24, nr. 4, p. 717-722.
6. Aini L., Shih L.M., Castro A.E., Zee Y.X. 1993. Comparison of herpesvirus isolates from falcons, pidgeons and psittacines by restriction endonuclease analysis, Journal of Wildlife Diseases, vol. 29, p. 196-202.
Articole din ediţiile anterioare
Pseudomonozele psitacinelor
Ordinul Psittaciformes încadrează taxonomic familiile: Loriinae (papagali Lori sau falşii peruşi), Cacatuidae (papagalii cu creastă şi peruşii n...
Studiu privind corelaţiile clinico-diagnostice în boala polichistică renală la feline
Examinarea cu ultrasunete a bolilor chistice ale organelor parenchimatoase are aplicabilitate universală, în scopul corelării şi confirmării prezen...
Actualităţi ale diagnosticului endometritelor la vacile de lapte
Într-o ordine descrescătoare, principalele trei afecţiuni care se soldează cu un procent crescut de reformă în rândul vacilor de lapte sunt patol...
Ultrasonografia în diagnosticul ileusului intestinal la cabaline
Tehnica ecografică standard utilizată în diagnosticul ileusului intestinal la cal, cunoscută şi sub denumirea de „Fast Localized Abdominal Sonograp...