Background. In the last years, the rate of prematurity has continuously increased worldwide while the survival age of premature babies has been decreased. Among the late complications of prematurity, retinopathy of prematurity (ROP) represents one of the pathologies with most serious and potentialy invalidating consequences (blinding); its ethiology, physiopathological mechanisms and risk factors are not yet completely elucidated. Objective. To identify pre- and postnatal factors which increase the risk of developing ROP in our hospital and to revise the actual ethiological hypotesis comprised in the medical literature. Methods. We performed a 2-year retrospective study (2015-2016) and we analized the data from the medical records of premature babies with gestational age of 34 weeks or below admitted in the Neonatology Department of the Emergency University Hospital in this period; among these patients, those who developed ROP were selected and we analyzed any possible association between the severity of illness and different pre- or postnatal factors. Results. Incidence of ROP in our study was of 16.5% among all premature babies, but higher (35.5%) in the selected group (≤34 weeks of gestation). Risk factors for developing ROP were determined to be the following: small gestational age and weight, prolonged oxygenotherapy, hypoxic or hyeroxic episodes, blood transfusions, intraventricular haemorrhage, corticotherapy, treatment with dopamine, parenteral nutrition; among potential prenatal causes, our study has identified intrauterine growth restriction (IUGR) as a risk factor for developing ROP. Conclusions. ROP is a multifactorial disease, influenced by postnatal care, but prenatal conditions and inherent, epigenetic factors seem to have also an important role. The classical theories according to which ROP is considered to be determined by low gestational age and prolonged oxygenotherapy need to be revised and completed with new extended thorough investigations. The results of these invesigations could influence the actual medical practice everywhere.
Actualităţi în retinopatia de prematuritate
An update in retinopathy of prematurity (ROP)
First published: 05 octombrie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.17.3.2017.1088
Abstract
Rezumat
Rata prematurităţii este în continuă creştere la nivel mondial, iar vârsta de gestaţie la care s-a reuşit supravieţuirea şi recuperarea prematurilor a scăzut în ultimii ani. Dintre complicaţiile tardive ale prematurităţii, retinopatia de prematuritate (ROP) reprezintă o patologie cu consecinţe grave şi potenţial invalidant (orbire), ale cărei cauze, mecanisme de producere sau condiţii favorizante sunt încă incomplet elucidate. Obiectiv. Identificarea unor factori pre- şi postnatali care cresc riscul de apariţie a ROP şi revizuirea ipotezelor etiologice existente în literatura de specialitate prin prisma experienţei personale, a cazuisticii secţiei de Neonatologie a Spitalului Universitar de Urgenţă Bucureşti. Metodă. Am efectuat un studiu retrospectiv pe doi ani (2015-2016), în care am analizat foile de observaţie ale tuturor nou-născuţilor prematuri cu vârsta de gestaţie egală sau mai mică de 34 de săptămâni internaţi în secţia de Neonatologie a Spitalului Universitar de Urgenţă Bucureşti; dintre aceşti pacienţi s-au identificat cei care au dezvoltat ROP şi s-au investigat posibile asocieri între frecvenţa şi gravitatea bolii şi anumiţi factori pre- sau postnatali. Rezultate. Incidenţa ROP în studiul nostru a fost de 16,5%, raportat la toţi prematurii, şi de 35,5%, în lotul selecţionat. Factori favorizanţi ai apariţiei ROP au fost: imaturitatea, greutatea mică la naştere, oxigenoterapia prelungită, episoadele de hipo- şi hiperoxie, transfuziile de sânge, hemoragia intraventriculară, tratamentul cu cortizon şi dopamină, necesarul crescut de nutriţie parenterală; dintre posibilele cauze care acţionează prenatal a fost identificată o asociere mai frecventă între ROP şi retardul de creştere intrauterină (RCIU). Concluzii. ROP este o boală cu etiologie multifactorială influenţată de îngrijirile postnatale, dar şi condiţiile prenatale, posibil şi factorii intrinseci, epigenetici, au un rol foarte important. Teoriile clasice în care ROP este considerată a fi determinată de vârsta mică de gestaţie şi oxigenoterapia prelungită trebuie revizuite şi completate prin studii extinse şi aprofundate. Eventualele descoperiri ar putea influenţa modelele de practică medicală actuale.
Introducere
Naşterea prematură (definită prin vârsta de gestaţie sub 37 de săptămâni complete sau 259 de zile) este o cauză importantă de mortalitate şi morbiditate infantilă. Prin complicaţiile ei, prematuritatea generează 35% dintre toate decesele survenite la nivel mondial şi 50% dintre decesele neonatale(1).
Morbiditatea asociată prematurităţii este, de asemenea, foarte importantă şi se extinde până la vârste mari, cu implicaţii sociale şi costuri economice enorme pentru familie şi societate. Dintre complicaţiile tardive pe care le dezvoltă nou-născutul prematur, retinopatia de prematuritate (ROP) este o tulburare a dezvoltării vasculare retiniene, care evoluează spre vindecare sau spre grade diferite de deficite de vedere, mergând până la orbire(2). Într-un studiu efectuat în SUA, retinopatia de prematuritate a fost desemnată a doua cauză importantă de orbire la copil, după cecitatea corticală(3). Incidenţa retinopatiei de prematuritate diferă mult de la o ţară la alta, formele severe cunoscând o explozie a numărului de cazuri în ţările cu venituri mai reduse, unde se estimează că, anual, 50000 de nou-născuţi orbesc ca urmare a acestei boli(4). În SUA, aproximativ 65% dintre copiii cu greutate mai mică de 1250 g şi 80% dintre copiii cu greutate sub 1000 g dezvoltă un grad de ROP(3). Din punct de vedere epidemiologic, există diferenţe de la o regiune la alta, ţările cu venituri mici şi medii raportând cazuri de ROP la vârste de gestaţie şi greutăţi mai mari comparativ cu ţările dezvoltate(5).
Clasic, este considerată certă influenţa vârstei de gestaţie şi a greutăţii mici la naştere asupra incidenţei ROP (relaţie invers proporţională). A fost discutat mult şi acceptat ca un factor de risc important oxigenoterapia prelungită sau cu concentraţii mari de oxigen, aici însă existând în prezent controverse, cauzate de evoluţia inconstant favorabilă a bolii după administrare de oxigen; un studiu efectuat în SUA a demonstrat că administrarea de oxigen suplimentar prematurilor cu ROP stadiul 2 a fost benefică, însoţindu-se de reducerea numărului de cazuri care au evoluat spre stadiul 3(6).
Au mai fost menţionate în decursul timpului corelaţii nefavorabile între gravitatea ROP şi alte condiţii patologice asociate prematurităţii: hemoragia intraventriculară, sepsisul, necesarul de transfuzii, expunerea la lumină. Relativ recent a fost descoperită legătura între alimentaţie, creşterea ponderală şi riscul mai redus de a face ROP la nou-născuţii care prezintă curbă ponderală rapid ascendentă(7,8). Nivelul seric al factorului de creştere insulin-like IGF1 (somatomedina), care este un indicator al statusului anabolic al organismului, pare să confirme că o creştere ponderală pre- şi postnatală adecvată a prematurului poate să fie un indicator pentru riscul redus de a dezvolta ROP(2,9,10).
Nu au fost descrise până în prezent în literatură asocieri între condiţii patologice materne sau alţi factori prenatali şi frecvenţa de apariţie sau gravitatea ROP; un studiu anterior efectuat tot în clinica Spitalului Universitar de Urgenţă Bucureşti în 2015, în colaborare cu colegii obstetricieni, a identificat ca potenţiali factori de risc prenatali: preeclampsia/eclampsia, corioamniotita, diabetul zaharat matern, obezitatea, FIV, retardul de creştere intrauterină (RCIU), sarcina multiplă(11).
Scopul studiului actual a fost de a verifica aceste noi ipoteze şi de a identifica corelaţii semnificative statistic între diverşi factori pre- sau postnatali şi riscul de apariţie a ROP.
Material şi metodă
Am efectuat un studiu retrospectiv pe doi ani (2015-2016), în care am analizat foile de observaţie ale tuturor nou-născuţilor prematuri internaţi în secţia de Neonatologie a Spitalului Universitar de Urgenţă Bucureşti. Au fost incluşi în lot doar nou-născuţii cu vârsta de gestaţie egală sau mai mică de 34 de săptămâni; aceşti nou-născuţi au fost subîmpărţiţi în patru categorii, în funcţie de vârsta de gestaţie: între 32 şi 34 de săptămâni de gestaţie, 29-31 săptămâni, 26-28 săptămâni şi sub 26 de săptămâni. Nou-născuţii au fost examinaţi oftalmologic, prin oftalmoscopie indirectă, la 3-4 săptămâni de viaţă, conform protocolului Programului Naţional de Prevenire a ROP, de către acelaşi oftalmolog. S-au selectat ulterior acei prematuri care au fost diagnosticaţi cu ROP la examenul oftalmologic şi s-au analizat condiţiile pre- şi postnatale comune şi mai frecvente în aceste cazuri. Au fost excluşi din studiu prematurii cu malformaţii congenitale, boli ereditare de metabolism sau cei care au prezentat complicaţii acute grave, care au dus la deces înainte de finalizarea studiului. Lotul-martor, format din prematuri cu aceleaşi caracteristici, dar care nu au dezvoltat ROP, a fost analizat comparativ, luând în considerare aceleaşi variabile.
Pentru clasificarea ROP s-au utilizat criteriile de severitate stabilite de Comitetul Internaţional pentru Clasificarea ROP (stadiile 1-5, boala prag, pre-prag, factor plus absent/prezent). Examinările oftalmologice au fost seriate la acelaşi copil, la un interval de 1-2 săptămâni, la recomandarea medicului oftalmolog, până când examenul polului posterior al ochiului a fost normal (cu sau fără tratament).
Analiza statistică s-a făcut cu ajutorul programului SPSS; pentru comparaţia lotului-martor cu cel de control s-a utilizat testul Chi pătrat. Nivelul de semnificaţie statistică a fost de 0,05.
Rezultate
În perioada studiată (1.01.2015-31.12.2016), în secţia de Neonatologie a Spitalului Universitar de Urgenţă au fost internaţi 6255 de nou-născuţi, născuţi local sau transferaţi din unităţi sanitare de nivel inferior. Rata prematurităţii (nou-născuţi cu vârsta de gestaţie sub 37 de săptămâni de gestaţie) a fost de 12,5% (787 de nou-născuţi). Mortalitatea neonatală în rândul prematurilor a fost de 6,93% în 2015 şi 4,33% în 2016. Numărul prematurilor ≤34 săptămâni de gestaţie care au fost luaţi în considerare în studiul de faţă (după excluderea deceselor până într-o lună de viaţă) a fost de 366 (5,85%). Aceştia au fost subîmpărţiţi în funcţie de vârsta de gestaţie, conform tabelului 1.
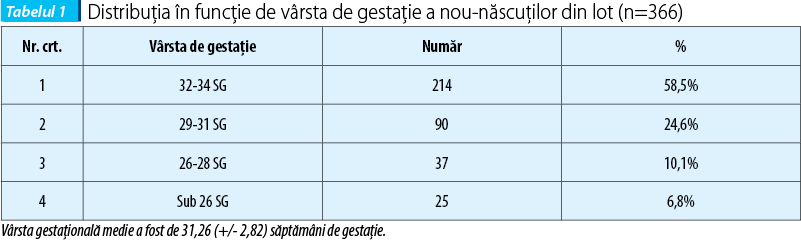
Repartiţia în funcţie de greutate a prematurilor internaţi în maternitatea SUUB în perioada studiului a fost următoarea (tabelul 2).
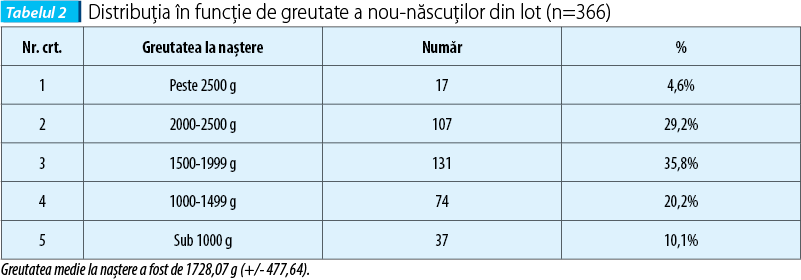
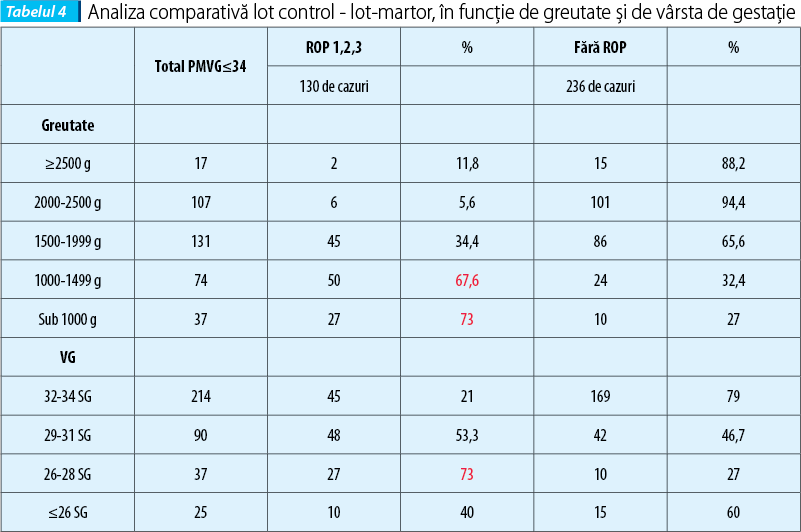
Din totalul prematurilor incluşi în studiu s-au separat cei diagnosticaţi cu ROP de cei fără ROP (lot-martor). Numărul de prematuri diagnosticaţi cu ROP a fost de 130 de cazuri (35,5%). Lotul-martor (prematuri fără ROP) a fost de 236 de cazuri (64,5%).
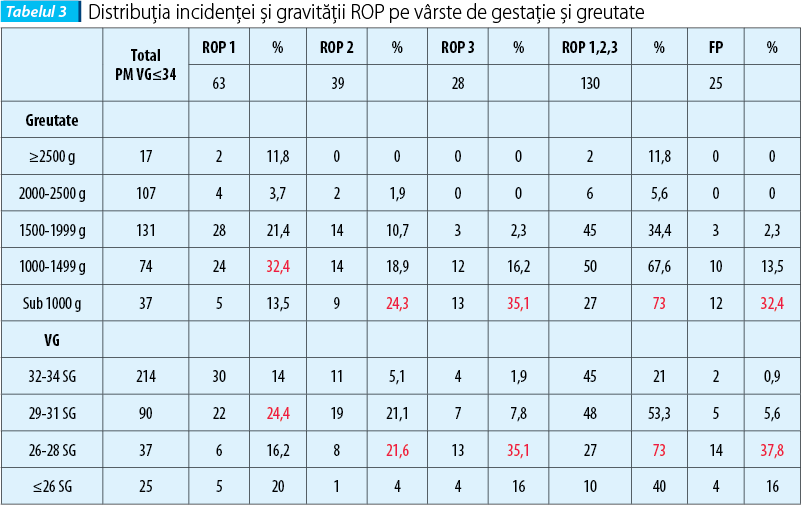
Raportat la gravitatea ROP, au fost diagnosticate 63 de cazuri (17,2%) de ROP stadiul 1, 39 de cazuri (10,6%) de ROP stadiul 2 şi 28 de cazuri (7,7%) de ROP stadiul 3 din totalul pacienţilor (n=366). Prezenţa factorului plus (gravitate crescută) s-a diagnosticat la 25 de pacienţi (6,8%). Nu au fost diagnosticaţi nou-născuţi cu ROP în stadiul 4 sau 5. Nou-născuţii cu ROP în stadiul 3 sau cu factor plus prezent au fost trataţi cu laserterapie (fotocoagulare) sau injectare intraoculară de bevacizumab (avastin). Incidenţa şi gravitatea ROP pe vârste de gestaţie şi greutate este prezentată în tabelul 3.
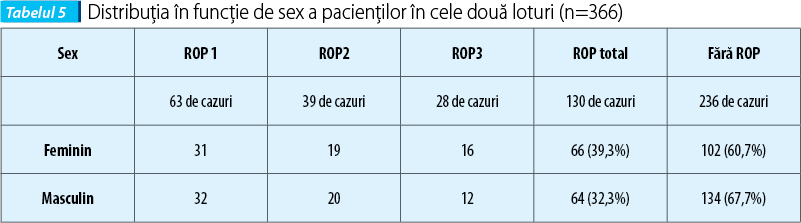
Repartiţia pe sexe a pacienţilor cu ROP în lotul studiat a fost următoarea: din 366 de prematuri ≤34 SG, 168 (45,9%) au fost de sex feminin, iar 198 (54,1%) au fost de sex masculin.

După grupul sangvin, distribuţia pacienţilor din lotul studiat este prezentată în tabelul 6.
După excluderea deceselor, dintre prematurii incluşi în studiu, 97 sunt proveniţi din sarcini gemelare şi 11 din sarcini triple. Dintre gemeni, 30 de copii (30,9%) au fost diagnosticaţi cu un grad de ROP: 11 copii (11,3%) - ROP 1, 10 copii (10,3%) - ROP 2 şi 9 copii (9,3%) - ROP 3 (n=97). Dintre nou-născuţii rezultaţi din sarcini triple, 5 copii (45,4%) au avut ROP, 2 stadiul 1 (27,2%) şi doi în stadiul 3 (18,1%).
De menţionat că, dintre gemeni, la 11 perechi din 15 au fost afectaţi ambii copii (73,3%). Din celelalte cazuri în care a fost afectat un singur geamăn, acesta a fost al doilea. Şi în ceea ce priveşte tripleţii, cei 5 prematuri care au făcut ROP au provenit din sarcini diferite, afectaţi fiind tot al doilea şi/sau al treilea frate.
Fertilizarea in vitro (FIV) (N=339) a fost asociată cu ROP în 10 cazuri (34,5%), 6 nou-născuţi au fost diagnosticaţi cu ROP 1, iar 4 nou-născuţi au prezentat ROP 2. În lotul-martor (copii fără ROP) au fost 19 sarcini obţinute prin FIV (65,5%).
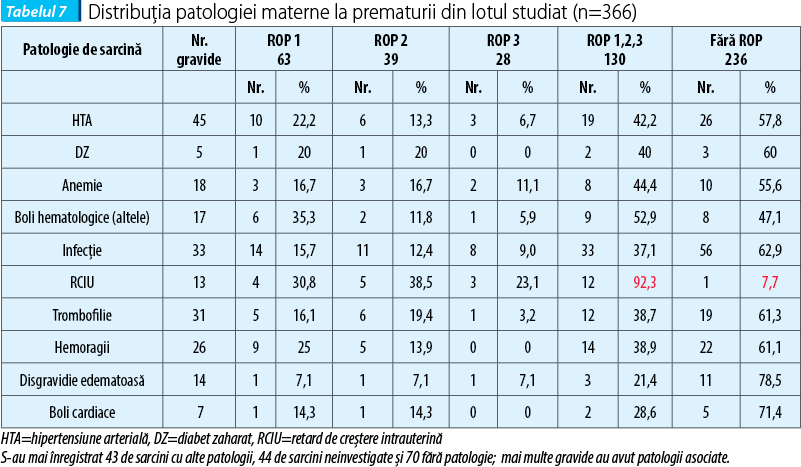
Patologiile materne întâlnite cel mai frecvent la prematurii din lot sunt redate în tabelul 7.
Influenţa diferiţilor factori de risc postnatali asupra apariţiei ROP este ilustrată în tabelul 8.

Discuţii şi analiza rezultatelor
O primă observaţie asupra rezultatelor studiului de faţă se referă la faptul că incidenţa ROP la prematuri în general este de 16,5%, dar creşte semnificativ la nou-născuţii cu vârsta de gestaţie ≤34 de săptămâni (35,5%); la vârste de gestaţie sub 28 de săptămâni incidenţa este chiar de 73%, iar sub greutatea de 1500 g, de 67,6%, similar cu datele din literatură, care consideră vârsta de gestaţie şi greutatea invers proporţionale cu riscul de a dezvolta ROP(2,3). Şi gravitatea bolii este similar corelată cu vârsta de gestaţie: se observă că ROP 1 este întâlnită cel mai frecvent la vârste de gestaţie de peste 29 de săptămâni, în timp ce ROP 2 şi 3, precum şi prezenţa factorului plus sunt cel mai frecvent întâlnite la nou-născuţii cu vârstă de gestaţie sub 28 de săptămâni şi greutate sub 1000 g.
De remarcat însă în studiul nostru că nu există totuşi o relaţie invers proporţională absolută între vârsta de gestaţie şi riscul de a face ROP, boala fiind mai frecventă la prematurii născuţi la 26-28 de săptămâni de gestaţie, comparativ cu cei sub 26 de săptămâni. Un procent mare, de 60%, dintre prematurii cu vârsta de gestaţie sub 26 de săptămâni nu fac ROP, ceea ce pledează pentru o importanţă mai mare a greutăţii comparativ cu vârsta de gestaţie în determinismul ROP şi pentru existenţa unor alţi factori determinanţi sau protectori.
Analiza distribuţiei ROP pe sexe nu indică diferenţe semnificative statistic în funcţie de sex (p≥0,05). De asemenea, comparaţia celor două loturi în funcţie de grupul sangvin arată că nu sunt diferenţe semnificative statistic între cele patru categorii (p≥0,05), deşi într-o cercetare anterioară condusă tot în clinica noastră, în 2014, dintre pacienţii incluşi în studiu, cei care au dezvoltat ROP au avut predominant grupul de sânge AII, faţă de cei fără ROP, care au avut grupul sangvin majoritar OI(12).
În ceea ce priveşte gemelaritatea, cifrele rezultate din studiul nostru arată că nu există un risc crescut pentru copiii proveniţi din sarcini multiple de a dezvolta ROP (p≥0,05). Dintre cei 108 prematuri proveniţi din sarcini gemelare sau triple, 35 de copii dezvoltă o formă de ROP (32,4%), în timp ce 73 (67,6%) nu fac această complicaţie. Mai interesant este că, deşi în majoritatea cazurilor sunt afectaţi ambii/toţi fraţii, în situaţia în care numai unul din doi (sau din trei) fraţi sunt afectaţi, complicaţia interesează al doilea sau al treilea copil; acest lucru s-ar putea explica prin riscul mai mare de a suferi hipoxie la naştere, fapt cunoscut în literatură pentru al doilea sau al treilea făt din sarcinile multiple(13).
Deşi nu a fost demonstrată până în prezent o legătură dintre anumite afecţiuni materne sau patologia sarcinii şi riscul nou-născutului de a dezvolta ROP, am analizat frecvenţa acestora în cazul pacienţilor cu diferite stadii de ROP şi am observat o frecvenţă mai mare a sarcinilor cu risc infecţios, cu HTA, anemie şi trombofilie, dar, comparativ cu prematurii fără ROP, fără semnificaţie statistică (p≥0,05).
Interesant este că, deşi nu au fost cazuri foarte numeroase, analiza statistică comparativă a lotului pacienţilor cu ROP şi a lotului-martor a scos la lumină o corelaţie importantă între prematurii cu RCIU şi ROP (p<0,05). Acest lucru pledează pentru ipoteza că etiologia ROP include şi factori antenatali. Explicaţia ar putea fi că pacienţii cu RCIU au un nivel seric scăzut de factor de creştere insulin-like (IGF1), care reprezintă un stimul pentru proliferarea, creşterea şi supravieţuirea celulelor neuronale şi a retinei (ca parte a sistemului nervos central - SNC)(10,14). Studiul ELGAN (Extremely Low Gestational Age Newborns), care a urmărit dezvoltarea copiilor prematuri sau cu greutate foarte mică la naştere pe o perioadă de doi ani postnatal, a scos la iveală, printre altele, că nou-născuţii cu greutate mică la naştere, în special cei cu RCIU, au un răspuns inflamator sistemic în primele săptămâni de viaţă mult mai puternic şi de durată mai îndelungată decât cei cu greutate normală pentru vârsta de gestaţie. Acest substrat inflamator a fost suspectat că ar influenţa negativ şi dezvoltarea vascularizaţiei retiniene, contribuind la gravitatea acestei complicaţii de prematuritate. Tot mecanismul inflamator pare să explice şi de ce aceşti copii au prezentat, în timp, cele mai multe afectări ale SNC, modificări structurale decelabile la ecografia transfontanelară sau dizabilităţi de învăţare mai târziu(14,15,16). Alţi autori consideră RCIU ca un indicator important pentru o probabilitate crescută de apariţie a unor fenomene epigenetice; copiii cu greutate mică la naştere dezvoltă mai frecvent ROP, boală pulmonară cronică, diabet, afecţiuni cardiace etc.(17,18).
Dintre factorii postnatali asociaţi cu risc crescut de a dezvolta ROP, analiza statistică a confirmat şi în studiul de faţă că expunerea prelungită la oxigen (peste 14 zile), episoadele de hipoxie la naştere şi hiperoxia generată de oxigenoterapia incomplet controlată sunt implicate în fiziopatologia acestei complicaţii (p<0,05).
Anemia neonatală şi necesarul de transfuzii crescut sunt asociate şi în studiul nostru în procente foarte mari cu apariţia ROP (p<0,05); cu cât este mai mare numărul de transfuzii, cu atât boala este mai frecventă (în literatură sunt citate procente de 9% risc adăugat pentru fiecare transfuzie)(19). Studiul nostru relevă şi că gravitatea bolii este mai mare la un număr de transfuzii crescut (prematurii cu ROP 3 au primit mai multe transfuzii decât cei cu ROP 1 sau 2). Mecanismul prin care transfuziile de sânge cresc riscul de ROP se datorează faptului că hemoglobina de tip adult transfuzată (HbA1) are o afinitate pentru oxigen şi o curbă de disociere a oxigenului diferită de cea fetală (HbF), favorizând hiperoxia(19,20). O altă ipoteză controversată este că transfuziile de sânge conduc la o supraîncărcare cu fier, din cauza deficienţei la prematur a unor proteine care leagă fierul, ceea ce generează formarea de radicali liberi, nocivi pentru retină(19). Din motivele prezentate anterior, putem afirma că şi momentul administrării transfuziilor este important, retina fiind cu atât mai vulnerabilă la efectul transfuziilor, cu cât vârsta de gestaţie şi vârsta postnatală sunt mai mici.
Asocierea ROP cu hemoragia intraventriculară în studiul nostru în procent de 63,2% este de asemenea semnificativă din punct de vedere statistic (p<0,05); cele două complicaţii au probabil mecanisme biochimice şi hemodinamice comune de producere. O ipoteză în acest sens este că stresul oxidativ (prezenţa radicalilor liberi) cauzat de terapia cu oxigen poate fi incriminat în fiziopatologia ambelor afecţiuni(21). Indiferent de cauzalitate, asocierea ROP cu hemoragia intraventriculară este citată şi în alte studii(22,23), ceea ce înseamnă că diagnosticarea precoce a unei hemoragii intraventriculare la prematur poate să aibă o valoare predictivă de luat în seamă pentru riscul crescut de a dezvolta ulterior ROP.
Am investigat şi influenţa tratamentelor cu cortizon postnatal şi cu dopamină, medicaţie destul de frecvent utilizată la nou-născuţii prematuri pentru susţinerea cardiocirculatorie sau în afectarea pulmonară cronică; se observă că un procent crescut (60,5%, respectiv 59,6%) de cazuri cu ROP au primit corticoterapie sau suport dopaminergic. Analiza statistică a confirmat riscul crescut pe care acest factor postnatal îl induce (p<0,05). Mecanismele de acţiune vizează modificări hemodinamice locale, mai evidente la dopamină, mai subtile în cazul corticoterapiei, al cărei efect asupra microcirculaţiei este diferit. Alte efecte oculare ale dopaminei sunt dilatarea pupilei (favorizează excesul de lumină) şi creşterea presiunii intraoculare, iar în cazul cortizonului - creşterea presiunii intracraniene, a presiunii intraoculare şi fenomene de vasculită locală(24).
Este extrem de interesant cum este influenţată ROP de strategia alimentară aplicată în îngrijirea prematurului: alimentaţia enterală pare să exercite o influenţă pozitivă, protectoare împotriva ROP, în timp ce numărul crescut de zile de nutriţie parenterală (NP), parţială sau totală, reprezintă un factor de risc (p<0,05). Literatura medicală subliniază că şi compoziţia aportului alimentar al nou-născutului prematur pare să aibă o importanţă mare, conţinutul de acizi graşi polinesaturaţi (LCPUFA), inositolul şi vitamina E fiind considerate factori protectori(9). Am încercat să verificăm în studiul nostru dacă tipul de alimentaţie enterală (lapte de mamă, lapte praf, mixt), influenţează evoluţia spre ROP, dar, deşi prematurii cuprinşi în studiu au fost alimentaţi preponderent natural, nu s-au înregistrat valori semnificative statistic mai scăzute la aceştia (p>0,05).
Concluzii
ROP este o complicaţie gravă a prematurităţii care poate conduce la orbire, în lipsa diagnosticului, a stadializării corecte şi a intervenţiei prompte, de aceea este extrem de util să se identifice orice factori care influenţează riscul de apariţie şi gravitatea acesteia, pentru a canaliza resursele umane şi materiale cu preponderenţă spre aceste cazuri. Alături de vârsta mică de gestaţie, şi greutatea mică la naştere, hipoxia şi oxigenoterapia prelungită, trebuie luate în considerare ca factori predictivi pentru apariţia ROP şi necesarul crescut de transfuzii sangvine, existenţa hemoragiei cerebrale, corticoterapia şi necesarul de dopamină. Prematurii par să fie mai vulnerabili la apariţia ROP dacă asociază şi un grad de RCIU. Foarte importantă şi nouă este constatarea că alimentaţia enterală precoce are, pe lângă alte avantaje nutriţionale, şi un efect de protecţie a nou-născutului împotriva acestei complicaţii redutabile a prematurităţii.
Bibliografie
2. Sun Y, Hellstrom A, Lois E., Smith H. Retinopathy of Prematurity, in Fanaroff & Martin’s Neonatal-Perinatal Medicine, Diseaes of the Fetus and Infant, 10th Ed., Elsevier Saunders, 2015;2,04:1767-73.
3. Zupancic JAF, Stewart JE, Retinopathy of Prematurity, Auditory and Ophtalmologic Problems. In: Cloherty JP, Eichenwald EC, Stark AR. Manual of Neonatal Care, Fifth Ed., 35:677-83.
4. Ola Didrik Saugstad, Retinopathy of Prematurity: what is new?, Available at: curoservice.com.
5. Gilbert Claire. Retinopathy of prematurity: A global perspective of the epidemics, population of babies at risk and implications for control, Early Human Development, volume 84, issue 2, February 2008, 77-82.
6. Tarah T. Colaizy, Susannah Longmuir, Kevin Gertsch, Michael David Abramoff and Jonathan M Klein. Use of a Supplemental Oxygen Protocol to Suppres Progression of Retinopathy of Prematurity, Clinical and Epidemiologic Research, volume 58, issue 2, February 2017.
7. Lundgren P1, Stoltz Sjöström E, Domellöf M, Källen K, Holmström G, Hard AL, Smith LE, Löfqvist C, Hellström A., WINROP identifies severe retinopathy of prematurity at an early stage in a nation-based cohort of extremely preterm infants, PloS One, 2013, Sep 12;8(9): e73256.doi 10.1371/ journal.pone.0073256. eCollection 2013.
8. http//:www. Winrop.com, WINROP algorithm.
9. Anna-Lena Hard, Lois E. Smith and Ann Hellström. Nutrition, insulin-like growth factor-1 and retinopathy of prematurity, Semin Fetal Neonatal Med, February 20, 2013.
10. Ligl R, Lofquist C, Hrlstrom A, Smith LEH. IGF1 in Retinopathy of Prematurity, a CNS neurovascular disease, Early Hum. Dev., 2016; 102:13-16.
11. Rădulescu L, Munteanu A, Munteanu O. Retinopathy of Prematurity, Ginecologia.ro, 2016; 4(11):36-40.
12. Dan AM, Rădulescu L, Vlădăreanu S, Roşoga MA, Cîrstoiu MM. Retinopatia de prematuritate, Ginecologia.ro, 2015; 3(8):34-8.
13. Danhaive O. Multiple Births. In: Cloherty JP, Eichenwald EC, Stark AR. Manual of Neonatal Care, Fifth Ed, 2016; 7:87-92.
14. Lee JW, Vanderveen DK, Alred EM, Leviton A, Dammann O. Prethreshold Retinopathy of Prematurity in Premature Infants with IUGR, Acta Paediat, 2015; 104(1):27-31.
15. Tyler CP, Paneth N, Allred EN, Hirtz D, Kuban K, McElrath T, Oshea TM, Miller C, Leviton A. Brain Damage in Premature Newborns and Maternal medication: The ELGAN study, Am J Obstet Gynecol, 2012; 207(3):192.e1–192. e9.
16. bmc.org, ELGAN 1, Research Study Results.
17. McElrath T, Allred EN, Van Marter L, Fichorova RN, Leviton A. Perinatal systemic inflamatory responses of IUGR peterm newborn. Acta Paediatr, 2013; 102 e 439-42.
18. Thorn SR, Rozance PJ, Brown LD, Hay WW Jr. The IUGR phenotype: fetal adaptation and potential implications for later life insulin-resistance and diabetes, Semin. Reprod. Med., 2011; 29:225-36.
19. Mikaniki E, Mikaniki M, Shirzadian AH. Effects of Blood Transfusion on ROP. In: Blood Transfusions in Clinical Practice, Puneet Kochhar P (Ed), 2012.
20. Hesse L, Eberl W, Schland M, Poets CF. Blood Transfusions, Iron Load and ROP, Eur J Pediatr, 1997; 156(6):465-70.
21. Crowe J, Rea PA, Rolfe P. ROP and Oxidative Damage, Pediatrics, 1986; 77(1).
22. Procianoy RS, Garcia-Prots JA, Hittner HM, Adams JM, Rudolph AJ. An Association between ROP and IVH in VLBW, Acta Paediatr Scand, 1981; 70(4):473-7.
23. Watts P, Adams G, Thorns R and Bunce C. IVH and Stage 3 ROP, Brit J Ophtalmol, 2000; 84(6):596-9.
24. Taketomo CK, Hodding JH, Kraus DM. Pediatric & Neonatal Dosage Handbook, 20th Edition, Lexicomp, 2017, 557-60, 642-3.
Articole din ediţiile anterioare
Monitorizarea cardiotocografică în caz de prematuritate extremă
Prematuritatea între 24 şi 32 de săptămâni reprezintă o cauză importantă de mortalitate şi morbiditate neonatală. S-au înregistrat progrese în ult...
Modificări metabolice şi riscul de naştere prematură
Statusul gravidic implică, în mod fiziologic, modificări metabolice menite să permită susţinerea şi dezvoltarea sarcinii. Momentul trecerii de ...
Factorul de creștere insulin-like (IGF1), sarcina și retinopatia de prematuritate (ROP)
Retinopatia de prematuritate (ROP) este o complicație tardivă oculară care survine la nou-născuții cu vârste de gestație și greutăți mici; ea con...
Tratamentul medical al endometriozei: este opţiunea medicului?
Introducere. Endometrioza este o patologie cronică benignă, iar managementul ei implică adoptarea unei strategii pe termen lung care include tr...