Factori de risc ante- şi perinatali implicaţi în dezvoltarea tulburărilor din spectrul autist la copii
Pre- and perinatal risk factors involved in the development of autistic spectrum disorders in children
Abstract
The aetiology of autism is unknown, although multiple research into the identification of factors involved in certain periods of gestation has been conducted in epidemiological research centers over the last 40 years. Currently, it is considered that the mechanism underlyng the development of autistic spectrum disorders is most likely polygenic and environmental factos can interact with genetic factors to increase the risk. Although the neuropathological mechanism are described evasively, the studies have shown that there are macroscopic, microscopic and functional abnormalities in the brain of these childrens. These different brain abnormalities suggest that the relevant aetiology may be in the pre- and peripartum period or in early childhood. A recent meta-analysis has centralized 60 studies that analized the association between perinatal, neonatal factors and autism. The factors identified as having an increased risk of autism are: folic acid deficiency in the first trimester of pregnancy, Rubella infections during pregnancy, smoking, pregnant women with an increased Body Mass Index, autoimmune thyroid diseases, abnormal presentations, fetal distress, obstetric trauma, multiple births, maternal bledding, birth in the summer, underweight foetuses registered at birth, congenital malformations, meconium aspiration, APGAR score decreased after 5 minutes from birth, neonatal feeding difficulties, neonatal anemia, RH and ABO incompatibility with isoimmunization, hyperbilirubinemia.Keywords
autismrisk factorscausesRezumat
Etiologia autismului este necunoscută, deşi cercetări multiple în ceea ce priveşte identificarea unor factori implicaţi în anumite perioade ale gestaţiei au fost efectuate în centre de cercetare epidemiologice în ultimii 40 de ani. În prezent, se consideră că mecanismul care stă la baza dezvoltării tulburărilor din spectrul autist este cel mai probabil poligenic, iar factorii de mediu pot interacţiona cu factorii genetici pentru a creşte riscul. Cu toate că mecanismele neuropatologice sunt descrise evaziv, studiile au arătat că există anomalii macroscopice, microscopice şi funcţionale ale creierului acestor copii. Aceste anomalii cerebrale diferite sugerează că etiologia relevantă poate fi în perioada ante- şi peripartum sau în copilăria timpurie. O metaanaliză recentă a centralizat 60 de studii care au analizat asocierea dintre factorii perinatali, neonatali şi autism. Factorii identificaţi ca având un risc crescut de autism sunt: deficitul de acid folic în primul trimestru al sarcinii, infecţia cu Rubella în cursul sarcinii, tabagismul, gravidele cu Indice de Masă Corporală crescut, tiroidita autoimună a gravidei, prezentaţiile anormale, suferinţa fetală, traumatismele obstetricale, naşterile multiple, hemoragiile materne, naşterea în timpul verii, feţi cu greutate mică la naştere, feţi mici pentru vârsta gestaţională, feţi cu malformaţii congenitale, aspiraţie de meconium, scorul APGAR scăzut la 5 minute, dificultăţile de hrănire în perioada neonatală, anemia neonatală, incompatibilitatea în sistem Rh şi ABO cu izoimunizare, hiperbilirubinemia.Cuvinte Cheie
autismfactori de risccauzeIntroducere
Tulburările din spectrul autist (TSA) reprezintă un grup eterogen de anomalii ale neurodezvoltării caracterizate printr-un comportament anormal, dificultăţi sociale, de comunicare şi de construcţie a unor relaţii interumane, precum şi de interese restrânse şi repetitive într-o anumită arie de activitate(1). Copiii prezintă, de asemenea, dificultăţi de adaptare senzorială, întârzieri de limbaj, probleme de stimă de sine şi încredere.
În această categorie largă sunt incluse autismul tipic, sindromul Asperger şi autismul atipic - care reprezintă o tulburare pervazivă nespecifică de neurodezvoltare(2).
TSA au devenit o provocare constantă şi majoră pentru clinicieni, pentru specialiştii psihiatri şi pediatri, având un impact puternic asupra persoanelor afectate, dar mai ales asupra familiilor lor. Presiunea a devenit mai acută, deoarece lipsesc multe dintre informaţiile ştiinţifice despre această tulburare, precum datele epidemiologice reale (afecţiunea fiind adeseori supradiagnosticată), etiologia ei şi istoria sa naturală.
Autismul este o tulburare de dezvoltare de origine neurobiologică şi reprezintă cea mai severă tulburare neuropsihiatrică a copilăriei.
Aceste tulburări prezintă o largă varietate de manifestări clinice, considerate a fi rezultatul unor disfuncţionalităţi de dezvoltare multifactoriale ale sistemului nervos central sau cu origini cel mai probabil poligenice. Provocarea majoră în cercetarea etiologiei autismului este interacţiunea complexă dintre mai mulţi factori (de mediu, genetici, sociali) şi efectul lor insuficient înţeles asupra funcţionării şi dezvoltării creierului unui copil autist. Se consideră că factorii de mediu pot interacţiona cu factori genetici pentru a creşte riscul de dezvoltare a TSA. Cauzele specifice sunt însă neclare.
Spectrul simptomelor, complexitatea extremă a dezvoltării acestei afecţiuni şi a altor probleme asociate cu TSA nu înseamnă neapărat o singură etiologie.
Cauzele genetice
Factorii genetici joacă cel mai important rol în etiologia tulburărilor din spectrul autismului, riscul de boală fiind semnificativ crescut la rudele de gradul întâi (fraţi, copii) şi la gemenii identici(3). Peste 3000 de gene şi multe mii de variante de gene au fost identificate până în prezent şi pot fi asociate cu TSA(4). Rolul factorilor ereditari implicaţi în dezvoltarea TSA poate fi cel mai mare dintre toate tulburările psihice(3). Variabilitatea genetică responsabilă de boală poate fi identificată cu succes în aproximativ 15-20% din cazuri. Acestea sunt în majoritate defecte genetice rare: mutaţii genetice izolate, aberaţii cromozomiale şi microaberaţii.
Factorii de mediu
Studiile largi efectuate în centre de cercetare epidemiologică în ultimii 40 de ani sugerează că etiologia relevantă poate fi în perioada ante- şi peripartum sau în copilăria timpurie şi este multifactorială. Cei mai mulţi dintre factorii de risc acţionează sinergic pentru a produce fenotipul autist(5). Identificarea factorilor de mediu este de o mare importanţă pentru prevenirea acestor tulburări, întrucât asupra acestor factori se poate interveni activ.
Prevalenţa globală în 2010 a TSA a fost estimată la 1/132 de persoane, reprezentând mai mult de 7,7 milioane de indivizi la nivel mondial(6), faţă de 0,05% în 1970. Prevalenţa este de 4 ori mai mare la băieţi decât la fete şi apare în aceeaşi măsură în familii aparţinând tuturor culturilor, claselor şi condiţiilor sociale, indiferent de nivelul de instruire al părinţilor.
O metaanaliză recentă a centralizat 60 de studii, care au analizat asocierea dintre factorii antenatali, perinatali, neonatali şi autism(7).
Fumatul în timpul sarcinii are numeroase implicaţii materno-fetale cunoscute, precum greutatea mică la naştere sau abruptio placentae(8), însă foarte puţin cunoscut şi diseminat este faptul că fumatul este de asemenea un factor de risc pentru mai multe tulburări de neurodezvoltare, deficit de atenţie, tulburări de comportament sau comportament antisocial(9).
O metaanaliză recentă, din 2015(10), care a analizat relaţia dintre fumatul activ al gravidei în timpul sarcinii şi autismul la copii în America de Nord, bazată pe 15 studii de observaţie, nu a sugerat o asociere semnificativă, însă a emis o serie de ipoteze de asocieri plauzibile. În primul rând, nicotina, din punct de vedere biochimic, are, cel mai probabil, efecte negative asupra dezvoltării cerebrale fetale, alături de celelalte mii de ingrediente ale fumului de tutun(11), prin efectele sale asupra receptorilor nicotinici ai acetilcolinei(12). O altă ipoteză ar fi aceea că tabagismul matern determină niveluri crescute de testosteron, care ar putea contribui la creşterea riscului de TSA(13). Cu toate acestea, sunt necesare studii suplimentare pentru a întări această constatare. Rezultatele acestui studiu au fost limitate pentru alte populaţii, cum ar fi gravidele africane sau asiatice, întrucât atât factorii genetici, cât şi cei de mediu variază foarte mult între etnii diferite.

Cannell a emis ipoteza ca hipovitaminoza D în timpul sarcinii poate contribui la dezvoltarea autismului în copilăria timpurie(14), însă, ţinând cont că incidenţa deficitului de vitamina D este raportată ca fiind larg răspândită în întreaga lume(15), există totuşi o dezbatere cu privire la incidenţa nu atât de crescută a autismului în rândul copiilor. Nivelurile serice normale de vitamina D ar trebui să fie între 20-30 ng/ml sau mai mare(16), iar cercetări recente în rândul copiilor cu autism au identificat niveluri scăzute de vitamina D(17). Nu este clar dacă acei copii cu TSA se nasc cu niveluri scăzute de vitamină D sau evoluează treptat către această hipovitaminoză în jurul vârstei de 18 luni. În cazul în care copiii cu TSA se nasc cu niveluri mai mici de vitamină D, atunci vitamina D poate fi factorul genetic sau de mediu mult timp căutat ca factor etiologic al acestei tulburări - figura 1(18).
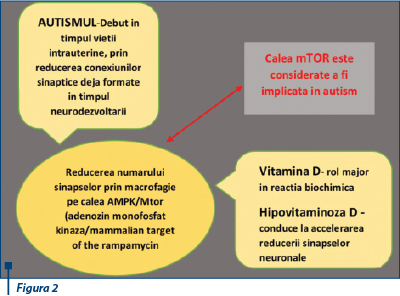
Mecanismul fiziopatologic probabil al autismului a fost descris ca având un debut în timpul vieţii intrauterine, prin reducerea conexiunilor sinaptice deja formate, în timpul dezvoltării cerebrale(19). Reducerea numărului acestor sinapse probabil are loc prin macroautofagie, pe calea AMPK/mTOR (adenozin monofosfat kinază/mammalian target of the rapamycin)(20), calea mTOR fiind considerată a fi implicată în autism(21,22). Vitamina D joacă un rol major în această reacţie biochimică(23), deci hipovitaminoza D conduce implicit la accelerarea reducerii sinapselor neuronale, cu evoluţie subsecventă spre dezvoltarea autismului.
Un alt mecanism descris ca fiind implicat în reducerea numărului conexiunilor sinaptice din perioada neurodezvoltării are ca element comun microglia(25,26). Dezvoltarea microgliei ca element în cadrul sinapsei neuronale este modulată de serotonină(27). Vitamina D activează transcripţia sintezei serotoninei (acţiune asupra genei hidroxilază triptofan 2 - TPH2) în creier şi reprimă transcripţia genei hidroxilază triptofan 1 - TPH1 în ţesuturi în afara barierei hemato-encefalice(28,29). Serotonina este un important neurotransmiţător al creierului, astfel că reducerea concentraţiei sale afectează neurodezvoltarea(30), iar la copiii diagnosticaţi cu autism a fost demonstrată tocmai existenţa acestui mecanism - „paradoxul serotoninei” -, care reprezintă scăderea concentraţiei acesteia la nivel cerebral, cu creşterea la nivel tisular în afara barierei hemato-encefalice. Descoperirile preliminare susţin ipoteza că vitamina D administrată în timpul sarcinii, la doze adecvate, şi suplimentarea la sugari şi copiii mici ar putea reduce incidenţa autismului(19).
Studii recente (2016) au încercat să identifice o relaţie între Indicele de Masă Corporală matern din perioada presarcinii şi a sarcinii şi riscul dezvoltării TSA(30). Întrucât rata obezităţii în lume aproape s-a dublat între 1980 şi 2008, iar prevalenţa TSA a fost de asemenea în creştere rapidă, este posibil ca „epidemia de obezitate” să joace un rol important în etiologia TSA. Comparând copiii ai căror mame au avut o greutate normală în sarcină, cu copiii născuţi din mame supraponderale şi obeze, s-a constatat că aceştia din urmă au avut un risc cu 28-36% mai mare de dezvoltare a TSA. Subponderabilitatea maternă nu a fost asociată cu un risc crescut al TSA.
Deşi mecanismul fiziopatologic rămâne de elucidat, efectele IMC matern asupra TSA pot fi explicate prin câteva ipoteze. Mecanismele cel mai frecvent menţionate pentru a explica asocierea dintre IMC matern şi TSA sunt inflamatoare. S-a observat că gravidele obeze au avut un nivel mai ridicat al proteinei C-reactive plasmatice comparativ cu cele cu greutate normală(31), cu creşterea numărului de celulele CD68 + CD14, care au determinat creşterea titrului citokinelor proinflamatoare, precum TNF α, interleukina 6 şi interleukina-1, la nivel placentar(32,33). Aceşti markeri inflamatori placentari determină reacţii inflamatoare sistemice fetale, cu leziuni cerebrale îndeosebi ale substanţei albe(33).
Concluzii
Autismul este cea mai severă tulburare neuropsihiatrică a copilăriei, de origine neurobiologică, cu etiologie care nu este pe deplin cunoscută, cu toate că în ultimii 40 de ani au fost efectuate numeroase studii aprofundate în vederea identificării factorilor implicaţi, a mecanismelor fiziopatologice şi a efectelor sale. Autismul rămâne în continuare o provocare pentru clinicieni, psihiatri şi pediatri, având un impact puternic asupra persoanelor afectate şi mai ales asupra familiilor acestora.
Bibliografie
- Lai MC, Lombardo MV, Baron-Cohen S. Autism. Lancet 2014;383:896–910.
- Christensen J. Gronborg TK. Sorensen MJ. Schendel D, Parner ET, Pedersen LH, Vestergaard M. Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. JAMA 2013;309:1696–1703.
- Bailey A, Le Couteur A, Gottesman I, Bolton P, Simono E,Yuzda E. et al. Autism as a strongly genetic disorder: evidence from a British twin study. Psychol Med 1995;25:63–77.
- Xu LM, Li JR, Huang Y, Zhao M, Tang X, Wei L. Autism KB: an evidence-based knowledgebase of autism genetics. Nucleic Acids Res 2012;40:D1016–22.
- Rădoi V, Bohîlţea L, Bohîlţea R, Cîrstoiu M. Genetic implications in autism spectrum disorders. Ginecologia.ro, 2015;10:29-32.
- Levy SE, Mandell DS, Schultz RT. Autism Lancet 2009;374:1627–38.
- Baxter AJ, Brugha TS, Erskine HE, Scheurer RW, Vos T, Scott JG. The epidemiology and global burden of autism spectrum disorders. Psychol. Med 2014;45:601–13.
- Gardener H, Spiegelman D, Buka SL. Perinatal and neonatal risk factors for autism: a comprehensive meta-analysis. Pediatrics 2011;128(2):344-55.
- Pineles BL, Park E, Samet JM. Systematic review and meta-analysis of miscarriage and maternal exposure to tobacco smoke during pregnancy. Am J Epidemiol 2014;179:807–23.
- Tran PL, Lehti V, Lampi KM, Helenius H, Suominen A, Gissler M, Brown AS, Sourander A. Smoking during pregnancy and risk of autism spectrum disorder in a Finnish National Birth Cohort. Paediatr Perinat Epidemiol 2013;27:266–74.
- Tang S, Wang Y, Gong X, Wang G. A meta-analysis of maternal smoking during pregnancy and autism spectrum disorder risk in offspring. Int J Environ Res Public Health 2015;12(9):10418-31.
- Tiesler CM, Heinrich J. Prenatal nicotine exposure and child behavioural problems. Eur Child Adolesc Psychiatry 2014;23:913–29.
- Dwyer JB, McQuown SC, Leslie FM. The dynamic effects of nicotine on the developing brain. Pharmacol Ther 2009;122:125–39.
- James WH. Potential explanation of the reported association between maternal smoking and autism. Environ Health Perspect 2013;121(2):a42.
- Cannell J. Autism and vitamin D. Med Hypotheses, 2008;70(4):750-9.
- Palacios C, Gonzalez L. Is Vitamin D deficiency a major global public health problem? J Steroid Biochem Mol Biol, 2014;144 Pt A:138-45.
- Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab, 2011;96:1911–30.
- Pioggia G, Tonacci A, Tartarisco G, Billeci L, Muratori F, Ruta L, Gangeni S. Autism and lack of D3 vitamin: a systematic review. Res Autism Spectr Disord, 2014;8(12):1685–98.
- Stubbs G, Henley K, Green J. Autism: Will vitamin D supplementation during pregnancy and early childhood reduce the recurrence rate of autism in newborn siblings? Med Hypotheses, 2016;88:74-8.
- Tang G, Gudsnuk K, Kuo SH, Cotrina ML. Loss of mTOR-dependent macroautophagy causes autistic-like synaptic pruning deficits. Neuron, 2014;83(5):1131-43.
- Boland B, Nixon RA. Neuronal macroautophagy: from development to degeneration. Mol Aspects Med, 2006;(27):503–19.
- Lipton JO, Sahin M. The neurology of mTOR. Neuron, 2014;(84):275–91.
- Phillips M, Pozzo-Miller L. Dendritic spine dysgenesis in autism related disorders - Neurosci Lett, 2015;601:30-40.
- Wooyoung J, Kim JK, Li H, Jo K, et al. 1,25-Dyhydroxyvitamin D3 attenuates rotenone-induced neurotoxicity in SH-SY5Y cells through induction of autophagy - Biochem Biophys Res Comm, 2014;451:142–7.
- Squarzoni P, Oller G, Hoeffel G, Pont-Lezica L, et al. Microglia modulate wiring of the embryonic forebrain.Cell Rep, 2014;8:1271–9.
- Paolicelli RC, Bolasco G, Pagani F, Maggi L. Synaptic pruning by microglia is necessary for normal brain development. Science, 2011;333:1456–8.
- Kolodziejczak M, Bechade C, Gervasi N, Irinopoulou T, et al. Serotonin modulates developmental microglia via 5-HT2B receptors: potential implication during synaptic refinement of retinogeniculate projections. ACS Chem Neurosci 2015;6(7):1219–30 .
- Patrick RP, Ames BN. Vitamin D hormone regulates serotonin synthesis. Part 1: relevance for autism. FASEB J, 2014;28:2398–413.
- Patrick RP, B.N. Ames BN. Vitamin D and omega-3 fatty acids control serotonin synthesis and action, Part 2: relevance for ADHD, bipolar, schizophrenia, and impulsive behavior. FASEB J 2015;29(6):2207-22.
- Yang CJ, Tan HP, Du TJ. The developmental disruptions of serotonin signaling may be involved in autism during early brain development. Neuroscience, 2014;267:1–10.
- Wang Y, Tang S, Xu S, Weng S, Liu Z. Maternal body mass index and risk of autism spectrum disorders in offspring: A meta-analysis. Sci Rep 2016;6:34248.
- Madan JC et al. Maternal obesity and markers of in ammation in pregnancy. Cytokine 2009;47:61–4.
- Bodean O, Munteanu O, Aramă SS, Băicuş A, Voicu D, Brătilă E, Bohîlţea E, Vlădăreanu S, Cîrstoiu M. Changes of metabolic parameters and the outcomes of pregnancy. Ginecologia.ro, 2016;13:6-9.
- Challier JC et al. Obesity in pregnancy stimulates macrophage accumulation and in ammation in the placenta. Placenta 2008;29:274–81 .
- Van der Burg JW, Sen S, Chomitz VR, Seidell JC, Leviton A, Dammann O. The role of systemic inflammation linking maternal body mass index to neurodevelopment in children. Pediat Res 2016;79(1-1):3-12.
