Noi metode diagnostice ale principalelor cancere cutanate non-melanocitare în practica medicală
New diagnostic methods of the main non-melanoma skin cancers
Abstract
Non-melanoma skin cancers represent the most common cancer in white-skinned individuals, with a continuous increasing global incidence. The main risk factor for their development is chronic exposure to sunlight. Unlike basal cell carcinoma, squamous cell carcinoma arises from precancerous lesions such as actinic keratoses. The diagnosis of non-melanoma skin cancer is based on clinical examination and dermoscopy, while histopathology certifies the diagnosis. The following article will present the main types of non-melanoma cancers with their respective clinical features, along with diagnostic methods and available therapeutic options.Keywords
basal cell carcinomasquamous cell carcinomadermoscopyreflectance confocal microscopysurgical excisionMohs micrographic surgeryRezumat
Neoplaziile cutanate non-melanocitare reprezintă cea mai frecventă formă de cancer la populaţia de culoare albă, având incidenţa globală în continuă creştere. Principalul factor de risc este expunerea intensivă la radiaţiile solare. Spre deosebire de carcinomul bazocelular, carcinomul spinocelular evoluează din leziuni precanceroase de tip keratoze actinice. Diagnosticul de carcinom cutanat non-melanocitar este realizat prin examen clinic şi dermatoscopie, diagnosticul de certitudine fiind stabilit în urma examenului histopatologic. În articolul ce urmează vor fi descrise principalele tipuri de cancere non-melanocitare, prezentările clinice ale acestora, alături de metodele diagnostice şi opţiunile terapeutice existente.Cuvinte Cheie
carcinom bazocelularcarcinom spinocelulardermatoscopiemicroscopie confocală de reflectanţăexcizie chirurgicalămicrochirurgie MohsCancerele non-melanocitare reprezintă cel mai frecvent tip de cancer la pacienţii caucazieni, cu o continuă creştere a incidenţei globale(1).
Carcinomul bazocelular (CBC) reprezintă 75% din totalul cancerelor cutanate. Acesta este o tumoare cu origine epidermică, cu evoluţie clinică lentă, de ordinul anilor, având o rată de vindecare crescută. CBC prezintă o rată de mortalitate redusă, cu o rată de metastazare de sub 0,1%(2). Uneori poate evolua agresiv la nivel local, provocând distrucţii tisulare extinse.
Carcinomul spinocelular (CSC) reprezintă al doilea cel mai frecvent cancer tegumentar de tip non-melanocitar (20%) şi conduce la majoritatea deceselor asociate cancerelor cutanate(3). Acest ultim aspect este explicat prin rata de metastazare de 0,3-3,7%(4). CSC este un cancer de origine epitelială a cărui apariţie este legată de expunerea intensivă la radiaţii UV, astfel că apare predominant la nivelul tegumentelor fotoexpuse(3).
Carcinoamele spinocelulare derivă, de cele mai multe ori (60% din cazuri), dintr-o keratoză actinică şi mai rar apar pe tegument aparent normal(5). Formele apărute pe keratoze actinice preexistente au o agresivitate mai redusă prin comparaţie cu formele care nu derivă din acestea.
Carcinoamele spinocelulare care apar în zonele non-fotoexpuse sunt legate de expunerea la substanţe chimice carcinogene de tipul arsenicului(3).
Factori de risc şi etiologie în cancerele non-melanocitare
Apariţia cancerelor non-melanocitare este datorată existenţei unei asocieri între factori de mediu şi genetici.
Unul dintre cei mai importanţi factori de risc este expunerea intensivă la radiaţii ultraviolete (mai ales la cele de tip UVB, cu lungimi de undă între 290 şi 320 nm). Acest lucru este susţinut de incidenţa mai crescută a cancerelor de tip non-melanocitar la pacienţii care trăiesc în ţări cu climat mai cald sau care au o expunere îndelungată la soare. Există studii în literatura de specialitate care sugerează faptul că expunerea la radiaţiile solare încă din tinereţe şi, totodată, numărul de arsuri solare apărute în decursul vieţii se corelează cu rata de apariţie a cancerelor de tip non-melanocitar(6). Utilizarea aparatelor de bronzat artificial induce o creştere de 2,5 ori a riscului de apariţie a CSC şi de 1,5 ori pentru CBC(7).
Radiaţiile solare induc afectarea ADN-ului keratinocitelor şi astfel vor conduce la mutaţii la nivelul genelor supresor-tumorale. Majoritatea mutaţiilor produse (30-50%) apar la nivelul p53 prin mutaţii punctiforme apărute după expunerea la UV: citozina este modificată în timină(6).
În cazul CBC s-a observat asocierea cu mutaţii germinale dispuse la nivelul genei PTCH (Protein Patched Homolog) situată pe braţul lung al cromozomului 9(8).
Aspectele fenotipice asociate cel mai frecvent cu apariţia cancerelor de tip non-melanocitar au fost identificate ca fiind următoarele:
Fototipurile I şi II conform scalei Fitzpatrick (fototipurile mai deschise au tendinţa să se ardă mai repede la expunerea la soare);
Afectarea actinică severă.
O atenţie deosebită ar trebui acordată pacienţilor imunosupresaţi (pacienţii transplantaţi, pacienţii care primesc medicaţie imunosupresivă) deoarece aceştia prezintă un risc crescut de a dezvolta un carcinom de tip non-melanocitar. Incidenţa creşte la aceşti pacienţi de 65-250 de ori în cazul CSC şi de 10 ori în cazul CBC(9).
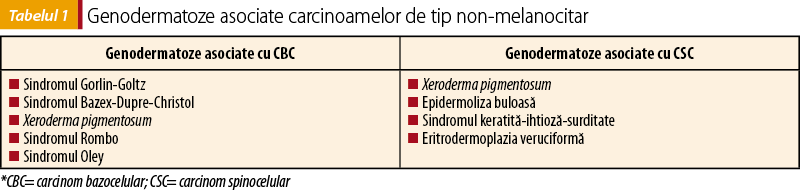
Alţi factori de risc asociaţi cu carcinoamele de tip non-melanocitar sunt: vârsta peste 60 de ani, sexul masculin, expunerea la arsenic, afecţiuni hematologice (leucemie, limfom), ulcere/inflamaţie cronică la nivel tegumentar sau al mucoaselor şi genodermatozele(6). Genodermatozele asociate cu carcinomul de tip non-melanocitar se regăsesc în tabelul 1.
I. Carcinomul bazocelular
Aspecte clinice CBC
Majoritatea carcinoamelor bazocelulare apar la nivelul feţei, dintre care 80% apar deasupra liniei care conectează colţul gurii cu lobul inferior al urechii.
Carcinoamele bazocelulare apar de novo pe piele normală, fără a se dezvolta dintr-o formă precanceroasă, aşa cum se întâmplă în cazul carcinomului spinocelular.
Carcinomul bazocelular reuneşte o multitudine de forme clinice, însă, în mare, ele se pot clasifica în forme superficiale (forma eritematoasă, forma pagetoidă) şi forme profunde (forma nodulară, forma nodulo-chistică, forma ulcerată)(10).
- Forma nodulară reprezintă cel mai frecvent subtip. Din punctul de vedere al aspectului clinic, se prezintă sub forma unei papule perlate sau nodul cu telangiectazii în suprafaţă. Deşi poate fi implicată orice suprafaţă a corpului, leziunile se găsesc cel mai frecvent la nivelul extremităţii cefalice şi al gâtului.
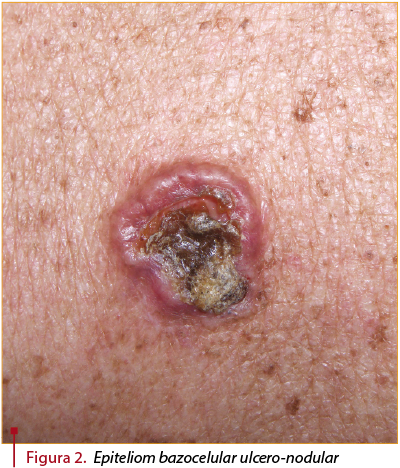
- Forma ulcero-nodulară are trăsături clinice sugestive pentru carcinom bazocelular, cum ar fi culoarea translucidă, telangiectaziile, ulceraţia centrală şi marginea palpabilă. Fiind ulcerată, va conduce la acoperirea leziunii de cruste (figura 2).
- Forma chistică prezintă multipli noduli hemisferici, cu densitate redusă, având o zonă centrală mai intens pigmentată comparativ cu periferia. Localizările cele mai frecvente sunt pleoapele şi regiunile superioare ale obrazului. Diagnosticul diferenţial se face cu mollusum contagiosum.
- Forma ulcerată (ulcus rodens) apare mai frecvent în cazul tumorilor dispuse la nivelul feţei sau al scalpului. Există şi o variantă de ulcere tenebrante în care nu este afectat doar ţesutul moale, ci şi osul şi cartilajul subiacent.
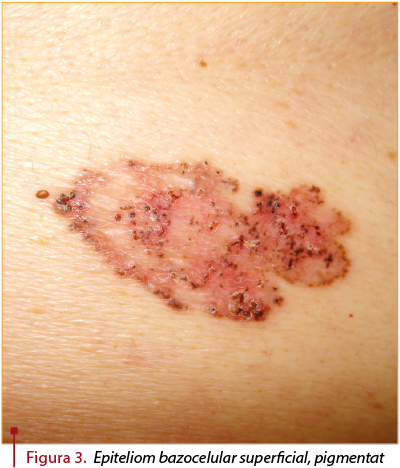
- Forma superficială se prezintă sub forma unei plăci eritemato-scuamoase, cu aspect psoriaziform, care prezintă margini discret reliefate, cu perle mici la acest nivel. Cel mai frecvent este dispusă la nivelul trunchiului şi se asociază cu expunerea anterioară la arsenic. Necesită diagnostic diferenţial cu eczema, psoriazisul şi boala Bowen (figura 3).
- Forma pigmentată este caracterizată prin producţia de melanină de către celulele tumorale şi celulele stromale. Are o incidenţă mai mare în populaţia cu fototip Fitzpatrick mai înalt. Atât formele superficiale, cât şi cele nodulare de carcinom bazocelular pot prezenta pigment. Dermatoscopia ne poate ajuta pentru a face diagnosticul diferenţial cu melanomul cutanat, însă metoda care ne confirmă diagnosticul este biopsia cutanată, urmată de examen histopatologic. Diagnosticul diferenţial se face cu melanomul cutanat, nevii nevocelulari, nevii albaştri, angiokeratomul sau melanoacantomul.
- Forma sclerotică/morfeiformă prezintă aspecte clinice sugestive pentru carcinom bazocelular, incluzând culoarea alb-roz şi telangiectaziile dispuse pe suprafaţă. Este important de recunoscut deoarece această formă necesită tratament mai agresiv în comparaţie cu celelalte. De cele mai multe ori apare sub forma unei cicatrice atrofice, cu câteva telangiectazii în suprafaţă, dispusă la nivelul feţei. Uneori poate să capete aspect hipertrofic şi astfel necesită diagnostic diferenţial cu cicatricea cheloidă. Această formă este, de cele mai multe ori, agresivă din punct de vedere clinic, putând să afecteze structuri profunde. Diagnosticul diferenţial se face cu morfeea.
- Forma tenebrantă (ulcus tenebrans) implică distrucţie tisulară profundă cu extindere spre cartilaj şi os, având o evoluţie mutilantă. Este frecvent localizată la nivelul feţei şi al scalpului. Este ameninţătoare de viaţă din cauza complicaţiilor asociate, cum ar fi hemoragiile sau afectarea meningeală.
CBC are o evoluţie cronică, cu creştere lentă în dimensiuni. Odată cu creşterea dimensiunilor tumorii, creşte şi riscul de ulcerare. Totodată, apariţia precoce a unei ulceraţii este asociată cu un prognostic mai rezervat(10).
Carcinomul bazocelular metastazează foarte rar (prevalenţa estimată este de sub 0,1%). Metastazele apar cel mai frecvent în tumorile ulcerate de dimensiuni mari sau în formele infiltrative ce reapar post-chirurgical sau post-radioterapie. Prezenţa invaziei vasculare a tumorii la examenul histopatologic a fost corelată cu un risc mai mare de metastazare.
Diagnosticul diferenţial al CBC
Deşi de cele mai multe ori diagnosticul carcinomului bazocelular este uşor de realizat clinic şi dermatoscopic, există anumite forme care pun problema diagnosticului diferenţial. Biopsia, urmată de examen histopatologic, este cea care rezolvă cu certitudine problemele de diagnostic diferenţial.
Diagnosticul diferenţial a fost precizat pentru fiecare formă în parte de CBC.
Examenul histopatologic al CBC
Din punct de vedere histopatologic, carcinoamele bazocelulare sunt caracterizate de proliferarea celulelor epidermice bazale. Intradermic se vor forma mase epiteliomatoase cu delimitare netă şi cu aspect monomorf, în a căror periferie sunt dispuse în palisadă keratinocite. Acestea sunt înconjurate de o stromă fibroasă. Epidermul este, de cele mai multe ori, atrofic şi poate să prezinte ulceraţii. În mod caracteristic se poate observa separare între ţesutul neoplazic şi stroma tumorală. Mitozele sunt frecvent observate.
Semne de alarmă pentru carcinomul bazocelular:
- O rană deschisă care sângerează, supurează sau formează cruste şi rămâne deschisă pe parcursul unei perioade de câteva săptămâni, care se vindecă şi ulterior resângerează. O rană persistentă, greu vindecabilă, este un semn de carcinom bazocelular în stadiu incipient.
- O pată roşiatică sau o zonă iritată, apărută frecvent la nivelul feţei, toracelui, umerilor, braţelor sau picioarelor. Uneori poate să fie acoperită de scuame şi poate să fie pruriginoasă sau chiar să doară. Anumite leziuni pot persista, fără a produce disconfort.
- Un nodul lucios cu aspect perlat şi care este deseori de culoare roz, roşie sau albă. La persoanele cu un fototip mai închis poate avea culoare maro sau chiar neagră, putând fi confundate cu un nev pigmentar.
- O excrescenţă de culoare roz cu marginea reliefată şi cu o crustă dispusă central. Pe măsură ce leziunea se extinde, vor apărea noi vase de sânge dispuse la suprafaţă.
- O zonă asemănătoare unei cicatrice de culoare albă sau galbenă, cu aspect ceros şi, de cele mai multe ori, având margini puţin delimitate şi pielea de un aspect strălucitor şi întins. Acest semn de alarmă poate indica un carcinom bazocelular invaziv, ce poate avea dimensiuni mai mari decât se observă macroscopic.
II. Carcinomul spinocelular
Aspecte clinice ale CSC
Carcinomul spinocelular se prezintă sub diverse aspecte clinice, de la forma in situ la forma infiltrativă.
Carcinomul spinocelular in situ este denumit şi boala Bowen. Cel mai comun mod de prezentare clinică este sub forma unei pete eritematoase acoperite de scuame sau o placă uşor ridicată ce apare la nivelul unei zone fotoexpuse la un individ vârstnic. Boala Bowen poate să apară de novo (pe piele aparent sănătoasă) sau pe o keratoză actinică preexistentă.
Forma de carcinom spinocelular in situ indusă de arsenic are aspectul clinic asemănător cu cel descris mai sus, însă are tendinţa la multifocalitate şi este localizată mai ales în zone non-fotoexpuse ale corpului.
Papuloza bowenoidă reprezintă transformarea în carcinom spinocelular in situ a verucilor genitale asociate HPV 16 sau 18.
Forma invazivă de carcinom spinocelular se prezintă sub forma unei papule eritematoase keratozice apărute la nivelul unei zone fotoexpuse. Leziunea prezintă un istoric de zonă indurată şi are tendinţa, odată cu creşterea, să devină nodulară. Leziunile pot ulcera, tumorile având o componentă exofitică şi una endofitică (invazivă) (figura 4).
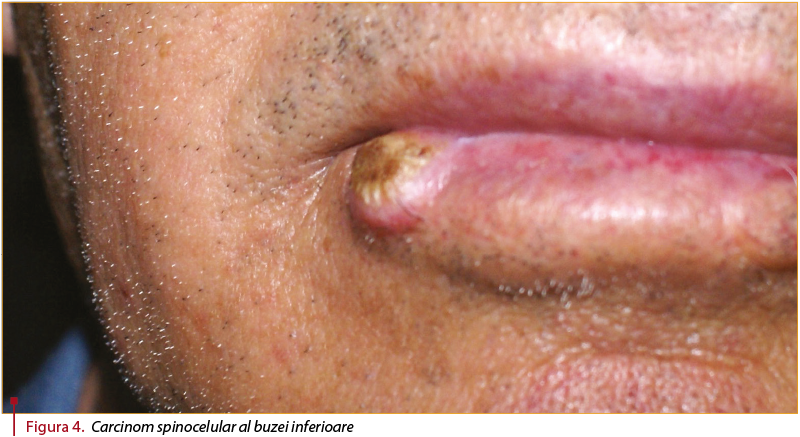
Situsuri predilecte pentru apariţia carcinomului spinocelular sunt considerate a fi zonele cu traumatisme în antecedente, cu cicatrice, inflamaţie, supuse radiaţiilor sau expunerii chimice. Foarte sugestivă este localizarea la nivelul buzei inferioare. Leziunile care apar pe cicatrice sau situsuri inflamatorii sunt mai predispuse să dezvolte metastaze. Totodată, incidenţa crescută a metastazelor creşte cu dimensiunea şi cu gradul de imunosupresie(10).
Examenul histopatologic al CSC
Diagnosticul de certitudine în carcinomul spinocelular se pune în urma biopsiei mucoasei/tegumentului afectat, urmată de examen histopatologic.
CSC se caracterizează prin apariţia unor mase celulare epidermice la nivel dermic. Spre deosebire de CBC, unde aspectul era monomorf, în CSC aspectul este polimorf.
Masele epiteliomatoase sunt alcătuite din celule spinoase tipice, celule keratinizate individual şi celule spinoase atipice, care prezintă atipii citoplasmatice şi nucleare (dimensiuni şi forme variate, nucleu mare şi hipercrom). Prin invadarea dermului de către celulele spinoase, se antrenează şi keratinocitele bazale, fiind dispuse la periferia insulelor tumorale.
La nivelul epidermului se observă o îngroşare a tuturor straturilor keratinocitare.
La nivelul ţesutului conjunctiv se observă un infiltrat inflamator bogat în limfocite (80-90% din acestea sunt de tip T) şi plasmocite.
Clasificarea Broders separă carcinoamele spinocelulare în patru grade, în funcţie de diferenţierea celulară (tabelul 2). Astfel că malignitatea unui carcinom spinocelular este corelată direct proporţional cu reducerea gradului de diferenţiere.

Evoluţia şi prognosticul CSC
Următoarele aspecte clinice şi histologice ale carcinomului spinocelular se asociază cu o rată crescută de metastazare:
- Diametrul peste 2 cm, adâncime peste 4 mm şi recurenţă tumorală
- Tumori nediferenţiate sau slab diferenţiate
- Diseminarea tumorală la nivel osos, muscular şi nervos
- Localizarea la nivelul lobului urechii, pe scalp sau la nivelul feţei
- Tumori care se dezvoltă pe leziuni preexistente: cicatrice, ulcere cronice, arsuri
- Pacienţi imunodeprimaţi
- Tumori cauzate de ingestia de arsenic.
Toţi pacienţii trataţi pentru carcinom spinocelular cutanat necesită supraveghere pentru descoperirea precoce a unei eventuale recidive locale sau regionale, pentru managementul complicaţiilor legate de tratament sau dezvoltarea de noi tumori. Evaluarea pacienţilor cu cancere non-metastatice necesită o urmărire de către dermatologi la fiecare 3-6 luni în primii 2 ani, apoi la 6-12 luni pentru următorii 3 ani, după care anual pentru restul vieţii.
Diagnosticul în cancerele de tip non-melanocitar
Diagnosticul în cancerele de tip non-melanocitar se realizează clinic şi este susţinut de apariţia leziunilor sugestive la nivelul tegumentului sau al mucoaselor fotoexpuse. Pentru a confirma diagnosticul cu certitudine sunt necesare realizarea unei biopsii din marginea leziunii şi examen histopatologic.
Metode moderne de investigare în carcinoamele non-melanocitare
Deşi dermatoscopia s-a dovedit a fi extrem de utilă în diferenţierea carcinoamelor cutanate non-melanocitare de tumorile cutanate benign, ajungând chiar la o sensibilitate de 95-97% şi o specificitate de 87-96% în cazul CBC(12), lista de criterii dermatoscopice pentru diagnosticul CBC şi CSC este în mod continuu revizuită şi completată(13).
Literatura de specialitate în această arie de studiu a dermatologiei este concentrată în mare parte în jurul leziunilor pigmentare(14). Drept urmare, criteriile dermatoscopice pentru diagnosticul CBC pigmentar sunt bine stabilite. Elementele vizibile la dermatoscopie în cazul CBC pigmentare, cum ar fi structuri concentrice, globuli bruni-negri şi uneori chiar pseudopode, sunt consecinţa acumulărilor de melanină la nivel dermo-epidermic(15). Unii autori sugerează chiar excluderea CBC pigmentar ca formă clinică distinctă din cauza faptului că orice formă clinică de CBC poate prezenta pigmentare.
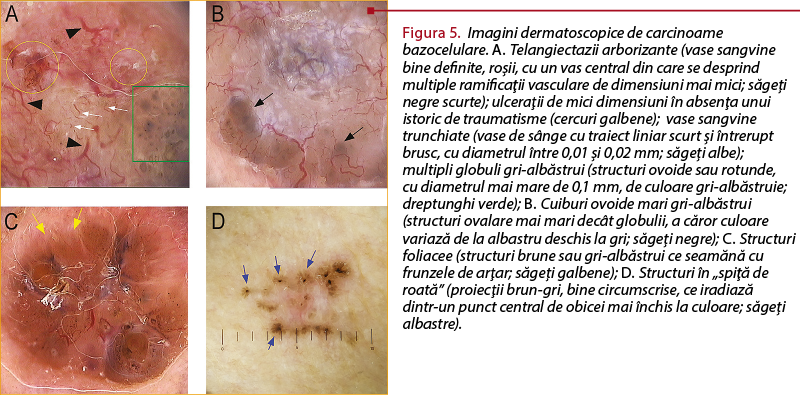
Bazându-se pe lipsa reţelei pigmentare caracteristice pentru leziunile melanocitare, în anul 2000, Menzies şi colab.(16) au introdus criteriile dermatoscopice clasice pentru diagnosticul carcinomului bazocelular. Acestea includ unul sau mai multe dintre următoarele patternuri: ulceraţii de mici dimensiuni în absenţa unui istoric de traumatisme, multipli globuli gri-albăstrui (structuri ovoide sau rotunde, cu diametrul mai mare de 0,1 mm, de culoare gri-albăstruie), structuri foliacee (structuri brune sau gri-albăstrui ce seamănă cu frunzele de arţar), cuiburi ovoide mari gri-albăstrui (structuri ovalare bine circumscrise, uneori confluate, mai mari decât globulii, a căror culoare variază de la albastru deschis la gri), structuri în „spiţă de roată” (proiecţii brun-gri, bine circumscrise, ce iradiază dintr-un punct central de obicei mai închis la culoare), telangiectazii arborizante (vase sangvine bine definite, roşii, cu un vas central cu grosime mai mare de 0,2 mm, din care se desprind multiple ramificaţii vasculare de dimensiuni mai mici), vase sangvine trunchiate (vase de sânge cu traiect liniar scurt şi întrerupt brusc, cu diametrul între 0,01 şi 0,02 mm), zone hipopigmentate. Acest set de criterii dermatoscopice îi este esenţial clinicianului pentru evaluarea iniţială a leziunilor, înaintea prelevării unei biopsii cutanate (figura 5).
În ceea ce priveşte carcinomul spinocelular cutanat, criteriile dermatoscopice clasice cuprind polimorfism vascular marcat, reprezentat prin vase sangvine punctate şi glomerulare (al căror aspect aminteşte de glomerulii renali), dispuse pe un fundal roşu, acoperit de scuame albicioase(17). Din nefericire, dermatoscopia nu poate diferenţia întotdeauna între displazia keratinocitară prezentă într-o keratoză actinică şi un CSC in situ, deseori fiind necesare investigaţii suplimentare.
Dermatoscopia s-a transformat progresiv dintr-o investigaţie de treapta a doua, utilizată în evaluarea leziunilor cutanate cu aspect clinic incert, într-o parte inseparabilă a examenului clinic dermatologic. Datorită interesului foarte mare pentru această tehnică şi răspândirii foarte largi a utilizării acesteia, criteriile de diagnostic dermatoscopic în cazul carcinoamelor cutanate non-melanocitare sunt bine cunoscute. În cazul carcinoamelor bazo- şi spinocelular, dermatoscopia ajută atât la buna desfăşurare a procesului de diagnostic diferenţial, cât şi la alegerea parcursului terapeutic optim şi la monitorizarea evoluţiei tratamentului pacienţilor.
Microscopia confocală de reflectanţă in vivo (MCR), o metodă de investigaţie imagistică neinvazivă, câştigă din ce în ce mai multă popularitate datorită capacităţii de a obţine rapid secţiuni orizontale prin straturile pielii ce sunt înregistrate ca imagini alb-negru, asemănătoare unei ecografii, cu rezoluţie capabilă să definească detalii vizibile până acum doar la microscopia optică(18). MCR este utilizată cu succes în evaluarea patologiei tumorale cutanate melanocitare şi non-melanocitare, dar şi în cazul patologiei inflamatorii sau infecţioase şi chiar şi în evaluarea estetică a tegumentelor(19-25). Principalele avantaje ale MCR sunt date de explorarea leziunilor cutanate in vivo, cu posibilitatea evaluării dinamice a vascularizaţiei tumorale, rezoluţia excelentă pentru evidenţierea detaliilor la nivel celular şi subcelular (pot fi observaţi nuclei celulari, granule citoplasmatice etc.) şi independenţa faţă de coloranţii şi agenţii de contrast externi, întrucât contrastul în microscopia confocală de reflectanţă este oferit de melanină, keratină şi colagen, tehnologia bazându-se pe indicii de refracţie diferiţi ai fiecărei substanţe.
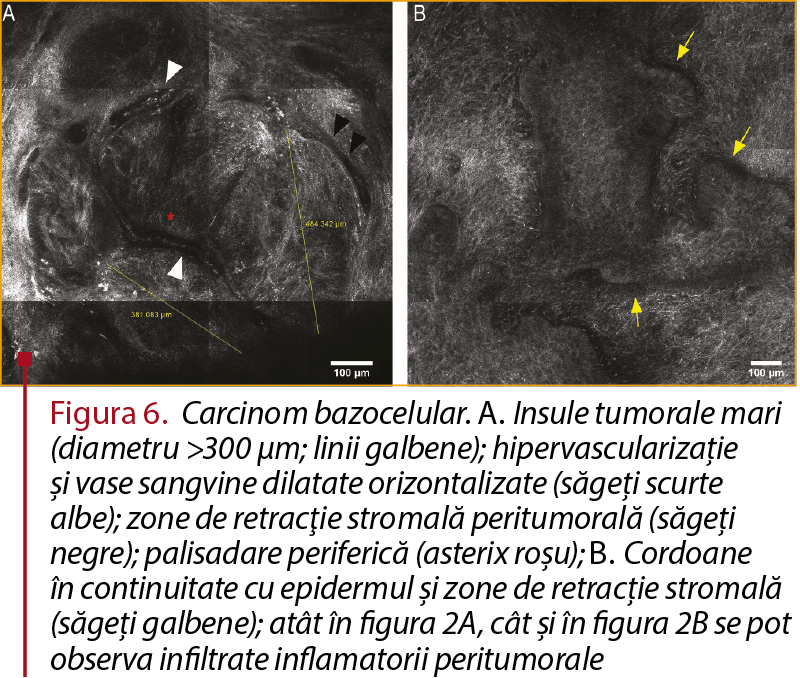
În cazul carcinomului bazocelular, criteriile de diagnostic prin microscopie confocală de reflectanţă includ agregate celulare tumorale sub formă de cordoane în continuitate cu epidermul (echivalentul „rufelor atârnate pe sârmă” în examenul histopatologic convenţional), insule tumorale mari (diametru >300 µm), zone hipo-refractile de retracţie stromală peritumorală, palisadare periferică, infiltrate inflamatorii peritumorale, hipervascularizaţie şi arii hiporefractile intradermice denumite plastic „siluete întunecate”. Unele dintre aceste criterii au o sensibilitate şi o specificitate foarte crescute pentru diagnosticul de carcinom bazocelular, astfel încât observarea lor creşte considerabil acurateţea diagnosticului (figura 6).
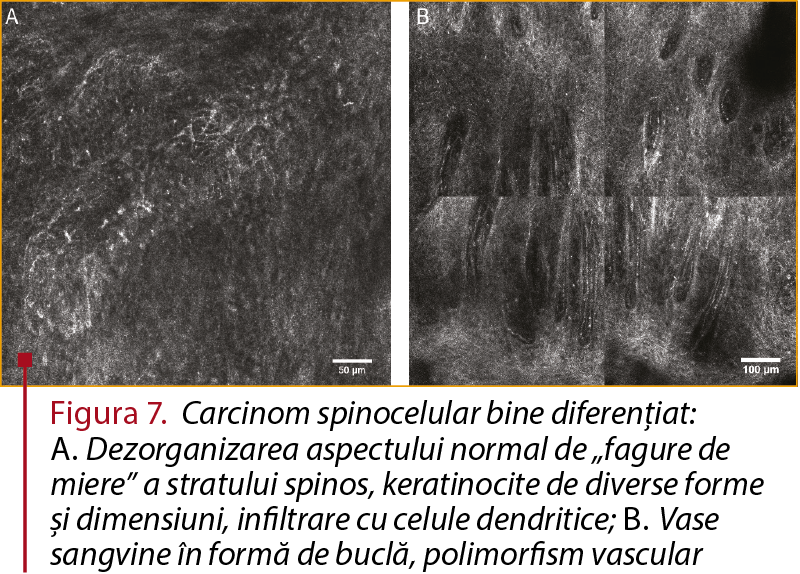
Carcinomul spinocelular se distinge la evaluarea prin MCR prin alterarea arhitecturii stratului cornos, prezenţa de keratinocite detaşate şi a parakeratozei. La nivelul stratului spinos se pot distinge dezorganizarea aspectului normal de „fagure de miere”, pleomorfism keratinocitar şi infiltrarea cu celule dendritice. La nivelul dermului se pot observa numeroase structuri fibrilare moderat-refractile reprezentând elastoză solară, dar şi cuiburi de celule tumorale. Dezorganizarea stratului spinos nu reprezintă un criteriu specific pentru diagnosticul CSC, acest aspect fiind descris de unii autori şi în cazul keratozelor actinice (figura 7).
Pe lângă aplicabilitatea MCR în diagnosticarea tumorilor cutanate pigmentare şi non-pigmentare, a leziunilor inflamatorii şi infecţioase, deloc neglijabilă este şi utilitatea acestei metode de investigaţie imagistică cutanată neinvazivă în alegerea locului de efectuare a unei biopsii cutanate, evitând astfel un posibil rezultat fals negativ produs de o eroare de sampling.
Într-un număr mare de cazuri, detaliile vizibile la MCR, coroborate cu aspectul la examenul dermatoscopic, permit diferenţierea între carcinoamele cutanate non-melanocitare şi tumorile cutanate benigne, evidenţiind faptul că această abordare complementară poate creşte în mod semnificativ acurateţea diagnosticului preterapeutic. Precizia diagnosticului preterapeutic constituie un aspect important pentru clinicieni, având în vedere tendinţa actuală de a personaliza abordarea terapeutică, ţinând cont de particularităţile histologice tumorale. Evaluarea preoperatorie neinvazivă a acestor tumori poate reduce considerabil numărul procedeelor invazive efectuate în scop diagnostic şi poate scădea morbiditatea şi costurile de diagnostic şi tratament.
Tratamentul în cancerele de tip non-melanocitar
Alegerea tratamentului în cancerele de tip non-melanocitar se face în funcţie de riscul tumoral (determinat prin analiza dimensiunilor, localizării şi subtipului tumoral), ţinându-se cont şi de preferinţele pacientului şi de posibilităţile terapeutice ale centrului medical.
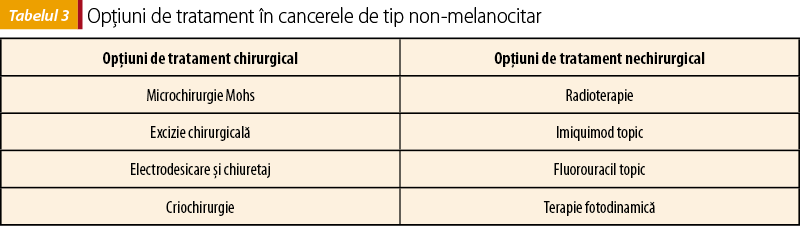
Există diferite modalităţi de tratament pentru cancerele de tip non-melanocitar: chirurgicale şi non-chirurgicale, acestea fiind ilustrate în tabelul 3.
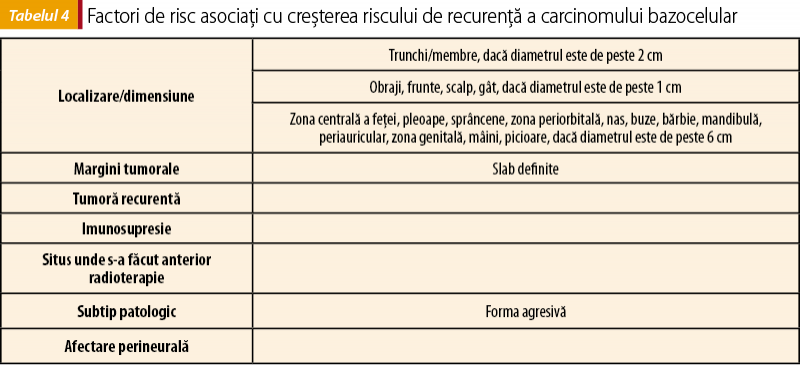
Trebuie ţinut cont de riscul de recurenţă al tumorii în momentul în care se alege tratamentul. Factorii de risc pentru recurenţă în cazul CBC se regăsesc în tabelul 4.
Opţiuni de tratament chirurgical
1. Microchirurgie Mohs
Microchirurgia Mohs permite o evaluare în timp real a marginilor tumorale, fiind superioară din punct de vedere histopatologic, asociată cu o conservare maximă a ţesuturilor prin comparaţie cu excizia chirurgicală.
Microchirurgia Mohs s-a dovedit a fi opţiunea terapeutică cu cea mai mare rată de vindecare şi cea mai mică rată de recurenţă, mai ales în cancerele non-melanocitare cu risc crescut sau cu risc de recurenţă. Un studiu realizat pe o perioadă de 5 ani de urmărire a pacienţilor a arătat o rată de vindecare de 99% pentru CBC şi de 97% pentru CSC în urma acestei terapii(26).
Ratele de recurenţă în urma microchirurgiei Mohs sunt de 3,2% pentru CBC primare şi de 6,7% pentru recurenţele de CBC, fiind mai mici decât în excizia chirurgicală standard, crioterapie sau radioterapie.
2. Excizie chirurgicală cu margini de siguranţă
Excizia chirurgicală cu margini de siguranţă de 3-4 mm în cazul CBC(27) şi de 4-5 mm pentru CSC(28) reprezintă tratamentul de elecţie pentru cancerele de tip non-melanocitar în cazul majorităţii pacienţilor. Este important de realizat controlul microscopic al marginilor de rezecţie.
Un studiu realizat pe o durată de 5 ani a arătat o rată de vindecare în urma exciziei chirurgicale cu margini de siguranţă de 98% pentru CBC şi de 92% pentru CSC, ceva mai mică decât în cazul microchirurgiei Mohs(29).
Ratele de recurenţă pentru excizia chirurgicală sunt de 4,8% pentru CBC primare şi de 11,6% pentru recurenţele de CBC.
3. Chiuretaj şi electrodesicare
Chiuretajul implică îndepărtarea epidermului şi dermului care conţin tumoarea şi este urmat de electrocauterizarea bazei post-excizionale în acelaşi timp operator.
Aceste metode sunt utilizate în cazul carcinoamelor de dimensiuni mici, aflate în stadii iniţiale sau forme superficiale, dar care sunt asociate cu imposibilitatea rezecării complete a tumorii. Sunt folosite în cazul unor tumori de dimensiuni mari sau în caz de recurenţă.
4. Crioterapie
Crioterapia tumorală este folosită pentru tratarea CBC superficiale, mai ales a celor localizate la nivelul feţei şi la pacienţii în vârstă. Rata de vindecare este crescută, fiind de 99% la 5 ani de la intervenţie pentru CBC(30).
Crioterapia nu se recomandă pentru CSC deoarece acest tip are potenţial de metastazare şi necesită astfel o terapie definitivă, cum sunt chirurgia, radioterapia sau chiuretaj şi electrodesicare.
Există riscul de apariţie a unei cicatrice hipopigmentate post-intervenţie, ceea ce determină un aspect cosmetic mai puţin favorabil decât în cazul altor tipuri de terapii.
Opţiuni de tratament non-chirurgical
1. Cremă cu imiquimod 5%
Imiquimodul este un imunomodulator topic care acţionează prin activarea limfocitelor T citotoxice împotriva celulelor tumorale.
Crema cu imiquimod reprezintă un tratament eficient pentru CBC superficiale, având o rată de vindecare de 84%(31). Imiquimodul topic nu este recomandat în CSC din cauza unei rate de recurenţă crescute.
Efectele adverse apărute cel mai frecvent sunt eritemul, scuame, durerea locală şi ulceraţia.
2. Cremă cu 5-fluorouracil
5-Fluorouracilul este un antimetabolit de tip pirimidinic care inhibă sinteza de ADN. Tratamentul topic poate fi utilizat pentru formele superficiale de CBC, dar nu este recomandat ca primă linie de tratament(32).
Tratamentul asociază riscul de apariţie a leziunilor de tip arsură.
3. Terapie fotodinamică
Terapia fotodinamică este un tratament eficient în cazul CBC superficiale sau cu risc scăzut.
Terapia presupune aplicarea de acid 5-aminolevulinic sau acid metil-aminolevulinic la nivelul tumorii, urmată de aplicarea de lumină albastră (lungime de undă 410 nm) sau lumină roşie (lungime de undă 630 nm)(33). Rata de succes evaluată la 2 ani de la intervenţie este de 90%(34).
Aspectul cosmetic post-intervenţie este excelent. Nu se foloseşte în caz de forme invazive de CBC sau în CSC, din cauza penetrării limitate a luminii terapeutice.
4. Radioterapia
Radioterapia este o modalitate eficientă de tratament al carcinoamele non-melanocitare care nu pot fi tratate folosind o metodă chirurgicală, având totuşi o rată de eficienţă mai scăzută în comparaţie cu microchirurgia Mohs sau excizia chirurgicală cu margini de siguranţă. Într-un studiu realizat pe 5 ani, s-a observat o rată de vindecare în urma radioterapiei de 91,3% pentru CBC şi de 90% pentru CSC(26).
Radioterapia adjuvantă poate fi utilă în cazul tumorilor care prezintă invazie perineurală. Mai poate fi utilizată ca tratament paliativ atunci când excizia completă a marginilor tumorale nu se poate realiza din cauza extinderii foarte mari a tumorii(35). Radioterapia nu este indicată în cazul tumorilor localizate în regiuni supuse traumatismelor repetate, cum ar fi articulaţiile sau recurenţele post-radioterapie. Se asociază cu risc de apariţie a leziunii cutanate atrofice şi a telangiectaziilor în zonele expuse la radioterapie.
Concluzii
Luând în considerare toate aceste aspecte, este evident faptul că numai prin dezvoltarea şi implementarea de strategii de prevenţie eficiente poate fi obţinută o reducere semnificativă a incidenţei acestui tip de cancer. Prevenţia primară în patologia dermato-oncologică trebuie concentrată în jurul factorilor de risc influenţabili, cum ar fi expunerea excesivă la radiaţii ultraviolete, fumatul, expunerea la substanţe carcinogene etc. Cadrele medicale trebuie să încurajeze în mod sistematic screeningul dermatologic regulat, în special la persoanele între 50 şi 65 de ani.
Arsenalul metodelor de diagnostic precoce al carcinoamelor cutanate non-melanocitare se îmbogăţeşte în mod continuu, astfel încât, în prezent, clinicienii au acces atât la investigaţii de primă linie cum ar fi dermatoscopia, cât şi la metode imagistice avansate, menite să facă legătura între dermatoscopie şi histopatologie, cum ar fi microscopia confocală de reflectanţă in vivo.
Valoarea acestor metode moderne de diagnostic al carcinoamelor cutanate non-melanocitare se regăseşte atât în stabilirea diagnosticului final, cât şi în utilizarea informaţiilor obţinute prin intermediul lor pentru alegerea parcursului terapeutic optim pentru aceşti pacienţi, reducând totodată morbiditatea şi costurile asociate procedurilor invazive de diagnostic.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Alam M, Nanda S, Mittal BB, Kim NA, Yoo S. The use of brachytherapy in the treatment of nonmelanoma skin cancer: A review. J Am Acad Dermatol. 2011; 65:377-388.
- Lo JS, Snow SN, Reizner GT, Mohs FE, Larson PO, Hruza GJ. Metastatic basal cell carcinoma: Report of twelve cases with a review of the literature. J Am Acad Dermatol. 1991;24:715-719.
- Burton KA, Ashack KA, Khachemoune A. Cutaneous Squamous Cell Carcinoma: A Review of High-Risk and Metastatic Disease. American Journal of Clinical Dermatology. 2016;17(5):491-508.
- Samarashinge V, Madan V, Lear JT. Management of high-risk squamous cell carcinoma of the skin. Expert Rev Anticancer Ther. 2011;11:763-769.
- Macbeth AE, Grindlay DJ, Williams HC. What’s new in skin cancer. An analysis of guidelines and systematic reviews published in 2008-2009? Clin Exp Dermatol. 2011;36:453-458.
- Zak-Prelich M, Narbutt J, Sysa-Jedrzejowska A. Environmental risk factors predisposing to the development of basal cell carcinoma. Dermatol Surg. 2004;30:248-252.
- Smeets NW, Kuijpers DI, Nelemans P, et al. Mohs’ micrographic surgery for treatment of basal cell carcinoma of the face – results of a retrospective study and review of the literature. Br J Dermatol. 2004;151:141-147.
- Xie J, Murone M, Luoh SM, et al. Activating smoothened mutations in sporadic basal-cell carcinoma. Nature. 1998;391:90-92.
- Euvrard S, Kanitakis J, Claudy A. Skin cancers after organ transplantation. N Eng J Med. 2003;348:1681-1691.
- Rubin AI, Chen EH, Ratner D. Basal-cell carcinoma. N Engl J Med. 2005;353:2262-2269.
- Alam M, Ratner D. Cutaneous squamous-cell carcinoma. N Engl J Med. 2001;344:218s-219s.
- Kenet RO, Kang S, Kenet BJ, Fitzpatrick TB, Sober AJ, Barnhill RL. Clinical diagnosis of pigmented lesions using digital epiluminescence microscopy. Grading protocol and atlas. Arch Dermatol. 1993;129:157–174.
- Lallas A, Apalla Z, Argenziano G, Longo C, Moscarella E, Specchio F, Raucci M, Zalaudek I. The dermatoscopic universe of basal cell carcinoma. Dermatology practical & conceptual. 2014;4(3):11-24.
- Argenziano G, Soyer HP, Chimenti S, Talamini R, Corona R, Sera F, et al. Dermoscopy of pigmented skin lesions: results of a consensus meeting via the Internet. J Am Acad Dermatol. 2003;48:679-693.
- Miller SJ, Moresi JM. Actinic keratosis, basal cell carcinoma and squamous cell carcinoma. In: Bolognia Jl, Jorizzo Jl., Rapini RP. eds. Dermatology. london: Mosby. 2003;1677–1696.
- Menzies SW, Westerhoff K, Rabinovitz H, Kopf AW, McCarthy WH, Katz B. Surface microscopy of pigmented basal cell carcinoma. Arch Dermatol. 2000;136: 1012-1016.
- Zalaudek I, Argenziano G, Leinweber B, et al. Dermoscopy of Bowen’s disease. Br J Dermatol. 2004;150(6):1112-1116.
- Longo C, Zalaudek I, Argenziano G, Pellacani G. New directions in dermatopathology: in vivo confocal microscopy in clinical practice. Dermatol Clin. 2012;30:799-814.
- Lupu M, Caruntu C, Solomon I, et al. The use of in vivo reflectance confocal microscopy and dermoscopy in the preoperative determination of basal cell carcinoma histopathological subtypes. Dermato-venerologie. 2017;62(4):265-275.
- Diaconeasa A, Boda D, Neagu M, Constantin C, Căruntu C, Vlădău L, et al. The role of confocal microscopy in the dermato–oncology practice. J Med Life. 2011;4(1):63.
- Caruntu C. Evaluation through in vivo reflectance confocal microscopy of the cutaneous neurogenic inflammatory reaction induced by capsaicin in human subjects. Journal of Biomedical Optics. 2012;17(8):085003.
- Căruntu C, Boda D, Căruntu A, Rotaru M, Baderca F, Zurac S. In vivo imaging techniques for psoriatic lesions. Romanian journal of morphology and embryology. 2014;55(Suppl 3):1191-6.
- Ali FR, Craythorne EE. Integration of reflectance confocal microscopy into clinical practice for the management of lentigo maligna. Clinical and Experimental Dermatology. 2017;42(5):593-5.
- Agozzino M, Gonzalez S, Ardigò M. Reflectance Confocal Microscopy for Inflammatory Skin Diseases. Actas Dermo-Sifiliográficas. 2016;107(8):631-9.
- Ulrich M, Zalaudek I, Welzel J. Shining into the White: The Spectrum of Epithelial Tumors from Actinic Keratosis to Squamous Cell Carcinoma. Dermatologic clinics. 2016;34(4):459-67.
- Rowe DE, Carroll RJ, Day CL. Long-term recurrence rates in previously untreated (primary) basal cell carcinoma: Implications for patient follow-up. J Dermatol Surg Oncol. 1989;15:315-328.
- Wolf DJ, Zitelli JA. Surgical margins for basal cell carcinoma. Arch Dermatol. 1987;123:340-344.
- Brodland DG, Zitelli JA. Surgical margins for excision of primary cutaneous squamous cell carcinoma. J Am Acad Dermatol. 1992;27:241-248.
- Telfer NR, Colver GB, Morton CA – British Association of Dermatologists. Guidelines for the management of basal cell carcinoma. Br J Dermatol. 2008;159:35-48.
- Kuflik EG. Cryosurgery for skin cancer: 30-year experience and cure rates. Dermatol Surg. 2004;30:297-300.
- Quirk C, Gebauer K, De’Ambrosis B, Slade HB, Meng TC. Sustained clearance of superficial basal cell carcinomas treated with imiquimod cream 5%: Results of a prospective 5-year study. Cutis. 2010;85:318-324.
- Romagosa R, Saap L, Givens M, Salvarrey A, He JL, Hsia SL, et al. A pilot study to evaluate the treatment of basal cell carcinoma with 5-fluorouracil using phosphatidyl choline as a transepidermal carrier. Dermatol Surg. 2000;26:338-340.
- Morton CA, McKenna KE, Rhodes LE – British Association of Dermatologists Therapy Guidelines and Audit Subcommitte and the British Photodermatology Group. Guidelines for topical photodynamic therapy: Update. Br J Dermatol. 2008;159:1245-1266.
- Stebbins WG, Hanke CW. MAL-PDT for difficult to treat nonmelanomas skin cancer. Dermatol Ther. 2011;24:82-93.
- LeBoeuf NR, Schmults CD. Update on the management of high-risk squamous cell carcinoma. Semin Cutan Med Surg. 2011;30:26-34.