Introducere
Durerea în gât este simptomul care apare în contextul unei inflamaţii sau infecţii la nivelul faringelui sau al laringelui. Cea mai frecventă afecţiune la acest nivel este faringita acută. Faringita acută reprezintă una dintre principalele cauze de adresabilitate la medic(1).
Apariţia inflamaţiei la nivelul mucoasei faringiene poate avea la bază un mecanism viral sau bacterian. Componenta virală este cea mai întâlnită (85-95% dintre cazuri la adulţi, 70% la copiii între 5 şi 16 ani, 95% la copiii mai mici de 5 ani)(2,3), faringita acută apărând în acest caz în contextul răcelii comune sau al unei infecţii de tract respirator superior. Infecţia bacteriană survine în aproximativ 10% dintre cazuri, cel mai frecvent germene fiind streptococul hemolitic de grup A(2).
Simptomatologia este variată în cazul inflamaţiilor faringiene, durerea în gât putând fi acompaniată de dificultate la înghiţit, odinofagie, senzaţie de gât umflat, senzaţie de uscăciune sau de arsură faringiană.
Mecanismul fiziopatologic al durerii în gât
Faringele este o structură musculară, peretele faringian fiind alcătuit din mai multe straturi: mucoasa epitelială, membrana bazală, lamina propria şi submucoasa.
Prima barieră fizică şi imunologică care protejează mucoasa faringiană este reprezentată de mucusul care tapetează mucoasa, iar clearance-ul mucociliar acţionează ca un mecanism fiziologic de protecţie împotriva agenţilor patogeni(4,5).
Mucoasa epitelială este formată dintr-un epiteliu scuamos stratificat şi reprezintă a doua barieră între flora patogenă şi straturile profunde. Celulele epiteliale din structura epiteliului îndeplinesc două funcţii importante – de protecţie şi imunologică(6,7). Pe lângă celulele epiteliale, la nivelul mucoasei epiteliale există şi celule inflamatorii (limfocite, mastocite, leucocite polimorfonucleare).
Alături de acestea, keratinocitele din structura mucoasei pot secreta celule proinflamatorii (Il-1, Il-8), care au rolul de a recruta limfocitele şi leucocitele în epiteliu(8). Prin această acţiune, limfocitele se activează şi se transformă în celule T limfocitare, cu rol important în procesul inflamator.
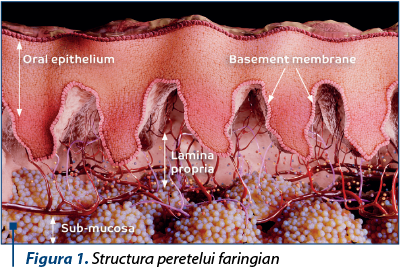
Cel de-al doilea strat cu un rol deosebit de important în statusul imun orofaringian este lamina propria. Din punct de vedere structural, lamina propria conţine o varietate de celule, cum ar fi macrofagele, fibroblaştii, mastocitele şi o serie de celule inflamatorii(9). Dacă fibroblaştii au rol structural, menţinând integritatea tisulară, celelalte grupe celulare au rol protector şi imunologic. Macrofagele sunt implicate în răspunsul imunologic local prin ingestia agentului patogen şi în producerea de citokine şi chemokine cu rol în repararea tisulară(10). La rândul lor, mastocitele, care sunt situate la nivelul membranei bazale a celulelor endoteliale, participă în diferitele etape ale procesului inflamator.
În mod normal, celulele inflamatorii se găsesc în număr mai mic la nivelul laminei propria, înmulţirea acestora pe fond inflamator ducând la eliberarea de citokine şi influenţarea secundară a reacţiilor de la nivelul epiteliului(9). În faza acută creşte numărul leucocitelor polimorfonucleare şi al macrofagelor, ca răspuns la infecţia virală sau bacteriană a mucoasei bucale şi orofaringiene(11).
Atât la nivelul mucoasei epiteliale, cât şi în lamina propria se află o bogată reţea de fibre nervoase, în marea lor majoritate senzoriale. Terminaţiile nervoase senzoriale, cunoscute şi sub denumirea de nociceptori, participă la iniţierea senzaţiei dureroase(12). Pe lângă factorii exogeni, nociceptorii pot fi stimulaţi şi de factori endogeni proveniţi în urma reacţiei inflamatorii locale (serotonina, histamina, citokinele, bradikinina etc.)(9).
Având în vedere toate cele de mai sus, putem spune că durerea în gât apare ca un răspuns imun local al tractului respirator superior la infecţia virală sau bacteriană(13,14). Deci înţelegerea fiziopatologiei durerii de gât este deosebit de importantă, având în vedere că tratamentul este de cele mai multe ori simptomatic.
În urma iritaţiei produse de stimulul viral sunt stimulate macrofagele, primele care anunţă răspunsul inflamator de fază acută prin eliberarea de citokine şi apariţia celulelor proinflamatorii(15). În urma acestui proces se declanşează răspunsul inflamator local şi sistemic(16). Bradikinina şi prostaglandinele eliberate prin apariţia inflamaţiei acţionează asupra nociceptorilor de la nivelul epiteliului şi al laminei propria, având drept rezultat apariţia durerii în gât(17,18).
Acţiunea compuşilor antiinflamatori
Fiind de cele mai multe ori o reacţie inflamatorie generată de un virus, tratamentul antibiotic nu reprezintă prima indicaţie în cazul durerii faringiene. Utilizarea pe scară largă a antibioticelor în cazurile de faringită sau rinofaringită acută virală a dus la o creştere dramatică a rezistenţei la antibiotice în lume, inclusiv în România, fenomen semnalat şi de Organizaţia Mondială a Sănătăţii(19). Administrarea tratamentului antibiotic este indicată doar în cazurile în care se confirmă infecţia bacteriană.
De cele mai multe ori este nevoie de un tratament simptomatic care are ca scop, în primul rând, reducerea eficientă şi rapidă a intensităţii senzaţiei dureroase. Antiinflamatoarele nesteroidiene sistemice pot fi utile, dar practica medicală arată că administrarea topică, direct la locul inflamaţiei, generează o scădere mult mai rapidă a durerii şi are un risc scăzut de toxicitate(20-22). Produsele folosite local pot fi sub formă de spray sau pastilă pentru supt (lozenge). Compuşii sub formă de lozenge eliberează ingredientele la nivelul cavităţii bucale şi al faringelui în decurs de 3-5 minute, în timp ce aplicarea unui spray se face direct la nivelul peretelui posterior faringian prin eliberarea unei doze unice(20,23).
O utilizare din ce în ce mai eficace o reprezintă produşii de tipul flurbiprofenului, care acţionează atât ca un antiinflamator nesteroidian, cât şi ca analgezic(24,25).
Flurbiprofenul eliberat la nivelul cavităţii bucale şi al orofaringelui se absoarbe rapid la nivelul mucoasei. Aceasta are loc printr-un proces difuzional pasiv, rata sa de absorbţie fiind dependentă de pH-ul local(26). Turner et al. au arătat că, după aplicarea locală, flurbiprofenul are capacitatea de a difuza în straturile profunde, substanţa putând fi detectată în mucoasa orofaringiană la 10 minute după administrare(27).
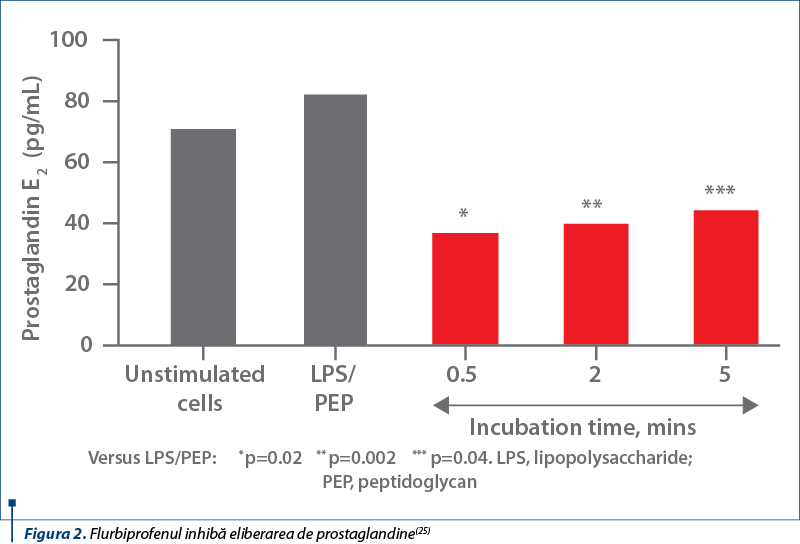
Flurbiprofenul acţionează asupra reacţiei inflamatorii prin blocarea celulelor proinflamatorii de tipul prostaglandinelor şi leucotrienelor. Ca urmare a acestui mecanism se produc o diminuare a vasodilataţiei locale şi o scădere a extravazării tisulare, acţiuni care au ca rezultat şi o scădere a stimulării nociceptorilor de la nivelul epiteliului şi al laminei propria(28). Fiind un antiinflamator nesteroidian, flurbiprofenul inhibă ciclooxigenaza şi canalele ionice prezente la nivelul nociceptorilor, reducând până la dispariţie transmiterea senzaţiei dureroase(29).
Eficacitatea flurbiprofenului în tratamentul durerii de gât
În literatura de specialitate există numeroase studii care susţin tratamentul local cu antiinflamator nesteroidian, respectiv flurbiprofen, în cazul durerii în gât(23,30-35).
Radkova et al.(23), într-un studiu dublu-orb multicentric efectuat în 2017, au testat eficacitatea flurbiprofenului 8,75 mg sub formă de spray şi lozenge în tratamentul durerii în gât apărute în contextul unei infecţii de tract respirator superior. Rezultatele au arătat că singurul avantaj al produsului sub formă de spray a fost eliberarea unei singure doze la nivelul inflamaţiei şi durerii. Atât flurbiprofenul lozenge, cât şi cel spray au avut eficacitate şi siguranţă egale în diminuarea intensităţii senzaţiei dureroase, eficacitatea la două ore de la administrare fiind aceeaşi în ambele loturi de pacienţi. Rezultate similare au fost raportate şi de Burova et al.(30)
Într-un studiu randomizat, dublu-orb, placebo controlat, efectuat pe 198 de pacienţi cu durere în gât moderată sau severă, Schachtel et al. au evaluat eficacitatea flurbiprofenului lozenge(31). Autorii au urmărit subiectiv intensitatea durerii în gât (Sore Throat Pain Intensity Scale), dificultatea la înghiţire (Difficulty Swallowing Scale), precum şi senzaţia de gât umflat (Swollen Throat Scale), înainte de tratament apoi la o oră şi la două ore după administrarea primei doze; la fiecare oră în primele 24 de ore, apoi la una şi la două ore după administrare din ziua a doua până în ziua a şaptea. Imediat după prima doză administrată s-a observat o scădere semnificativă statistic a senzaţiei dureroase în grupul pacienţilor care au primit flurbiprofen (p<0,01).
La 24 de ore, pacienţii din grupul de studiu au raportat o reducere semnificativă a simptomatologiei comparativ cu placebo – 59% reducerea intensităţii durerii, 45% reducerea dificultăţii la înghiţit, 44% reducerea senzaţiei de gât umflat (p<0,001). După 7 zile de administrare s-a raportat o reducere cu 38% a durerii, o îmbunătăţire cu 36,9% a deglutiţiei şi cu 45% a senzaţiei de gât umflat în cazul grupului de studiu comparativ cu placebo. Studiul a demonstrat eficacitatea ridicată a flurbiprofenului lozenge, fără efecte adverse semnificative.
Aceeaşi eficienţă a flurbiprofenului lozenge a fost demonstrată şi de Aspley et al.(32) Studiul dublu-orb randomizat, efectuat pe 124 de pacienţi trataţi cu flurbiprofen lozenge sau cu placebo, un comprimat la 3-6 ore, a arătat că după 24 de ore de la administrare în grupul de studiu intensitatea durerii era redusă cu 79,8%, reducerea dificultăţii la înghiţit cu 99,6% şi a senzaţiei de gât umflat cu 69,3% faţă de placebo (p<0,01).
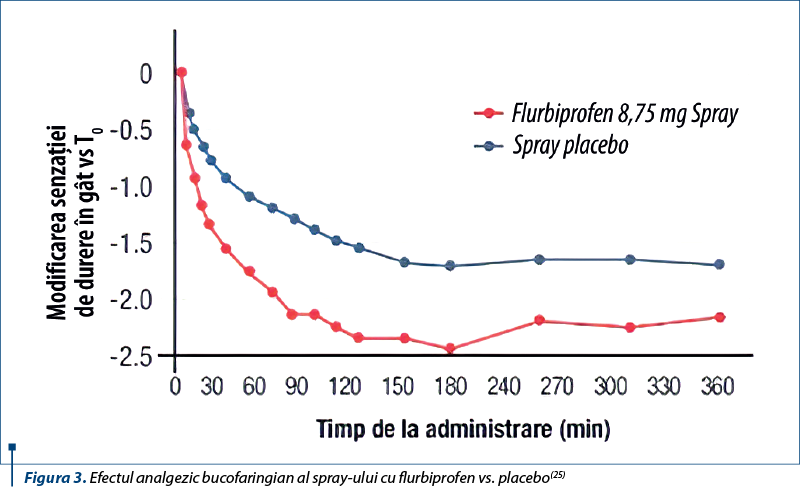
În ceea ce priveşte flurbiprofenul spray, de Looze et al.(33) i-au evaluat eficienţa şi siguranţa într-un studiu randomizat, dublu-orb, placebo controlat, efectuat pe 505 pacienţi (249 grupul de studiu, 256 grupul placebo). Pacienţii din grupul de studiu au relatat o scădere a intensităţii durerii în gât în aproximativ 20 de minute (p<0,01), a dificultăţii la înghiţit în 5 minute (p<0,05), a senzaţiei de gât umflat în 30 de minute (p<0,001), cu durata până la 6 ore comparativ cu placebo. Reacţiile adverse raportate nu au fost semnificative. Pe de altă parte, conform lui Russo et al.(34), flurbiprofenul spray reduce semnificativ durerea în gât până la 5 ore comparativ cu placebo (p<0,05).
Experienţa personală susţine studiile prezentate anterior. Utilizarea flurbiprofenului, atât sub formă de spray, cât şi lozenge, în tratamentul simptomatic al faringitei sau al amigdalitei acute (forma virală sau bacteriană) a contribuit încă de la prima administrare la diminuarea durerii în gât, a odinofagiei şi a dificultăţii la înghiţit, indiferent de intensitatea simptomatologiei.
Având în vedere dublul efect al flurbiprofenului, antiinflamator şi antialgic, l-am introdus în schema de tratament după intervenţii chirurgicale minim invazive la nivelul orofaringelui (criptoliză LASER sau radiofrecvenţă, uvulopalatoplastie LASER, rigidizare văl palatin). Administrat timp de 5-7 zile, la 3-6 ore/24 de ore, atât forma spray, cât şi cea lozenge ajută la diminuarea intensităţii durerii în gât şi a odinofagiei, efectul fiind de durată (până la 4 ore de la administrare). Eficacitatea flurbiprofenului spray/lozenge în tratamentul durerii faringiene acute postoperatorii este susţinută şi de literatura de specialitate(36-39).
Reacţiile adverse raportate de pacienţi au fost minore, aceştia relatând o uşoară accentuare a iritaţiei faringiene imediat după prima administrare, durere de cap sau febră, ultimele două fiind întâlnite mai mult în contextul simptomatologiei fireşti a unei faringite sau amigdalite acute.
Concluzii
Având în vedere experienţa clinică, se poate spune că flurbiprofenul spray şi pastile pentru supt (lozenge) reprezintă un tratament eficient pentru durerea de gât prin acţiunea lor de durată (până la 6 ore), prin profilul de siguranţă ridicat şi prin acţiunea atât asupra senzaţiei dureroase, cât şi asupra senzaţiei de gât umflat şi a odinofagiei.
Conflict of interests: The authors declare no conflict of interests.