There are countless skin lesions that can bring the small patient to the consultation. Sometimes the appearance of the lesions is highly suggestive of a disease, sometimes the anamnesis is the one that helps us significantly in establishing the diagnosis. For maximum accuracy in establishing the diagnosis and therapy, the consultation is mandatory to be complete.
We will take into account the appearance and localization of the rash, the clinical evolution and associated symptoms, such as pruritus or fever, localization with endemic diseases such as chicken pox, for example, residing in unhealthy conditions (increases the possibility of having scabies, pediculosis, bacterial, fungal or viral infections). The morphology and distribution of the lesions are the key features that help to establish the diagnosis. Sometimes lab tests or even skin biopsies may be needed. Any skin lesion is accompanied by the concern of the parents, but also of the children, and in the case of adolescents the worries of being excluded from the social group may arise. The term dysmorphophobia describes the irrational, persistent, pathological fear of becoming deformed, centered on the illusion of total or partial modification of the body pattern(1) and this condition is increasingly encountered in medical practice.
Diagnosticul principalelor erupţii cutanate la copil
Diagnosis of main rashes in children
First published: 15 decembrie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.3.4.2019.2754
Abstract
Rezumat
Sunt nenumărate leziuni cutanate care pot să aducă micul pacient la consultaţie. Uneori aspectul leziunilor este înalt sugestiv pentru o boală, alteori anamneza este cea care ne ajută semnificativ în stabilirea diagnosticului. Pentru o acurateţe maximă în stabilirea diagnosticului şi a conduitei terapeutice, consultaţia este obligatoriu să fie completă.
Vom ţine seama de aspectul şi localizarea erupţiei, de evoluţia clinică şi simptomele asociate, cum sunt pruritul sau febra, de localizări cu boli endemice ca varicela, de exemplu, de domicilierea în spaţii insalubre (creşte posibilitatea de a avea scabie, pediculoză, infecţii bacteriene, fungice, virale). Morfologia şi distribuţia leziunilor sunt trăsăturile-cheie care ajută la stabilirea diagnosticului. Uneori pot fi necesare şi teste de laborator sau chiar biopsie cutanată. Orice leziune cutanată este însoţită de îngrijorarea părinţilor, dar şi a copiilor, iar în cazul adolescenţilor poate apărea teama de a fi excluşi din grupul social. Termenul de dismorfofobie descrie teama iraţională, persistentă, patologică de a deveni diform, centrată pe iluzia de modificare totală sau parţială a schemei corporale(1), iar această afecţiune este tot mai frecvent întâlnită în practica medicală.
Principalul loc de desfăşurare a interacţiunii dintre organism şi mediul extern, pielea serveşte ca barieră protectoare, prevenind diverse traume ale ţesuturilor interne produse mecanic sau de radiaţii ultraviolete, temperaturi extreme, toxine sau microorganisme patogene.
Când pacientul se prezintă la medic pentru leziuni cutanate, există câteva întrebări importante care trebuie puse:
-
De cât timp este erupţia prezentă?
-
Cum a arătat când a apărut prima oară? Cu ce este diferită acum?
-
Care a fost evoluţia şi progresia bolii? Unde a apărut prima oară şi unde este acum?
-
Ce simptome s-au asociat cu apariţia leziunii? De exemplu, prurit, senzaţie de arsură, durere, sensibilitate crescută sau simptome sistemice (febră, dureri articulare etc.).
-
Au fost alţi membri ai familiei afectaţi de leziuni similare?
-
A mai prezentat pacientul vreodată o astfel de erupţie? Dacă da, care au fost tratamentul şi răspunsul la tratament?
-
Ce consideră pacientul sau părinţii că a cauzat erupţia?
-
S-a expus pacientul la ceva nou sau diferit (medicaţie, produse de îngrijire personală)?
-
Ce impact are erupţia cutanată asupra vieţii pacientului?
-
Ce tratamente s-au folosit şi care a fost răspunsul?
-
Are pacientul vreo condiţie medicală acută sau cronică? A administrat vreun tratament, fie el medicament OTC sau chiar remedii naturiste? Are pe cineva în familie cu probleme de piele sau cancere cutanate? Are vreo alergie? Are animal de companie? Are factori de risc pentru boli cu transmitere sexuală (atenţie la adolescenţi)?
Antecedentele personale patologice pot să aibă şi ele importanţă: utilizarea de cosmetice sau anumite tipuri de textile (pentru dermatita de contact), obiceiurile alimentare (consumul de gluten, cu exacerbare a dermatitei herpetiforme), istoricul recreaţional, istoricul menstrual (urticaria cu exacerbare la progesteron).
Examenul obiectiv al unui pacient care se prezintă cu leziuni cutanate include inspecţia vizuală şi palparea pielii în scopul evaluării următoarelor trăsături: morfologia leziunilor individuale, distribuţia leziunilor, culoarea, consistenţa, numărul lor, gruparea leziunilor (grupate, liniare, confluente sau zosteriforme). Pentru clinicianul cu experienţă, inspecţia vizuală poate oferi uneori un diagnostic instantaneu. Cu toate acestea, o astfel de recunoaştere a modelului aparent fără efort este de fapt un proces de „raţionament nonanalitic” extrem de complex, în care componentele individuale sunt analizate separat(2). Pe pielea închisă la culoare (tipurile Fitzpatrick III până la VI), intens pigmentată, eritemul este mult mai dificil de identificat; el poate avea un aspect maro-închis(3), iar leziunile descuamative au un aspect gri-violaceu sau maro. De asemenea, şi teleangiectaziile sunt mai greu de identificat pe pielea închisă la culoare. Leziunile de urticarie pot avea aceeaşi culoare sau pot fi uşor mai deschise la culoare, în funcţie de gradul edemului, iar purpura poate fi dificil de observat. Palparea pielii are şi ea un rol important în diagnosticarea bolilor cutanate prin furnizarea de informaţii privind temperatura, textura, consistenţa şi mobilitatea faţă de planurile subiacente. Digitopresiunea sau vitropresiunea sunt utile în diagnosticul diferenţial al leziunilor cu implicare vasculară. Lampa Wood este o sursă de lumină ultravioletă, utilă în examinarea pielii, de exemplu în diagnosticul eritrasmei, unde zonele afectate au aspect roz fluorescent. În cadrul examinării pielii se mai poate folosi şi dermatoscopia, utilă mai ales în evaluarea leziunilor pigmentare, dar tot mai frecvent utilizată şi în evaluarea altor tipuri de leziuni.
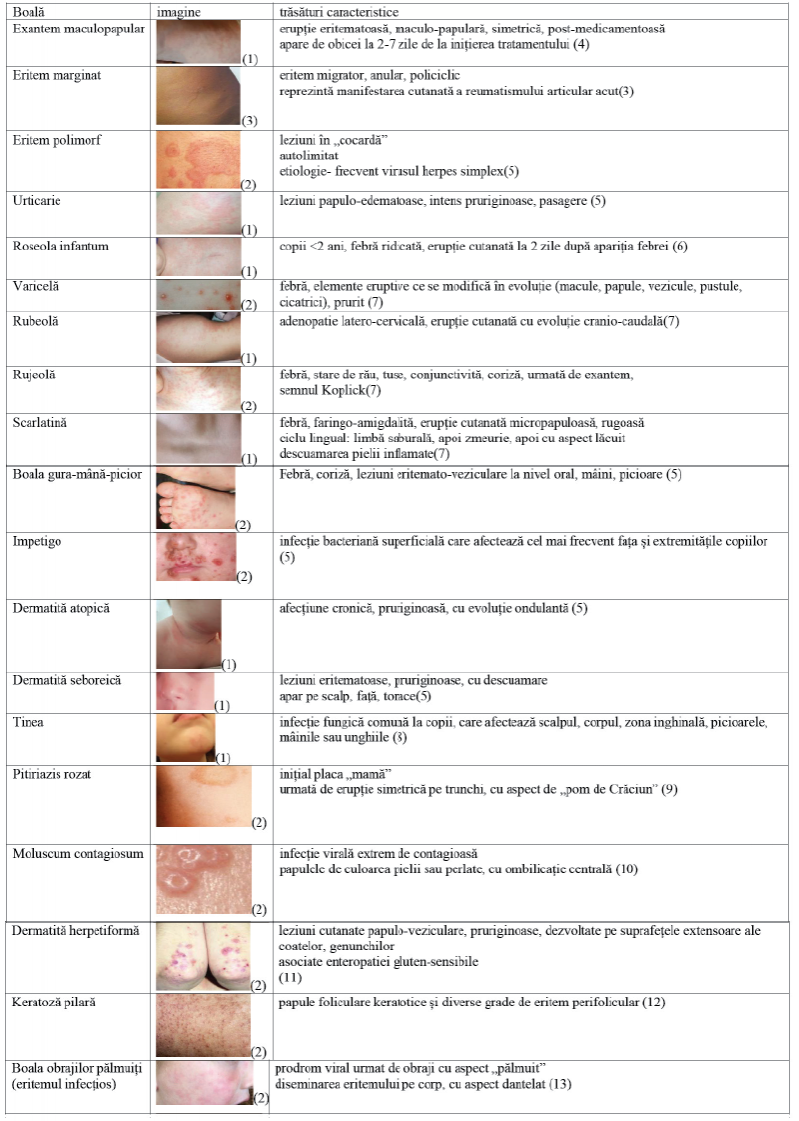
Exantemul maculopapulos
Ca reacţie adversă medicamentoasă, exantemul – sau erupţia medicamentoasă maculo-papulară – este una dintre cele mai frecvente tipuri de reacţii medicamentoase, constituind 95% dintre reacţiile medicamentoase cu manifestări cutanate, în timp ce urticaria indusă medicamentos reprezintă doar 5% din reacţiile cutanate induse medicamentos. Reacţiile induse medicamentos se produc la până la maximum 5% dintre pacienţii expuşi la medicamente, mai ales la antibiotice (1-8%)(4).
Examenul obiectiv relevă o erupţie eritematoasă, maculară sau papulară, simetrică, ce apare de obicei la aproximativ 7 zile de la iniţierea tratamentului sau, la pacienţii sensibilizaţi anterior, chiar în primele 1-2 zile de tratament. În cazul unor medicamente precum anticonvulsivantele sau alopurinolul, erupţia poate apărea chiar şi la 3 săptămâni de la iniţierea tratamentului. Mucoasele pot fi afectate în formele severe de boală.
Mecanismul imunologic implicat în producerea exantemului este imunologic şi se consideră că ar fi de tip întârziat, de hipersensibilitate de tip IV, mediat celular de către limfocitele T, cu activarea altor tipuri de celule: eozinofile, neutrofile, macrofage. Medicamentele sau metaboliţii acestora acţionează ca haptene, formând legături covalente cu o proteină şi devenind astfel antigen. Medicamentele pot însă interacţiona cu receptori specifici şi pot activa celulele imunitare în mod direct, potrivit conceptului p-i (interacţiune farmacologică cu receptori imunitari)(5).
Medicamentele care pot cauza astfel de reacţii mediate celular sunt numeroase, dar cel mai frecvent sunt implicate penicilinele şi cefalosporinele prin nucleul betalactamic şi/sau prin catena laterală(6). La majoritatea medicamentelor nu se cunoaşte particula antigenică (de exemplu, la macrolide, tuberculostatice, inhibitori de pompă de protoni).
Pentru alte medicamente este necesară formarea de metaboliţi pentru a produce reacţii (antiinflamatoare nesteroidiene, trimetoprim-sulfametoxazol, carbamazepină, fenitoină). Medicamentele care au fost introduse într-o perioadă de 1-4 săptămâni anterior reacţiei sau care au fost administrate anterior şi apoi reintroduse au şanse mai mari de a fi vinovate de producerea reacţiilor decât cele administrate neîntrerupt(7). Pe lângă predispoziţia genetică, s-a constatat că există boli concomitente predispozante pentru dezvoltarea de reacţii medicamentoase, cum sunt imunodeficienţele, infecţiile cu citomegalovirus, cu virus Epstein-Barr sau cu virusurile herpetice HHV-6 şi 7, medicaţie concomitentă (valproat de sodiu, lamotrigină)(8).
Ca tablou clinic, exantemul indus medicamentos se prezintă în general cu macule şi papule, foarte rar cu pustule sau bule (ridică suspiciunea de dezvoltare de pustuloză exantematoasă acută generalizată – AGEP), şi predominant implică trunchiul şi proximal extremităţile. Apariţia leziunilor mucoase (orale, genitale) este rară şi ridică suspiciunea de sindrom Stevens-Johnson (SJS) sau de epidermoliză toxică necrotică (TEN). Leziunile pot fi însoţite de prurit, febră, eozinofilie şi creşterea proteinelor de fază acută (leziunile extinse asociate cu simptomele sistemice şi prezenţa eozinofiliei ridică suspiciunea de sindrom DRESS (reacţie medicamentoasă cu eozinofilie şi simptome sistemice – drug rash with eosinophilia and systemic symptoms).
Exantemul apare de obicei în primele 5-14 zile de la iniţierea tratamentului (chiar dacă tratamentul s-a încheiat) sau chiar în prima zi de tratament la pacienţii deja sensibilizaţi.
Evoluţia exantemului maculopapulos trebuie monitorizată regulat în faza iniţială, pentru a exclude semne precoce de DRESS, SJS/TEN sau AGEP. Un diagnostic de eritem maculopapulos este păstrat datorită evoluţiei benigne şi tabloului clinic.
Semne de pericol timpuriu specifice care indică SJS/TEN sunt: vezicule sau cruste minuscule, culoarea gri-violacee sau închiderea la culoare a leziunilor, eritrodermizarea, edemul facial, pielea sau mucoasele dureroase sau cu senzaţie de arsură, pe lângă febră (>38,5 °C) şi stare de rău. Pacienţii trebuie informaţi că, dacă apar oricare dintre aceste semne, trebuie să solicite asistenţă medicală imediată.
Când sunt prezente eroziuni hemoragice ale mucoaselor şi descuamări, reacţia este în mod evident mai severă şi trebuie luat în considerare diagnosticul diferenţial cu SJS/TEN şi cu alte afecţiuni buloase. În cazurile de DRESS, leziunile cutanate pot apărea ca eritem maculopapulos timp de câteva zile, dar progresia spre peste 50% din suprafaţa corpului ar trebui să îndemne la alte mijloace diagnostice, cum ar fi verificarea repetată a valorilor de laborator (hemoleucograma cu formulă leucocitară completă, transaminaze, creatinină etc.). Edemul facial poate apărea în DRESS, precum şi în AGEP, iar hemoleucograma le poate diferenţia prin relevarea eozinofiliei sau, respectiv, a neutrofiliei.
Dintre reacţiile adverse medicamentoase cu manifestare cutanată severă, AGEP este mai puţin probabil să fie diagnosticat greşit ca exantem/eritem maculopapulos în fazele incipiente, deoarece se prezintă în mod obişnuit cu zone mai mari de eritem, deseori predominant în pliurile corpului şi ale membrelor. Zeci de pustule nonfoliculare apar de obicei în 1-2 zile după apariţia eritemului. Febra acută de 38,5 °C şi mai mare este, de obicei, observată în AGEP, DRESS şi SJS/TEN, dar rareori poate însoţi şi eritemul maculopapulos(9).
Diagnosticul este în general clinic, susţinut de istoricul bolii, de examenele de laborator şi uneori de examenul histopatologic (recomandat acolo unde se suspicionează că erupţia nu este indusă medicamentos sau în cazurile severe), dar şi de rezoluţia eritemului după stoparea tratamentului cu medicamentul incriminat – de obicei, în decurs de 7-14 zile.
Tratamentul este simptomatic cu antihistaminice şi corticosteroizi topici, după ce în primă instanţă s-a stopat administrarea medicamentului suspicionat a fi trigger. Nu se recomandă de rutină administrarea de corticosteroid sistemic decât în cazurile severe, unde doza este de 1-2 mg/kgc/zi, timp de 7-10 zile. Când se consideră că medicamentul care a provocat erupţia este absolut necesar, se pot încerca continuarea administrării acestuia şi tratarea concomitentă a erupţiei. Sigur că în acest caz există riscul agravării reacţiei! Pentru o astfel de conduită există însă dovezi limitate şi trebuie estimate foarte atent riscurile versus beneficiile(10).
Urticaria
Urticaria se caracterizează prin apariţia de leziuni maculopapuloase şi de plăci cu caracter efemer la nivelul pielii. Leziunile profunde ale pielii sau ale mucoasei constituie angioedemul. Maculele, papulele şi plăcile urticariene sunt eritematoase, pruriginoase, în timp ce angioedemul este adesea dureros, mai puţin bine definit şi nu arată nicio schimbare de culoare. Urticaria poate fi acută sau cronică(11).
Urticaria acută (cu durată <6 săptămâni) este cauzată de infecţiile de tract respirator superior (40%), medicamente (9%), alimente (1%) şi rămâne idiopatică în 50% dintre cazuri(12). Urticaria cronică este în doar 5% dintre cazuri asociată cu infecţii, 5% asociată cu pseudoalergii, în 25% dintre cazuri este inductibilă, în 20% dintre cazuri e asociată cu autoimunitate, iar în 45% dintre cazuri rămâne idiopatică. Urticaria se clasifică, în funcţie de modalitatea de apariţie, în urticarie spontană şi urticarie inductibilă, unde sunt incluse dermografismul simptomatic, urticaria la frig, urticaria presională tardivă, urticaria solară, urticaria la cald, angioedemul vibrator, urticaria colinergică, urticaria de contact şi urticaria aquagenică.
Deficitul de C1 inhibitor de esterază trebuie luat în considerare drept cauză a angioedemului recurent fără urticarie.
Diagnosticul urticariei se bazează în principal pe istoric şi pe examenul clinic. Determinarea etiologiei sau a factorilor declanşatori, precum şi excluderea altor diagnostice pot necesita investigaţii suplimentare, inclusiv analize de sânge, provocări medicamentoase şi alimentare, teste cutanate şi chiar biopsie tegumentară.
Diagnosticul diferenţial include urticaria papulară sau prurigo postînţepătură de insectă, sindroamele autoinflamatorii (Muckle Wells, sindromul autoinflamator familial la rece, sindroame periodice asociate criopirinelor), sindromul Schnitzler, pemfigoidul bulos în faza prebuloasă, anafilaxia indusă de exerciţiu fizic, urticaria vasculitică, urticaria pigmentară (urticaria care poate apărea când leziunile maculopapuloase pigmentare sunt fricţionate) şi angioedemul fără urticarie – indus de inhibitorii de enzimă de conversie a angiotensinei şi angioedemul ereditar(13).
Leziunile de urticarie sunt relativ uşor de diferenţiat după durata de maximum 24 de ore a leziunilor individuale. De reţinut că, în special la copiii mici, urticaria poate dezvolta un centru gri-violaceu şi poate fi confundată cu eritemul multiform(11).
Eritemul marginat
Eritemul reprezintă o modificare a culorii pielii în roz, roşu sau chiar roşu-violaceu, cauzată de dilataţia vaselor sangvine, mai ales a celor din dermul papilar şi reticular, care dispare la digitopresiune. Unele tipuri de eritem durează zile, altele doar minute. Numeroase boli se manifestă prin eritem.
Eritemul marginat (denumit şi eritemul anular reumatic sau eritem marginat reumatic) este un eritem migrator, anular, policiclic şi reprezintă manifestarea cutanată a reumatismului articular acut. Se poate asocia cu apariţia de noduli subcutanaţi, cu afectare cardiacă, poliartrită migratorie şi coreea Sydenham.
Apare mai frecvent la copii decât la adulţi, dar frecvenţa cazurilor a scăzut de când se folosesc antibioticele. Din punct de vedere clinic, după faringita streptococică iniţială, există de obicei o perioadă de latenţă de 2 până la 5 săptămâni înainte de dezvoltarea atacului acut de reumatism.
Leziunile eritemului marginatum debutează ca macule eritematoase care se răspândesc periferic şi pot deveni plăci ori pot avea aspect policiclic. Nu prezintă scuame. Leziunile sunt de obicei asimptomatice şi, pe o perioadă de 12 ore, pot migra 2-12 mm; în zonele de implicare anterioară, pielea poate părea palidă sau uşor pigmentată. Expunerea la căldură poate accentua leziunile.
Diagnosticul diferenţial include în principal urticaria şi eritemul inelar al copiilor, precum şi varianta sa – eritemul figurat neutrofilic al copiilor. Mai rar, trebuie luate în considerare boala Still, sindroamele febrile periodice ereditare (în special sindromul periodic asociat cu receptorii TNF (TRAPS), eritemul anular, boala Kawasaki şi alte afecţiuni).
Există, de asemenea, un eritem inelar cu un aspect similar cu eritemul marginatum, care precedă sau însoţeşte episoade de angioedem ereditar şi este observat doar ocazional la pacienţii cu boală de zgârietură de pisică sau psitacoză. Eritemul figurat asociat angioedemului poate fi legat de depunerile de bradinkinină din derm(11,14).
Eritemul polimorf
Eritemul polimorf este o afecţiune acută a pielii, mai rară la copii, caracterizată prin leziuni „în ţintă”. S-a descris forma minoră, cu afectarea doar a pielii, şi forma majoră, cu afectarea mucoaselor. În cazurile de formă majoră a eritemului polimorf este important de făcut diagnosticul diferenţial cu sindromul Steven-Johnson (SJS), boală distinctă, cu etiologie şi prognostic diferite(15,16).
Cauza cea mai frecventă a eritemului polimorf este infecţia, mai ales cea virală indusă de herpes simplex. Evoluţia bolii este de obicei autolimitată, rezolvându-se în câteva săptămâni fără sechele semnificative. Într-o minoritate de cazuri, boala reapare frecvent pe parcursul anilor.
Eritemul polimorf major (TEN/SJS)
Reacţiile adverse cutanate severe sunt asociate cu morbiditate şi mortalitate semnificative. Ele pot fi periculoase pentru viaţa pacientului şi dificil de tratat. Astfel de afecţiuni includ necroliza epidermică toxică (TEN), sindromul Stevens-Johnson (SJS), pustuloza exantematică generalizată acută (AGEP) şi sindromul DRESS (reacţia medicamentoasă cu eozinofilie şi simptome sistemice). Deoarece prognosticul, etiologia şi tratamentul diferitelor reacţii diferă, este important un diagnostic clar bazat pe modelul clinic specific(17).
Cauze medicamentoase de SJS semnificative au fost: etosuximida, fenitoina, fenobarbitalul, gabapentina, carbamazepina, zonisamida, clonazepam şi lamotrigina. Cauzele TEN au fost declarate ca fiind – în primul rând – gabapentina, apoi etosuximida, fenobarbitalul, carbamazepina şi zonisamida(18).
Se credea că incidenţa la copii este redusă, dar în SUA există studii efectuate pentru perioada 2009-2012, la copiii spitalizaţi, cu vârsta sub 18 ani, care arată o incidenţă de 6,3 pentru SSJ, 0,7 pentru SJS/overlap TEN şi 0,5 pentru TEN la 100000. Cea mai mare incidenţă la copii a fost la cei cu vârsta cuprinsă între 11 şi 15 ani (38,4 la 100000). TEN şi SJS/overlap TEN au fost asociate cu spitalizare mai lungă şi cu mortalitate mai mare decât sindromul Stevens-Johnson. Mortalitatea spitalicească a fost cea mai mare la copiii cu TEN şi la copiii cu vârste între 0 şi 5 ani. Concluzia studiului a fost că incidenţa sindromului Stevens-Johnson şi a necrolizei epidermice toxice la copii este mai mare decât cea raportată la adulţi şi există variaţii semnificative ale incidenţei, pe grupe de vârste(19).
Conform unei clasificări larg acceptate, SJS şi TEN sunt considerate un continuum al bolii şi se disting în principal prin severitate, în funcţie de procentul de suprafaţă corporală afectată de vezicule, bule şi eroziuni:
-
SJS este starea mai puţin severă, în care detaşarea pielii este <10% din suprafaţa corporală.
-
TEN implică o detaşare de >30% din suprafaţa corporală.
-
Overlap SJS/TEN descrie pacienţii cu detaşare de piele de 10% până la 30% din suprafaţa corporală(20,21).
Pacienţii suspectaţi de SJS şi TEN trebuie să fie internaţi pentru un management optim, în vederea determinării severităţii şi prognosticului bolii utilizându-se scorul SCORTEN. Pentru pacienţii cu detaşare extinsă a pielii şi/sau SCORTEN ≥2, se recomandă transferul la Terapie Intensivă sau la Unitatea de Arşi.
Recunoaşterea timpurie şi retragerea imediată a agenţilor medicamentoşi potenţial cauzatori sunt primii paşi critici în gestionarea SJS/TEN.
Îngrijirea de susţinere este elementul principal al tratamentului şi include îngrijirea rănilor, gestionarea fluidelor şi a electroliţilor, asistenţă nutriţională, îngrijire oculară, gestionarea temperaturii, controlul durerii şi monitorizarea sau tratamentul suprainfecţiilor. Antibioticele ghidate de antibiogramă se vor administra la primul semn de infecţie.
Ca terapie adjuvantă la debutul bolii, se utilizează ciclosporină 3-5 mg/kgc/zi (în primele 24-48 de ore). Nu se recomandă imunoglobulină intravenoasă (IVIG), iar rolul corticosteroizilor sistemici în managementul SJS/TEN rămâne incert. Rata totală de mortalitate la pacienţii cu SJS/TEN este de aproximativ 25%. Sepsisul, sindromul de detresă respiratorie acută şi insuficienţa multiplă de organ sunt cauzele cele mai frecvente de deces. Sechelele pe termen lung care implică pielea şi ochii sunt frecvente în rândul supravieţuitorilor. Din punctul de vedere al investigaţiilor de laborator, se efectuează: hemoleucogramă (HLG), glicemie, creatinină, transaminaze, Ca, proteine totale, albumină, electroliţi, VSH şi proteina C-reactivă. La copii, reacţia în lanţ a polimerazei şi/sau serologiile pentru infecţia cu Mycoplasma pneumoniae trebuie obţinute în stadiul incipient al bolii şi trei săptămâni mai târziu. Se recomandă efectuarea unei radiografii pulmonare, dat fiind riscul crescut de pneumonie. În câteva studii au fost evaluaţi – ceea ce se doreşte a fi – markeri serologici pentru diagnosticarea precoce a SJS/TEN: Fas ligand solubil, CD40 ligand solubil, granulysin, interleukina (IL)-15 şi HMGB1 (high-mobility group box 1 protein)(22,23,24).
Diagnosticul diferenţial al sindromului Stevens-Johnson/necrolizei epidermice toxice (SJS/TEN) include:
-
Eritemul polimorf se prezintă de obicei cu leziuni în ţintă tipice şi este asociat cu infecţia cu virusul herpes simplex în aproximativ 90% dintre cazuri şi numai rareori cu medicamente.
-
Eritrodermia şi erupţiile medicamentoase eritematoase – eritemul generalizat şi simetric, maculopapulos, al unei erupţii medicamentoase poate imita SJS/TEN timpuriu. Cu toate acestea, erupţiile exantematoase medicamentoase nu au afectare mucoasă şi durerea proeminentă a pielii din TEN.
-
Eritemul fix medicamentos – forma buloasă, extrem de rară, caracterizată prin bulele mari şi flasce suprapuse peste macule sau plăci roşii sau brune. Implicarea mucoasei este de obicei absentă. Remisiunea apare în general în una până la două săptămâni după întreruperea medicamentului.
-
Pustuloza exantematoasă acută generalizată (AGEP) poate fi dificil de diferenţiat de SJS/TEN; se dezvoltă, în mod obişnuit, în câteva zile de la expunerea la medicament, cel mai adesea un antibiotic betalactamic, şi se rezolvă fără tratament în una până la două săptămâni după întreruperea medicamentului. Histologic, AGEP prezintă pustule spongiforme, subcorneale şi/sau intraepidermice.
-
Erupţii fototoxice – formele severe pot fi confundate cu SJS/TEN. Din anamneză şi examen obiectiv se obţin indicii importante pentru diagnosticul corect: expunerea recentă la soare, fototoxicitatea cunoscută a unor medicamente şi localizarea leziunilor pe zonele expuse la soare.
-
„Sindromul pielii opărite” (Staphylococcal scalded skin syndrome – SSSS) este cauzat de toxinele epidermolitice produse de anumite tulpini de stafilococi şi apare de obicei la nou-născuţi şi copii mici. SSSS se prezintă cu eritem generalizat, urmat rapid de apariţia veziculelor flasce şi de descuamare. Membranele mucoase nu sunt implicate. Histologia dezvăluie afectarea straturilor superioare ale epidermei, în contrast cu scindarea subepidermică cu necroză epidermică observată în SJS/TEN.
SSSS are patru forme clinice.
1. Boala Ritter apare la nou-născut, cu evoluţie gravă, clinic – eritem generalizat dureros, cu exfoliere şi semnul Nikolsky pozitiv. Germenii toxino-producători se localizează în nazofaringe, de unde toxina este resorbită în circulaţie. Posibilele focare infecţioase sunt: artrita septică, osteomielita, pneumonia. Posibilitatea unei bacteriemii la unii copii impune efectuarea unei hemoculturi. Tratamentul constă în terapie energică cu antibiotice, atât local, cât şi general.
2. Sindromul Lyell reprezintă varianta clasică de SSSS şi este caracteristic perioadei de sugar. Este necesară dovedirea focarului stafilococic. Tratamentul se va efectua cu antibiotice pe cale orală, minimum 10 zile, la nevoie, şi rehidratare. Letalitatea este sub 5%. Sindromul Lyell poate fi declanşat şi de medicamente (antibiotice şi anticonvulsivante), în acest caz apărând în general la copilul mare, adolescent sau adult, iar diagnosticul diferenţial este dificil şi poate necesita biopsie cutanată. Când mucoasa bucală este intactă, se poate considera că etiologia nu este medicamentoasă, în special când antibioticele au fost administrate pe cale orală. În sindromul Lyell medicamentos se suprimă toate medicamentele, iar tratamentul este reprezentat de corticoterapie. Letalitatea este mult mai mare, chiar şi 30%.
3. Scarlatina stafilococică apare la copiii mai mari cu o stare de imunodeficienţă. Este similară clinic scarlatinei streptococice, dar lipseşte enantemul de la nivelul mucoasei bucale, acesta fiind elementul de bază în diagnosticul diferenţial. Uzual se prezintă ca fiind o formă uşoară de boală şi, din acest motiv, tratamentul este reprezentat de antibiotic administrat pe cale orală.
4. Impetigo bulos se manifestă clinic prin multiple leziuni pustuloase în care este prezent stafilococul auriu. Tratamentul se efectuează cu antibiotice aplicate topic(25).
O formă atipică de febră Chikungunya – caracterizată prin febră şi erupţie generalizată, cu vezicule şi eroziuni superficiale – a fost raportată la sugari şi copii mici. Are aspect SJS/TEN-like, implicarea mucoasei este în general absentă, iar rezolvarea manifestărilor cutanate apare în majoritatea cazurilor în 4-10 zile(26).
Dermatoza buloasă liniară cu IgA este o boală autoimună rară şi debutează la copil după vârsta de 5 ani. Clinic se observă bule în tensiune, cu lichid clar şi dispoziţie uneori în rozetă, pe tegument cu aspect normal sau eritematos. Histologic, prezintă bule subepidermice cu infiltrat neutrofilic dermic subiacent. Imunofluorescenţa directă arată depozite liniare de IgA, la joncţiunea dermoepidermică, uneori asociate cu C3 şi IgG(27).
Pemfigusul paraneoplazic este o afecţiune rară, mai ales la copii, clinic manifestată prin leziuni cutanate şi mucoase (oculare şi orale) severe. Acesta poate fi manifestarea iniţială a unei malignităţi sau poate apărea la un pacient cu un proces neoplazic cunoscut – boala Castleman la copii. Rata mortalităţii se apropie de 90%(28).
Eritemul infecţios (cea de-a cincea boală)
Infecţia cu parvovirusul B19 variază foarte mult ca prezentare clinică în funcţie de vârstă şi de starea imunologică şi hematologică a individului infectat. Se descriu cinci variante clinice asociate cu infecţia cu parvovirusul B19: eritemul infecţios, artropatia (mai ales la adulţi, mai frecvent la femei), infecţia fetală, criza aplastică tranzitorie şi aplazia eritocitară la persoanele imunocompromise.
În momentul apariţiei erupţiei cutanate, persoanele infectate nu mai sunt contagioase. Eritemul infecţios este caracterizat printr-o erupţie malară eritematoasă cu o paloare perilezională urmată de o erupţie dantelată pe trunchi şi extremităţi; poate fi însoţit de febră şi enantem la nivelul palatului moale şi al pilierilor amigdalieni. Palmele şi tălpile au fost cruţate invariabil. Uneori erupţia este însoţită de prurit ori poate avea caracter purpuric. Când apare la adulţi, erupţia este mai puţin caracteristică. Rezoluţia spontană a bolii apare în aproximativ 2 săptămâni(29).
Confirmarea etiologiei virale nu este, în general, esenţială pentru îngrijirea clinică în astfel de cazuri. Boala conduce la imunitate, dovedită prin prezenţa anticorpilor de tip IgG specifici antiparvovirus B19. Manifestările clasice ale parvovirusului B19 au fost observate mai rar la pacienţii cu o boală preexistentă comparativ cu pacienţii anterior sănătoşi.
Diagnosticul diferenţial al infecţiei cu parvovirusul B19 include şi alte exanteme virale, hipersensibilitate la medicamente şi artrita reumatoidă acută(30).
Roseola infantum
Roseola infantum, cunoscută şi sub denumirea de exantem subit sau a şasea boală, este o boală a copiilor mici, cu vârsta sub 2 ani, cu o prevalenţă maximă între 7 şi 13 luni de viaţă. Majoritatea cazurilor apar sporadic. Dobândirea infecţiei cu HHV-6B este destul de frecventă la copii şi este adesea întâlnită drept cauză de adresare în toate serviciile de urgenţă din întreaga lume. HHV-6B este un virus omniprezent, cu peste 90% din populaţia umană infectată în primii trei ani de viaţă. Herpesvirusul 6 uman (HHV-6) a fost descoperit iniţial în limfocitele din sânge ale adulţilor cu boli limfoproliferative sau SIDA şi a fost etichetat ca virus B-limfotropic uman. Cercetări ulterioare au identificat HHV-6 în limfocitele CD4+ şi ca membru al herpesvirusurilor(31). Herpesvirusul 6 uman (HHV-6) varianta B este cauza cea mai frecventă a roseolei. Alte cauze includ virusul HHV-7, enterovirusurile, adenovirusul şi virusul parainfluenza de tip 1. Roseola începe în mod clasic cu 3-5 zile de febră care poate depăşi 40 °C. Ca urmare a defervescenţei febrile, se dezvoltă o erupţie maculară sau maculopapuloasă, nepruriginoasă, roz, care începe pe gât şi trunchi şi se răspândeşte pe faţă şi extremităţi(32).
Diagnosticul este clinic, investigaţiile de laborator sunt rareori necesare, dar cu toate acestea pot fi efectuate la copii cu trăsături atipice sau ca parte a evaluării febrei. Caracteristicile de laborator ale roseolei includ neutropenie relativă şi limfocitoză atipică uşoară. Copiii cu roseola pot avea, de asemenea, trombocitopenie sau piurie sterilă.
Roseola este diagnosticată clinic pe baza trăsăturilor caracteristice: febră timp de trei până la cinci zile urmată de o defervescenţă bruscă şi dezvoltarea unei erupţii la un copil mic.
Diagnosticul diferenţial al roseolei include mai multe alte exanteme infecţioase şi alergie la medicamente. Măsurile standard de igienă pot ajuta la prevenirea răspândirii agenţilor patogeni virali care provoacă roseola. Nu există o perioadă recomandată de excludere din colectivitate. Roseola este de obicei o boală benignă autolimitată. Tratamentul este suportiv. Recuperarea este de obicei completă, fără sechele semnificative. Cu toate acestea, HHV-6/7 se poate reactiva atât la persoanele imunocompetente, cât şi la persoanele imunocompromise cu consecinţe sistemice severe. Convulsiile febrile sunt o complicaţie frecventă a bolii(33).
Infecţia primară cu HHV-6B a reprezintă un procent de 12% în unele studii din vizitele la departamentul de urgenţe(34).
Varicela
Virusul Varicella zoster (VZV), agentul cauzator al varicelei şi al zonei zoster, este un alfaherpesvirus omniprezent, care produce varicela la infecţia primară, apoi devine latent în ganglioni. La persoanele vârstnice şi imunocompromise, VZV se reactivează şi migrează de-a lungul fibrelor nervoase periferice, rezultând zoster(35).
Infecţia primară (varicela) la copii este uşoară în comparaţie cu prezentările mai severe la adulţi sau la pacienţii imunocompromişi de orice vârstă. Vaccinarea s-a introdus în unele ţări din anii ’90, din cauza faptului că boala este extrem de contagioasă (prin particule aerosolizate din secreţiile nazofaringiene sau prin contact cu lichid din vezicule) şi reprezintă o povară constantă asupra asistenţei medicale din numeroase ţări(36).
Perioada de incubaţie este de aproximativ 2 săptămâni, debutul fiind cu febră, faringită şi apoi cu erupţie veziculară diseminată. Pacienţii cu antecedente de malignitate sau cu terapie imunosupresivă, infecţie cu HIV sau cu transplant de organe solide sunt sensibili la diseminarea varicelei(37). În general, cei cu patologie asociată necesită o evaluare în vederea vaccinării, anterior iniţierii unei terapii imunosupresoare(38).
La copiii imunocompetenţi, reactivarea este rară şi este considerată o consecinţă a scăderii imunităţii mediate de celule. Complicaţiile infecţiei includ nevralgia postherpetică şi sechele neurologice, precum şi infecţia bacteriană a pielii(39).
Rubeola
Virusul rubeolei este un agent patogen important la nivel mondial, cu aproximativ 100000 de cazuri noi de sindrom de rubeolă congenitală (infecţia în cursul sarcinii poate duce la deces fetal, naştere prematură, anomalii congenitale: pierderea auzului, întârzierea dezvoltării, întârzierea creşterii şi defecte cardiace şi oftalmice(40)) estimate să apară în fiecare an. Vaccinul antirubeolic este extrem de eficient şi sigur(41), dar vaccinarea nu este aplicată în toate ţările.
Rubeola este o infecţie virală caracterizată de obicei prin erupţii cutanate, febră şi adenopatie. Erupţia este de obicei un exantem maculopapulos eritematos, discret, care începe pe faţă, cu caracter de răspândire craniocaudală. De obicei dispare în trei zile, dar poate persista opt zile. Infecţia se transmite pe cale respiratorie, perioada de incubaţie este de aproximativ 2-3 săptămâni, iar tratamentul este suportiv, neexistând nicio terapie specifică. Scopul vaccinării împotriva rubeolei este de a preveni infecţia cu rubeola congenitală. Cel puţin o doză de vaccin viu conţinut de rubeolă este recomandată tuturor persoanelor cu vârsta de 12 luni sau mai mult.
Rujeola
Rujeola este o boală virală extrem de contagioasă. Infecţia este caracterizată de febră, stare de rău, tuse, conjunctivită, coriză, urmate de exantem. Perioada de contagiozitate este estimată a fi de la cinci zile înainte de apariţia erupţiei cutanate până la patru zile după aceea. Boala poate fi transmisă în spaţiile publice, chiar şi în absenţa unui contact direct. Pacienţii trebuie să fie izolaţi(42).
După incubaţia de 1-3 săptămâni vor urma 3-4 zile de febră şi stare de rău, urmată de conjunctivită, coriză şi tuse, apoi erupţia cutanată maculopapuloasă, eritematoasă, cu extindere craniocaudală. Semnul Koplik, un enantem considerat patognomonic pentru rujeolă, apare de obicei cu aproximativ 48 de ore înainte de exantem.
Erupţia dispare în 5-6 zile, iniţial estompându-se în ordinea în care a apărut.
Tusea poate persista două săptămâni după rujeolă. Apariţia febrei după a treia până la a patra zi de erupţie cutanată sugerează prezenţa unei complicaţii, cel mai frecvent infecţii, care se vor manifesta ca pneumonii, laringo-traheobronşite, otite, diaree, chiar encefalite(43). Tratamentul este suportiv şi include simptomatice, rehidratare, antibiotice în caz de suprainfecţie bacteriană şi suplimentare cu vitamina A(44).
Scarlatina
Scarlatina este un rash cutanat asociat cel mai frecvent cu faringita şi/sau amigdalita bacteriană, cu aspect clinic de piele de şmirghel (hârtie abrazivă). Apare mai des la copiii care frecventează colectivităţile şcolare.
Bacteria cauzatoare este streptococul betahemolitic de grup A, Streptococcus pyogenes, care generează mai multe tipuri de toxine eritrogene responsabile de apariţia erupţiei cutanate, care, per se, nu este periculoasă. Aceeaşi bacterie poate produce şi impetigo, erizipel, celulită sau chiar fasceită necrozantă(45).
Diferenţa între reacţia la infecţie a adulţilor faţă de cea a copiilor constă în diferenţa de imunitate. Când un pacient este suspectat a avea scarlatină, după anamneză şi examen obiectiv, cu ajutorul criteriilor CENTOR se poate stabili probabilitatea de a avea infecţie streptococică. Se calculează un scor, în funcţie de evaluarea prezenţei sau absenţei tusei, a febrei, a adenopatiei cervicale anterioare, a amigdalelor şi a vârstei(46).
Exantemul se declanşează la 1-2 zile de la debutul febrei şi este uşor pruriginos, nedureros; debutează pe gât, umeri şi toracele superior şi apoi cuprinde complet trunchiul în decurs de ore, ulterior în decursul unei zile se extinde pe extremităţi, dar fără a afecta faţa, palmele şi plantele. La nivelul plicilor, erupţia este mai accentuată şi are aspect patognomonic, sub forma unor linii hemoragice, conform pliurilor de flexiune, la nivelul unde pielea lezată de toxină este traumatizată prin mişcări (acumulare liniară de papule în jurul punctelor de presiune) –semnul Grozovici-Pastia(47). Acest semn este util şi în diagnosticul tardiv al scarlatinei, persistând câteva zile după dispariţia erupţiei, chiar şi în perioada convalescenţei imediate. În cazurile obişnuite de boală, erupţia cutanată atinge extensia maximă în 2-3 zile, se menţine 1-2 zile şi apoi se şterge treptat, dispărând uzual după o săptămână.
Erupţia are aspect de micropapule punctiforme eritematoase sau chiar cianotice, pe un fond intens eritematos, şi dispare la digito-presiune. Centrul micropapulelor este mai intens colorat şi în relief, ceea ce determină la palpare o senzaţie aspră, de rugozitate (glaspapir/şmirghel). Tegumentul prezintă şi xeroză. După dispariţia erupţiei apare o descuamare la nivelul trunchiului, palmelor şi plantelor, care poate persista până la 2 săptămâni. Aspectul limbii în scarlatină este tipic: iniţial limba este saburală, apoi devine intens eritematoasă, cu hipertrofie papilară, asemănătoare cu zmeura (limba zmeurie) – în zilele 4-5 de evoluţie, ulterior reepitelizându-se şi având un aspect „lăcuit” (limba de pisică). Acest ciclu al aspectului lingual este caracteristic bolii. Tratamentul de primă linie este cu penicilină(48). Complicaţiile infecţiei cu acest streptococ pot fi supurative – prin extensie locală a infecţiei (faringită, sinuzită, otită, meningită) sau nesupurative (reumatism articular sau glomerulonefrită)(49).
Boala gură-mână-picior (BGMP)
Cele mai multe cazuri apar la copiii mai mici, în vârstă de 5 până la 7 ani, dar şi persoanele de orice vârstă pot fi afectate. Este cauzată, în majoritatea cazurilor, de virusurile Coxsackie A16 şi de enterovirusul A71. Transmiterea este fecal-orală, prin secreţii orale şi respiratorii şi prin lichid vezicular. Perioada de incubaţie este de obicei de trei până la cinci zile. Copiii prezintă disfagie sau refuzul de a mânca. Febra este în general de grad scăzut. Leziunile orale, care pot apărea izolat, apar de obicei pe limbă şi mucoasa bucală. Ele încep ca macule şi progresează spre vezicule care se rup şi formează ulcere superficiale. Leziunile orale sunt dureroase şi pot interfera cu alimentaţia. Leziunile pielii, care pot apărea izolat, sunt nepruriginoase. Pot fi maculare, maculopapuloase sau veziculare şi implică în mod obişnuit mâinile, picioarele, fesele (în special la sugari şi copii mici) şi extremităţile. BGMP cauzată de enterovirusul 71 şi enterovirusul 68 a fost asociată cu boli grave, complicată de edemul pulmonar şi hemoragii ale sistemului nervos central şi de insuficienţă cardiacă(50).
Diagnosticul de BGMP se face de obicei clinic, pe baza aspectului şi localizării tipice a enantemului oral şi a exantemului. Diagnosticul diferenţial al BGMP include alte afecţiuni asociate cu leziunile orale (de exemplu, ulcere aftoase, gingivo-stomatita cauzată de herpes simplex). În plus, diagnosticul diferenţial al BGMP include alte afecţiuni asociate cu erupţii maculopapuloase sau veziculare, urticarie papulară, dermatită de contact, eritem polimorf major şi eczema herpeticum. Manifestările atipice ale bolii la copiii cu dermatită atopică pot imita suprainfecţia herpetică(51). Evoluţia este de obicei fără complicaţii, cu rezolvarea completă, spontană, în decursul a 7 zile. Tratamentul este simptomatic.
Impetigo
Impetigo este cea mai frecventă infecţie bacteriană a pielii, o infecţie bacteriană superficială, contagioasă, care apare mai ales în colectivităţi, în special la copiii cu vârsta cuprinsă între 2 şi 5 ani(52). Există două tipuri principale: nonbulos (70% dintre cazuri) şi bulos (30% dintre cazuri). Impetigo nonbulos, sau impetigo contagiosa, este cauzat de Staphylococcus aureus sau Streptococcus pyogenes şi se caracterizează prin cruste melicerice pe faţă şi extremităţi. Impetigo afectează în principal pielea sau, secundar, înţepăturile/muşcăturile de insecte, eczemele sau leziunile herpetice. Impetigo bulos, care este cauzat exclusiv de S. aureus, are ca rezultat bulele mari şi flasce şi este mai probabil să afecteze zonele intertriginoase. Impetigo poate fi urmat de glomerulonefrită poststreptococică sau reumatism acut. Tratamentul impetigoului cu un număr mic de leziuni este cu antibiotice aplicate topic. Dezinfectantele topice nu se recomandă a fi utilizate, fiind inferioare tratamentului cu antibiotice. Dacă leziunile sunt numeroase, se recomandă terapia orală cu antibiotic. Durata recomandată a tratamentului este de 5-7 zile. Acidul fusidic, mupirocin şi retapamulin reprezintă terapia infecţiilor cu S. aureus şi streptococ(53).
Dermatita atopică
Dermatita atopică a fost descrisă prima oară în 1933, dar este menţionată încă din Antichitate(54).
Este cea mai frecventă boală netransmisibilă, afectând până la 20% dintre copii. Caracteristice în dezvoltarea bolii sunt o influenţă genetică puternică (80% concordanţă în gemenii monozigoţi), devierea imunitară spre calea Th2 în faza de iniţiere, cu producţia crescută de IgE, prezenţa de citokine proinflamatorii, funcţia de barieră a pielii deficitară, colonizare microbiană anormală cu organisme patogene precum Staphylococcus aureus sau Malassezia spp. (în comparaţie cu Staphylococcus epidermidis la persoanele neafectate) şi o influenţă psihosomatică evidentă(55).
Xeroza cutanată şi pruritul sever sunt trăsăturile de bază ale dermatitei atopice, în asociere cu hiperreactivitate cutanată la diverşi stimuli de mediu, inclusiv expunerea la alimente şi alergeni respiratori, iritanţi şi infecţii. Diagnosticul dermatitei atopice este unul clinic.
Criteriile de diagnostic includ:
-
prezenţa pruritului cutanat (obligatoriu), plus trei sau mai multe dintre următoarele criterii:
-
istoric de dermatită a pliurilor
-
dermatită vizibilă a suprafeţelor flexurale
-
istoric personal sau familial de astm sau rinită alergică
-
prezenţa xerozei cutanate în ultimul an
-
simptome prezente înainte de vârsta de 2 ani (la copiii cu vârsta sub 4 ani, dermatită a obrajilor).
Biopsia pielii şi analizele de laborator, inclusiv nivelurile de IgE, de obicei nu sunt necesare.
Obiectivele tratamentului pentru dermatita atopică sunt reducerea simptomelor, prevenirea exacerbărilor şi minimizarea riscurilor terapeutice.
Managementul optim necesită o abordare multidisciplinară care implică eliminarea factorilor exacerbatori, refacerea funcţiei de barieră a pielii, hidratarea pielii, educaţia pacientului şi tratamentul farmacologic al inflamaţiei pielii cu corticosteroizi topici şi inhibitori de calcineurină topică (tacrolimus sau pimecrolimus). Uneori pot fi necesare fototerapia sau chiar şi tratamentul cu imunosupresoare. Dar, atenţie, aceste tratamente nu sunt potrivite pentru sugari şi copii mici(54,55).
Dermatita seboreică
Dermatita seboreică este o afecţiune frecventă a pielii la sugari, adolescenţi şi adulţi. Leziunile eritematoase caracteristice suferă descuamare şi sunt pruriginoase, ele apărând cel mai des pe scalp, faţă şi torace anterior, dar uneori şi pe toracele posterior, axilar sau inghinal. La sugari, dermatita seboreică este o afecţiune uşoară şi autolimitată, care implică cel mai frecvent scalpul.
Diagnosticul este unul clinic, bazat pe localizarea şi aspectul leziunilor. Modificările pielii sunt considerate a rezulta dintr-un răspuns inflamator la un microorganism comun aflat la nivelul pielii: Malassezia. Tratamentul cu agenţi antifungici, cum ar fi ketoconazolul topic, este baza principală a terapiei pentru dermatita seboreică a feţei şi corpului. Din cauza posibilelor efecte adverse, agenţii antiinflamatori, cum ar fi corticosteroizii topici şi inhibitorii de calcineurină, trebuie folosiţi doar pe perioade scurte. Şampoanele antifungice (pe termen lung) şi corticosteroizii topici (pe termen scurt) pot fi folosiţi ca tratament al dermatitei seboreice a scalpului. Dacă erupţia nu se rezolvă sau nu se îmbunătăţeşte considerabil după o săptămână de terapie cu corticosteroizi sau două săptămâni de terapie antifungică, diagnosticul trebuie reconsiderat. În cazuri selectate, se pot utiliza şi inhibitorii de calcineurină. Formele severe, cu generalizare, se întâlnesc de obicei în caz de imunodeficienţe(56,57).
Tinea
Dermatofiţii din genurile Trichophyton, Microsporum şi Epidermophyton provoacă majoritatea infecţiilor fungice superficiale la copii, având ca forme clinice tinea pedis, tinea corporis, tinea cruris, granulomul lui Majocchi, tinea capitis şi tinea unguium.
Tinea pedis se întâlneşte rar la copii şi se poate prezenta ca o zonă macerată, albicioasă, între degetele 3 şi 4 ale degetelor de la picioare.
Tinea corporis îi afectează frecvent pe copiii care trăiesc în climate calde şi umede. Prezentarea clinică clasică este cu o placă circulară, cu margini bine definite. Boala poate fi asimptomatică şi din acest motiv se poate răspândi cu uşurinţă în colectivităţile de copii.
Tinea cruris afectează mai rar copiii, fiind de obicei bilaterală şi însoţită de prurit.
Tinea capitis îi afectează în principal pe copiii de vârstă şcolară. Se pot produce granuloame numite „kerion” unde poate apărea alopecia definitivă.
Tinea unguium: implicarea distală este cea mai frecventă prezentare, unghia afectată este hiperkeratozică, cu detritusuri subunghiale cu aspect de „măduvă de soc”, care determină separarea unghiei de patul unghial.
Contaminarea se produce prin contactul cu oameni, sol sau animale infectate. Diagnosticul unei infecţii cutanate cu dermatofiţi poate fi suspectat pe baza aspectului clinic.
Pentru a confirma diagnosticul trebuie utilizat un preparat de hidroxid de potasiu (KOH). Se mai poate utiliza şi examinarea cu lampa Wood. Majoritatea infecţiilor cu tinea pot fi gestionate cu terapii topice. Pentru pacienţii cu tinea pedis limitată, tinea corporis sau tinea cruris se recomandă tratament cu un antifungic topic cu activitate antidermatofitică, mai degrabă decât terapie sistemică; tratamentul oral este rezervat pentru tinea capitis, tinea pedis severă şi tinea unguium. Terapia topică cu alilaminele fungicide poate avea rate de vindecare uşor mai mari şi durata de tratament mai scurtă decât în cazul azolilor fungistatici. Deşi griseofulvina orală a fost tratamentul standard pentru tinea capitis, mai mulţi agenţi antifungici orali, precum terbinafină, itraconazol şi fluconazol, sunt eficienţi, siguri şi au durate mai scurte de tratament. Terapia antifungică orală este utilizată pentru infecţii extinse sau infecţii refractare la tratamentul topic. Recidivele de tinea pedis şi tinea cruris sunt frecvente(58,59).
Pitiriazisul rozat
Pitiriazisul rozat este o boală cutanată autolimitată, exantematoasă, pruriginoasă, cel mai probabil de etiologie virală (HHV-6/7). Erupţia debutează cu o „placă‑mamă”, rotundă sau ovalară, bine delimitată, de culoare roz-somon, situată în mod obişnuit pe trunchi sau pe gât, cu diametrul de 2-5 cm. În 3-14 zile, leziuni cu acelaşi aspect, dar cu dimensiuni mai mici vor apărea pe trunchi şi pe zonele proximale ale extremităţilor. Aranjarea leziunilor este „în pom de Crăciun”.
În majoritatea cazurilor, pacienţii nu necesită terapie. Acolo unde există o afectare a calităţii vieţii, se pot administra topice cu corticosteroizi sau efectua fototerapie. Pentru cei cu evoluţie severă se recomandă tratamentul oral cu aciclovir. Rezolvarea spontană poate apărea în 4-12 săptămâni. Când leziunile cutanate durează peste 2 luni, se va lua în considerare posibilitatea implicării unor medicamente.
Există descrise în literatură cazuri de erupţii pitiriazis rozat-like, induse medicamentos de antifungice sau antibiotice (metronidazol, terbinafină), antidepresive, antiepileptice (lamotrigină), antihipertensive (captopril), agenţi biologici (rituxibam), vaccinuri etc.(60)
Molluscum contagiosum
Molluscum contagiosum este o infecţie a pielii, autolimitată, localizată, cauzată de un poxvirus, cel mai mare virus uman şi singurul membru al genului Molluscipox.
Molluscum contagiosum este frecvent întâlnit la copii, dar poate apărea şi la adulţi. Virusul este transmis prin contact direct cu pielea sau cu obiecte contaminate sau prin autoinoculare. Incubaţia se presupune că durează între 2 şi 6 săptămâni. Infecţia cu Molluscum contagiosum în regiunea genitală poate rezulta din transmiterea în timpul activităţii sexuale.
Clinic, infecţia se prezintă sub formă de papule mici multiple, de culoarea pielii, cu ombilicare centrală. Persoanele imunodeprimate au un risc crescut de a dezvolta leziuni mai mari şi mai extinse. Diagnosticul se bazează de obicei pe aspectul clinic al leziunilor pielii.
Până în prezent nu există un tratament specific disponibil pentru molluscum contagiosum. Fiind o infecţie autolimitată, există şi opţiunea de a nu trata.
Leziunile din zona genitală trebuie tratate dat fiind potenţialul de transmitere sexuală.
Inflamarea leziunilor este frecventă şi poate fi un semn de regresie iminentă. Inflamarea nu trebuie confundată cu infecţia bacteriană. Eficacitatea terapiilor este discutabilă.
Se iau în considerare: cauterizarea, crioterapia, laserul, imiquimodul, hidroxidul de potasiu (KOH), acidul salicilic şi retinoizii topici. Însă soluţia de 20% KOH topică s-a dovedit a fi o modalitate terapeutică ieftină şi neinvazivă la copii. Aceasta poate provoca o reacţie iritantă la nivelul pielii, care variază în funcţie de regiunea corpului şi de susceptibilitatea individuală. De obicei, inflamaţia se dezvoltă după o perioadă medie de tratament de 5 până la 7 zile. Când inflamaţia apare, se opreşte aplicarea soluţiei. Majoritatea copiilor au o senzaţie tranzitorie de înţepătură timp de 1-2 minute, la scurt timp după aplicaţii.
Copiii cu molluscum contagiosum nu trebuie excluşi de la şcoală. Leziunile trebuie acoperite cu îmbrăcăminte sau cu un bandaj, pentru a reduce riscul transmiterii(61,62).
Dermatita herpetifomă
Dermatita herpetifomă este o afecţiune cutanată inflamatorie asociată cu enteropatia gluten-sensibilă. Predispoziţia genetică, producerea de anticorpi împotriva transglutaminazei epidermice împreună cu răspunsul imunitar la gluten reprezintă factorii-cheie în dezvoltarea bolii. Dermatita herpetiformă poate fi prima manifestare a bolii celiace, deoarece cel puţin 75% dintre aceşti pacienţi prezintă un anumit grad de enteropatie, variind de la aplatizarea mucoasei la atrofie viloasă parţială. Simptomele gastrointestinale şi abdominale sunt, de obicei, absente. În schimb, doar 24% dintre pacienţii cu boală celiacă dezvoltă dermatită herpetiformă. Boala recidivantă e prezentă de obicei la tineri (15-40 de ani), este puţin mai frecventă la bărbaţi şi afectează predominant persoanele albe. Erupţia pruriginoasă caracteristică, papulo-veziculară, se dezvoltă simetric şi este cel mai adesea evidentă pe suprafeţele extensoare ale coatelor şi ale genunchilor, antebraţelor, scalpului şi feselor, proximal. Frecvent este însoţită de senzaţie de arsură. Diagnosticul de certitudine se stabileşte prin imunofluorescenţă directă: depunerea de IgA la nivelul joncţiunii dermoepidermice. Serologic, se pot măsura nivelurile de anticorpi antitransglutaminază epidermică şi tisulară. Pacienţii au risc crescut de a dezvolta tiroidită autoimună sau limfom. Tratamentul este reprezentat de dieta fără gluten şi dapsonă pentru leziunile cutanate(63,64).
Keratoza pilară
Keratoza pilară (KP) se caracterizează prin papule foliculare keratozice şi diferite grade de eritem perifolicular. Cea mai acceptată teorie a patogenezei sale propune keratinizarea defectuoasă a epiteliului folicular, rezultând într-un dop infundibular keratozic.
Există însă studii conform cărora KP poate să nu fie o tulburare a cheratinizării, ci este cauzată de axul circular al părului care, crescând, rupe epiteliul folicular, conducând la inflamaţie şi cheratinizare foliculară anormală.
Adesea, KP se regăseşte în practică în asociere cu dermatita atopică sau cu ihtioza vulgară.
Debutul este de obicei în copilărie sau adolescenţă, cu papule keratozice spinoase care implică predominant aspectele extensoare ale braţelor şi coapselor, proximal. Faţa, trunchiul, fesele şi extremităţile distale pot fi de asemenea afectate.
Diagnosticul de KP este clinic. Implicarea sprâncenelor, inflamaţia marcată şi cicatrizarea atrofică cu alopecie sugerează diagnosticul de KP atrofică. KP se îmbunătăţeşte de obicei odată cu vârsta, fără tratament. Cu toate acestea, pentru pacienţii cu KP întinsă şi/sau eritem intens, care au probleme cosmetice, tratamentul poate oferi o uşurare simptomatică parţială, temporară. Tratamentul iniţial al KP include măsuri generale de îngrijire a pielii, emoliente şi keratolitice topice (acid salicilic 5%, acid lactic 10%). Pentru pacienţii care nu răspund la terapia iniţială, retinoizii topici pot fi o opţiune de tratament(65,66,67).
Concluzii
Deoarece erupţiile din copilărie pot fi dificil de diferenţiat numai prin aspect, este important să se ia în considerare întreaga prezentare clinică pentru a stabili diagnosticul adecvat. Vom ţine seama de aspectul şi localizarea erupţiei, de evoluţia clinică şi simptome asociate, cum sunt pruritul sau febra. Este probabil să apară febră asociat bolilor infecto-contagioase, cum sunt: scarlatina, varicela, rujeola, rubeola, roseola infantum şi eritemul infecţios. Pruritul poate însoţi dermatita atopică, pitiriazisul rozat, eritemul infecţios, molluscum contagiosum ori infecţiile cu fungi.
Stabilirea diagnosticului corect este extrem de importantă, câtă vreme acesta ne va dirija abordarea investigaţională a cazului şi conduita terapeutică.
Bibliografie
- Rusu V. Dicţionar medical, Ed Medicală, Bucureşti 2001, pag 372
- Norman G, Young M, Brooks L. Non-analytical models of clinical reasoning: the role of experience. Med Educ 2007; 41:1140.
- Al-Dabagh A, Davis SA, McMichael AJ, Feldman SR. Rosacea in skin of color: not a rare diagnosis. Dermatol Online J. 2014
- Bigby M, Jick S, Jick H, Arndt K. Drug-induced cutaneous reactions. A report from the Boston Collaborative Drug Surveillance Program on 15,438 consecutive inpatients, 1975 to 1982., JAMA. 1986;256(24):3358.
- Pichler WJ. Drug hypersensitivity reactions: Classification and relationship to T-cell activation. In: Drug Hypersensitivity, Pichler WJ (Ed), Karger Publishers, Basel 2007. pag 66-72
- Ariza A, Mayorga C, Fernandez TD, Barbero N, Martín-Serrano A, Pérez-Sala D, Sánchez-Gómez FJ, Blanca M, Torres MJ, Montanez MI. Hypersensitivity reactions toβ-lactams: relevance of hapten-protein conjugates. J Investig Allergol Clin Immunol. 2015;25(1):12
- Litt JZ. Litt’s Drug Eruptions and Reactions Manual, 16th ed, Informa Healthcare, London 2010.
- Tohyama M, Hashimoto K. New aspects of drug-induced hypersensitivity syndrome. J Dermatol. 2011;38(3):222.
- Brockow K, Ardern-Jones MR, Mockenhaupt M, Aberer W, Barbaud A, Caubet JC, Spiewak R, Torres MJ, Mortz CG. EAACI position paper on how to classify cutaneous manifestations of drug hypersensitivity. Allergy. 2019 Jan; 74(1):14-27.
- Lin D, Li WK, Rieder MJ. Cotrimoxazole for prophylaxis or treatment of opportunistic infections of HIV/AIDS in patients with previous history of hypersensitivity to cotrimoxazole. Cochrane Database Syst Rev. 2007;
- Grattan CEH, Saini SS. Urticaria and Angioedema. Dermatology EBook, pag. 304-319.
- Zuberbier T, Iffländer J, Semmler C, Henz BM. Acute urticaria: clinical aspects and therapeutic responsiveness. Acta Derm Venereol. 1996;76:295–7.
- Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, Bernstein JA, Bindslev-Jensen C, Brzoza Z, Buense Bedrikow R, Canonica GW, Church MK, Craig T, Danilycheva IV, Dressler C, Ensina LF, Gimenez-Arnau A, Godse K, Goncalo M, Grattan C, Hebert J, Hide M, Kapp A, CKatelaris CH, Kocaturk E, Kulthanan K, Larenas-Linnemann D, Leslie TA, Magerl M, Mathelier-Fusade P, Nast A, Nettis E, H. Oude-Elberink H, Sanchez-Borges M, Schmid-Grendelmeier P, Toubi E, Vena GA, Vestergaard C, Wedi B, Kaplan A, Meshkova RY, Metz M, Rosumeck S, Saini SS, Staubach P, Sussman G, Werner ZN, Zhao Z, Maurer M. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018 Jul; 73(7):1393-1414.
- Sharma S, Biswal N. Erythema Marginatum. Indian Pediatr. 2015 Dec;52(12):1100.
- Paulino L, Hamblin DJ, Osondu N, Amini R. Variants of Erythema Multiforme: A Case Report and Literature Review. Cureus 2018 Oct 16;10(10):e3459. doi: 10.7759/cureus.3459.
- Assier H, Bastuji-Garin S, Revuz J, Roujeau. Erythema multiforme with mucous membrane involvement and Stevens-Johnson syndrome are clinically different disorders with distinct causes. Arch Dermatol. 1995;131(5):539.
- Mockenhaupt M. Stevens-Johnson syndrome and toxic epidermal necrolysis: clinical patterns, diagnostic considerations, etiology, and therapeutic management. Semin Cutan Med Surg. 2014 Mar; 33(1):10-6.
- Inada A, Oyama S, Niinomi I, Wakabayashi T, Iwanaga K, Hosohata K. Association of Stevens-Johnson syndrome and toxic epidermal necrolysis with antiepileptic drugs in pediatric patients: Subgroup analysis based on a Japanese spontaneous database. J Clin Pharm Ther. 2019 Oct;44(5):775-779. doi: 10.1111/jcpt.13001. Epub 2019 Jun 23.
- Antoon JW, Goldman JL, Lee B, Schwartz A. Incidence, outcomes, and resource use in children with Stevens-Johnson syndrome and toxic epidermal necrolysis. Pediatr Dermatol. 2018 Mar;35(2):182-187. doi: 10.1111/pde.13383. Epub 2018 Jan 9.
- Bastuji-Garin S, Rzany B, Stern RS, Shear NH, Naldi L, Roujeau JC. Clinical classification of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome, and erythema multiforme. Arch Dermatol. 1993 Jan;129(1):92-6.
- Roujeau JC. Stevens-Johnson syndrome and toxic epidermal necrolysis are severity variants of the same disease which differs from erythema multiforme. J Dermatol. 1997 Nov;24(11):726-9.
- Mockenhaupt M, Wolkenstein P, Dunant A, Le Gouvello S, Chen CB, Chosidow O, Valeyrie-Allanore L, Bellon T, Sekula P, Wang CW, Schumacher M, Kardaun SH, Hung SI, Roujeau JC, Chung WH. Interleukin-15 Is Associated with Severity and Mortality in Stevens-Johnson Syndrome/Toxic Epidermal Necrolysis. J Invest Dermatol. 2017;137(5):1065. Epub 2016 Dec 21
- Murata J, Abe R, Shimizu H. Increased soluble Fas ligand levels in patients with Stevens-Johnson syndrome and toxic epidermal necrolysis preceding skin detachment. J Allergy Clin Immunol. 2008;122(5):992. Epub 2008 Aug 9.
- Abe R, Yoshioka N, Murata J, Fujita Y, Shimizu H. Granulysin as a marker for early diagnosis of the Stevens-Johnson syndrome. Ann Intern Med. 2009;151(7):514.
- Popescu V. Infecţiile stafilococice la copil. Revista Română de pediatrie – VOL. LVII, NR. 2, pag 113-114, 2008
- Valamparampil JJ, Chirakkarot S, Letha S, Jayakumar C, Gopinathan KM. Clinical profile of Chikungunya in infants. Indian J Pediatr. 2009;76(2):151. Epub 2009 Mar 28.
- Pătraşcu V. Boli dermatologice şi infecţii sexual-transmisibile. Craiova, 2014, ISBN 798-606-11-4091-6, pag 305-306
- Kappius RH, Ufkes NA, Thiers BH. Paraneoplastic Pemphigus. Treasure Island (FL): StatPearls Publishing; 2019-2019 Sep 17.
- Drago F, Ciccarese G, Javor S, Cozzani E, Parodi A. Atypical exanthems associated with parvovirus B19 infection: similarities and differences between adults and children. Le Infezioni in Medicina. n. 3, 283-284, 2015
- Sim JY, Chang LY, Chen JM, Lee PI, Huang LM, Lu CY. Human parvovirus B19 infection in patients with or without underlying diseases. J Microbiol immunol Infect 2019 Aug;52(4):534-541. doi: 10.1016/j.jmii.2019.05.009. Epub 2019 Jun 19.
- King O, Al Khalili. Herpes Virus Type 6. Treasure Island (FL): StatPearls Publishing; 2019 May 4.
- Mullins TB, Krishnamurthy K. Roseola Infantum (Exanthema Subitum, Sixth Disease). StatPearls Publishing; 2019 Jun 10.
- Stone RC, Micali GA, Schwartz RA. Roseola infantum and its causal human herpesviruses. Int J Dermatol. 2014 Apr;53(4):397-403.
- Hattori F, Kawamura Y, Kozawa K, Miura H, Miyake M, Yoshikawa A, Ihira M, Yoshikawa T. Clinical Characteristics of Primary HHV-6B Infection in Children Visiting the Emergency Room. Pediatr Infect Dis J 2019 Oct;38(10):e248-e253. doi: 10.1097/INF.0000000000002379.
- Nagel MA, Jones D, Wyborny A. Varicella zoster virus vasculopathy: The expanding clinical spectrum and pathogenesis. J Neuroimmunol. 2017 Jul 15;308:112-117. doi: 10.1016/j.jneuroim.2017.03.014. Epub 2017 Mar 18.
- McCarthy KN, Ó Maoldomhnaigh C, Butler KM, Gavin PJ. Varicella Related Hospital Admissions in Ireland. Ir Med J. 2019 Aug 1;112(7):966.
- Gershon AA, Mervish N, LaRussa P, Steinberg S, Lo SH, Hodes D, Fikrig S, Bonagura V, Bakshi S. Varicella-zoster virus infection in children with underlying human immunodeficiency virus infection. J Infect Dis. 1997 Dec;176(6):1496-500.
- Adams DJ, Nylund CM. Hospitalization for Varicella and Zoster in Children with Inflammatory Bowel Disease. J Pediatr. 2016 Apr;171:140-5. doi: 10.1016/j.jpeds.2015.12.072. Epub 2016 Jan 27.
- Ashi A, Ali A, Alzahrani M, Ali J, Albar R. Herpes Zoster Eruption in an Otherwise Healthy Child: A Case Report. Cureus. 2019 Jul 22; 11(7):e5194.doi:10.7759/cureus.5194.
- Duszak RS. Congenital rubella syndrome-major review. Optometry. 2009 Jan;80(1):36-43. doi: 10.1016/j.optm.2008.03.006.
- Lambert N, Strebel P, Orenstein W, Icenogle J, Poland GA. Rubella. Lancet. 2015 Jun 6;385(9984):2297-307. doi: 10.1016/S0140-6736(14)60539-0. Epub 2015 Jan 8.
- Bester JC. Measles and Measles Vaccination: A Review. JAMA Pediatr. 2016 Dec 1;170(12):1209-1215. doi:10.1001/jamapediatrics.2016.1787.
- Beckford AP, Kaschula RO, Stephen C. Factors associated with fatal cases of measles. A retrospective autopsy study. S Afr Med J. 1985 Dec 7;68(12):858-63.
- Measles vaccines: WHO position paper – April 2017
- Stevens DL, Bryant AE. Impetigo, Erysipelas and Cellulitis. Streptococcus pyogenes : Basic Biology to Clinical Manifestations. Oklahoma City (OK): University of Oklahoma Health Sciences Center; 2016-. 2016 Feb 10.
- Walker G, Kwon R. Calculated decisions: Centor Score (Modified/McIsaac) for strep pharyngitis. Pediatr Emerg Med Pract. 2017 Dec 1;14(Suppl 12):1-3.
- Voiculescu M, Perederi S. O contribuţie românească la semeiologia scarlatinei: semnul Pastia. Viaţa med. 1983, pag 30, pag 329.
- Voiculescu MG. Boli infecţioase. Vol. II. Editura Medicală, Bucureşti, 1990
- Ralph AP, Carapetis JR. Group a streptococcal diseases and their global burden. Curr Top Microbiol Immunol. 2013;368:1-27. doi: 10.1007/82_2012_280.
- Ventarola D, Bordone L, Silverberg N. Update on hand-foot-and-mouth disease. Clin dermatol. 2015 May-Jun;33(3):340-6. doi: 10.1016/j.clindermatol.2014.12.011. Epub 2014 Dec 9.
- Nassef C, Ziemer C, Morrell DS. Hand-foot-and-mouth disease: a new look at a classic viral rash. Curr Opin Pediatr. 2015 Aug;27(4):486-91. doi: 10.1097/MOP.0000000000000246.
- VanRavenstein K, Durham CO, Williams TH, Smith W. Diagnosis and management of impetigo. Nurse Pract. 2017 Mar 7;42(3):40-44. doi: 10.1097/01.NPR.0000508173.18540.51.
- Hartman-Adams H, Banvard C, Juckett G. Impetigo: diagnosis and treatment. Am Fam Physician. 2014 Aug 15;90(4):229-35.
- Wallach D, Taïeb A. Atopic dermatitis/atopic eczema. Chem Immunol Allergy. 2014;100:81-96. doi: 10.1159/000358606. Epub 2014 May 22.
- Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, Gieler U, Girolomoni G, Lau S, Muraro A, Czarnecka-Operacz M, Schäfer T, Schmid-Grendelmeier P, Simon D, Szalai Z, Szepietowski JC, Taïeb A, Torrelo A, Werfel T, Ring J; European Dermatology Forum (EDF), the European Academy of Dermatology and Venereology (EADV), the European Academy of Allergy and Clinical Immunology (EAACI), the European Task Force on Atopic Dermatitis (ETFAD), European Federation of Allergy and Airways Diseases Patients’ Associations (EFA), the European Society for Dermatology and Psychiatry (ESDaP), the European Society of Pediatric Dermatology (ESPD), Global Allergy and Asthma European Network (GA2LEN) and the European Union of Medical Specialists (UEMS). Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018 May;32(5):657-682. doi: 10.1111/jdv.14891.
- Clark GW, Pope SM, Jaboori KA. Diagnosis and treatment of seborrheic dermatitis. Am Fam Physician. 2015 Feb 1;91(3):185-90.
- Schwartz RA, Janusz CA, Janniger CK. Seborrheic dermatitis: an overview. Am Fam Physician. 2006 Jul 1;74(1):125-30.
- Andrews MD, Burns M. Common tinea infections in children. Am Fam Physician. 2008 May 15;77(10):1415-20.
- Alok Kumar Sahoo, Rahul Mahajan. Management of tinea corporis, tinea cruris, and tinea pedis: A comprehensive review. Indian Dermatol Online J. 2016 Mar-Apr; 7(2): 77–86. doi: 10.4103/2229-5178.178099
- Eisman S, Sinclair R. Pityriasis rosea. BMJ 2015; 351 doi: https://doi.org/10.1136/bmj.h5233
- Mahajan BB, Pall A, Gupta RR. Topical 20% KOH--an effective therapeutic modality for moluscum contagiosum in children. Indian J Dermatol Venereol Leprol. 2003 Mar-Apr;69(2):175-7.
- Leung AKC, Barankin B, Hon KLE. Molluscum Contagiosum: An Update. Recent Pat Inflamm Allergy Drug Discov. 2017;11(1):22-31. doi: 10.2174/1872213X11666170518114456.
- Adam D Jakes, Stephen Bradley. Dermatitis herpetiformis. BMJ 2014; 348:g2557.
- Mendes FB, Hissa-Elian A, Abreu MA, Gonçalves VS. Review: dermatitis herpetiformis. An Bras Dermatol. 2013 Jul-Aug;88(4):594-9. doi: 10.1590/abd1806-4841.20131775.
- Thomas M, Uday Sharadchandra Khopkar. Keratosis Pilaris Revisited: Is It More Than Just a Follicular Keratosis? Int J Trichology. 2012 Oct-Dec; 4(4): 255–258. doi: 10.4103/0974-7753.111215
- Tanawatt Kootiratrakarn, Kowit Kampirapap, Chakkrapong Chunhasewee. Epidermal Permeability Barrier in the Treatment of Keratosis Pilaris. Dermatol Res Pract. 2015; 2015: 205012. Published online 2015 Feb 24. doi: 10.1155/2015/205012
- Hwang S, Schwartz RA. Keratosis pilaris: a common follicular hyperkeratosis. Cutis. 2008 Sep;82(3):177-80.