Oncology care has two important aspects: the management of adverse effects caused by chemotherapy and palliative care. Adverse reactions are common, severe and occurring at therapeutic doses. They may be acute or chronic, permanent or temporary, mild or severe. The management of side effects is very important because they can affect treatment, tolerability and quality of life. Palliative care is the last line of possible medical intervention for end-stage patients with incurable diseases to ensure the best possible quality of life until the last minute.
Îngrijirea pacientului oncologic
Caring for the oncological patient
First published: 30 aprilie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.181.2.2018.1682
Abstract
Rezumat
Îngrijirea pacientului oncologic prezintă două aspecte importante: gestionarea efectelor adverse determinate de chimioterapie şi îngrijirea paliativă. Reacţiile adverse sunt frecvente, severe şi apar la doze terapeutice. Pot fi acute sau cronice, permanente sau temporare, uşoare sau severe. Managementul reacţiilor adverse este foarte important, deoarece acestea pot afecta tratamentul, tolerabilitatea şi calitatea vieţii. Îngrijirea paliativă reprezintă ultima linie de intervenţie medicală posibilă pentru pacienţii aflaţi în faza terminală a unor boli incurabile, pentru a asigura o calitate a vieţii cât mai bună până în ultima clipă.
A. Prevenirea, reducerea şi gestionarea reacţiilor adverse ale medicamentelor antineoplazice
Terapia cancerului include: chirurgie (tumori izolate şi solide), radioterapie (la aproape jumătate din toate tipurile de cancer, utilizată curativ sau pentru ameliorarea simptomelor), chimioterapie (în toate cazurile, asociate cu alte tipuri de tratament, 10-15% efect curativ în monoterapie), imunoterapie, îngrijire paliativă (gestionarea simptomelor)(1).
Medicamentele antineoplazice se utilizează singure sau în combinaţie, în tratamentul cancerului, cu următoarele scopuri terapeutice(1):
- chemoprevenţie (prevenirea sau suprimarea carcinogenezei la persoanele predispuse la anumite tipuri de cancer)
- vindecare (distrugerea tuturor celulelor canceroase; speranţă de viaţă neschimbată)
- control (prevenirea sau încetinirea creşterii unei tumori, pentru a prelungi supravieţuirea)
- paliaţie (gestionarea simptomelor).
Iniţial, reacţiile adverse au fost grupate în două categorii: de tip A (Augmentate) – dependente de doză, predictibile, corelate cu mecanismul farmacodinamic, determinate de efectul farmacologic augmentat, reprezintă aproximativ 80% din reacţiile adverse ale medicamentelor (Baldo BA, 2013) şi de tip B (Bizare) – imprevizibile, cu incidenţă mică în populaţie, depind de farmacologia medicamentului, dar nu depind de doză (au fost numite efecte bizare). Au mai fost adăugate încă cinci categorii: de tip C (Cronice) – apar la tratament cronic, sunt corelate cu doza şi durata de tratament; de tip D (Întârziate – eng. Delayed) – apar după mult timp de la tratament; de tip E (Oprirea tratamentului – eng. End of use), la oprirea bruscă a tratamentului; de tip F (Eşec terapeutic – eng. Failure) şi de tip G (Reacţii Genetice)(2).
Severitatea evenimentelor clinice adverse este stabilită de Criteriile de terminologie comună pentru evenimente adverse v5.0 (Common Terminology Criteria for Adverse Events – CTCAE v5.0).
Efectele adverse întâlnite frecvent la pacienţii cu medicaţie citostatică sunt: infecţii, leucopenie, trombocitopenie, sindrom de tromboză, greaţă, vărsături, diaree, constipaţie, afecţiuni la nivelul cavităţii orale (mucozită orală), toxicitate pulmonară, toxicitate cardiacă, alopecie, disfuncţia gonadelor, oboseală cronică, cancere secundare, afectare neurocognitivă(3). Aceste reacţii adverse sunt de tip A.
Toxicitatea hematologică
Chimioterapia citostatică prezintă frecvent ca efect secundar citopenia periferică, determinată de mielosupresie. Această reacţie adversă limitează doza de citostatic şi induce leziuni acute sau cronice la nivelul măduvei osoase. Chimioterapia distruge activitatea proliferării celulelor precursoare hematopoietice, conducând la scăderea celulelor sangvine şi la creşterea incidenţei hemoragiilor şi infecţiilor care pot pune în pericol viaţa(4). Antineoplazicele care determină toxicitate hematologică sunt menţionate în tabelul 1.
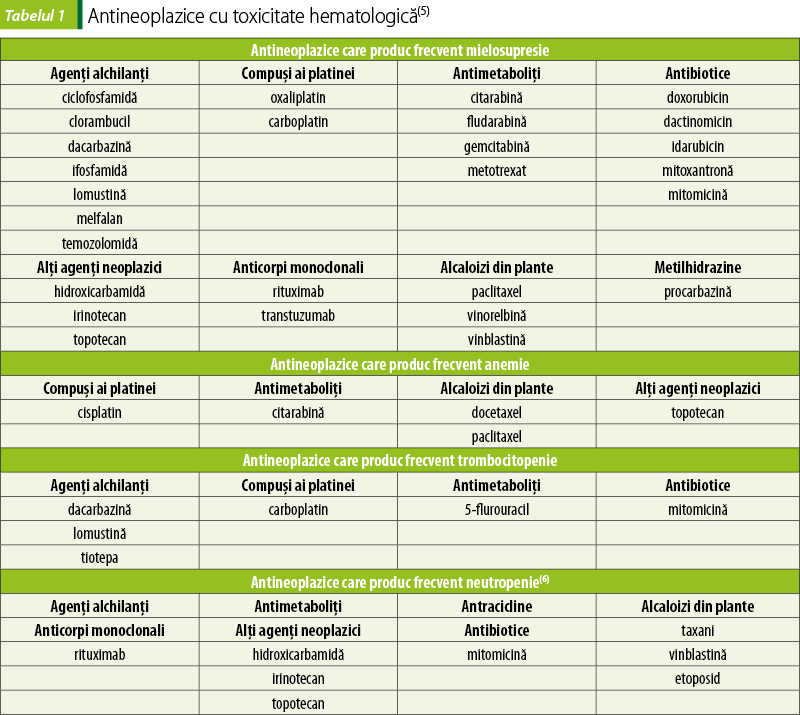
Mielosupresia produsă de citostatice este însoţită de leucopenie, neutropenie şi trombocitopenie, fiind asociată cu un risc foarte crescut de evenimente hemoragice şi anemie. Clasificarea evenimentelor adverse la nivelul sângelui, conform Criteriilor de terminologie comună pentru evenimente adverse v5.0, este prezentată în tabelul 2. Frecvenţa este crescută la asocierea de citostatice şi la utilizarea unor doze mari. Scăderea numărului de leucocite şi trombocite atinge valori minime în primele două săptămâni de tratament. Refacerea măduvei osoase şi revenirea parametrilor hematologici la valori normale are loc în câteva săptămâni. Anemia se dezvoltă, de obicei, după mai multe cicluri de tratament(7)
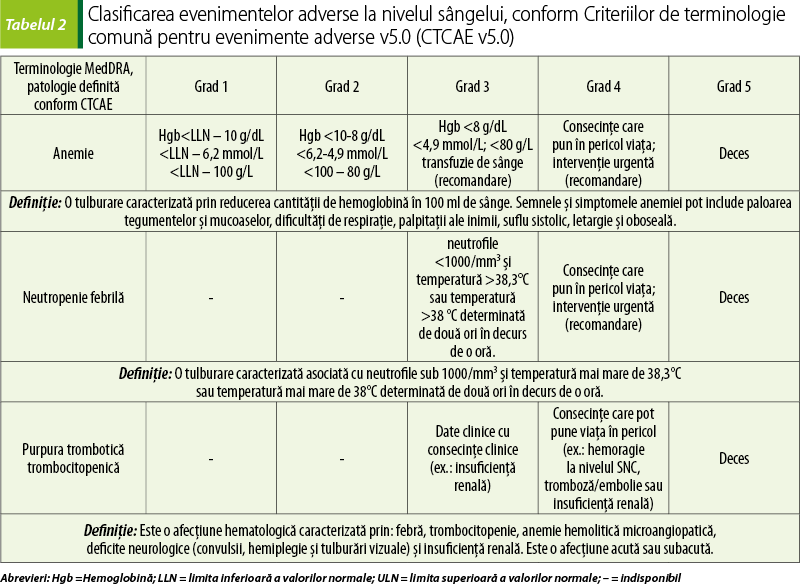
Managementul toxicităţii hematologice este diferit şi se poate realiza fie prin reducerea dozei de citostatic, fie prin tratarea neutropeniei febrile. Pacienţii care dezvoltă toxicitate de gradul 4 (consecinţe care pun în pericol viaţa) necesită spitalizare pentru tratarea infecţiilor sau hemoragiilor. Curele de chimioterapie sunt amânate până când mielosupresia se reduce. Se pot utiliza medicamente care stimulează sinteza de etritrocite (eritropoietină umană recombinantă, darbepoetină alfa), factori umani de stimulare a coloniilor formatoare de granulocite (G-CSF: filgrastim, lenograstim şi pegfilgrastim), factori umani de stimulare a coloniilor formatoare de granulocite şi macrofage (GM-CSF: sargramostim, molgramostim, regramostim), citokine sau transfuzii de trombocite(5).
Anemia
Etiologia anemiei la pacientul cu cancer cuprinde mai mulţi factori, incluzând pierderi de sânge, rezerve nutriţionale reduse, infiltrarea spaţiului măduvei hematopoietice cu celule anormale (anemie mieloftizică) şi efectul direct al citostaticelor.
Simptomele asociate cu anemia uşoară sau moderată pot afecta negativ abilităţile funcţionale normale şi calitatea vieţii. Este necesară o investigaţie de laborator pentru a evalua cauza anemiei. Decizia de transfuzie trebuie să se bazeze pe corelarea simptomelor pacientului cu datele de laborator. Medicamentele anticanceroase implicate în dezvoltarea anemiei sunt prezentate în tabelul 1.
Tratamentul anemiei include: transfuzie de eritrocite şi/sau stimularea sintezei de etritrocite (eritropoietină umană recombinantă, darbepoetină alfa)(5).
Neutropenia febrilă
Cu toate progresele legate de prevenire şi tratare, neutropenia febrilă rămâne una dintre cele mai frecvente şi grave reacţii adverse ale chimioterapiei. Este o cauză majoră a morbidităţii, de utilizare a resurselor medicale şi poate compromite eficacitatea tratamentului, deoarece determină întârzieri în realizarea schemelor de tratament, precum şi reduceri ale dozelor de chimioterapice. În timp s-a redus constant mortalitatea determinată de neutropenia febrilă, dar aceasta rămâne semnificativă(8).
Pentru schemele de tratament cu doze standard, chimioterapia este asociată cu 6-8 zile de neutropenie, iar neutropenia febrilă apare la aproximativ 8 cazuri din 1000 de pacienţi oncologici. 20-30% dintre pacienţi prezintă complicaţii care necesită spitalizare, cu o mortalitate generală de spitalizare de aproximativ 10%. Costul mediu pe spitalizare în ţările occidentale este de aproximativ 13.500 €(8).
Există o legătură clară între gravitatea neutropeniei (care influenţează direct incidenţa neutropeniei febrile) şi schema farmacografică a chimioterapiei. În prezent, diferite citostatice ca monoterapie sau asocieri de citostatice sunt clasificate ca producând un risc ridicat (>20%), un risc intermediar (10-20%) sau un risc scăzut (<10%) de neutropenie febrilă(9).
Între gradul şi durata neutropeniei şi riscul de infectare este o relaţie invers proporţională. Pentru pacienţii cu afecţiune neutropenică, obiectivul principal este prevenirea complicaţiilor infecţioase şi detectarea infecţiei la cel mai incipient stadiu. Dezvoltarea febrei la pacienţii cu neutropenie este o urgenţă medicală care necesită evaluare rapidă, deoarece la aceştia pot să lipsească semnele şi simptomele infecţiei, infecţiile evoluând rapid(5).
Managementul neutropeniei febrile include şi administrarea de factori de stimulare a coloniilor formatoare de granulocite (G-CSF: filgrastim, lenograstim şi pegfilgrastim) sau de granulocite şi macrofage (GM-CSF: sargramostim, molgramostim, regramostim), care reduc frecvenţa şi severitatea neutropeniei, a infecţiei, a sepsisului şi a altor complicaţii datorate neutropeniei(5).
Iniţierea promptă a antibioterapiei de primă intenţie cu antibiotic cu spectru larg, în doze maxime, iar calea de administrare se alege în funcţie de gradul de risc.
a) Grupă cu risc scăzut – tratament p.o. cu fluorochinolone (ciprofioxacină), asociate cu amoxicilină cu acid clavulanic (în mod excepţional, tratamentul se poate face ambulatoriu);
b) Grupă cu risc crescut – spitalizare, tratament i.v., monoterapie cu peniciline anti-Pseudomonas (piperacilină-tazobactam sau ticarcilină-clavulanat) ori cefalosporine de generaţia a III-a (ceftazidima, cefotaxim, cefoperazona + sulbactam) sau generaţia a IV-a (cefepima). În caz de probabilitate mare de infecţie cu germeni gram negativi rezistenţi, se asociază cu aminoglicozide (gentamicina, amikacina). În caz de probabilitate mare de infecţie cu pneumococ penicilinorezistent sau Streptococcus viridans, se asociază cu glicopeptid (vancomicină, teicoplanină) sau linezolid. În caz de suspiciune de infecţie cu germeni anaerobi, se asociază cu metronidazol(10).
Tratamentul este reevaluat după trei zile şi se modifică în funcţie de evoluţie (afebril sau febril) şi după rezultatul antibiogramei. În cazul identificării etiologiei, se adaptează tratamentul conform antibiogramei. Dacă nu este identificată etiologia şi pacientul este afebril, se continuă tratamentul cu antibiotic, dar dacă pacientul este febril, se schimbă penicilina sau cefalosporina cu un carbapenem (imipenem) asociat cu un antifungic (fluconazol, caspofungin)(10).
Durata tratamentului se stabileşte în funcţie de evoluţia numărului de neutrofile şi prezenţa febrei după 3-5 zile de tratament antibiotic. Dacă pacientul este afebril şi numărul neutrofilelor depăşeste 500/mm3 timp de două zile consecutive, se opreşte antibioterapia după 48 de ore. Dacă numărul de neutrofile este sub 500/mm3 şi pacientul este clinic stabil, antibioterapia se face 5-7 zile. Dacă pacientul este clinic instabil, antibioterapia se face maximum 14 zile şi apoi se reevaluează cazul. Pentru pacienţii cu febră persistentă după 3-5 zile şi pentru care numărul neutrofilelor depăşeşte 500/mm3 timp de două zile consecutiv, se opreşte antibioterapia după 4-5 zile şi apoi se reevaluează cazul. Pentru pacienţii cu febră persistentă după 3-5 zile şi număr de neutrofile sub 500/mm3, antibioterapia se face maximum 14 zile şi apoi se reevaluează cazul(10).
Terapia asociată antibioterapiei
A. Factori de creştere a coloniilor granulocitare: r-metHuG-CSF (filgrastim) este indicaţie majoră în neutropenia febrilă complicată (pneumonie, hTA, celulite sau sinuzite severe, infecţii fungice invazive, sepsis cu disfuncţii multiorganice) sau la pacienţii cu neutropenie severă (neutrofile sub 500/mm3 mai mult de 7 zile) infecţie documentată microbiologic şi care nu răspund la antibioterapia-ţintă.
B. Masă leucocitară: nu este terapie de rutină, doar în infecţii severe necontrolate de antibioterapie sau infecţii fungice severe necontrolate de tratamentul antifungic.
C. Măsuri de terapie suportivă: reechilibrare hidroelectrolitică, alimentaţie parenterală, terapia durerii, substituţie cu produs din sânge(10).
Trombocitopenia
Riscul moderat de sângerare apare când numărul de trombocite scade sub 50000 celule/mm3, iar riscul major este asociat cu o reducere a numărului de trombocite sub 10.000 celule/mm3. Manifestările clinice includ: echimoze, purpură, peteşii, sângerări ale mucoaselor. Antitumoralele care cauzează trombocitopenie sunt prezentate în tabelul 1.
Trombocitopenia moderată este tratată cu transfuzie de trombocite. Pentru reducerea transfuziei de trombocite, a fost autorizată de FDA interleukina umană 11 (factor de creştere trombopoietic, care stimulează direct proliferarea celulelor stem hematopoietice, induce maturarea megacariocitelor, celule precursoare pentru trombocite), dar aceasta a fost asociată cu numeroase efecte secundare la nivel cardiopulmonar.
Emeza şi greaţa
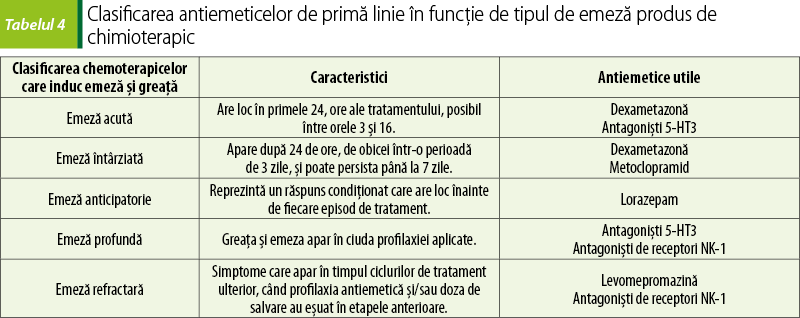
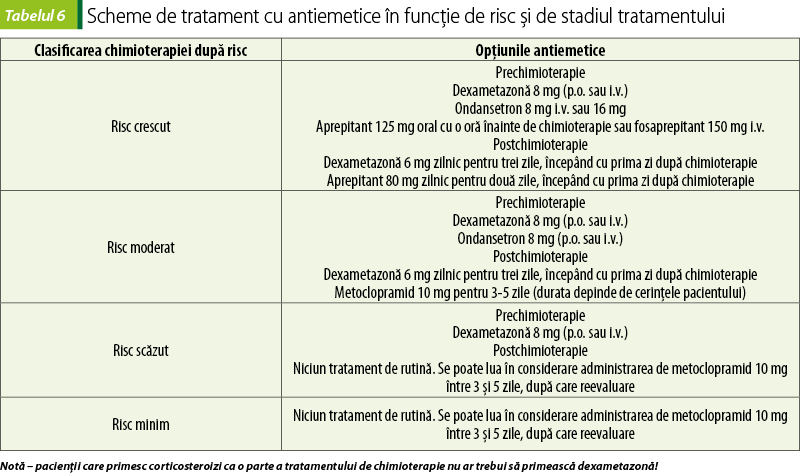
Greaţa şi emeza reprezintă cele mai neplăcute reacţii adverse ale chimioterapiei, în ciuda unor descoperiri recente în ceea ce priveşte managementul lor. Când nu sunt gestionate cum trebuie, acestea pot afecta calitatea vieţii pacientului şi au un impact negativ asupra tolerabilităţii tratamentului cu chimioterapice(12,13). Noile tendinţe de tratament presupun scheme terapeutice cu chimioterapice administrate oral şi cu autoadministrare, aşadar urmărirea neaderenţei crescute datorate emezei şi greţei devine din ce în ce mai relevantă. O importanţă majoră pentru a minimiza acest efect advers cu potenţial debilitant este reprezentat de înţelegerea corectă a mecanismelor prin care chimioterapicele produc aceste efecte şi factorii de risc care intervin pe parcursul tratamentului(14). După această etapă, alegerea celor mai potrivite antiemetice se poate face urmând un plan logic. Aceste reacţii adverse sunt atât de pregnante, încât pot determina pentru pacient disconfort fiziologic şi psihologic, putând culmina cu renunţarea la tratament. Greaţa apare la 4-6 ore după tratament şi poate dura până la 2 zile. Agenţii chimioterapici sunt clasificaţi şi în funcţie de emeza pe care o produc, în puternic emetici, moderat emetici şi slab emetici.
Deşi alegerea celor mai potrivite antiemetice va fi influenţată de factorii individuali ai pacientului, recomandările de primă linie sunt împărţite pe categorii, după caracteristicile terapeutice ale agentului care este folosit.
Când emeza nu este bine controlată, înainte de a se lua în calcul schimbarea tratamentului, este important să se excludă alte posibile cauze ale emezei – metastaze la nivelul sistemului nervos central, administrarea de alte medicamente(12,18).
Ţinta terapiei este să prevină cele trei faze ale greţei şi emezei. Emeza anticipatorie are loc înainte de administrarea tratamentului, emeza acută urmează în primele 24 de ore după tratament, iar emeza care persistă mai mult de 24 de ore după tratament este emeza întârziată(17,19).

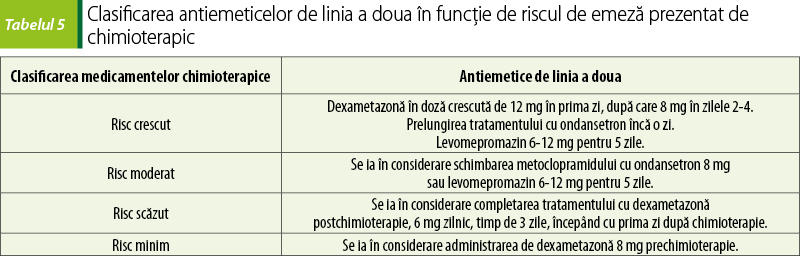
Combinaţiile de antagonişti 5-HT3 şi corticosteroizi reprezintă standardul folosit pentru tratarea emezei acute. Prevenirea greţei acute şi a emezei se realizează prin administrarea de antagonişti ai serotoninei – ondansetron, granisetron, în asociere cu corticosteroizi pentru medicamentele chimioterapice care prezintă potenţial emetic moderat sau ridicat. În cazul chimioterapicelor cu potenţial emetic scăzut, se folosesc corticosteroizi şi un antiemetic antagonist D2 – metoclopramid în doze mari(14,16).
Factorii de risc pentru un pacient cu chimioterapie sunt vârsta (<50 ani), sexul feminin, niciun/minim antecedent al consumului de alcool şi tutun, susceptibilitate la rău de mişcare, terapie anterioară cu chimioterapice, anxietate, emeza din timpul sarcinii, hipercalcemia, obstrucţia gastrointestinală. Odată excluse, se poate lua în considerare o linie de tratament alternativ(15).
În plus, în completarea tratamentului medicamentos, pacientul mai poate beneficia de intervenţii nefarmacologice – terapie prin masaj, autohipnoză, terapie prin muzică(20).
Constipaţia
La pacienţii al căror cancer are drept consecinţă imobilitate şi debilitate sau la cei care au în tratament analgezice opioide, constipaţia constituie o problemă particulară. Multe din medicamentele folosite în terapia cancerului pot determina constipaţie, mai ales opioidele. Ele cauzează inhibarea contracţiei muşchilor netezi şi secreţie intestinală. Secundar, apare o absorbţie intestinală a fluidelor şi electroliţilor. Constipaţia poate apărea de asemenea în cazul pacienţilor care au fost trataţi cu agenţi chimioterapici neurotoxici. Alţi factori care pot contribui la apariţia constipaţiei sunt motilitatea intestinală redusă, hipercalcemia, deshidratarea, administrarea de opioide, imobilitatea, vârsta înaintată, hipokaliemia, alkaloizii de vinca şi costicosteroizii(21).
Management. Constipaţia cronică reprezintă o problemă la pacienţii cu cancer, care este mai uşor de prevenit decât de tratat. Aceasta poate fi minimizată printr-o dietă bogată în fibre, fructe proaspete, legume şi lichide adecvate. Din punct de vedere medicamentos, două dintre cele mai potente laxative acceptate pentru uz pe termen lung sunt lactuloza şi sorbitolul(21).
Diareea
Printre cauzele diareii la pacienţii cu cancer se numără chimioterapia, radioterapia, boala însăşi, suplimentele alimentare, anxietatea sau infecţia cu Clostridium difficile. Consecinţele diareii includ deshidratarea, pierderea de albumină, de electroliţi şi nutrienţi(21). Medicamentele incriminate în producerea diareii sunt: metotrexat, citarabin, nitrosourea, paclitaxel, irinotecan, floxuridina.
Management. În cazul apariţiei diareii la pacienţii care suferă de cancer, este important să fie identificată şi eliminată cauza şi să fie întreruptă, dacă e posibil, medicaţia suspectată a fi responsabilă, precum şi începerea tratamentului cu antibioticele potrivite. Managementul tratamentului în cazul diareii este simptomatic şi nu necesită o modificare în terapia cancerului. Abordarea farmacologică se face după 12-24 de ore dacă nu există un răspuns adecvat sau imediat dacă este prezentă diareea de grad 3 sau 4. Tratarea diareii include administrarea de caolin, pectine, loperamid sau octreotid(22).
Toxicitatea orală
Mucoasa bucală normală prezintă o rată de reînnoire (turnover rate) între 5 şi 16 zile şi reprezintă un efect citotoxic cu risc crescut al chimioterapiei. Mucoasa se poate infecta secundar dacă există o ulceraţie care poate funcţiona ca poartă de intrare pentru infecţiile sistemice(23).
Proliferarea normală epitelială este afectată, iar rata de reînnoire a suprafeţei mucoasei este încetinită, având drept consecinţă stomatita, disfagia, diareea, ulceraţiile orale şi proctita, cu durere şi sângerare(24). Probabilitatea dezvoltării stomatitei în urma administrării unui medicament depinde de agentul respectiv, de doză şi de ritmul de administrare(23).
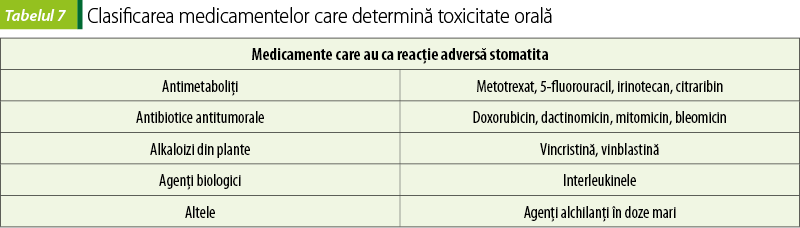
Management. Toxicitatea orală a anticanceroaselor poate fi prevenită printr-o nutriţie corespunzătoare, iar igiena dentară potrivită şi detectarea timpurie sunt esenţiale. Complicaţiile orale pot fi evitate prin folosirea de agenţi de curăţare, lubrifianţi şi analgezice sistemice sau anestezice cu efect local(25). Infecţia orală secundară trebuie tratată prompt şi corespunzător. Infecţiile fungice pot fi tratate folosind suspensie cu nistatin pentru badijonaj bucal, clotrimazol sau fluconazol oral. Infecţiile virale se tratează cel mai des cu aciclovir administrat oral sau i.v.(26).
Alopecia
Alopecia este cel mai comun efect advers cutanat legat de efectele citotoxice ale medicamentelor asupra proliferării rapide a celulelor foliculului de păr. Pierderea de păr indusă de chimioterapie nu reprezintă neapărat o complicaţie fiziologică severă, însă din punct de vedere psihologic, poate fi unul dintre cele mai devastatoare efecte adverse şi poate cauza un impact emoţional sever la unii pacienţi. Alopecia indusă de chimioterapice este doză-dependentă şi este reversibilă la oprirea tratamentului. Expunerea repetată la agenţi citotoxici determină pierderea completă a părului. Alţi foliculi de păr terminali, precum cei ai sprâncenelor, genelor sau părul pubian, sunt câteodată afectaţi. Părul reîncepe să crească de obicei normal după completarea tratamentului. Medicamentele anticancer care determină alopecie sunt: doxorubicin, daunorubicin, vincristină, paclitaxel, ifosamid, etoposid, metotrexat(27).
Management. Un aspect foarte important îl constituie informarea şi pregătirea pacientului în vederea posibilei alopecii. Studii recente au demonstrat că utilizarea produsului Imuvert® – un preparat ribozomal cu vezicule de membrană dintr-o bacterie – poate anula parţial sau complet alopecia cauzată de agenţii chimioterapeutici(28).
Toxicitatea cardiacă
Cardiomiopatia este cea mai cunoscută reacţie adversă a chimioterapiei, datorată unei posibile afectări mediate prin intermediul radicalilor liberi(29). Ischemia miocardiacă, pericardita, aritmia, angina şi modificările valorilor EKG-ului apar mult mai puţin frecvent(30). Antraciclinele prezintă cel mai mare risc pentru cardiomiopatie(31). Efectele acute se manifestă în câteva ore de la administrare şi includ aritmia şi tahicardia sinusală. Cardiomiopatia subacută poate apărea în timpul sau la două săptămâni sau chiar luni după tratament, în unele cazuri posibilitatea apariţiei acestei reacţii prelungindu-se până la un an. O declanşare târzie a toxicităţii cardiace poate avea loc între 1 şi 5 ani de la începerea tratamentului(30,32).
Management. Principala strategie în cazul toxicităţii cardiace este reprezentată de prevenire şi detectarea timpurie. Utilizarea chelatorului de fier cardioprotector dexrazoxanul reprezintă abordarea de prevenire primară(33).
Precauţii speciale pentru eliminarea reziduurilor de antineoplazice
Trebuie acordată atenţie în cursul manipulării tuturor antineoplazicelor. Trebuie purtate mănuşi de protecţie corespunzătoare, pentru evitarea contactului medicamentului cu tegumentele şi mucoasele. Toate obiectele utilizate pentru prepararea şi administrarea citotoxicelor sau care au intrat în contact cu acestea în orice fel trebuie îndepărtate, în concordanţă cu ghidurile de înlăturare locale privind manipularea compuşilor citotoxici(11).
B. Îngrijirea paliativă a pacientului oncologic
Definiţii
Potrivit Organizaţiei Mondiale a Sănătăţii (OMS), îngrijirea paliativă reprezintă acea formă de îngrijire care are ca scop ameliorarea calităţii vieţii pacienţilor şi a aparţinătorilor acestora, pentru a face faţă problemelor cauzate de boli incurabile cu prognostic defavorabil; îngrijirea este centrată pe prevenţia şi înlăturarea suferinţei, prin identificarea precoce, evaluarea şi tratarea cu maximă eficienţă a durerii şi a altor probleme fizice, psihosociale şi spirituale(34).
Îngrijirea de tip azil (hospice) are aceleaşi obiective, dar se desfăşoară într-un cadru instituţional, precum centrele de zi sau cu caracter permanent, iar personalul organizat în echipe multidisciplinare asigură în mod intensiv satisfacerea tuturor nevoilor fizice, emoţionale, sociale şi spirituale ale pacienţilor(35).
Un caz particular al îngrijirii paliative este îngrijirea de suport, care se ocupă cu prevenirea şi gestionarea efectelor adverse ale cancerului şi ale tratamentelor oncologice. Se consideră că îngrijirea de suport se adresează pacienţilor aflaţi încă sub tratament cu antineoplazice şi supravieţuitorilor, în timp ce îngrijirea paliativă propriu-zisă se concentrează mai ales asupra pacienţilor aflaţi în faza terminală şi pentru care tratamentul a fost deja sistat, principala diferenţă între cele două noţiuni fiind aceea că îngrijirea de suport face parte din îngrijirea oncologică, în timp ce îngrijirea paliativă are un caracter mai general, aplicându-se tuturor pacienţilor suferind de diverse boli în stadiu terminal(36,37).
Îngrijirea la sfârşit de viaţă este o formă particulară de îngrijire paliativă care se adresează pacienţilor muribunzi aflaţi în ultimele ore şi zile de viaţă, venind în întâmpinarea nevoilor specifice acestui moment. Deşi termenul se foloseşte mai ales în tratamentul pacienţilor oncologici, acest tip de îngrijire este aplicabil tuturor pacienţilor aflaţi în acest punct, indiferent de patologie(38).
Îngrijirea de tip „respiro“ este o formă de asistenţă cu caracter discontinuu, menită să vină atât în întâmpinarea aparţinătorilor sau îngrijitorilor primari ai unui pacient cu nevoi de îngrijire paliativă, cât şi a pacientului însuşi, când îngrijirea primară continuă devine prea împovărătoare şi sunt necesare pauze planificate sau neplanificate(39).
Context
Pentru 2017 au fost previzionate în SUA 1,68 milioane de noi cazuri de cancer şi peste 600.000 dintre pacienţi s-a estimat că vor deceda. Incidenţa cancerelor este în creştere la nivel global, proporţional cu numărul de potenţiali supravieţuitori care trebuie să îndure simptome şi dizabilităţi consecutive bolii canceroase(40). Un amplu studiu observaţional de cohortă a evidenţiat faptul că peste o treime dintre pacienţii bolnavi de cancer raportează simptome moderate sau severe din toate categoriile (durere, greaţă, vomă, depresie, anxietate, ameţeli, dispnee, oboseală etc.) în ultimele săptămâni de viaţă(41). În ultimii 20 de ani, aspectele care ţin de calitatea vieţii pacienţilor oncologici pe parcursul bolii şi/sau tratamentului au căpătat o importanţă crescândă. Astfel, îngrijirea paliativă în oncologie a început cu îngrijirea de tip azil şi de sfârşit de viaţă, dar s-a dezvoltat într-o parte integrantă a tratamentului oncologic, acordată devreme, în paralel cu tratamentul de bază(42).
Îngrijirea paliativă trebuie iniţiată de echipa oncologică primară (medic specialist, asistentă medicală, asistent social, psiholog, farmacist, nutriţionist, preot) şi apoi amplificată prin colaborare cu o echipă interdisciplinară de experţi în îngrijirea paliativă care să vină în întâmpinarea problemelor psihosociale complexe. În momentul în care se estimează că menţinerea tratamentului oncologic nu mai poate aduce beneficii suplimentare sau chiar poate face mai mult rău decât bine, îngrijirea paliativă devine forma principală de îngrijire a pacienţilor suferinzi de cancere terminale(42).
Filosofia îngrijirii paliative(43)
Deşi abordările îngrijirii paliative sunt diferite la nivel european şi nord-american, există o serie de linii directoare şi valori comune ale conceptului general de îngrijire paliativă.
Autonomia
Îngrijirea paliativă respectă şi recunoaşte individualitatea, unicitatea şi autonomia decizională a fiecărui pacient, sens în care ea va fi oferită numai când atât pacientul, cât şi aparţinătorii sunt pregătiţi să o accepte. Pentru a putea decide în cunoştinţă de cauză, pacientul şi/sau aparţinătorii trebuie să primească informaţii corecte, exprimate clar şi pe înţelesul lor despre diagnostic, prognostic, tratament, opţiuni terapeutice şi natura îngrijirii paliative.
Demnitate
Îngrijirea paliativă trebuie executată în mod respectuos, deschis şi atent la credinţele, valorile, practicile personale, religioase şi culturale specifice fiecărui pacient, cu respectarea normelor legislative din ţara pe teritoriul căreia se realizează.
Cooperare
Personalul de specialitate care se ocupă cu îngrijirea paliativă trebuie să dezvolte o relaţie de colaborare cu pacienţii şi aparţinătorii lor pentru planificarea îngrijirii şi pentru optimizarea rezultatelor acesteia. Atât cooperarea, cât şi eficienţa îngrijirii pot fi îmbunătăţite prin axarea mai mult pe resursele şi pe competenţele pacientului decât pe dificultăţile întâmpinate de acesta. Un accent mai mare pe capacitatea de rezistenţă a pacientului în faţa bolii incurabile de care suferă şi a problemelor colaterale (adică pe resurse) favorizează un tonus psihic pozitiv, spre deosebire de cel care este indus punând accent mai mare pe simptomele, riscurile, problemele şi vulnerabilităţile consecutive bolii (adică pe deficit).
Calitatea vieţii
Sprijinirea, conservarea şi îmbunătăţirea calităţii vieţii sunt obiective centrale pentru îngrijirea paliativă, deşi acest concept nu poate fi standardizat, fiind subiectiv şi în strânsă corelaţie cu percepţia individuală a fiecărui pacient. Dimensiunile calităţii vieţii, precum şi priorităţile care ţin de aceasta se schimbă adesea în funcţie de evoluţia bolii, iar îngrijirea paliativă trebuie să fie suficient de flexibilă încât să se adapteze acestor schimbări.
Poziţia faţă de viaţă şi moarte
În accepţiunea OMS, „medicina paliativă susţine viaţa şi consideră moartea un proces normal“. Îngrijirea paliativă nu încearcă nici să grăbească, nici să amâne moartea, deoarece consideră moartea ca un deznodământ firesc al vieţii. Eutanasia sau suicidul asistat nu trebuie să facă parte din responsabilitatea îngrijirii paliative(44).
Comunicarea
O îngrijire paliativă de calitate nu se poate realiza fără o bună comunicare axată pe trei direcţii: personal medical – pacient, personal medical – aparţinători şi între membrii personalului medical aparţinând diverselor departamente implicate în îngrijire. Comunicarea nu se referă doar la schimbul de informaţii, ci şi la capacitatea îngrijitorilor de a empatiza cu pacientul, de a înţelege solicitările lui şi de a le soluţiona cu sinceritate şi dăruire, sens în care trebuie asigurate toate condiţiile necesare unei comunicări eficiente.
Abordare multiprofesională şi interdisciplinară
Deşi condiţiile minimale de îngrijire paliativă pot fi asigurate de o singură persoană, aparţinând unei singure profesii, complexitatea îngrijirii paliative de calitate superioară impune o colaborare strânsă şi permanentă între exponenţi ai diverselor profesii şi discipline, pentru a putea oferi un sprijin optim pe plan fizic, psihologic, spiritual şi social. Există studii care atestă că o astfel de abordare scade în mod semnificativ statistic costul medical total prin reducerea timpului petrecut de pacient în mediul intraspitalicesc.
Durerea
Managementul durerii în cadrul îngrijirii paliative se axează atât pe tratarea durerii fizice resimţite de pacientul în stadiul terminal, cât şi asupra durerii emoţionale resimţite de aparţinători în ultimele zile de viaţă ale pacientului şi imediat după decesul acestuia, în perioada de doliu. Serviciile de suport în perioada de doliu sunt recunoscute ca o componentă de bază a serviciilor de îngrijire paliativă(45).
Niveluri de îngrijire paliativă(45)
Abordarea paliativă
Abordarea paliativă este o modalitate de a integra metodele şi procedurile de îngrijire paliativă în medii nespecializate pentru îngrijirea paliativă. Aceasta nu cuprinde doar măsuri farmacologice şi nefarmacologice de control al simptomelor, ci şi comunicarea cu pacientul, familia sau alţi profesionişti şi stabilirea obiectivelor în conformitate cu principiile generale de îngrijire paliativă.
Îngrijire paliativă generală
Profesioniştii implicaţi mai frecvent în îngrijirea paliativă, precum medicii oncologi şi geriatri, a căror activitate nu se concentrează în principal pe acordarea acestui tip de îngrijire, dar care au dobândit educaţie şi instruire specializată, pot oferi îngrijire paliativă generală.
Îngrijirea paliativă de specialitate
Îngrijirea paliativă de specialitate este oferită de servicii specializate pacienţilor cu probleme complexe care nu sunt acoperite corespunzător de alte opţiuni de tratament.
Serviciile specializate de îngrijiri paliative necesită o abordare de echipă, care să combine echipele interprofesionale cu un mod de lucru interdisciplinar. Membrii echipei trebuie să aibă o înaltă calificare, iar activitatea acestora trebuie să se concentreze strict pe îngrijirea paliativă.
Centre de excelenţă
Centrele de excelenţă trebuie să ofere îngrijire paliativă de specialitate într-o gamă variată de medii, inclusiv îngrijire în regim de internare şi ambulatorii, îngrijire la domiciliu şi servicii de consultare, şi trebuie să ofere unităţi academice de cercetare şi educare.
Furnizarea îngrijirilor paliative(46)
Pentru a putea furniza în mod eficient îngrijiri paliative, trebuie avute în vedere următoarele aspecte:
- planificarea în avans a îngrijirii;
- accesul la servicii;
- continuitatea îngrijirii;
- locul preferat de acordare a îngrijirilor.
Planificarea îngrijirii
În mod normal, pacientul, aparţinătorii şi echipa de îngrijire discută planificarea şi oferirea îngrijirii paliative, în funcţie de preferinţele pacientului, de resursele disponibile şi de cele mai bune recomandări medicale. Directivele privind planificarea în avans a îngrijirii le permit pacienţilor să-şi păstreze autonomia personală şi să ofere instrucţiuni de îngrijire pentru cazurile în care pacienţii nu mai au discernământ şi nu mai sunt capabili să ia decizii(47).
Accesul la servicii
Serviciile trebuie să fie accesibile de îndată tuturor pacienţilor, oriunde şi oricând aceştia le solicită. Accesul la îngrijiri paliative de înaltă calitate nu trebuie să depindă de resursele financiare ale pacienţilor sau ale îngrijitorilor.
Continuitatea îngrijirii
Continuitatea îngrijirii pe parcursul evoluţiei bolii şi în diferite medii din sistemul sanitar este o cerinţă de bază a îngrijirii paliative. Continuitatea îngrijirii contribuie la evitarea erorilor şi a suferinţei inutile a pacienţilor afectaţi de o boală incurabilă; aceasta poate elimina sentimentul de abandon al pacientului şi al familiei şi va asigura respectarea alegerii şi preferinţelor pacientului.
Locul preferat de acordare a îngrijirilor
Cei mai mulţi dintre pacienţi doresc să fie îngrijiţi la domiciliu, dacă este posibil, până la momentul decesului. Cu toate acestea, locul de deces al majorităţii pacienţilor este spitalul sau centrul de îngrijire. Tratamentul, îngrijirea şi suportul paliativ sunt furnizate de obicei la domiciliu, în centre de îngrijire, în cămine de bătrâni, în spitale şi în aziluri sau, la cerere, în alte medii de îngrijire. Locul preferat de furnizare a îngrijirii şi locul decesului ar trebui discutate cu pacientul şi cu familia şi ar trebui luate măsuri pentru respectarea, pe cât posibil, a acestor preferinţe.
În prezent, se admite că îngrijirea paliativă în comunitate ar trebui furnizată de-a lungul unei largi palete de specializări, care se extinde de la îngrijirea medicală primară la serviciile a căror activitate centrală este limitată la furnizarea de îngrijiri paliative(48).
Îngrijirea paliativă poate fi furnizată ca o abordare de îngrijiri paliative sau ca îngrijire paliativă generală în cadrul serviciilor nespecializate, precum şi în cadrul serviciilor specializate de îngrijiri paliative(45).
Serviciile nespecializate de îngrijiri paliative sunt:
- medici de familie;
- servicii de îngrijire în ambulatoriu;
- unităţi spitaliceşti;
- centre de îngrijire.
Serviciile specializate de îngrijiri paliative sunt:
- unităţi cu paturi de îngrijiri paliative de tip azil;
- echipe mobile de îngrijiri paliative în spitale;
- echipe de îngrijiri paliative la domiciliu;
- centre de zi;
- clinici ambulatorii.
Având în vedere speranţa de viaţă limitată a pacienţilor aflaţi în îngrijire paliativă, ar trebui introduse căi rapide de îngrijire în cadrul serviciilor medicale.
Managementul durerii
Managementul durerii în îngrijirea paliativă se concentrează pe dobândirea unui control al durerii prin administrarea medicamentului potrivit, la doza potrivită şi la timpul optim. Analgezicele folosite se pot împărţi în trei clase: nonopioide (paracetamol), opioide (codeină, morfină) şi adjuvante (antidepresive, antiepileptice). Se utilizează combinaţii din diferite clase, în funcţie de tipul de durere şi de răspunsul la tratament. Analgezicele sunt mai eficiente în prevenirea durerii decât în uşurarea durerii deja prezente, de aceea este important să se administreze regulat(49).
Pentru a gestiona o durere uşoară e suficient tratamentul cu paracetamol sau cu un antiinflamator nesteroidian. Dacă analgezicele nonopioide nu sunt suficient de active, atunci analgezicele opioide, singure sau în combinaţie cu analgezicele nonopioide la o doză adecvată, pot fi de ajutor în controlul durerii moderate. Codeina sau tramadolul se pot lua în considerare pentru acest tip de durere(52).
În caz contrar, morfina este cel mai util analgezic opioid. Tratamentul alternativ pentru morfină – plasturii transdermici cu buprenorfină, fentanil, hidromorfonă, metadonă sau oxicodonă – ar trebui iniţiat de cei cu experienţă în îngrijirea paliativă. Începerea tratamentului cu un analgezic opioid nu ar trebui întârziată din cauza unei îngrijorări asupra unei dependenţe teoretice de tip adicţie.
Faţă de abordarea prezentată, alte mijloace utile pentru tratarea durerii în acest caz mai sunt reprezentate de radioterapie sau de tratamentul cu bifosfonaţi şi izotopi radioactivi de stronţiu, în cazul metastazelor osoase(50).
Pacienţii cu durere neuropată pot beneficia de un tratament cu antidepresive triciclice, la care se poate adăuga un antiepileptic dacă durerea persistă – gabapentin sau pregabalin. Câteodată se foloseşte şi ketamina, dar sub supravegherea unui specialist în durerea neuropată care nu răspunde la analgezice opioide. Durerea datorată compresiei nervilor poate fi redusă folosind un corticosteroid precum dexametozana, care reduce edemul din jurul tumorii, reducând astfel şi compresia. Blocarea nervilor sau tehnicile de anestezie regională (inclusiv utilizarea de catetere epidurale sau intratecale) se pot lua în calcul când durerea este localizată într-o zonă specifică.
Managementul durerii cu opioide
Tratamentul cu morfină se administrează oral, folosind preparate cu eliberare imediată sau modificată. Doza iniţială se stabileşte în funcţie de medicaţia folosită anterior, de severitatea durerii şi ţinând cont şi de alţi factori, precum afectarea renală sau vârsta înaintată. Doza se administrează ori sub forma unui preparat cu eliberare imediată – în 4 ore – sau cu eliberare modificată – în 12 ore. Dacă durerea apare între dozele obişnuite de morfină (durere episodică intensă), o doză adiţională (doza de salvare), de morfină cu eliberare imediată ar trebui administrată.
O doză suplimentară ar trebui de asemenea administrată cu 30 de minute înainte de o activitate care cauzează durere, cum este bandajarea. Doza standard de opioid puternic pentru durerea episodică intensă este de obicei între 1/6-1/10 din doza obişnuită pentru 24 de ore, repetată la 2-4 ore (sau chiar din oră în oră dacă durerea este severă ori sunt ultimele zile din viaţă). Fiecare pacient ar trebui evaluat pe baze individuale(49).
Formulările cu fentanil care se administrează nazal, bucal sau sublingual sunt, de asemenea, indicate în durerea episodică intensă.
Când se ajustează doza de morfină, numărul de doze de salvare necesare şi răspunsul la tratament ar trebui luate în considerare; creşterea dozei de morfină nu ar trebui să depăşească 1/3-1/2 din doza zilnică pentru 24 ore.
Prin urmare, doza ar trebui ajustată cu evaluarea atentă a durerii, iar utilizarea de analgezice adjuvante ar trebui de asemenea luată în considerare. Creşterea dozei de morfină se opreşte când durerea este uşurată sau când apar efecte adverse nedorite, după care este necesar să se considere măsuri alternative.
Morfina cu eliberare imediată 30 mg/4 ore – sau cea cu eliberare modificată (100 mg/12) ore este de obicei adecvată pentru majoritatea pacienţilor; unii pacienţi au nevoie de morfină cu eliberare imediată până la 200 mg/4 ore sau cu eliberare modificată – 600 mg la 12 ore. Odată ce durerea este controlată, pacienţii pot trece de la morfina cu eliberare imediată la 4 ore la aceeaşi doză pentru 24 de ore. Modificările ar trebui făcute ţinând cont de doză, şi nu de frecvenţa de administrare. Pacientul trebuie monitorizat corespunzător, pentru a evalua eficacitatea şi reacţiile adverse, în special constipaţia, greaţa şi emeza. Un laxativ ar trebui prescris de rutină(51).
Oxicodona se poate utiliza la pacienţii care au nevoie de un opioid, dar care nu pot tolera morfina. Dacă pacientul a primit deja un opioid, doza de oxicodonă ar trebui să fie echivalentă cu cea a analgezicului curent. Oxicodona din preparatele cu eliberare imediată poate fi administrată pentru durerea profundă.
Doza parenterală echivalentă (s.c., i.m sau i.v.) este aproximativ jumătate din doza care se administrează oral.
Dacă pacientul are probleme de deglutiţie, morfina se administrează s.c. sub formă de perfuzie continuă. Câteodată se preferă utilizarea diamorfinei, deoarece, datorită solubilităţii, se poate administra în volum mai mic. Doza de diamorfină s.c. reprezintă aproximativ 1/3 din doza orală de morfină.
Dacă pacientul poate relua administrarea medicamentelor pe cale orală, atunci morfina orală poate substitui morfina sau diamorfina administrate s.c.
Morfina este disponibilă şi pentru administrare rectală, sub formă de supozitoare. Alternativ, se pot folosi supozitoare cu oxicodonă.
Preparatele transdermice cu fentanil şi buprenorfină nu sunt potrivite în cazul durerii acute la pacienţii ale căror nevoi din punct de vedere analgezic se schimbă rapid. Medicii prescriptori ar trebui să se asigure că sunt familiarizaţi cu utilizarea corectă a plasturilor transdermici, deoarece utilizarea defectuoasă poate determina probleme grave(52).
În concluzie, cele două aspecte tratate în acest articol, managementul reacţiilor adverse ale chimioterapicelor şi îngrijirea paliativă a pacientului oncologic, necesită atenţie deosebită şi trebuie realizate astfel încât, permanent, binele pacientului să primeze.
Bibliografie
- Cancer Australia. EdCaN module: Fundamentals of antineoplastic agent therapy for cancer. version 2.3. 2018.
- Meyer UA. Pharmacogenetics and adverse drug reactions. Lancet. 2000 Nov 11;356(9242):1667-71.
- Edwards IR, Aronson JK. Adverse drug reactions: definitions, diagnosis, and management. Lancet. 2000;356: 1255–1259.
- Devita VT, Hellman S and Rosenberg SA. Principles and Practice of Oncology, 9th edition. Lippincott Williams and Wilkins. 2011.
- Remesh A. Toxicities of anticancer drugs and its management. International Journal of Basic & Clinical Pharmacology, 2012 1(1), 2-12. . Retrieved from http://www.ijbcp.com/index.php/ijbcp/article/view/1388/1241.
- Moore DC. Drug-Induced Neutropenia: A Focus on Rituximab-Induced Late-Onset Neutropenia. Pharmacy and Therapeutics. 2016;41(12):765-768.
- ANM- RCP Endoxan. 2016.
- Klastersky J, de Naurois J, Rolston K, Rapoport B et al. Management of febrile neutropaenia: ESMO Clinical Practice Guidelines. Ann Oncol. 2016;27 (5): v111–v118, https://doi.org/10.1093/annonc/mdw325.
- Crawford J, Becker PS, Armitage JO, Blayney DW, Chavez J, Curtin P, Dinner S, Fynan T, Gojo I, Griffiths EA, Hough S, Kloth DD, Kuter DJ, Lyman GH, Mably M, Mukherjee S, Patel S, Perez LE, Poust A, Rampal R, Roy V, Rugo HS, Saad AA, Schwartzberg LS, Shayani S, Talbott M, Vadhan-Raj S, Vasu S, Wadleigh M, Westervelt P, Burns JL, Pluchino L. Myeloid Growth Factors, Version 2.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2017 Dec;15(12):1520-1541. doi: 10.6004/jnccn.2017.0175.
- Popp A. Neutropenia febrilă. P-HTM-13. Ghid propus de Centrul de Hematologie şi Transplant medular. Institutul Clinic Fundeni. 2016. Accesat 04.2018 (http://srh.org.ro/wp-content/uploads/2016/08/document_17.pdf).
- ANM-RCP Paclitaxel EBEWE 2016.
- Carelle N et al. Changing patient perceptions of the side effects of cancer chemotherapy. Cancer. 2002;95(1):155-63.
- Grunberg SM et al. Incidence of chemotherapy-induced nausea and emesis after modern antiemetics. Cancer. 2004;100(10):2261-8.
- Miller AD, Wilson VJ. „Vomiting Centre“ reanalyze an electrical stimulation study. Brain res. 1983;270:154-8.
- Hesketh PJ et al. Evaluation of risk factors predictive of nausea and vomiting with current standard-of-care antiemetic treatment: analysis of two phase III trials of aprepitant in patients receiving cisplatin-based chemotherapy. Support Care Cancer. 2010;18(9):1171-7.
- Hesketh P et al. Double-blind, randomized comparison of the anti-emetic efficiency of intravenous dolansetron mesylate and intravenous ondansetron in the prevention of acute cisplatin-induced emesis in patients with cancer. J Clin Oncol. 1997;15:103-9.
- Roila F et al. Prevention of chemotherapy-and radiotherapy-induced emesis: results of the 2004 Perugia International Antiemetic Consensus Conference. Ann Oncol. 2006;17:20-8.
- Basch E et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2011;29:4198-98.
- Malik IA et al. Clinical efficacy of lorazepam in prophylaxis of anticipatory, acute, and delayed nausea and vomiting induced by high doses of cisplatin. A prospectove randomized trial. Am J Clin Oncol. 1995;18:170-5.
- Multinational Association of Supportive Care in Cancer (MASCC). www.mascc.org/antiemetic-guidelines (accesat 19 aprilie 2018).
- Early DS. Gastrointestinal complication of chemotherapy. Cancer chemotherapy source book. Michel C Perrie. 2001;3:427-31 .
- Gibson RJ, Stringer AM. Chemotherapy-induced diarrhoea. Current Opinion Support Palliative Care. 2009;3:31-5 .
- Sharma R, Tobin P, Clarke SJ. Management of chemotherapy-induced nausea, vomiting, oral mucositis, and diarrhoea. Lancet Oncol. 2005;6: 93-102 .
- Main BE, Calman KC, Ferguson MM, Kaye SB, Mac Far lane TW, Mairs RJ et al. The effect of cytotoxic therapy on saliva and oral flora. Oral Surg Oral Med Oral Pathol. 1984;58:545-8 .
- Sonis S, Clark J. Prevention and management of oral mucositis induced by antineoplastic therapy. Oncology (Williston Park). 1991;5:11-8 .
- Peterson DE. Research advances in oral mucositis. Curr Opin Oncol. 1999;11: 261-66 .
- Jimenez JJ, Huang HS, Yunis AA. Treatment with ImuVert/JV-Acetyl cysteine Protects Rats from Cyclophosphamide / Cytarabine-Induced Alopecia. Cancer Invest. 1992;10:271-6 .
- Jimenez JJ, Sawaya ME, Yunis AA. Interleukin 1 protects hair follicles from cytarabine (ARA-C)-induced toxicity in vivo and in vitro. FASEB J. 1992;6:911-3 .
- Keizer HG, Pinedo HM, Schuurhuis GJ, Joenje H. Doxorubicin (adriamycin): a critical review of free radical-dependent mechanisms of cytotoxicity. Pharmacol Ther. 1990;47:219-31 .
- Michael C, Ewer S, Benjamin RS. Cardio toxicity of chemotherapeutic drugs, The Chemotherapy source book, 2nd edition, Michael C Perry. 1996;651-9 .
- Boll DC, Yarbro JW. Vascular toxicity. The chemotherapy source book, 2nd edition, Michael C Perry. 1996;767-75 .
- Hardy D, Liu CC, Cormier JN, Xia R, Du XL. Cardiac toxicity in association with chemotherapy and radiation therapy in a large cohort of older patients with non-small-cell lung cancer. Ann Oncol. 2010;21:1825-33 .
- Russo A, Mitchell JB. Potentiation and protection of doxorubicin cytotoxicity by cellular glutathione modulation. Cancer Treat Rep. 1985;69: 1293-6.
- Council of Europe. Recommendation Rec (2003) 24 of the Committee of Ministers to member states on the organisation of palliative care. 2003 .
- Centeno C, Clark D, Lynch T et al. EAPC Atlas of Palliative Care in Europe. Houston: IAHPC Press. 2007.
- Multinational Association of Supportive Care in Cancer. MASCC strategic plan. 2007. www.mascc.org.
- Smyth JF. Disclosing gaps between supportive and palliative care: the past 20 years. Support Care Cancer. 2008;16: 109–111.
- Department of Health. End of Life Care Strategy: Promoting high quality care for all adults at the end of life. London: DH, 2008.
- Ingleton C, Payne S, Nolan M, Carey I. Respite in palliative care: a review and discussion of the literature. Palliat Med. 2003;17: 567–575.
- Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67:7–30.
- Seow H, Barbera L, Sutradhar R, et al. Trajectory of performance status and symptom scores for patients with cancer during the last six months of life. J Clin Oncol. 2011;29:1151–1158 .
- Dans M, Smith T, Black A, Baker JN et al. NCCN Guidelines Insights Palliative Care, Version 2.2017, Featured Updates to the NCCN Guideliness. JNCCN. 2017;15(8):989-997.
- Radbruch L, Payne S. White paper on standards and norms for hospice and palliative care in Europe: part 1. European Journal of Palliative Care,2009 vol 16, no. 6.;278-289.
- Materstvedt LJ, Clark D, Ellershaw J et al. Euthanasia and physicianassisted suicide: a view from an EAPC Ethics Task Force. Palliat Med. 2003;17: 97–101;discussion 102–179.
- Council of Europe. Recommendation Rec (2003) 24 of the Committee of Ministers to member states on the organisation of palliative care. 2003 .
- Radbruch L, Payne S. White Paper on standards and norms for hospice and palliative care in Europe: part 2. European Journal of Palliative Care, 2010; vol 17, no. 1.;22-33.
- Kaas-Bartelmes BL, Hughes R, Rutherford MK. Advance care planning: preferences for care at the end of life. Rockville: US Department of Health and Human Service, Agency for Healthcare Research and Quality. 2003 .
- Tomlinson S. National Action Planning Workshop on End-of-life Care. Winnipeg: Health Canada Secretariat on Palliative and End-of-life Care. 2002 .
- BMJ Group, Royal Pharmaceutical Society. https://www.bnf.org, 71. 2016.Prescribing in palliative care, pp. 40-44.
- Use of Opioids for the Treatment of Chronic Pain. The American Academy of Chronic Pain. http://www.painmed.org/files/use-of-opioids-for-the-treatment-of-chronic-pain.pdf (accesat 18 Aprilie 2018).
- Methadone for Pain Management: Improving Clinical Decision Making. The American Academy of Chronic Pain. http://www.painmed.org/files/methadone-for-pain-management-improving-clinical-decision-making.pdf (accesat 18 Aprilie 2018).
- Clinical Practice Guidelines. American Pain Society. http://americanpainsociety.org/education/guidelines/overview (accesat 18 Aprilie 2018)
Articole din ediţiile anterioare
Din secretele longevităţii… nutraceuticele – partea a XIV-a. Calitatea vieţii – sănătate şi vitalitate la vârste înaintate
Comisia Europeană a prezentat pe 27 ianuarie 2021 un ghid (green paper), prin care lansează o amplă dezbatere privind necesitatea implementării uno...
Opţiuni farmacoterapeutice în afecţiuni neoplazice – partea a II-a
Se estimează că 25% din populaţie se va confrunta cu diagnosticul de cancer pe parcursul vieţii. Mai puţin de un sfert dintre aceşti pacienţi vor f...
Opţiuni farmacoterapeutice în afecţiuni neoplazice – partea a III-a
Se estimează că 25% din populaţie se va confrunta cu diagnosticul de cancer pe parcursul vieţii. Mai puţin de un sfert dintre aceşti pacienţi vor f...
Imunoterapeutice (II)
Imunoterapeuticele au revoluţionat tratamentul unor afecţiuni severe. Anticorpii monoclonali şi alte medicamente biologice care acţionează la nivel...