The diseases that occur in patient populations with a maximum prevalence of 6-8% of the world’s population are defined as rare diseases or orphan diseases, with birth defects, and especially adulthood. The legislation to promote the registration of orphan medicinal products started in the US with the Orphan Drug Act, issued in 1983, and in 1999 the European Union developed Regulation 141/2000 and 847/2000. While progress has been made in the research, development and production of orphan drugs, it is necessary to develop and implement common, coherent and functional policies at national, European and global level in this field. This means involving all relevant decision makers, competent regulatory authorities, appropriate health strategies and policies, engaging academia in research, and setting up national registries for rare diseases for neonatal screening tests and developing and interconnecting European reference networks.
Medicamentele orfane și bolile orfane, prezent și viitor
Orphan drugs and rare diseases, present and future
First published: 26 mai 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.176.3.2017.776
Abstract
Rezumat
Bolile care se manifestă în populațiile de pacienți cu o prevalență de maximum 6-8% din populația lumii sunt definite ca boli rare sau boli orfane, cu incidență la naștere și mai ales la maturitate. Legislația în scopul promovării înregistrării medicamentelor orfane a debutat în SUA cu actul medicamentelor orfane elaborat în 1983, iar în 1999 Uniunea Europeană a elaborat Regulamentul CE 141/2000 și 847/2000. Cu toate progresele înregistrate în cercetarea, dezvoltarea și producția medicamentelor orfane, sunt necesae realizarea și implementarea unor politici comune, coerente și funcționale la nivel național, european și global în acest domeniu. Acest lucru presupune implicarea tuturor decidenților din domeniu, autorități competente de reglementare, strategii și politici de sănătate adecvate, angrenarea mediilor academice în cercetare și crearea registrelor naționale pentru bolile rare pentru teste de screening neonatal și dezvoltarea și interconectarea rețelelor europene de referință.
Definiții și reglementări
Bolile care se manifestă în populațiile de pacienți cu o prevalență de maximum 6-8% din populația lumii sunt definite ca boli rare sau boli orfane. Ele sunt patologii a căror incidență la naștere este mai mică de 1 la 2000. Simptomele unor boli rare pot apărea la naștere sau în copilărie, cum ar fi atrofie musculară spinală infantilă, tulburări de stocare lizozomală, persistența canalului arterial (PDA), polipoză adenomatoasă familială (PAF) și fibroza chistică.Cu toate acestea, mai mult de 50% dintre bolile rare apar la maturitate, cum ar fi gliom, carcinom renal și leucemie acută mieloidă. Alte boli rare sunt rezultatul unor infecții (bacteriene sau virale) sau au cauze degenerative și proliferative.
Legislația în scopul promovării înregistrării medicamentelor orfane a debutat în SUA cu actul medicamentelor orfane (http://www.fda.gov/orphan/oda.htm) elaborat în 1983. A fost urmat zece ani mai târziu de Regulamentul medicamentelor orfane din Japonia. Legislația japoneză este o excepție în care aceasta nu include criteriul economic. În plus, în timp ce domeniul de aplicare a legislației în majoritatea cazurilor se limitează la medicamente și vaccinuri, în Japonia legea include și dispozitivele medicale.
În 1998, Australia a lansat politica sa în domeniul medicamentelor orfane, iar Uniunea Europeană a elaborat în 1999 Regulamentul CE 141/2000 și 847/2000 (http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol1_en.htm).
Reglementarea medicamentelor orfane în SUA
Legea medicamentelor orfane (ODA) stimulează cercetarea, dezvoltarea și aprobarea de produse care tratează boli rare. Actul oferă acum siguranță financiară și permite companiilor să investească în îmbunătățirea stării de sănătate a pacienților cu boli rare, care afectează mai puțin de 200 000 de persoane din SUA sau care au o prevalență scăzută (mai puțin de 5 la 10 000 în comunitate).Experiența acumulată în Statele Unite ale Americii și Japonia a arătat că cel mai puternic stimulent pentru industria farmaceutică este să investească în dezvoltarea și comercializarea de produse orfane, cu perspectiva exclusivității pe piață pentru un anumit număr de ani, timp în care o parte semnificativă a investițiilor ar putea fi recuperată.
Biroul de dezvoltare a produselor orfane (OOPD) își dedică misiunea pentru promovarea dezvoltării de produse care să fie promițătoare pentru diagnosticarea și/sau tratarea unor boli rare sau condiții și administrează Programul de granturi al produselor orfane care oferă finanțare pentru cercetarea clinică a bolilor rare. FDA (Food and Drug Administration) finanțează dezvoltarea de produse orfane prin intermediul programului de granturi pentru studii clinice.
Cererea pentru aplicații (RFA) care anunță disponibilitatea fondurilor este publicată în Registrul federal în fiecare an, de obicei în luna iunie. Eligibilitatea pentru finanțarea granturilor este extinsă la dispozitivele medicale și alimente medicale pentru care nu există nicio așteptare rezonabilă de dezvoltare fără o astfel de asistență.
Cererile sunt analizate de comisii de experți externi și sunt finanțate prioritar medicamentele și produsele biologice pentru boli rare. Procedura pentru a obține statutul de medicament orfan este descrisă în Codul Regulamentului Federal (CFR) 316.20 (b).
Conform legii, cererea pentru acordarea statutului ca produs orfan se poate face în orice moment înainte de depunerea unei cereri de punere pe piață a produsului. Un sponsor prezintă două copii ale unei cereri completate, datate și semnate, care conține următoarele informații:
- o declarație că sponsorul (orice persoană fizică sau juridică cu domiciliul stabil în SUA, care încearcă să obțină sau care a obținut desemnarea unui produs drept medicament orfan) solicită cererea pentru statutul de medicament orfan pentru o boală rară sau condiție;
- numele și adresa sponsorului, numele de contact al sponsorului principal persoane și/sau agent rezident, inclusiv titlul, adresa și numărul de telefon; denumirea generică și denumirea comercială, dacă este cazul, ale produsului medicamentos sau ale medicamentelor, precum și numele și adresa sursei de medicament, dacă nu este fabricat de sponsor;
- descrierea bolii rare sau a condiției pentru care medicamentul este sau va fi investigat, indicația propusă sau indicații pentru utilizarea medicamentului, precum și necesitatea acestei terapii;
- descrierea medicamentului și justificarea științifică pentru utilizarea medicamentului pentru boli rare sau condiție, inclusiv toate datele non-clinice de laborator, studii, investigații clinice și alte date relevante, care sunt disponibile la sponsor, pozitive, negative sau neconcludente. Copii ale lucrărilor relevante și irelevante, publicate sau nepublicate sunt de asemenea necesare;
- în cazul în care un medicament este în curs de dezvoltare pentru doar un subset de persoane cu o anumită boală sau condiție, este necesară o demonstrație că subsetul este medical valid;
- un rezumat al stării de reglementare și istoria comercializării medicamentului în SUA și în țări străine; de exemplu, ce utilizări sunt în curs de investigare și în ce țări; pentru ce indicație este medicamentul aprobat în țările străine;
- documente, cu referințe autorizate anexate, care demonstrează că:
- boala sau condiția pentru care medicamentul este destinat afectează mai puțin de 200 000 de persoane din SUA sau, în cazul în care este un vaccin, medicament de diagnostic sau acționează preventiv, persoanele cărora medicamentul le va fi administrat în SUA sunt mai puține de 200 000 pe an, în conformitate cu art. 316.21 (b), sau
- o declarație care să indice dacă sponsorul care depune cererea este partea reală în interesul dezvoltării și producției și vânzările intenționate sau efective ale produsului.
Medicamentele orfane trebuie să prezinte un plan de investigație pediatrică (PIP). Medicamentele orfane pot primi doi ani suplimentari de exclusivitate, atunci când acestea sunt conforme cu PIP.
Reglementarea medicamentelor orfane în Uniunea Europeană
Agenția Europeană a Medicamentului (EMA) definește un produs medicamentos orfan ca un medicament care este destinat pentru diagnosticarea, prevenirea sau tratarea unei condiții care pune în pericol viața sau provoacă o invaliditate cronică, și nu afectează mai mult de 5 din 10 000 de persoane din UE la data de depunere a cererii de desemnare (criteriu de prevalență).Un produs medicamentos orfan poate, înainte de depunerea unei cereri de autorizare pentru introducerea pe piață, să solicite opinia agenției cu privire la desfășurarea diferitelor teste și studii necesare pentru a demonstra calitatea, siguranța și eficacitatea medicamentului, în conformitate cu articolul 510 din Regulamentul (CEE) 2309/93.
În Uniunea Europeană, companiile destinate producerii medicamentelor orfane beneficiază de stimulente din partea asistenței de protocol (consultanță științifică în cursul etapei de dezvoltare a produsului). Lor li se acordă autorizația de introducere pe piață de 10 ani de exclusivitate de comercializare și li se acordă stimulente financiare în ceea ce privește reduceri de taxe sau scutiri și stimulente naționale.
În Uniunea Europeană, la 1 ianuarie 2007, medicamentele orfane sunt eligibile pentru următorul nivel de reduceri de taxe: reducere de 100% pentru asistența de protocol și de urmărire; reducere de 100% pentru inspecțiile preautorizare, reducere de 50% pentru cererile noi de punere pe piață, reducere de 50% pentru activitățile de postautorizare, inclusiv taxe anuale (se aplică numai întreprinderilor mici și mijlocii), în primul an după acordarea unei autorizații de comercializare.
Statele membre nu acceptă o altă cerere pentru autorizație de introducere pe piață (MA), nu acordă o altă MA și nici nu acceptă o cerere de autorizare pentru a extinde o piață existentă pentru aceeași indicație terapeutică, pentru un produs medicamentos similar.
În 2007, Fondul de scutiri de taxe la nivelul UE s-a ridicat la suma de 6 milioane de euro. Pentru a beneficia de aceste stimulente, produsele în cauză trebuie să fie înregistrate ca medicamente orfane de către EMA.
În scopul evaluării cererilor de medicamente orfane, EMA a implementat un Comitet pentru Medicamente Orfane (COMP) constituit din reprezentanți ai statelor membre, reprezentanți ai EMA, precum și organizațiile pacienților (fără drept de vot) și Asociația Europeană a Liberului Schimb (AELS), alături de Comisia Europeană, în calitate de observatori generali.
Sarcinile COMP constau în consilierea Comisiei cu privire la instituirea și elaborarea unei politici referitoare la produsele medicamentoase orfane pentru UE, pentru a examina orice cerere și a decide dacă medicamentul se califică drept un medicament orfan, pentru a asista Comisia în stabilirea unor legături internaționale pe probleme referitoare la produsele medicamentoase orfane și stabilirea legăturilor cu grupurile de sprijin ale pacienților și, în cele din urmă, pentru a asista Comisia în crearea de orientări detaliate.
Înainte de a aplica pentru statutul de medicament orfan, sponsorul trebuie să depună o scrisoare de intenție la agenție. O reuniune de preprezentare este puternic încurajată. Cererea este apoi supusă EMA, validată și transmisă COMP.
Avizul COMP este înaintat Comisiei Europene, care adoptă apoi o decizie (http://www.emea.europa.eu/pdfs/human/comp/1422200en.pdf). Cererea poate fi depusă în paralel în UE și în Statele Unite ale Americii, utilizând aplicația comună.
Toate produsele pentru care a fost depusă o cerere de medicament orfan sunt introduse în Registrul comunitar pentru produsele medicamentoase orfane pentru uz uman (http://ec.europa.eu/enterprise/pharmaceuticals/registru/index.htm).
Registrul listează toate produsele pentru care au fost depuse aplicațiile pentru statutul de medicament orfan, indiferent de rezultat. În iulie 2008, acest registru menționa 831 de aplicații, inclusiv 552 de medicamente cu statut de medicament orfan, dintre care 42 au obținut MA.
Sponsorii desemnați ai medicamentelor orfane sunt obligați să prezinte o dezvoltare anuală și să raporteze la EMA pentru orientare (http://www.emea.europa.eu/pdfs/human/comp/018901een.pdf).
Aplicația pentru statutul de medicament orfan este posibilă în orice etapă de dezvoltare a medicamentului, totuși acest lucru trebuie să fie înainte de depunerea cererii de autorizare pe piață. În cazul în care o cerere de autorizație de introducere pe piață pentru același medicament (în ceea ce privește aceeași indicație terapeutică și prezentat de același sponsor) a fost depusă în orice stat membru, în cadrul Comunității, atunci acest produs medicamentos nu mai este eligibil pentru o nouă autorizație.
Un sponsor poate totuși aplica pentru acordarea statutului de medicament orfan pentru un produs deja aprobat, cu condiția ca desemnarea ca medicament orfan să se refere la medicamente neaprobate cu aceeași indicație. În acest caz, un MA separat trebuie să fie aplicat, care să acopere numai indicația de medicament orfan.
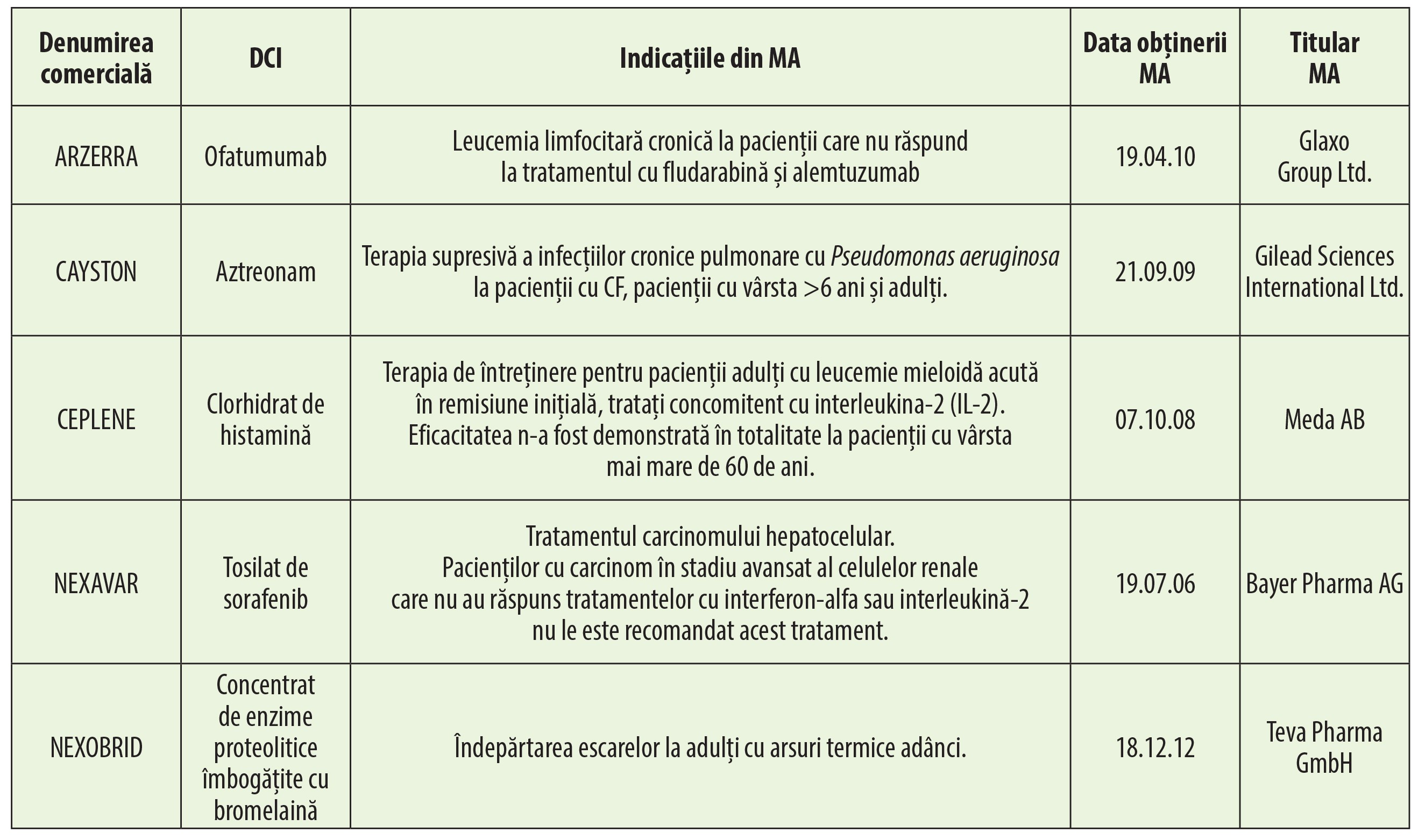
Ibuprofenul este un bun exemplu în acest sens, obținând MA în 2004 ca medicament orfan pentru tratamentul unei malformații congenitale la inimă (persistența canalului arterial), la sugari, o condiție care afectează aproximativ 97 900 de pacienți din UE (tabelul 1).
Lista medicamentelor orfane din Europa cu statutul de orfan și autorizația de punere pe piață europeană este determinată prin corelarea listei medicamentelor care au fost statuate ca orfane (http://ec.europa.eu/health/documente/comunitate-registru/HTML/alforphreg.htm) cu lista medicamentelor cărora li s-a acordat o autorizație de introducere pe piață (http://ec.europa.UE/sănătate/documente/comunitate-registru/HTML/alfregister.htm).
Ambele liste sunt disponibile pe website-ul Direcției Generale pentru Sănătate și Consumatori (DG SANCO) al Comisiei Europene. Prima clasificare a medicamentelor orfane în UE se realizează după (tabelul 2):
- denumirea comercială
- data obținerii autorizației de punere pe piață în ordine descrescătoare
- criteriul ATC
- titularul autorizației de punere pe piață.
De asemenea, această parte a documentului oferă o listă a tuturor medicamentelor utilizate pentru tratarea bolilor rare, care au primit o autorizație de punere pe piața europeană (MA) pentru una sau mai multe indicații de utilizare pentru o boală rară, dar cărora nu li s-a acordat statutul de medicament orfan european sau a căror desemnare a fost retrasă (tabelul 3).
Aceste medicamente pot primi statutul de medicament orfan într-o altă zonă geografică din lume. Ele apar în lista DG Sanco a medicamentelor care au primit autorizația de punere pe piață (http://ec.europa.eu/health/documente/comunitate-registru/HTML/alfregister.htm).
Prima clasificare în funcție de denumirea comercială furnizează numele substanței active, autorizația de punere pe piață, indicația „rar“, data de obținere a autorizației de punere pe piață și titularul ei.
Trei liste suplimentare propun o altă clasificare în funcție de:
- data obținerii autorizației de punere pe piață (MA) în ordine descrescătoare
- categoria ATC
- titularul autorizației de punere pe piață.
Informații suplimentare pot fi găsite pentru fiecare medicament la categoria „medicamente orfane“ pe Orphanet, site-ul www.orpha.net, sau pe site-ul EMA, (http://www.ema.europa.eu).
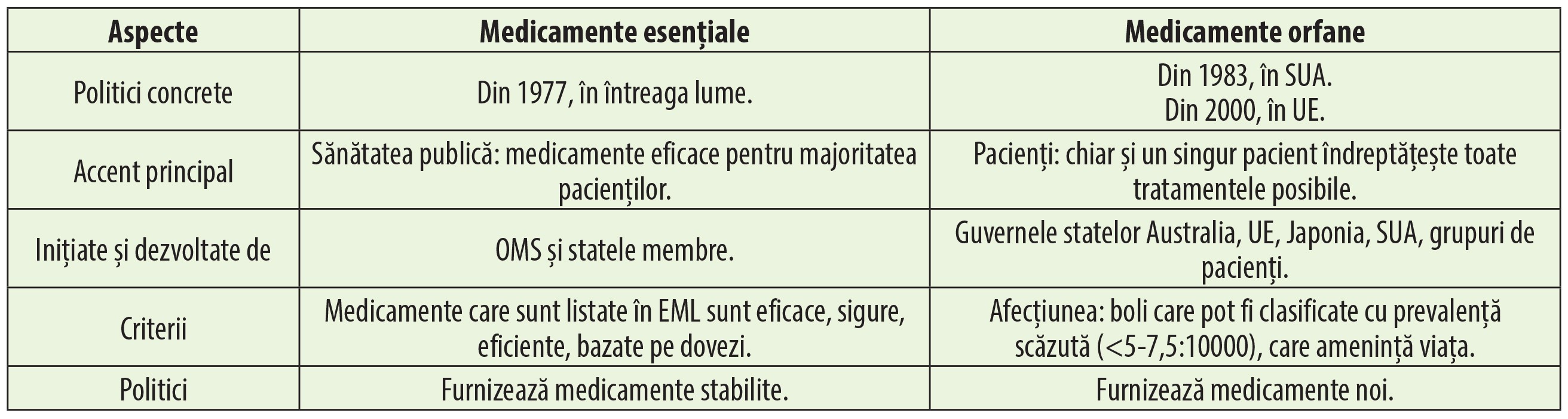
Deși atât medicamentele esențiale (EML), cât și cele orfane împărtășesc principiile de justiție socială și echitate, tabelul 4 prezintă câteva dintre diferențele care există între acestea.
În România se acceptă criteriile de desemnare a medicamentelor orfane, stabilite în reglementările nr. 141/2000/CE şi 847/2000/CE şi desemnarea făcută de Comitetul pentru Medicamente Orfane al Agenţiei Europene pentru Evaluarea Medicamentelor, la art. 3.
Autorizarea de punere pe piață în România a medicamentelor orfane se face prin procedura simplificată CADREAC (Collaboration Agreement of Drug Regulatory Authorities from European Union Associated Countries) pentru acordarea autorizației de punere pe piață de către țările central și est-europene pentru medicamentele de uz uman autorizate de Uniunea Europeană prin procedura centralizată, de aprobare a variațiilor și de reînnoire a acestor autorizații de punere pe piață, aprobată prin hotărârea Consiliului științific al Agenției Naționale a Medicamentului nr. 7/2001.
Prin Ordinul Ministerului Sănătății nr. 1215/2013, s-a înființat Consiliul Național pentru Bolile Rare (CNBR), organism științific interdisciplinar format din experți în domeniul bolilor rare, cu atribuții în coordonarea metodologică și științifică din domeniul bolilor rare.
În ultimii ani, datorită eforturilor asociațiilor de pacienți și ale specialiștilor, Planul Național de Boli Rare a fost inclus în strategia Națională de Sănătate Publică 2014-2020, fapt care crește speranța de a îmbunătăți calitatea îngrijirii acestor pacienți.
Planul Naţional de Boli Rare (PNBR) îşi propune să furnizeze o serie de măsuri concrete care să permită o structurare şi o organizare coerentă a sistemului de diagnostic, tratament, îngrijire şi profilaxie a bolilor rare.
Alianța Națională pentru Boli Rare din România, înființată în 2007, la inițiativa organizațiilor de boli rare și a grupurilor de pacienți, are misiunea de a dezvolta și derula activități de lobby și advocacy pentru îmbunătățirea calității vieții pacienților cu boli rare din România.
Începând cu 2016, Agenţia Medicamentelor și Dispozitivelor Medicale (ANMDM) din România, prin personalul de specialitate, a realizat desemnarea unui număr de cinci molecule ca medicamente orfane. Aceasta presupune că ele se vor regăsi în perioada următoare în studii clinice şi probabil că, mai târziu, în autorizaţii de punere pe piaţă.
Dezvoltarea medicamentelor orfane: blocaje și oportunități
Multe dintre denumirile medicamentelor orfane din UE reprezintă utilizări inovatoare ale moleculelor existente. Aproximativ 85% dintre cererile denumirilor orfane provin de la întreprinderile mici și mijlocii (IMM-uri) (Torrent-Farnell, ICORD 2005, http://www.icord.cc/stock-holm_2005.php?p=speaker_presentations).Pentru aceste companii, Regulamentul UE oferă o oportunitate importantă de a demonstra potențialul noilor platforme tehnologice și al produselor medicamentoase.
Produsele promițătoare pot fi autorizate ulterior sau vândute altor companii pentru dezvoltarea ulterioară sau pot fi dezvoltate de către IMM-uri.
Regulamentul UE joacă un rol important în stimularea inovării în domeniul științelor vieții în Europa, așa cum a făcut în SUA Actul pentru medicamentele orfane.
Acest fenomen este accentuat de faptul că din 50 de medicamente aprobate, cele orfane reprezintă o parte considerabilă din numărul total al medicamentelor aprobate prin procedura centralizată a UE din 2000.
Cu toate acestea, numai sponsorii cu reședința în Spațiul Economic European (SEE) pot depune cererile la Agenția Europeană a Medicamentelor (EMA) și, în consecință, un număr considerabil de cereri ale companiilor sau instituțiilor din afara SEE sunt depuse la filialele SEE sau de către firmele de consultanță.
Dintre cele 521 de denumiri orfane, un total de 300 (58%) au fost inițial dezvoltate de companii sau instituții europene, în timp ce restul dintre denumirile originare din afara Europei sunt predominant din SUA (177 din 521, 34%).
În special Franța și Germania, fiind cele mai mari țări europene, au reprezentat o mare parte dintre cele 300 de denumiri europene orfane. Pentru 12 dintre cele 15 state membre, lipsa denumirilor orfane poate fi parțial explicată prin faptul că descoperirea de medicamente și dezvoltarea reprezintă un proces de lungă durată și că, înainte de aderarea la UE în 2004 sau 2006, companii sau instituții din aceste țări din Europa de Est nu au avut acces la stimulentele prevăzute în Regulamentul UE.
Prin contrast, mai multe țări din afara SEE, în special Elveția și SUA, au dezvoltat un număr considerabil de denumiri orfane, în timp ce aceste țări nu au avut acces la stimulentele UE.
Având în vedere că frecvența bolilor rare a scăzut în Statele Unite ale Americii, bolile care afectează preponderent țările sărace sunt eligibile din punct de vedere tehnic pentru toate prevederile de stimulare ale Orphan Drug Act (ODA). Cu toate acestea, țările în curs de dezvoltare nu dispun de resursele necesare pentru a-și permite aceste medicamente, cu un venit de mai puțin de 2 dolari pe cap de locuitor pe an pentru îngrijirea sănătății.
Există două categorii de medicamente în general neglijate de companiile farmaceutice: (i) medicamentele pentru boli rare și (ii) medicamentele pentru bolile tropicale.
Compania producătoare de medicamente se așteaptă să vândă pe piață. Volumul vândut depinde, printre altele, de prevalența bolii vizate și eficiența logistică și de distribuție a medicamentului.
Semnarea Acordului privind Aspectele comerciale ale drepturilor de proprietate intelectuală (TRIPS), în 1994, a ajutat parțial la rezolvarea aceste probleme. Cu toate acestea, mai multe organizații internaționale și ONG-urile au avertizat că protecția brevetului și TRIPS ar putea duce la creșterea producției de medicamente orientate spre nevoile țărilor sărace și ar putea înrăutăți limitatul acces la medicamente esențiale (OMS, 2006).
Există un consens general că cel puțin unele dintre medicamente orfane aflate acum pe piață nu ar fi fost obținute fără stimulentele acordate de ODA (Goldman et al., 1992; Arno et al., 1995; Rhode, 2000; Haffner, 2006).
În SUA, la 24 de ani de la trecerea Actului medicamentelor orfane (ODA), 282 de medicamente și produse biologice cu statutul de medicament orfan oferă un tratament pentru mai mult de 14 milioane de pacienți.
Aproximativ 20% dintre denumirile orfane acordate de FDA sunt pentru molecule noi și includ cele mai noi terapii biologice, cum ar fi anticorpi monoclonali, terapii bazate pe celule, țesuturi și produse pe bază de inginerie tisulară.
Legislația Statelor Uniteale Americii, prin urmare, pare să fi susținut planul de cercetare și dezvoltare bazat pe aplicarea de noi tehnici moleculare și celulare, biologie și pe cunoștințele științifice de ultimă oră ale bolii.
De la introducerea legislației ODA în 2000, Uniunea Europeană a înregistratat aproximativ 250 de produse medicamentoase orfane în principal pentru tratamentul formelor rare de cancer, deși doar 18 produse au fost aprobate ulterior (Joppi et al., 2006).
Companiile cu cel mai mare număr de produse cu statut de orfan sunt firmele mijlocii (de exemplu, Genzyme Corporation, Orphan Medical, Serono și Pharmacia) și companii, cum ar fi Amgen and Genentech, care au început ca Biotechs mici și s-au dezvoltat în companii mari.
În general, piața medicamentelor orfane a oferit niveluri de rentabilitate care nu sunt comparabile cu medicamentele blockbuster tradiționale ale industriei farmaceutice (cu vânzări de peste 1 miliard de dolari).
Dacă ne limităm la cazul bolilor rare transmise genetic, vânzările anuale pentru cele mai multe produse variază între 50 de milioane de dolari (de exemplu, Aldurazyme, pentru tratamentul mucopolysaccharidosis tip 1) și 300 milioane de dolari (de exemplu, Fabrazyme, pentru boala Fabry, Pulmozyme, pentru fibroza chistică).
Un bun exemplu este reprezentat de eritropoietină (EPO), care a fost aprobată ca medicament orfan pentru o populație-țintă foarte limitată și care este folosită pentru a atenua anemia indusă de chimioterapie, într-un grup larg de pacienți, devenind în SUA cea mai mare cheltuială pentru programul public Medicare (Cotter et al., 2006).
Cu toate acestea, este important de reținut că succesul companiilor cum ar fi Amgen și Genentech și al produselor lor a depins nu numai de stimulentele create de statutul de medicament orfan, dar de asemenea a depins și de ofertele pe termen lung și de relațiile pe care aceste societăți le-au negociat cu marile companii farmaceutice, care au sprijinit foarte mult activitățile de cercetare, de dezvoltare și de marketing ale acestor firme.
În final, trebuie remarcat faptul că grupurile de interes au avut un rol-cheie în dezvoltarea medicamentelor orfane pentru boli rare.
Organizațiile de advocacy ale pacienților au practicat de multe ori un lobby agresiv pentru promovarea legislației și încurajarea dezvoltării acestor medicamente, iar contribuabilii terți, ulterior, au constrâns companiile de asigurări, în cazul SUA, și guvernele, în cazul sistemelor finanțate de stat, la asigurarea rambursării integrale a produselor, în ciuda prețurilor ridicate.
Producătorii de medicamente orfane au înțeles importanța sprijinului acestor grupuri și au colaborat cu ei în inițiativele de lobby. Se menționează, de exemplu, cazul bolii Gaucher și al medicamentului Cerezyme, medicament dezvoltat de compania Genzyme.
În acest caz, grupurile de pacienți au jucat un rol-cheie atât în promovarea eforturilor de cercetare și dezvoltare, cât și în argumentarea pentru rambursarea integrală a costurilor terapiei cu medicamentul respectiv. Genzyme, în plus, a început un parteneriat cu organizația umanitară Proiectul Hope cu scopul de a garanta rambursarea Cerezyme (Goldman et al., 1992, Datamonitor, 2006; http://www.gaucherdisease.org).
Mai multe analize (Haffner, 1996; Haffner, 2006) arată că marea majoritate (mai mult de 70%) dintre producătorii de medicamente orfane sunt companii mici, cu activitate de R&D centrată pe biotehnologie. Mai mulți factori au promovat această tendință.
Mai întâi de toate, granturile de cercetare, subvențiile fiscale, asistența tehnică, precum și procesul de aprobare rapidă incluse în legile medicamentelor orfane au redus riscurile financiare ale investițiilor în R&D și au facilitat intrarea companiilor mici pe piață (Borgman, 1992).
În al doilea rând, micile companii axate pe biotehnologie par să fie mai dispuse decât marile firme farmaceutice de a dezvolta proiecte riscante și inovatoare, iar aceste companii sunt finanțate, de obicei, de un grup restrâns de investitori.
Cei mai de succes producători de medicamente orfane (cum ar fi Amgen, Genentech și Genzyme) au devenit viabili financiar și au obținut profituri chiar și cu piețe relativ mici, prin exploatarea stimulentelor acordate de ODA.
Toate cele trei companii s-au născut din inițiativele oamenilor de știință universitari cu expertiză în noile tehnici sau domenii terapeutice de nișă, date fiind competențele antreprenoriale bine dezvoltate.
Companiile au urmărit apoi strategii diferite, specializate în mare parte în trei zone distincte: tehnologii de recombinare a ADN-ului, anticorpi monoclonali și terapii bazate pe enzime de substituție, care le-au permis să evite concurența directă.
În plus, unul dintre aspectele critice ale succesului Genentech, în ciuda piețelor sale mici, a fost capacitatea de a crea relații de afaceri pe termen lung cu companiile farmaceutice mari, în primul rând Eli Lilly și, mai recent, Roche.
În 2014, Agenția Europeană pentru Medicamente a recomandat spre aprobare cel mai mare număr de medicamente orfane dintr-un an – dintre cele 82 de medicamente de uz uman recomandate în 2014, 17 sunt destinate pentru tratamentul unor boli rare, oferind terapii pentru pacienții care adesea au puține sau nicio altă opțiune de tratament.
Lista include și primul medicament pentru tratamentul distrofiei musculare Duchenne (Translarna), precum și primul tratament pentru protoporfiria eritropoietică, o boală genetică rară care provoacă intoleranță la lumină (Scenesse).
De asemenea, a fost făcută prima recomandare la nivel mondial a unui tratament pe bază de celule stem, folosind medicamentul orfan Holoclar pentru un tratament la nivelul limbului în LSCD, o afecțiune rară care poate conduce la cecitate.
Pentru aceste trei produse au fost utilizate metode de reglementare speciale: autorizație de introducere pe piață condiționată pentru Translarna și Holoclar și aprobare în situații excepționale pentru Scenesse.
Recent, în februarie 2017, Comisia Europeană a acordat statutul de medicament orfan (EU/3/17/1846) Grupului de studiu al histocitelor din Franța pentru vemurafenib, pentru tratamentul bolii Erdheim-Chester. Același statut a fost atribuit, tot în februarie 2017, către PlumeStars S.R.L., Italia, pentru talidomidă, pentru tratamentul telangiectaziei hemoragice ereditare.
Medicamentele orfane, încotro?
Viitorul industriei medicamentelor orfane va depinde în mare măsură de intrarea biogenericelor, deoarece medicamentele biologice reprezintă mai mult de 50% din piața medicamentelor orfane. Succesul dezvoltării medicamentelor orfane constă în abordarea unor strategii comune, atât la nivel național, cât și european. Acestea vizează mai multe paliere de acțiune:
activitatea de conștientizare și educație cu privire la bolile rare și la prevalență;
coordonarea cercetării prin implicarea factorilor decidenți;
accesul la stabilirea unui diagnostic precis în timp util, pentru a permite administrarea unui tratament în timp util;
screening genetic neonatal obligatoriu accesibil pentru bolile orfane și pentru mai multe boli comune;
testarea genetică medicală relevantă să fie considerată o parte integrantă din prestarea serviciilor de sănătate;
rețeaua la nivelul UE pentru testele de diagnosticare a bolilor genetice rare să fie creată și susținută financiar în regim de urgență;
responsabilizarea partajată între medic, dezvoltatorul produsului și autorități;
evitarea birocrației pentru studiile clinice transfrontaliere și pentru modificările mici de protocol pentru medicamentele orfane;
crearea și asigurarea de standarde europene de îngrijire comune;
crearea de sisteme informaționale interoperabile la nivel internațional.
Răspunsul la aceste solicitări vine din partea Comisiei Europene pentru Boli Rare, care intenționează crearea unei platforme europene pentru înregistrarea bolilor rare. Aceasta presupune înființarea de registre europene pentru boli rare, folosind platforma informatică creată pentru Rețelele europene de referință (RER), primele 24 fiind lansate în luna trecută a anului curent.
În România, diverse foruri sunt deja implicate în eforturile privind crearea registrelor naționale pentru boli rare. Astfel, au fost realizate – de către Consiliul Național pentru Bolile Rare, universități, clinicieni, organizații ale pacienților – registre cu acoperire națională pentru atrezie biliară, mucoviscidioză, dar sunt și alte inițiative care nu acoperă toate cerințele necesare (hemofilie, imunodeficiențe primare, talasemie).
De asemenea, s-au realizat registre pentru teste de screening, așa cum sunt Registrul național de screening neonatal pentru fenil-cetonurie (PKU) și hipotiroidism congenital (CHT), coordonate în centre ca parte a Programului Național de Sănătate, care corelează datele de screening cu toate datele de laborator.
De asemenea, există registre pe patologii specifice realizate de asociațiile de pacienți, firmele care produc sau importă tratamentul adecvat patologiilor respective, precum și șapte centre-expert românești incluse deja în rețelele europene.
Concluzii
Cu toate progresele înregistrate în cercetarea, dezvoltarea și producția medicamentelor orfane, sunt necesare realizarea și implementarea unor politici comune, coerente și funcționale la nivel național, european și global în acest domeniu.Aceasta presupune implicarea tuturor decidenților din domeniu, autorități competente de reglementare, strategii și politici de sănătate adecvate, angrenarea mediilor academice în cercetare și crearea registrelor naționale pentru bolile rare, pentru teste de screening neonatal și dezvoltarea și interconectarea rețelelor europene de referință.
Bibliografie
- Brewer GJ. Drug development for orphan diseases in the context of personalized medicine. Transl Res. 2009;154 : 314–22.
- Cote T, Kelkar A, Xu K, Braun MM, Phillips MI. Orphan products: An emerging trend in drug approvals. Nat Rev Drug Discov. 2010; 9: 84.
- Thielke D, Thyssen JP, Hansen BJ. Orphan drugs--medications for patients with rare diseases. Ugeskr Laeger. 2006; 168: 2236–8.
- Ariyanchira S. Global Markets for Orphan Drugs, BCC Research, BCC00191, PHM038C, May 2010. Available from: http://www.bccresearch.com/report/PHM038C.html
- FDA. Final Rule, 21 CFR 316. Orphan Drug Regulations 57 FR 62076 December 29. 1992. Available from: http://www.fda.gov/orphan/designat/apply.htm
- http://www.fda.gov/ForIndustry/DevelopingProductsforRareDiseasesConditions/default.htm
- OOPD Program Overview. Available from: http://www.fda.gov/orphan/progovw.htm.
- http://www.ema.europa.eu/pdfs/human/comp/29007207en.pdf
- Stolk P, Willemen MJ, Leufkens HG. Rare essentials: Drugs for rare diseases as essential medicines. Bull World Health Organ. 2006; 84:745–51.
- Brewer GJ. Fundamental problems lie ahead in the drug discovery and commercialization process: Restructuring of the pharmaceutical industry and an improved partnership with academia are required. J Investig Med. 2006; 54: 291–302.
- Das S, Bale SJ, Ledbetter DH. Molecular genetic testing for ultra rare diseases: Models for translation from the research laboratory to the CLIA-certified diagnostic laboratory. Genet Med. 2008; 10 : 332–6.
- Scheindlin S. Rare diseases, orphan drugs, and orphaned patients. Mole Interv, 2006; 6: 186–91.
- Opportunities in Orphan Drugs: Strategies for developing maximum returns from niche indications, Business Insights. 2010. Available from: http://www.globalbusinessinsights.com/content/rbhc0251m.pdf
- Fischer A, Borensztein P, Roussel C. The European rare diseases therapeutic initiative. PLoS Med. 2005;2: e243.
- Marin A. F., Registrele pentru boli rare: o inițiativă pe care România nu are voie să o rateze, Viața Medicală, 15, 2017, 3.