Tuberculosis (TB) remains an important cause of mortality and morbidity in pregnancy worldwide, being directly related to HIV epidemic. Immunological changes during pregnancy increase the risk of the latent TB infection reactivation or the potential of a new TB infection. Diagnosis of tuberculosis in pregnancy may be challenging, mainly because of the often nonspecific nature of the early symptoms of the disease, which may be attributed to pregnancy itself. TB treatment in pregnancy poses several problems, such as contraindications to anti-TB treatment, and their potential risks because of possible toxicity, changes in tolerability, pharmacokinetics of drugs, side effects, and the pill burden. There are no guidelines regarding the management of multidrug-resistant (MDR) tuberculosis in pregnancy, the available data being provided only by case reports, and the second-line TB drugs, used for treating this form of TB, are known to be associated with obstetric, fetal, and infant complications. Improved diagnosis and treatment of TB in pregnant women are important interventions for both maternal and child health. Successful control of TB in pregnancy in high-prevalence areas demands a range of interventions, including BCG vaccination, active and latent TB screening in pregnant women, primary prevention of HIV-infected pregnant women, treatment of active and latent TB and public enlightenment.
Tuberculoza pulmonară în sarcină
Pulmonary tuberculosis in pregnancy
First published: 15 aprilie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Tuberculoza (TB) rămâne, la nivel global, o cauză importantă de mortalitate şi morbiditate în sarcină, fiind în directă legătură cu endemia infecţiei cu HIV. Schimbările imunologice survenite în timpul sarcinii cresc riscul reactivării unei infecţii tuberculoase latente sau posibilitatea apariţiei uneia noi. Diagnosticul tuberculozei în sarcină poate constitui o provocare, în special din cauza simptomatologiei nespecifice din debutul bolii, simptome care pot fi atribuite modificărilor prezente în mod obişnuit în sarcină. Tratamentul TB în sarcină ridică câteva probleme, precum contraindicaţiile medicamentelor anti-TB şi potenţialele riscuri legate de toxicitate, schimbările în tolerabilitate, farmacocinetică, efecte secundare şi accesul la terapie. Pentru TB multidrog-rezistentă (TB-MDR) nu există recomandări speciale în ghiduri, datele din literatură constând doar în serii de cazuri raportate, iar medicamentele de linia a doua utilizate în tratamentul acestor forme de TB sunt asociate cu posibile complicaţii obstetricale, fetale şi la nou-născut. Îmbunătăţirea metodelor de diagnostic şi tratament al TB în sarcină reprezintă intervenţii importante atât pentru mamă, cât şi pentru copil. Pentru asigurarea succesului în controlul TB în sarcină sunt necesare o serie de intervenţii, incluzând vaccinarea BCG, screeningul pentru depistarea şi tratamentul TB active şi latente, prevenţia primară la femeile HIV-pozitive şi educaţia medicală în populaţia generală.
Introducere
Tuberculoza pulmonară (TB) rămâne o problemă majoră de sănătate publică la nivel global, fiind o boală infecţioasă, cu evoluţie cronică, curabilă dacă este rapid diagnosticată şi corect tratată, dar care se însoţeşte de un grad înalt de mortalitate şi morbiditate în lipsa tratamentului.
Aproximativ o treime din populaţia globului este infectată cu Mycobacterium tuberculosis, ceea ce corespunde unui număr de 900 de milioane de femei care au infecţie tuberculoasă latentă(1), femeile gravide având un risc mai mare de progresie a infecţiei către TB activă comparativ cu bărbaţii. Încă de la primele publicaţii medicale care au abordat asocierea TB cu sarcina, s-au evidenţiat câteva aspecte care au rămas valabile şi în prezent: 1. TB şi sarcina sunt două condiţii care se influenţează reciproc negativ, iar asocierea lor se însoţeşte de un prognostic prost; 2. efectele TB asupra sarcinii sunt variabile şi foarte greu de apreciat, mai ales într-o sarcină la debut, iar deciziile terapeutice se iau în funcţie de fiecare caz în parte; 3. global, ar trebui să existe prevederi speciale pentru femeile gravide care sunt diagnosticate cu TB activă(2). În majoritatea ţărilor cu incidenţă mare a TB, recomandările în ceea ce priveşte screeningul şi diagnosticul TB la femeia gravidă sunt aceleaşi cu cele utilizate pentru depistarea TB la populaţia generală, acest lucru având drept consecinţă numărul mare de cazuri nediagnosticate şi netratate.
Pe lângă acest aspect, la nivel global, există încă două mari probleme apărute în ultimele trei decade: endemia infecţiei HIV-SIDA, pacienţii HIV-pozitivi având un risc de 20-37 de ori mai mare de a dezvolta TB comparativ cu cei fără coinfecţie HIV prezentă, şi răspândirea TB multidrog-rezistente (TB-MDR). Doar 44% dintre ţări au ghiduri aliniate Organizaţiei Mondiale a Sănătăţii (OMS) în ceea ce priveşte tratamentul antiretroviral (ARV) în sarcină(3), fiind şi mai puţine cele în care să existe şi să se respecte o strategie pentru diagnosticul şi tratamentul TB în sarcină. Tratamentul TB la pacientele gravide HIV-pozitive ridică probleme majore privind toxicitatea însumată a celor două terapii, efectele secundare, accesibilitatea la tratament, tolerabilitatea variabilă şi farmacocinetica diferită. Rifampicina, un medicament major de linia I utilizat în tratamentul TB, interferează cu metabolismul tuturor medicamentelor ARV folosite în sarcină. Există o lipsă majoră a datelor care să clarifice aceste aspecte şi influenţa lor în evoluţia tratamentului TB şi al infecţiei cu HIV în timpul sarcinii. Mai mult, creşterea incidenţei TB-MDR la nivel global a ridicat o altă problemă majoră în managementul acestor cazuri la femeia gravidă, întrucât această formă de TB se însoţeşte de o mortalitate înaltă, iar medicamentele de linia a II-a utilizate în tratamentul TB-MDR sunt contraindicate în sarcină.
Prevalenţa tuberculozei în sarcină
Tuberculoza este o cauză non-obstetricală majoră de deces la femeia gravidă, netratată putând atinge o mortalitate de până la 40%(4), iar în cazurile HIV-pozitive, de aproape 300%(5).
Organizaţia Mondială a Sănătăţii (OMS) a raportat, în anul 2015, 3,2 milioane de cazuri noi de îmbolnăvire la femei, 480.000 de decese, dintre care 140.000 (29,1%) în populaţia HIV-pozitivă(1). Raportul nu menţionează prevalenţa TB la femeile gravide, semn că majoritatea ţărilor nu au un program de screening pentru această populaţie şi/sau nu se raportează statusul de gravidă la femeile cu TB activă. Prevalenţa globală a tuberculozei în sarcină este dificil de estimat, în principal din cauza faptului că diagnosticul TB la femeia gravidă este unul dificil, simptomele fiind nespecifice, adesea suprapunându-se pe modificările care apar în mod normal în timpul sarcinii(6). Cu toate că metodele de confirmare a TB sunt uşor accesibile, multe cazuri rămân nediagnosticate şi neraportate. OMS estimează că aproximativ 3 milioane de cazuri de TB activă rămân nedepistate anual, dintre care o mare proporţie la femeile gravide(7). Conform unui studiu recent, în ţările cu endemie tuberculoasă joasă, prevalenţa TB la gravide se situează între 0,06% şi 0,25%, iar în ţările cu endemie ridicată, între 0,07 şi 0,5% la HIV-negative şi între 0,7 şi 11% la HIV-pozitive(4). În contextul infecţiei HIV materne, dar şi pentru femeile gravide HIV-negative din zonele cu prevalenţă mare a TB, OMS recomandă un screening standardizat pentru depistarea TB în perioada prenatală(8), însă aderenţa ghidurilor naţionale la această recomandare este una scăzută la nivel mondial(4).
Influenţa modificărilor imunologice din sarcină asupra tuberculozei
Femeile au un risc crescut de a dezvolta TB în timpul sarcinii(9), schimbările imunologice care se produc în această perioadă reprezentând o oportunitate pentru infecţia cu M. tuberculosis sau pentru reactivarea infecţiei latente (LTBI). În special în ultimul trimestru de sarcină, s-au observat creşteri ale nivelului şi activităţii fagocitelor şi celulelor dendritice, scăderea citotoxicităţii celulelor natural killer (NK) prin factorul blocant activat de către progesteron şi interleukina 10 (IL-10), de asemenea, o scădere a producţiei de interferon gamma (IFN-g), toate acestea reprezentând o reducere generală a răspunsului imun mediat celular(10). În ceea ce priveşte răspunsul celular adaptativ, s-a observat o inhibare a eliberării de citokine inflamatorii (IFN-g şi IL-12) de către limfocitele Th1, iar schimbările din cadrul imunităţii umorale includ creşterea nivelului complementului seric, al reactanţilor de fază acută şi a imunoglobulinelor; studiile privind activitatea limfocitelor Th2 în timpul sarcinii sunt controversate(10,11). Prin scăderea răspunsului proinflamator al limfocitelor Th1 din cauza sarcinii, simptomele de TB activă pot fi atenuate sau mascate, în acelaşi timp creşte susceptibilitatea la o nouă infecţie sau probabilitatea unei reactivări a infecţiei latente.
Diagnosticul tuberculozei active
sau latente în sarcină
Diagnosticul tuberculozei active în timpul sarcinii poate constitui o adevărată provocare pentru clinicieni, în principal din cauza simptomatologiei nespecifice din stadiile iniţiale ale infecţiei, cum ar fi astenia fizică, fatigabilitatea, simptome ce se regăsesc în mod obişnuit în timpul sarcinii şi nu ridică suspiciunea unei infecţii TB(12).
Din punct de vedere clinic, TB la gravide se manifestă similar cu cea din populaţia generală, localizarea pulmonară fiind cea mai frecventă(12,13), iar dintre localizările extrapulmonare, cele mai frecvente sunt limfoganglionară, intestinală şi osoasă(14). Cel mai important aspect în suspiciunea unui diagnostic de TB în sarcină este identificarea prezenţei factorilor de risc şi a simptomelor sugestive pentru infecţie. OMS recomandă screeningul pentru simptome ca tuse, indiferent de durată, febră, transpiraţii nocturne, scădere ponderală(1). Absenţa acestor simptome are o valoare predictivă negativă de 90-97,7%, chiar şi în peripartum(15), dar o sensibilitate şi o valoare predictivă pozitivă scăzute(15,16). În cazul femeilor simptomatice, sau asimptomatice, dar cu istoric de contact TB recent, CDC (Centers for Disease Control and Prevention) recomandă efectuarea unei radiografii pulmonare cu şorţ de protecţie toraco-abdominală, care are un risc minim pentru făt(17). Dacă există aspecte radiologice patologice sugestive pentru tuberculoză, sau chiar şi în absenţa acestora, dar cu infecţie HIV prezentă, este recomandat examenul bacteriologic al sputei, microscopie şi cultură(18) pentru evidenţierea M. tuberculosis. În cazul miliarei tuberculoase sau al localizării extrapulmonare, bacteriologia poate fi neconcludentă, în aceste cazuri fiind utilă o biopsie tisulară.
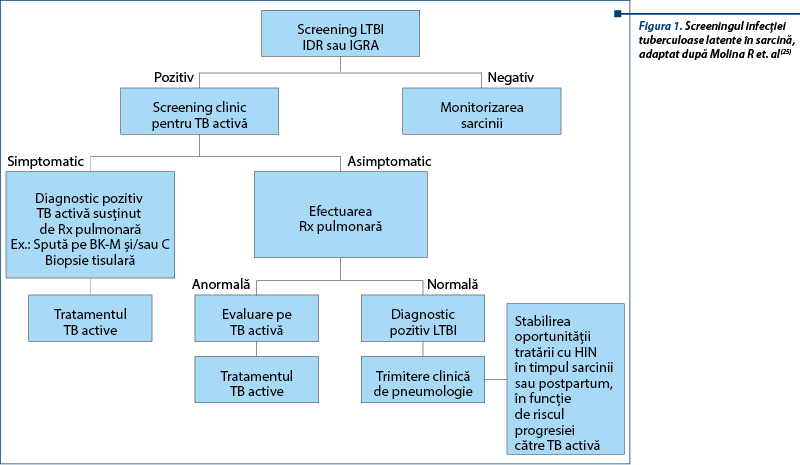
Screeningul pentru infecţia TB latentă (LTBI) urmăreşte identificarea pacientelor cu risc crescut de a dezvolta boala activă şi care ar beneficia de un tratament profilactic care să împiedice această evoluţie (figura 1). Testele utilizate în prezent pentru a demonstra prezenţa LTBI sunt testul cutanat (intradermoreacţia) la tuberculină (IDR) şi testele din sânge care cuantifică răspunsul imun al organismului, prin eliberarea de interferon g (IGRA), la antigene specifice de M. tuberculosis. Ambele teste au limite. IDR poate fi pozitiv din cauza vaccinării BCG sau a infecţiei cu alte specii de micobacterii, având o specificitate şi o sensibilitate scăzută, mai ales în cazul coinfecţiei HIV(19), posibil şi în cazul sarcinii(20). De asemenea, necesită disponibilitatea testelor, personal calificat pentru efectuarea lor şi încă o vizită la 72 de ore pentru interpretare, fapt care nu se întâmplă în 20-30% din cazuri la femeile gravide(21). IGRA are avantajul de a nu interacţiona cu vaccinarea BCG sau cu infecţiile cu alte micobacterii, nu necesită o extravizită pentru interpretare, în schimb, este mai scumpă, necesită recoltare de sânge, infrastructură de laborator şi nu a fost încă validată la scară largă în testarea femeilor gravide(22), deşi într-un studiu din Kenia ce a inclus femei gravide HIV-pozitive, testul IGRA pozitiv s-a asociat cu un risc de 4,5 ori mai mare de a dezvolta TB activă(23).
În ţările cu endemie TB joasă, CDC recomandă screeningul LTBI doar pentru femeile cu risc crescut: cele cu contact TB recent, HIV pozitive sau cunoscute cu alte cauze de imunosupresie, utilizatoare de droguri injectabile sau emigrante provenite din regiuni cu prevalenţă înaltă a tuberculozei(17). Nici în ţările cu endemie înaltă screeningul LTBI nu este recomandat de rutină, cu toate că administrarea chimioprofilaxiei cu izoniazidă (HIN) femeilor HIV pozitive cu IDR pozitiv ar aduce un beneficiu major prin scăderea riscului de boală tuberculoasă(24). Interpretarea testelor IDR sau IGRA nu se face diferit în sarcină; un IDR se consideră pozitiv dacă diametrul induraţiei este ≥10 mm pentru HIV negativ, respectiv ≥5 mm pentru HIV pozitiv; IGRA pozitiv reprezintă o concentraţie de IFN-g>0,35 IU/mL (QGIT) sau >6 spots (Tspot.TB), indiferent de statusul infecţiei HIV(19,23). CDC afirmă că IGRA poate înlocui IDR-ul şi este de preferat a fi utilizat la femeile vaccinate BCG şi în cazurile cu mare probabilitate de a nu efectua vizita pentru interpretarea unui IDR(17). OMS nu recomandă utilizarea de rutină a IGRA în screeningul LTBI(24); nici una dintre aceste organizaţii nu specifică despre utilizarea IGRA în sarcină(17,24).
Tratamentul TB active în sarcină
În ceea ce priveşte siguranţa, tolerabilitatea şi efectele pe termen lung ale tratamentului antituberculos în sarcină sau post-partum, datele sunt insuficiente, în particular pentru femeile cu infecţie HIV prezentă, care primesc tratament ARV. Beneficiile terapiei tuberculostatice depăşesc totuşi riscurile(26).
Recomandările OMS şi IUATLD (International Union Against Tuberculosis and Lung Diseases) pentru tratamentul TB în sarcină nu diferă de cele pentru populaţia generală, regimul terapeutic incluzând administrarea de:
-
Izoniazidă (HIN) 5 mg/kg/zi × 2 luni, apoi 10 mg/kg, 3 zile/săptămână, 4 luni
-
Rifampicină (RMP) 10 mg/kg/zi × 6 luni, apoi 10 mg/kg, 3 zile/săptămână, 4 luni
-
Etambutol (EMB) 15 mg/kg/zi × 2 luni
-
Pirazinamidă (PZM) 25 mg/kg/zi × 2 luni
-
şi de Piridoxină 10-25 mg/zi, în scopul prevenirii apariţiei neuropatiei periferice induse de administrarea de HIN(27).
Ghidul CDC nu include PZM în tratamentul antituberculos în sarcină, din cauza datelor de siguranţă limitate, terapia incluzând doar trei medicamente (HIN, RMP, EMB) în dozele recomandate şi de OMS, cu administrare zilnică, pe o durată de 9 luni; de asemenea, acest ghid recomandă urmărirea funcţiei hepatice lunar, pe toată perioada tratamentului antituberculos, din cauza riscului de toxicitate hepatică indus de HIN. Deşi RMP nu are contraindicaţie de administrare în sarcină, CDC recomandă o singură doză de vitamina K, profilactic, la nou-născut, pentru a reduce riscul de hemoragii pe care acest medicament l-ar induce(17).
Medicamentele antituberculoase contraindicate în sarcină sunt aminoglicozidele: streptomicina, kanamicina, amikacina, capreomicina, din cauza ototoxicităţii fetale şi a riscurilor renale, şi fluorochinolonele, din cauza posibilităţii apariţiei anomaliilor osoase la făt(28).
În ceea ce priveşte tratamentul LTBI în sarcină, nu există un consens în recomandările ghidurilor (tabelul 1). OMS nu oferă comentarii legate de tratamentul cu HIN al femeilor HIV-negative în timpul sarcinii(24), în timp ce CDC recomandă amânarea tratamentului profilactic până la două-trei luni post-partum, cu excepţia situaţiei în care există documentat un contact TB recent(29).

Tratamentul tuberculozei la femeia gravidă HIV pozitivă nu diferă faţă de cel adresat populaţiei adulte, fiind marcat de provocările în ceea ce priveşte aderenţa, numărul mare de medicamente pentru tratarea celor două boli, dar şi efectele secundare cumulate ale acestora. Mai mult de 50% din mortalitatea TB în sarcină se datorează coinfecţiei cu HIV(30), care este asociată cu efecte adverse multiple, materne, dar şi fetale, incluzând prematuritatea, întârzieri în creşterea intrauterină şi complicaţiile datorate toxicităţii terapiei(31).
Deşi tratamentul antituberculos şi cel ARV pot fi începute concomitent, OMS recomandă o perioadă de minimum 8 săptămâni între iniţierea terapiei tuberculostatice şi începutul terapiei ARV(27), dată fiind posibilitatea apariţiei sindromului de reconstrucţie imunologică (IRIS) odată cu iniţierea ARV, mai ales în cazurile de imunosupresie severă. Regimul constă în 6 până la 12 luni de HIN, RMP, EMB şi PZM, în dozele standard. Rifampicina, ca şi rifampin scad concentraţia plasmatică a majorităţii medicamentelor ARV, în special a inhibitorilor de non-nucleozid revers transcriptază (NNRTIs) şi a inhibitorilor de protează(32). Alternativele ar consta fie în înlocuirea RMP cu rifabutin, însă acesta nu este accesibil în toate ţările, inclusiv în România, fie utilizarea RMP cu efavirenz, ale cărui concentraţii plasmatice nu sunt influenţate de asocierea cu RMP(33). Utilizarea efavirenz în sarcină a fost subiect de controversă în diverse studii, administrarea acestuia în primul trimestru de sarcină fiind asociată cu apariţia unor defecte ale tubului neural la făt(34), însă o metaanaliză recentă, ce a cuprins 11 studii prospective şi 5 retrospective, nu a arătat o creştere a acestui risc, comparativ cu al altor medicamente ARV(35). Totuşi, pentru că nu există recomandări clare ale ghidurilor privind tratamentul anti-TB şi ARV în sarcină, în astfel de situaţii, tratamentul ar trebui să fie elaborat de o echipă multidisciplinară, care să includă specialişti obstetricieni, pneumologi şi infecţionişti.
Tratamentul TB-MDR în sarcină se bazează doar pe experienţa din câteva cazuri raportate în literatură(36-38). Siguranţa medicamentelor utilizate în terapia TB-MDR (cicloserina, ofloxacina, amikacina, kanamicina, capreomicina, etionamida) nu este stabilită pentru femeile gravide, toate aceste grupe de medicamente fiind asociate cu diverse efecte secundare teratogene. Au fost luate în considerare atât avortul terapeutic, cât şi amânarea tratamentului TB-MDR până la terminarea sarcinii, dar au fost raportate şi cazuri în care utilizarea terapiei individualizate cu medicamente de linia a II-a, în diverse combinaţii, a avut efecte favorabile, cu vindecarea TB-MDR, fără efecte adverse obstetricale(37). Într-un studiu din Peru ce a cuprins 38 de femei gravide cu TB-MDR, 23 (60%) au fost vindecate, 5 (13%) au decedat (4 din cauza TB), două au fost declarate eşec terapeutic. Complicaţii ale sarcinii au fost raportate în 8 (21%) cazuri: avort spontan sau sângerări vaginale; un copil a decedat din cauza unei pneumonii(36).
Pentru viitor se aşteaptă o îmbunătăţire a experienţei şi a cunoştinţelor în managementul TB-MDR la femeia gravidă, în condiţiile creşterii prevalenţei acestei forme grave de tuberculoză la nivel global.
Efectele tuberculozei asupra fătului
Tuberculoza poate fi transmisă copilului in utero, pe cale hematogenă, prin vena ombilicală sau prin aspirarea sau înghiţirea de lichid amniotic, intrapartum, prin contactul cu lichidul amniotic sau secreţii genitale, iar post-partum, prin aspirarea aerosolilor infectanţi sau prin laptele infectat. Deşi TB congenitală este rară, într-un studiu din Africa de Sud, transmiterea verticală a TB s-a produs în 16% din cazuri, independent de statusul HIV al mamei(39).
Mortalitatea infantilă variază, ajungând până la 38%(40). Aceleaşi variaţii se regăsesc şi în ceea ce priveşte alte complicaţii perinatale. Într-un studiu din SUA nu s-au înregistrat diferenţe în statusul copiilor născuţi de mame cu TB versus mame fără TB(41), în timp ce într-un studiu din India, copiii cu mame cu TB au avut o rată mai mare de afectare fetală, greutate mică la naştere, prematuritate şi mortalitate infantilă(42).
Concluzii
Stabilirea unui diagnostic precoce şi a unui tratament adecvat al tuberculozei în sarcină reprezintă intervenţii majore pentru îmbunătăţirea stării de sănătate atât a mamei, cât şi a copilului. Diagnosticul tuberculozei la femeia gravidă poate fi dificil din cauza simptomatologiei nespecifice care se regăseşte în mod obişnuit în timpul sarcinii. Screeningul şi tratamentul infecţiei tuberculoase latente sunt de maximă importanţă, mai ales în zonele cu endemie mare a tuberculozei, având în vedere riscul mare de progresie către boala activă cu care se asociază sarcina. Colectarea datelor privind formele de tuberculoză asociate cu HIV sau multidrog-rezistente la femeile gravide, analiza şi publicarea lor reprezintă etape importante pentru o îmbunătăţire a cunoştinţelor şi elaborarea de ghiduri pentru un mai bun management al acestor situaţii.
Bibliografie
2. Stewart DA. Pregnancy and tuberculosis: Part I - The effects of pregnancy on tuberculosis. Can Med Assoc J. 1922; 12: 1–3.
3. Gupta S, Granich R, Suthar AB, Smyth C, Baggaley R, Sculier D. et al. Global policy review of antiretroviral therapy eligibility criteria for treatment and prevention of HIV and tuberculosis in adults, pregnant women, and serodiscordant couples. J Acquir Immune Defic Syndr. 2013; 62: e87–e97.
4. Mathad J, Gupta A. Tuberculosis in pregnant and postpartum women: epidemiology, management, and research gaps. Clin Infect Dis. 2012; 55: 1532–1549.
5. Adhikari M. Tuberculosis and tuberculosis/HIV co-infection in pregnancy. Semin Fetal Neonatal Med. 2009; 14: 234–240.
6. Zumla A, Bates M, Mwaba P. The neglected global burden of tuberculosis in pregnancy. Lancet Glob Health 2014; 2(12):675-76.
7. Herbert N, George A, Cunliffe-Lister S et al. World TB Day 2014: finding the missing 3 million. Lancet. 2014; 383: 1016–1018.
8. World Health Organization. WHO policy on collaborative TB/HIV activities: guidelines for national programmes and other stakeholders. World Health Organization, Geneva; 2012.
9. Zenner D, Kruijshaar ME, Andrews N, Abubakar I. Risk of tuberculosis in pregnancy: a national, primary care-based cohort and self-controlled case series study. Am J Respir Crit Care Med. 2012; 185: 779–784.
10. Kraus T, Engel S, Sperling R, Kellerman L, Lo Y, Wallenstein S et al. Characterizing the pregnancy immune phenotype: results of the viral immunity and pregnancy (VIP) study. J Clin Immunol. 2012; 32: 300–311.
11. Singh, N. and Perfect, J.R. Immune reconstitution syndrome and exacerbation of infections after pregnancy. Clin Infect Dis. 2007; 45: 1192–1199.
12. Efferen LS. Tuberculosis and pregnancy. Curr Opin Pulm Med 2007;13:205–11.
13. Adhikari M. Tuberculosis and tuberculosis/HIV co-infection in pregnancy. Semin Fetal Neonatal Med 2009;14:234–40.
14. Jana N, Vasishta K, Saha SC, Ghosh K. Obstetrical outcomes among women with extrapulmonary tuberculosis. N Engl J Med. 1999;341:645–9.
15. Getahun H, Kittikraisak W, Heilig CM, et al. Development of a standardized screening rule for tuberculosis in people living with HIV in resource-constrained settings: individual participant data meta-analysis of observational studies. PLoS Med. 2011;8:e1000391.
16. Gupta A, Chandrasekhar A, Gupte N, et al. Symptom screening among HIV-infected pregnant women is acceptable and has high negative predictive value for active tuberculosis. Clin Infect Dis. 2011;53:1015–8.
17. Centers for Disease Control and Prevention. Trends in tuberculosis—United States, 2010. MMWR Morb Mortal Wkly Rep. 2012;61:181–5.
18. Health Protection Agency. Pregnancy and tuberculosis: guidance for clinicians. London: Health Protection Agency; 2006.
19. Cobelens FG, Egwaga SM, van Ginkel T, Muwinge H, Matee MI, Borgdorff MW. Tuberculin skin testing in patients with HIV infection: limited benefit of reduced cutoff values. Clin Infect Dis. 2006;43:634–9.
20. Eriksen N, Helfgott A. Cutaneous anergy in pregnant and nonpregnant women with human immunodeficiency virus. Infect Dis Obstet Gynecol. 1998;6:13–7.
21. Schulte J, Bryan P, Dodds S, Potter M, Onorato I, O’Sullivan MJ. Tuberculosis skin testing among HIV-infected pregnant women in Miami, 1995 to 1996. J Perinatol. 2002;22:159–62.
22. Dheda K, van Zyl Smit R, Badri M, Pai M. T-cell interferon-gamma release assays for the rapid immunodiagnosis of tuberculosis: clinical utility in high-burden vs. low-burden settings. Curr Opin Pulm Med. 2009;15:188–200.
23. Jonnalagadda S, Lohman Payne B, Brown E, et al. Latent tuberculosis detection by interferon γ release assay during pregnancy predicts active tuberculosis and mortality in human immunodeficiency virus type 1-infected women and their children. J Infect Dis. 2010;202:1826–35.
24. World Health Organization. Guidelines for intensified tuberculosis case-finding and isoniazid preventive therapy for people living with HIV in resource-constrained settings. Geneva, Switzerland: WHO; 2011.
25. Molina R, Diouf K, Nour N.Tuberculosis and the Obstetrician-Gynecologist: A Global Perspective. Rev Obstet Gynecol. 2013; 6(3-4): 174–181.
26. Figueroa-Damian R, Arredondo-Garcia JL. Pregnancy and tuberculosis: influence of treatment on perinatal outcome. Am J Perinatol. 1998;15:303–6.
27. World Health Organization. Treatment of tuberculosis guidelines. 4th ed. Geneva, Switzerland: WHO; 2010.
28. Bothamley G. Drug treatment for tuberculosis during pregnancy: safety considerations. Drug Saf. 2001;24:553–65.
29. Centers for Disease Control and Prevention. Latent tuberculosis infection: a guide for primary health care providers. Available at: http://www.cdc.gov/tb/publications/LTBI/treatment.htm Accessed 28 March 2015
30. Khan M, Pillay T, Moodley JM, Connolly CA, the Durban Perinatal TB HIV-1 Study Group Maternal mortality associated with tuberculosis-HIV-1 co-infection in Durban, South Africa. AIDS. 2001;15(14):1857–1863.
31. Burman WJ. Issues in the management of HIV-related tuberculosis. Clinics in Chest Medicine. 2005;26(2):283–294.
32. Maartens G, Decloedt E, Cohen K. Effectiveness and safety of antiretrovirals with rifampicin: crucial issues for high-burden countries. Antivir Ther 2009;14:1039–43
33. Cohen K, Meintjes G. Management of individuals requiring antiretroviral therapy and TB treatment. Curr Opin HIV AIDS 2010;5:61–9.
34. De Santis M, Carducci B, De Santis L, et al. Periconceptional exposure to efavirenz and neural tube defects. Arch Intern Med. 2002;162:355.
35. Ford N, Mofenson L, Kranzer K, et al. Safety of efavirenz in first-trimester of pregnancy: a systematic review and meta-analysis of outcomes from observational cohorts. AIDS. 2010;24:1461–1470.
36. Palacios E, Dallman R, Muñoz M. Drug-resistant tuberculosis and pregnancy: treatment outcomes of 38 cases in Lima, Peru. Clin Infect Dis. 2009;48:1413–9.
37. Shin S, Guerra D, Rich M, et al. Treatment of multi-drug resistant tuberculosis during pregnancy: a report of 7 cases. Clin Infect Dis. 2003;36:996–1003.
38. Nitta AT, Milligan D. Management of four pregnant women with multi-drug resistant tuberculosis. Clin Infect Dis. 1999;28:1298–304.
39. Pillay T, Sturm AW, Khan M, et al. Vertical transmission of Mycobacterium tuberculosis in KwaZulu Natal: impact of HIV-1 co-infection. Int J Tuberc Lung Dis. 2004;8:59–69.
40. Cantwell MF, Shehab ZM, Costello AM, et al. Brief report: congenital tuberculosis. N Engl J Med. 1994;330:1051–4.
41. Schaefer G, Zervoudakis IA, Fuchs FF, David S. Pregnancy and pulmonary tuberculosis. Obstet Gynecol. 1975;46:706–15.
42. Jana N, Vasishta K, Jindal SK, Khunnu B, Ghosh K. Perinatal outcome in pregnancies complicated by pulmonary tuberculosis. Int J Gynaecol Obstet. 1994;44:119–24.
Articole din ediţiile anterioare
Modificările statusului periodontal în sarcină – review şi prezentare a unui caz clinic
Sarcina este o perioadă caracterizată de schimbări fiziologice legate de o vulnerabilitate ridicată a sănătăţii orale. Variaţia prevalenţei modific...
Diabetul gestaţional – o provocare obstetricală, neonatală şi postnatală
In recent decades, the demographics of pregnant women have changed, with an increase of women giving birth at an older age and which, associated wi...
Principii de tratament cu metotrexat al sarcinii extrauterine necomplicate
Sarcina extrauterină reprezintă o urgenţă ginecologică severă care, în lipsa unui diagnostic stabilit corect şi rapid, precum şi a unei intervenţii...
Sarcina ectopică cu evoluţie atipică
Prezentăm cazul unei paciente în vârstă de 32 de ani, cu istoric de infertilitate de cauză neexplicată (2 inseminări şi 2 fertilizări in vitro pe c...