Obesity is recognised as a major risk factor for type 2 diabetes, and this association forms the basis for our assessment of the potential benefits of gastric bypass for the treatment of diabetes. The present study was conducted on a series of 128 patients, associating obesity and type 2 diabetes who were operated by laparoscopic gastric bypass method in Tivoli University Hospital in Belgium, between February 2003 and March 2012. The evolution of type 2 diabetes was analyzed retrospectively by studying specific metabolic parameters (fasting blood glucose, hemoglobin HbA1c) and clinical outcomes (weight dynamics and the evolution of treatment for diabetes). Thanks to this combination of treatment mechanisms, a type 2 diabetes remission rate of 62% over 36 months was achieved with gastric bypass. Gastric bypass is incontrovertibly efficacious in the control of type 2 diabetes by virtue of clinical, metabolic and therapeutic improvements.
Evoluţia diabetului de tip 2 după bypass gastric - studiu retrospectiv pe 128 de cazuri
Evolution of type 2 diabetes after gastric bypass - retrospective study of 128 cases
First published: 19 mai 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/MED.117.3.2017.741
Abstract
Rezumat
Asocierea obezității cu diabetul a permis valorizarea potențialului terapeutic al bypassului gastric asupra diabetului. Studiul de față a fost realizat pe o serie de 128 de pacienți, asociind obezitate și diabet de tip 2, care au fost operați prin metoda bypass gastric laparoscopic la Spitalul Universitar Tivoli din Belgia, între februarie 2003 și martie 2012. Evoluția diabetului de tip 2 a fost analizată retrospectiv, prin studierea parametrilor metabolici specifici (glicemie à jeun, hemoglobina A1c) și a rezultatelor clinice (dinamica ponderală și evoluția tratamentului pentru diabet). Studiul seriei întregi și al unui eșantion de 30 de cazuri urmărite de manieră omogenă timp de 36 de luni a confirmat ameliorările clinice, biologice și terapeutice așteptate în relație cu pierderea în greutate postoperatorie, demonstrând că intervenția este asociată de efecte benefice de natură hormonală apărute înaintea declanșării dinamicii ponderale. Astfel, bypassul gastric induce o rată de remisiune de până la 62% a diabetului de tip 2 la 36 de luni.
Introducere
Prevalența globală și creșterea continuă a numărului de cazuri de diabet de tip 2 îndreptățesc caracterizarea lui ca „epidemic”. 284 de milioane de persoane erau diabetice în 2010 în întreaga lume și se estimează o creștere de 54%, atingând 438 de milioane în 2030(1). Diabetul de tip 2 reprezintă 90-95% din total. În termeni de impact sanitar, în 2004, Organizaţia Mondială a Sănătăţii raporta 3,4 milioane de decese pe an ca urmare a complicațiilor diabetului(2), numărul urcând în 2012 la 4,6 milioane, doar ca urmare a diabetului de tip 2. Diabetul este, în prezent, a șasea cauză de mortalitate în lume(3) și este responsabil de o reducere a speranței de viață cu 5 până la 10 ani. Conform raportului anual din 2011 al Federației Internaționale a Diabetului, cheltuielile aferente îngrijirilor medicale pentru diabet se cifrau la 465 miliarde de dolari pe an. Această dinamică nefastă se traduce, de exemplu, în Belgia, printr-o prevalență a diabetului de tip 2 care a crescut de la 3,2% în 2000(4) la 4,7% în 2009, reprezentând 500.000 de pacienți(5).Obezitatea este un factor de risc major al diabetului de tip 2. Mai mult de 80% dintre pacienții diabetici de tip 2 sunt supraponderali (IMC>25 kg/m2), 50% au un IMC>30 kg/m2 și 10% au IMC peste 40 kg/m2(6). Asocierea între diabet și obezitate a stat la baza ipotezelor privind rolul benefic al bypassului gastric în controlul diabetului de tip 2(7), precum și în reducerea morbidității și mortalității legate de diabet în populația obeză(8). În aceeași ordine de idei, atenuarea simptomelor diabetului fusese deja raportată de studii realizate anterior, prin urmărirea gastrectomiilor subtotale(9) și după rezecția gastrică(10).
În momentul de față, recomandările ADA/DSS-II susțin tratamentul diabetului de tip 2 la pacienții cu obezitate de gradul III (IMC≥40 Kg/m2) și la cei cu obezitate de gradul II (IMC 35-39,9 Kg/m2) la care hiperglicemia nu este controlată corect printr-un tratament medical optimal(11).
Obiectivul acestei lucrări constă în analiza retrospectivă a evoluției diabetului de tip 2 pe o serie de 128 de pacienți operați prin metoda bypass gastric pentru obezitate morbidă, prin studierea pre- și postoperatorie a parametrilor metabolici (glicemia à jeun, hemoglobina A1c) și a rezultatelor clinice (dinamica ponderală și evoluția tratamentului diabetului).
Material și metodă
Între februarie 2003 și martie 2012, dintr-un total de 681 de operații de bypass gastric primar, a fost studiată o serie de 128 de pacienți (18,8%) care sufereau de diabet de tip 2. Intervenția a fost realizată, în toate cazurile, pe cale laparoscopică, sub anestezie generală. Un mic rezervor gastric proximal în continuitatea esofagului, calibrat pe o sondă Charrière 34, a fost separat prin agrafare de restul stomacului. Rezervorul, cu un volum aproximativ de 20 ml, a fost ulterior anastomozat cu jejunul printr-un montaj de tip Roux-en-Y, a cărui ansă biliopancreatică a fost măsurată la 75 cm, plecând de la unghiul lui Treitz, iar ansa alimentară separând anastomoza proximală de piciorul montajului a fost măsurată la 150 cm.Următoarele date au fost colectate din cele 128 de dosare ale pacienților diabetici:
- parametri fizici: vârsta, sexul, talia, greutatea preoperatorie și greutatea ideală preoperatorie, respectiv dinamica greutății pe parcursul urmăririi și mijloacele de calcul pentru raportarea acestei dinamici - indicele de masă corporală (IMC) și procentul de exces ponderal pierdut (%EWL; excess weight loss);
- parametri biologici: glicemia à jeun și nivelul hemoglobinei A1c prelevate în dinamică;
- date referitoare la tratamentul diabetului: pe de o parte, numărul de antidiabetice orale de diferite clase (AODC) în fiecare stadiu de evoluție și, pe de altă parte, cantitatea totală de insulină injectată zilnic (U.I.). Aceste date au fost exprimate cantitativ pe zi, per pacient (/zxp).
Pentru a cuantifica evoluția tratamentului antidiabetic s-a folosit clasificarea Asociației Americane de Diabet:
- Faza I: stabilitate glicemică menținută prin optimizarea stilului de viață, fără tratament (nici antidiabetice orale, nici insulină).
- Faza a II-a: folosirea de antidiabetice orale.
- Faza a III-a: asocierea de insulină și antidiabetice orale.
- Faza a IV-a: diabet strict insulino-dependent.
Rezultate
Seria întreagă este constituită din 128 de pacienți (60% femei și 40% bărbați), a căror vârstă medie este de 50,5 ± 9,5 ani. Greutatea medie preoperatorie este de 121,5 ± 21,1 kg (extreme: 78,1 kg, respectiv 186,4 kg), talia medie fiind de 165,5 ± 9,5 cm. IMC-ul preoperator mediu este de 44,3 ± 6,5 kg/m2 (extreme: 35 kg, respectiv 67,2 kg/m2). Glicemia medie preoperatorie a fost calculată la 232,5 ± 101,2 mg/dl (extreme: 100,5 mg/dl, respectiv 605,6 mg/dl), în timp ce valoarea medie a HbA1c era în acel moment de 8,9 ± 2,5% (extreme: 5,5%, respectiv 14,9%).Tratamentele antidiabetice preoperatorii medii au fost cuantificate la 1,22 ± 0,7 AODC/zxp (extreme: 0, respectiv 3) și 28 ± 51 U.I./zxp (extreme: 0, respectiv 220 U.I.). Repartiția pacienților între diferitele faze de tratament antidiabetic în preoperator era de: 1% în faza I, 67,7% în faza a II-a, 22,3% în faza a III-a și 9% în faza a IV-a.
Durata urmăririi medii postoperatorie a fost de 26 de luni (între 3 și 84 de luni).
Evoluția ponderală a seriei întregi este ilustrată prin dinamica valorilor greutății, a IMC-ului și a %EWL. Figura 1 prezintă grafic evoluția IMC. Se constată o diminuare progresivă a IMC, de la o valoare medie preoperatorie de 44,3 kg/m2 până la un minim de 30,5 kg/m2 18 luni mai târziu, corespunzând unei pierderi de 73,8% EWL.
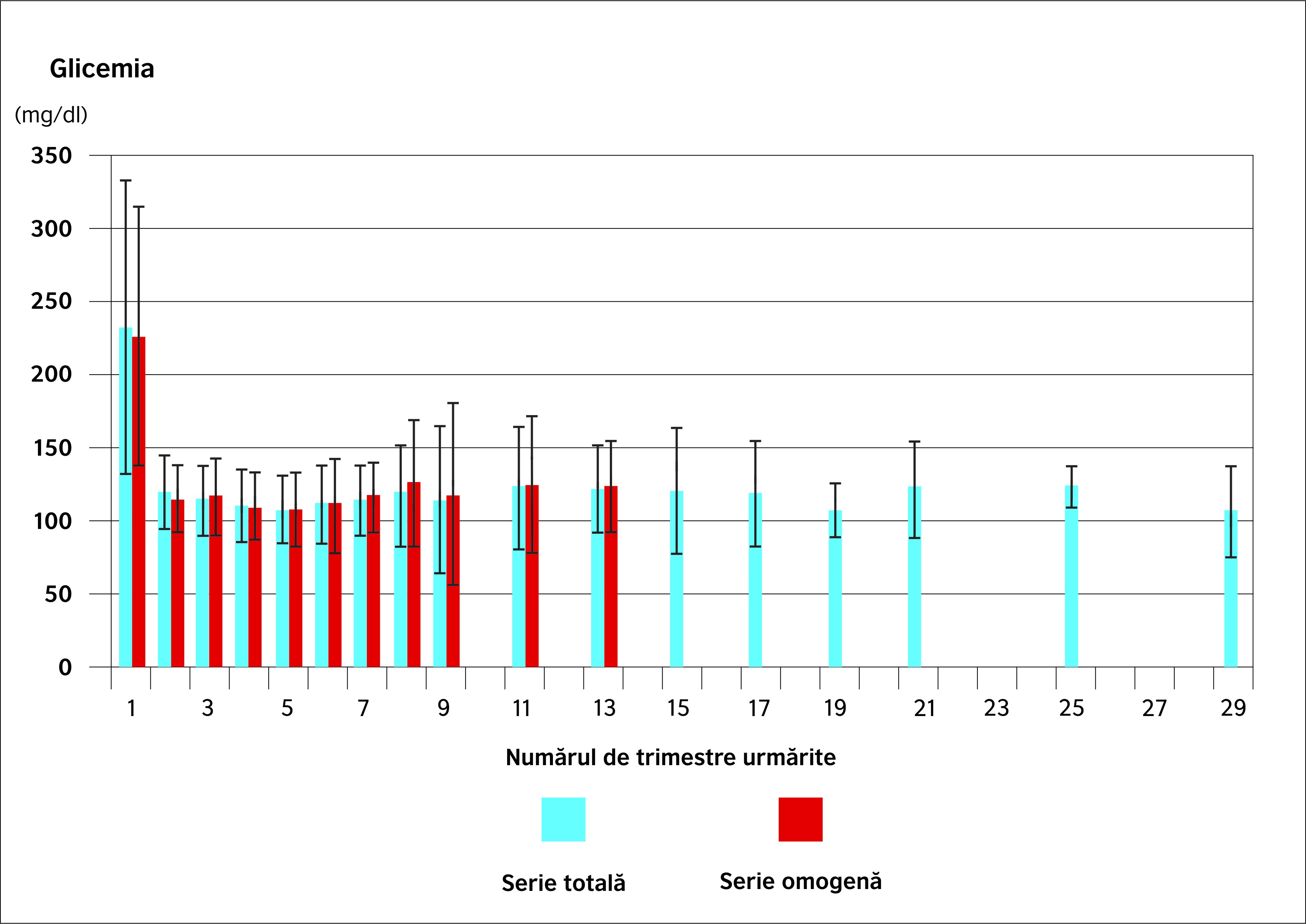
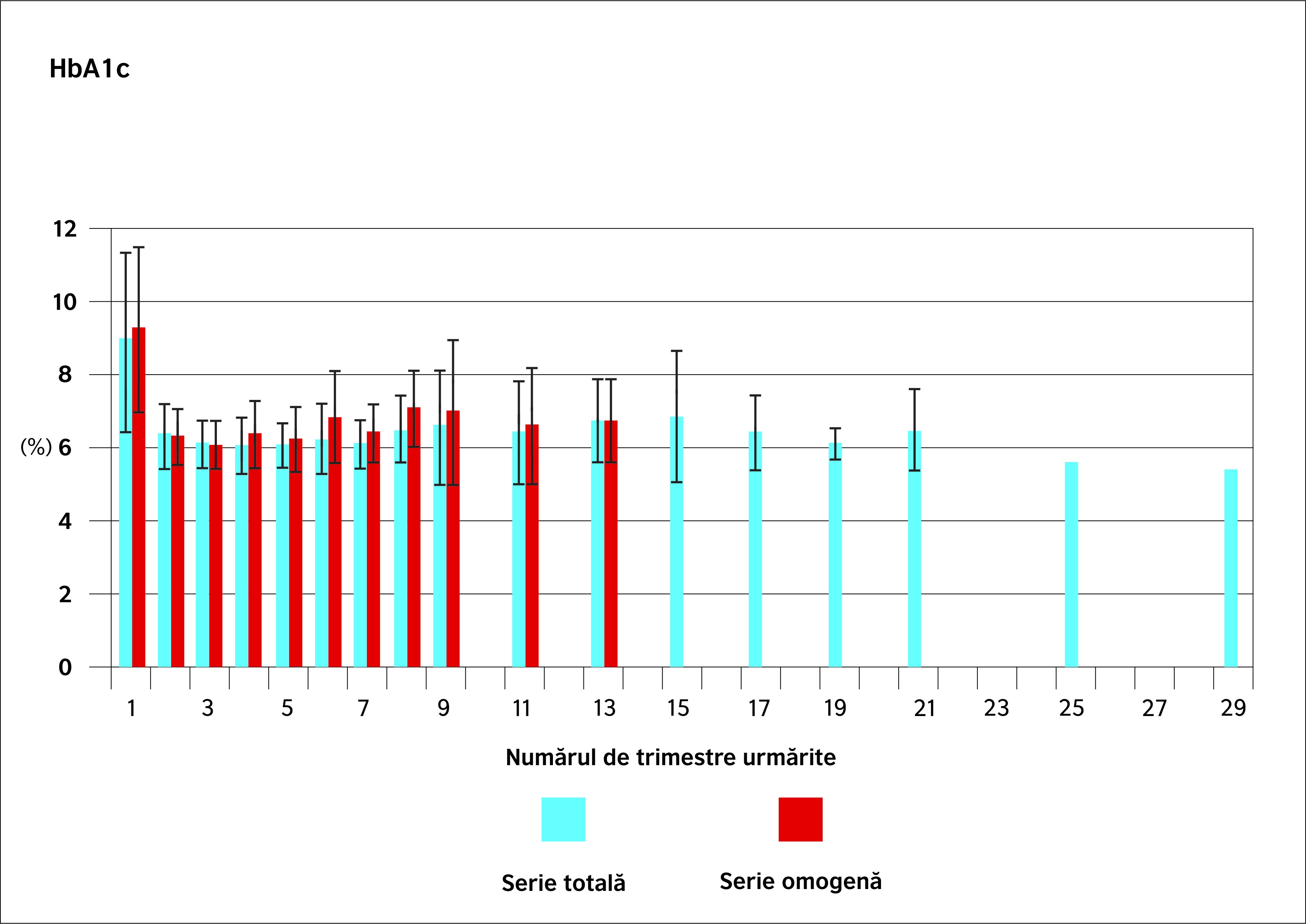
Evoluția metabolică a seriei întregi în ceea ce privește diabetul de tip 2 a fost evaluată prin urmărirea regulată a valorilor glicemice și a nivelului de HbA1c. Figurile 2 și 3 ilustrează aceste rezultate. Tendința descrescătoare observată în evoluția parametrilor de greutate se regăsește și aici: glicemia medie are cea mai mică valoare la 12 luni postoperator (107,2 mg/dl), iar HbA1c scade de la 8,9% în preoperator la 6% după 9 luni de urmărire. Se remarcă, în mod evident, că ameliorarea parametrilor metabolici este mai rapidă decât evoluția ponderală.
Evoluția tratamentelor antidiabetice pe seria întreagă este ilustrată în figura 4. Se observă o scădere drastică a consumului de agenți terapeutici din a treia lună postoperatorie (0,33 AODC/zxp și 4,7 U.I./zxp). În continuare, se remarcă o diminuare mai puțin importantă a AODC în raport cu U.I., care traduce prioritatea terapeutică acordată sevrajului insulinic și trecerii din faze avansate de tratament (fazele a IV-a și a III-a) către fazele a II-a și I, recurgând la AODC. În a 21-a lună postoperatorie, ne regăsim la capătul unei descreșteri progresive și sincrone a numărului de U.I. de insulină și a AODC, mediile observate în punctul minim fiind de 0,2 AODC/zxp și 1,7 U.I./zxp. După acest stadiu, corespunzător celui mai bun rezultat pentru IMC, se observă în timpul fazei de stabilizare (până la a 36-a lună) o paralelă între recâștigarea în greutate și mărirea necesarului terapeutic antidiabetic până la 0,2 AODC și 5 U.I./zxp.
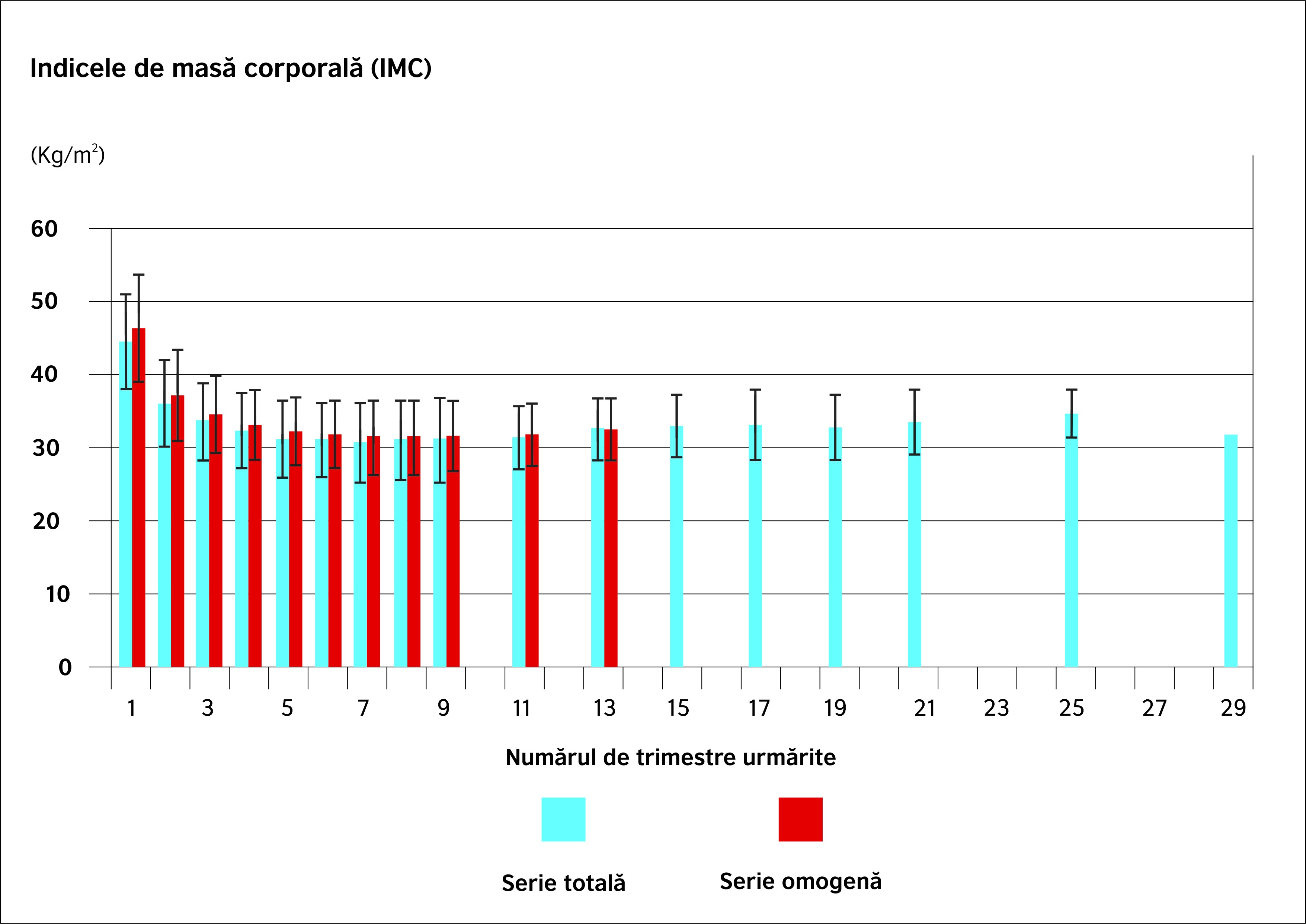

Seria omogenă de 30 de pacienți urmăriți 36 de luni a făcut obiectul unei analize similare. Este vorba despre 30 de pacienți (17/30, însemnând 56,7% femei) cu o vârstă medie de 51 ± 8,9 ani. IMC-ul mediu preoperator este de 46,3 ± 7,3 kg/m2.
- Studierea IMC-ului mediu (figura 1) arată o descreștere postoperatorie până la minimul atins în 21 de luni (de la 46,3 la 31,2 kg/m2). Ca și în seria întreagă, IMC-ul cunoaște o discretă creștere ulterioară până la 32,2 kg/m2
- Glicemiile și HbA1c urmează o tendință similară (figurile 2 și 3): minimul este atins pentru acești doi parametri după 12 luni (glicemia scăzând de la 226,4 mg/dl la 106,9 mg/dl și HbA1c de la 9,2% la 6,2%). Valorile la 36 de luni sunt în lejeră creștere (123 mg/dl și 6,6%).
- Studiul cantitativ al tratamentelor antidiabetice (figura 4) arată, în preoperator, o medie de 1,1 AODC/zxp și 21 U.I./zxp. În ceea ce privește AODC, scăderea necesarului este drastică în primul trimestru postoperator (până la 0,3 AODC/zxp), minimul de 0,2 AODC/zxp fiind atins în a 21-a lună, pentru a se stabiliza puțin mai sus, la 0,3 AODC/zxp la 36 de luni. Dimpotrivă, în perioada studiată, dozele de insulină au urmat o dinamică descrescătoare până în a 21-a lună, cu scădere spectaculoasă în primele trei luni (de la 21 U.I./zxp la 9,3 U.I./zxp), iar apoi mai lentă, până la 4,3 U.I./zxp. Creșterea ulterioară a acestei valori până la 6,5 U.I./zxp spre a 36-a lună postoperator corespunde vârfului regăsit la studiul seriei complete de 128 de pacienți (conform figurii 4).
- Progresia pe diverse faze de tratament antidiabetic a seriei de 30 de pacienți este ilustrată în tabelul 1. Se constată migrarea progresivă a pacienților către fazele terapeutice mai lejere, proporția pacienților în remisiune (fără tratament) trecând de la 1/30 (3,3% - un caz descoperit preoperator) la 19/30 (63,3%) după 36 de luni postoperator.
Discuții
Rezultatele acestui studiu confirmă eficacitatea bypassului gastric în tratamentul diabetului de tip 2 la pacienții cu obezitate morbidă: cei 60% de pacienți cu diabetul în remisiune după 36 de luni de urmărire în seria omogenă confirmă concluziile metaanalizei lui Buchwald et al.(12), care raportau o rată de 62% a remisiunii la peste doi ani după chirurgia bariatrică. Pories(13) și Schauer(14) au raportat la 83% din cazuri remisiunea diabetului de tip 2 după bypass gastric.Legătura de cauzalitate bine stabilită între obezitate și diabet sugerează că pierderea excesului de greutate indusă de bypassul gastric ar fi responsabilă de ameliorările clinice și biologice înregistrate în evoluția bolii. Din punct de vedere epidemiologic, situația este mai complexă, deoarece 10% dintre pacienții diabetici de tip 2 sunt slabi, în timp ce trei sferturi dintre pacienții cu obezitate morbidă nu sunt diabetici(15). În plus, în privința eficacității bypassului gastric asupra diabetului de tip 2, la fel ca în această lucrare, numeroase studii atestă o disjuncție între ameliorarea spectaculoasă și precoce a statusului glicemic al pacienților operați și pierderea în greutate care nu survine decât ulterior. Laferrere et al.(16) au raportat, ca urmare a unui studiu comparativ pe două grupuri la care s-a înregistrat o pierdere în greutate de 10 kg, o netă ameliorare a răspunsului insulinic după consumul de glucoză în cadrul grupului unde pierderea greutății fusese indusă prin bypass gastric, în raport cu grupul supus doar restricţiilor legate de dietă. Într-un studiu randomizat, Hofso et al.(17) au arătat că bypassul gastric permite obținerea unui control glicemic mai bun la pacientul cu diabet și obezitate, la doi ani de la operație, decât tratamentul medical.
Aceste rezultate sugerează că bypassul gastric induce alte modificări specifice pentru controlul diabetului, decât simpla pierdere în greutate: mecanisme hormonale. Cummings(18), Dixon(19) și Herron(20) au clarificat teoriile privind aceste mecanisme: se asistă, în primul rând, la o creștere a GLP-1(glucagon-like peptide 1) (Bose et al.(21)) produsă de intestinul subțire distal, capabil să mărească secreția de insulină și să scadă apetitul. În studiul deja raportat al lui Laferrere et al., creșterea secreției insulinice după bypassul gastric a fost explicată prin stimularea sintezei GLP-1. Restaurarea spectaculoasă a secreției de insulină imediat după bypassul gastric(22) și independentă de pierderea în greutate(16) ar fi, astfel, indusă printr-o majorare postprandială importantă a efectului GLP-1 asupra celulelor β (efect de incretină). Modul de acțiune exact al bypassului gastric asupra acestui mecanism nu este clar elucidat. Două ipoteze se înfruntă:
- teoria intestinului proximal avansează ideea inhibării unor factori „anti-incretină” prezenți la diabetici, inhibare indusă de absența pasajului alimentar la nivelul duodenului și jejunului proximal(23);
- teoria intestinului distal(24) sugerează că sosirea rapidă a nutrienților la nivelul intestinului subțire distal accentuează secreția la acest nivel a hormonilor insulino-trofici, precum GLP-1(25-27).
În lucrarea de față, eficacitatea metabolică precoce a bypassului gastric a fost regăsită în diminuarea valorii medii a HbA1c în postoperator cu 2,6% la 3 luni, 2,9% la 18 luni și 2,5% după 5 ani de urmărire. În seria omogenă de 30 de pacienți urmăriți timp de 3 ani, rezultatele sunt respectiv de 3% la 3 luni, 2,9% la 18 luni și 2,6% după 36 de luni. Dimpotrivă, conform observațiilor lui Kim et al.(30), eficacitatea bypassului gastric asupra diabetului de tip 2 rămâne, pe termen lung, asociată eficacității sale ponderale: creșterea discretă a nivelului HbA1c după 18 luni este corelată cu recâștigarea în greutate, rămânând totodată asociată diminuării semnificative a tratamentelor. Numeroase mecanisme sunt implicate în eficacitatea ponderală a bypassului gastric:
- restricția mecanică în relație cu mărimea rezervorului gastric și cu diametrul anastomozei gastro-jejunale;
- mecanismele de modulare a foamei și sațietății, prin creșterea sintezei peptidelor anorexigene precum PYY 3-36(31) sau oxyntomodulina(32), respectiv diminuarea peptidelor orexigene precum grelina(33);
- sindromul dumping postprandial care intervine prin evitarea anumitor alimente(34);
- ipoteze noi și variate sunt avansate, precum: modificarea de origine hormonală a tranzitului activ al glucozei la nivel intestinal(35), creșterea consumului energetic al intestinului prin hipertrofie musculară, modificarea florei digestive(36) sau alterarea ciclului enterohepatic al acizilor biliari(37).
Pe termen lung, pentru a asigura un rezultat optim asupra diabetului de tip 2, este deci imperativă - în plus față de respectarea criteriilor inițiale de selecție care prevăd neadmiterea pentru tratament chirurgical a pacienților cu tulburări psihice grave, dependenți de consumul de droguri sau alcool - impunerea unui control riguros al dinamicii ponderale a pacientului operat de bypass, prin măsuri de stabilizare, asociind urmărirea strictă și optimizarea obiceiurilor alimentare.
Concluzii
Studiul de faţă demonstrează, o dată în plus, eficacitatea incontestabilă a bypassului gastric în evoluția diabetului de tip 2 la pacienții cu un IMC de peste 35 kg/m2, prin ameliorările induse pe plan clinic, metabolic și terapeutic. Numeroase întrebări cu privire la mecanismele care asigură eficacitatea sau la factorii care deteriorează eficacitatea bypassului gastric rămân încă neelucidate. O adevărată poartă deschisă pentru cercetare și deja considerat standard de aur(39) în tratamentul obezității, bypassul gastric ocupă un loc promițător în arsenalul terapeutic al diabetului de tip 2(40).Bibliografie
2. Shamseddeen H, Zelada Getty J, Hamdallah IN, Ali MR. Epidemiology and Economic Impact of Obesity and Type 2 Diabetes, Surg Clin N Am 91 (2011) 1163–1172.
3. World Health Organization, The top causes of death, disponibil la: http://www.who.int/mediacentre/factsheets/fs310/en/
4. Fleming DM, Schellevis FG, Van Casteren V. The prevalence of known diabetes in eight European countries. Eur J Public Health 2004 ; 14, 10-4.
5. Institut national d’assurance maladie-invalidité (INAMI). Infospot 12.07.2010. http://www.inami.fgov.be/drug/fr/statistics-scientificinformation/pharmanet/info-spot/2010-07-12/pdf/infospot20100712.pdf, consulté le 31.07.2010.
6. Scheen AJ, De Flines J, De Roover A, Paquot N. Bariatric surgery in patients with Type 2 diabetes: benefits, risks, indications and perspectives. Diabetes & Metabolism vol. 35 (2009): 537-543.
7. Pories WJ, Caro JF, Flickinger EG, Meelheim HD, Swanson MS. The control of diabetes mellitus (NIDDM) in the morbidity obese with the Greenville Gastric Bypass. Ann Surg 1987; 206: 316-23.
8. Mac Donald KGJr, Long SD, Swanson MS, Brown BM, Morris P, Dohm GL, Pories WJ. The gastric bypass operation reduces the progression and mortality of non-insulin-dependent diabetes mellitus. J Gastrointestinal Surgery 1997; 1: 213-20.
9. Friedman MN, Sancetta AJ, Maggvern GJ. The amelioration of diabetes mellitus following subtotal gastrectomy. Surg Gynecol Obstet 1955; 100: 201-4.
10. Angerwall L, Dotervall G, Tillander H. Amelioration of diabetes mellitus following gastric resection. Acta Med Scand 1961; 169: 743-8.
11. Francesco Rubino, David M. Nathan, Robert H. Eckel, Philip R. Schauer Metabolic Surgery in the Treatment Algorithm for Type 2 Diabetes: A Joint Statement by International Diabetes Organizations. Diabetes Care 2016 Jun; 39(6): 861-877.
12. Buchwald H, Estok R, Fahrbach K, et al. Weight and Type 2 Diabetes after Bariatric Surgery: Systematic Review and Meta-analysis. The American Journal of Medicine: Vol. 122, No. 3: 248-256, March 2009.
13. Pories WJ, Dohm GL Full and durable remission of type 2 diabetes? Through surgery? Surg Obes Relat Dis 2009; 5(2): 285-8.
14. Schauer PR, Burguera B, Ikramuddin S, et al. Effect of laparoscopic Roux-en Y gastric bypass on type 2 diabetes mellitus Ann Surg 2003; 238: 467-84.
15. Makdad AH, Bowman BA, Ford ES, et al. The continuing epidemics of obesity and diabetes in the United States. JAMA. 2001; 286: 1195-1200.
16. Laferrere B, Teixeira J, McGinty J, et al. Effect of weight loss by gastric bypass surgery versus hypocaloric diet on glucose and incretin levels in patients with type 2 diabetes. J Clin Endocrinol Metab 2008; 93: 2479-85.
17. Hofso D, Nordstrand N, Johnson LK, et al. Obesity-related cardiovascular risk factors after weight loss: a clinical trial comparing gastric bypass surgery and intensive life-style intervention. Eur J Endocrinal 2010; 163: 735-45.
18. Cummings DE, Overduin J, Foster-Schubert KE, Carlson MJ. Role of the bypassed proximal intestine in the anti-diabetic effects of bariatric surgery. Surg Obes Relat Dis 2007; 3: 109-15.
19. Dixon JB. Obesity and diabetes: the impact of bariatric surgery on type 2 diabetes. World J surg 2009; 33: 2014-21.
20. Herron DM, Tong W. Role of surgery in management of type 2 diabetes mellitus. Mt Sinai. J Med 2009; 76: 281-93.
21. Bose M, Olivan B, Teixeira J, Pi-Sunyer FX, Laferrere B. Do Incretins play a role in the remission of type 2 diabetes after gastric bypass surgery: What are the evidence? Obes Surg 2009; 19: 217-229.
22. Laferrere B, Heshka S, Wang K, et al. Incretin levels and effect are markedly enhanced 1 month after Roux-en-Y gastric bypass surgery in obese patients with type 2 diabetes. Diabetes Care 2007; 30: 1709-16.
23. Rubino F, Forgione A, Cummings DE, et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Annals of Surg. 2006; 244: 741-9.
24. Cummings DE, Overduin J, Foster-Schubert KE Gastric bypass for obesity: mechanism of weight loss and diabetes resolution. J Clin Endocrinol Metab. 2004; 89: 2608-15.
25. Strader AD, Vahl TP, Jandacek RJ, et al. Weight loss through ileal transposition is accompanied by increased ileal hormone secretion and synthesis in rats. Am J Physiol Endocrinol Metab. 2005; 288: E447-53.
26. Patriti A, Facchiano E, Annetti C, et al. Early improvement of glucose tolerance after ileal transposition in a non-obese type 2 diabetes rat model. Obes Surg. 2005; 15: 1258-64.
27. Patriti A, Aisa MC, Annetti C, et al. How the hindgut can cure type 2 diabetes. Ileal transposition improves glucose metabolism and beta-cell function in Goto-Kakizaki rats through an enhanced proglucagon gene expression and L-cell number. Surg. 2007; 142: 74-85.
28. Bose M, Machineni S, Olivan B. Superior appetite hormone profile after equivalent weight loss by gastric bypass compared to gastric banding. Obesity 2010; 18: 1085-1091.
29. Fried M, Ribaric G, Buchwald JN, Svacina S, Dolezalau K, Scopinaro N. Metabolic surgery for the treatment of type 2 diabetes in patients with BMI< 35 kg/m2: an integrative review of early studies. Obes Surg 2010; 20: 776-90.
30. Kim S, Richards WO Long term follow-up if the metabolic profiles in obese patients with type 2 diabetes mellitus after Roux-en-Y gastric bypass. Ann Surg 2010; 251: 1049-55.
31. Olivan B, Teixera J, Bose M, et al. Effect of weight loss by diet or gastric bypass surgery on peptide YY3-36 levels. Ann Surg 2009; 249: 948-53.
32. Laferrere B, Swerdlow N, Bawa B, et al. Rise of oxyntomodulin in response to oral glucose after gastric bypass surgery in patients with type 2 diabetes. J Clin Endocrinol Metab 2010; 95: 4072-6.
33. Thaler JP, Cummings DE. Minireview: Hormonal and metabolic mechanisms of diabetes remission after gastrointestinal surgery. Endocrinology 2009; 150: 2518-25.
34. Tack J, Arts J, Caenepeel P, De Wulf D, Bisschops R. Pathophysiology, diagnosis and management of postoperative dumping syndrome. Nat Rev Gastroenterol Hepatol 2009; 6: 583-90.
35. Stearns AT, Balakrishnan A, Tavakkolizadeh A. Impact of Roux-en-Y gastric bypass surgery on rat intestinal glucose transport. Am J Physiol Gastrointest Liver Physiol 2009; 297: G950-7.
36. Furet JP, Kong LC, Tap J, et al. Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss: links with metabolic and low-grade inflammation markers. Diabetes 2010; 59: 3049-57.
37. Patti ME, Houten SM, Bianco AC, et al. Serum bile acids are higher in humans with prior gastric bypass: potential contribution to improved glucose and lipid metabolism. Obesity (Silver Spring) 2009; 17: 1671-7.
38. Bikman BT, Zheng D, Paries WJ, et al. Mechanism for improved insulin sensitivity after gastric bypass surgery. J Clin Endocrinol Metab 2008; 93: 4656-63.
39. American Society for Metabolic and Bariatric Surgery, Bariatrc Surgery Procedures http://asmbs.org/obesity-and-surgery-learning-center/bariatric-surgery-procedures/
40. American Society for Metabolic and Bariatric Surgery, Bariatric Surgery Guidelines and Recommendations, http://asmbs.org/resources/bariatric-surgery-guidelines-and-recommendations
Articole din ediţiile anterioare
Hipertensiunea arterială la copii și adolescenţi
Actualmente, cercetarea hipertensiunii arteriale (HTA) în rândul copiilor și adolescenților prezintă un interes crescând, motivat de implicarea HTA...
Sindromul ovarelor polichistice
Sindromul ovarelor polichistice (SOP) este o afecţiune complexă, frecvent întâlnită în rândul femeilor în perioada reproductivă, care însumeaz...
Legătura complexă dintre ficatul gras nonalcoolic şi diabetul zaharat de tip 2
Boala ficatului gras nonalcoolic (FGNA) reprezintă o problemă de sănătate publică la nivel mondial, fiind o importantă sursă de morbiditate şi mort...
Statusul nutriţional, obezitatea şi SARS-CoV-2
În ultimele luni, un nou virus din familia coronavirusului (denumit SARS-CoV-2) s-a răspândit în întreaga lume, fiind declarată pandemie din 11...