Acute liver failure (ALF) is a syndrome defined by the rapid decline of hepatic function, jaundice, coagulopathy (INR>1.5) and hepatic encephalopathy in patients with no evidence of previous liver disease. In children, the etiology of ALF is different, depending on age, and is associated with a high mortality, despite optimal medical therapy. The treatment for children with ALF will be directed to maintain vital functions, to prevent and treat the complications or against the etiologic agent when it is known. The therapeutic measures consist in stabilizing the child by the administration or adjustment of liquids, vasoactive medication or respiratory support if necessary, the treatment of encephalopathy through measures to reduce the ammonia in the blood, correction of hypoglycemia or hydroelectrolytic imbalances, the treatment of hemorrhage and coagulopathy. Specific treatment can be life-saving if the etiology is known, and includes administering antidots in toxic ALF, antivirals or antibacterial medication in infectious causes, immunosuppressive therapy in autoimmune hepatitis, cooper chelators in Wilson disease, or specific diets in metabolic disorders. In severe ALF in children, extracorporeal methods (hemodiafiltration, plasma exchange or hepatic dialysis) may be used, but the only therapeutic option remains emergency liver transplantation. The management of these cases requires a multidisciplinary team, involving pediatric hepatologist, critical care specialist, nephrologist, or liver transplant surgeon.
Tratamentul insuficienţei hepatice acute la copil
Treatment of acute liver failure in children
First published: 28 martie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.53.1.2019.2349
Abstract
Rezumat
Insuficienţa hepatică acută (IHA) este un sindrom caracterizat prin alterarea rapidă a funcţiei hepatice, icter şi coagulopatie severă (o valoare a INR >1,5 în prezenţa encefalopatiei hepatice sau INR >2 în absenţa acesteia), la un pacient fără boală hepatică preexistentă. La copil, etiologia IHA depinde de vârsta de debut şi este asociată cu mortalitate, în ciuda tuturor măsurilor terapeutice. Tratamentul IHA la copil va fi orientat spre menţinerea funcţiilor vitale, prevenirea şi tratarea complicaţiilor sau terapia împotriva agentului etiologic atunci când acesta este cunoscut. Măsurile terapeutice constau în stabilizarea copilului prin administrarea sau reducerea aportului de lichide (în funcţie de necesitate), medicaţie vasoactivă sau suport respirator la pacienţii comatoşi sau instabili hemodinamic, tratamentul encefalopatiei hepatice, prin măsuri specifice de reducere a amoniemiei, corectarea hipoglicemiei sau a dezechilibrelor hidroelectrolitice, tratamentul prompt al hemoragiei şi coagulopatiei. Tratamentul specific poate fi salvator de viaţă acolo unde etiologia este cunoscută şi include administrarea de antidoturi în IHA de cauză toxică, medicaţie antivirală sau antibiotice în etiologiile infecţioase, terapie imunosupresoare în hepatitele autoimune, d-penicilamina administrată în boala Wilson sau diete speciale în cazul erorilor înnăscute de metabolism care asociază IHA. În cazurile extrem de grave se pot utiliza metode de epurare extracorporeală (hemodiafiltrare, plasma-separare sau dializă hepatică) pentru înlăturarea metaboliţilor toxici. Cu toate acestea, singura opţiune terapeutică în aceste cazuri rămâne transplantul hepatic de urgenţă. Gestionarea cu succes a acestor copii cu IHA necesită o echipă multidisciplinară şi o bună colaborare între hepatolog, pediatru, anestezist, nefrolog şi chirurg specializat în efectuarea transplantului hepatic.
Introducere
Insuficienţa hepatică acută (IHA) este o afecţiune rară şi potenţial letală la copil, cu o mortalitate cuprinsă între 20% şi 50%(1). IHA este definită după criteriile PALF (Pediatric Acute Liver Failure Group) ca un sindrom caracterizat prin absenţa unei afecţiuni cronice hepatice, coagulopatie hepatică necorectabilă după administrarea parenterală de vitamină K şi o valoare a INR (International Normalised Ratio) între 1,5 şi 1,9 în prezenţa encefalopatiei hepatice sau INR >2 în absenţa encefalopatiei(2,3). Nu există un tratament definitiv pentru IHA la copil, acesta fiind orientat către menţinerea funcţiilor vitale, minimizarea complicaţiilor bolii sau direct împotriva agenţilor etiologici atunci când se cunoaşte agentul cauzator(2,3).
I. Măsuri generale
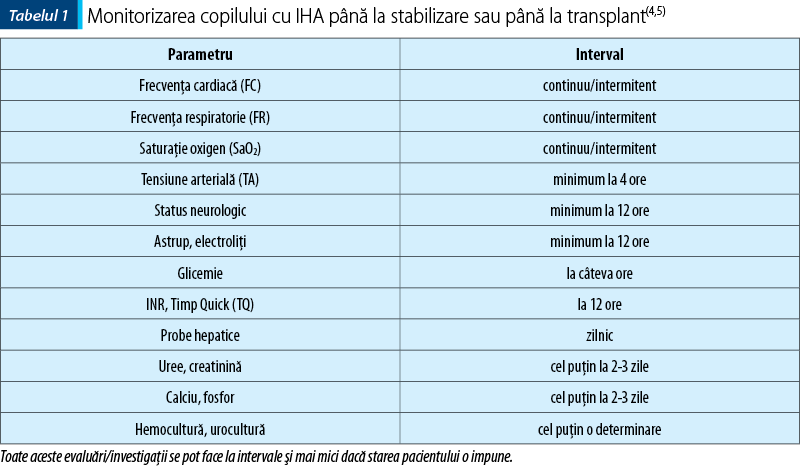
Monitorizarea copilului cu IHA trebuie realizată într-o secţie de terapie intensivă. Se va monta cateter venos central, care va fi folosit pentru recoltarea de analize, administrarea medicaţiei şi a produselor din sânge sau pentru măsurarea presiunii venoase centrale, acolo unde este posibil. La cazurile grave sau instabile respirator/hemodinamic se vor asigura suport respirator şi medicaţie vasoactivă, cardiotropă(4,5). Pacienţii comatoşi necesită intubare orotraheală pentru asigurarea suportului respirator, evitarea pneumoniei de aspiraţie sau reducerea edemului cerebral prin hiperventilaţie. Se recomandă precauţie la administrarea de medicamente care deprimă sistemul nervos central (barbiturice, benzodiazepine) din cauza riscului de agravare a encefalopatiei(4,5). Pentru sedare se va folosi soluţie de propofol (1-2 mg/kg). Periodic vor fi monitorizate semnele vitale, statusul neurologic, electroliţii serici, glicemia, funcţia hepatică şi renală (tabelul 1)(4,5). Administrarea de lichide se va face cu prudenţă, pentru a preveni supraîncărcarea volemică. Se folosesc soluţii bazate în special pe glucoză, care să asigure un minim de glucide de 4-6 mg/kg/min(4,5).
II. Tratamentul encefalopatiei hepatice
1. Restricţie proteică
Aportul de proteine va fi de maximum 1-2 mg/kg/zi. Acestea vor fi administrate per os, pe sondă nazogastrică sau parenteral. Dozele se pot creşte treptat, pe măsură ce starea pacientului se ameliorează(6,7). Se utilizează soluţii de aminoacizi esenţiali (valină, leucină, izoleucină) şi soluţie de arginină (200-800 mg/kg/zi), cunoscut fiind rolul acesteia din urmă în reducerea amoniemiei şi în stimularea ureogenezei(6). În cazul în care există suspiciunea de tulburare de metabolism în ciclul ureei, se recomandă prudenţă în administrarea soluţiilor de aminoacizi, obiectivul terapiei fiind reducerea hiperamoniemiei (tabelul 2). De asemenea, soluţia de arginină sorbitol este total contraindicată dacă se suspectează intoleranţa ereditară la fructoză, deoarece sucroza agravează insuficienţa hepatică, şi în deficitul de arginază (tulburare a ciclului ureei)(6).

2. Lactuloza
Lactuloza (b-galactosidofructoza) ameliorează manifestările neurologice din IHA, reducând concentraţia amoniacului din sânge până la 25-50%. Se recomandă administrarea de lactuloză în doză de 0,4-1 ml/kg la fiecare 4 ore, per os sau pe sondă nazogastrică. Odată ajunsă în intestin, lactuloza este degradată până la acid acetic de către bacteriile intestinale. Scăderea pH-ului intestinal favorizează formarea ionului de amoniu (NH4+), care nu este absorbabil şi va fi eliminat prin scaun. De asemenea, lactuloza stimulează motilitatea intestinală şi favorizează multiplicarea lactobacteriilor formatoare de amoniac în detrimentul celor care produc amoniac şi fenol (E. coli, Proteus vulgaris). Este contraindicată la sugarii cu galactozemie sau intoleranţă ereditară la fructoză, la aceştia recomandându-se folosirea lactitolului (un dizaharid neabsorbabil, care are aceleaşi efecte ca lactuloza)(8,9).
3. Antibiotice
Neomicina sau rifaximina sunt folosite în tratamentul encefalopatiei hepatice la copil. Acestea, administrate per os, au un rol bactericid asupra bacteriilor formatoare de amoniac din intestin, determinând scăderea producţiei de amoniac(6-8).
4. Tratamentul sângerărilor gastrointestinale
Hemoragia digestivă superioară reprezintă unul din principalii factori precipitanţi ai encefalopatiei hepatice, deoarece sângele din tractul gastrointestinal conţine o cantitate foarte mare de proteine (15-18 g/100 ml). De asemenea, din izoleucina conţinută în hemoglobină se produce o cantitate mult mai mare de amoniac decât în orice altă proteină animală(7). Pentru prevenirea sau tratarea acesteia se vor folosi inhibitori de pompă de protoni (10-20 mg/kg/zi i.v.), antagonişti de receptori H2 (ranitidină, 1-3 mg/kg/zi i.v.) sau sucralfat (1-2 g/kg/zi), administrat per os sau pe sondă nazogastrică(6,10-13).
5. Tratamentul edemului cerebral
Edemul cerebral şi hipertensiunea intracraniană (HTIC) reprezintă principalele cauze de deces la copiii cu IHA. Pentru depistarea precoce a edemului cerebral sau HTIC se recomandă monitorizarea atentă a statusului neurologic, a presiunii intracraniene şi explorări specifice: ecografie transfontanelară, RMN sau CT cerebral, examen de fund de ochi(6). Dacă presiunea intracraniană creşte mai mult de 30 mmHg (acolo unde se poate monitoriza) sau dacă există semne de hipertensiune intracraniană, se vor lua următoarele măsuri terapeutice:
-
poziţionarea capului mai ridicat faţă de restul corpului;
-
evitarea hipertermiei; chiar reducerea temperaturii corporale (până la hipotermie);
-
soluţii hiperosmolare: manitol 20% sau soluţie salină NaCl 3%;
-
hiperventilaţie pentru a reduce pCO2<35 mmHg;
-
restricţie de lichide (75% din necesar);
-
tratamentul agitaţiei şi al convulsiilor cu fenitoin (10 mg/kg/doză) sau tiopental (0,5-3 mg/kg/oră)(4,6,8).
III. Tratamentul hipoglicemiei şi al dezechilibrelor hidroelectrolitice
Pentru prevenirea sau tratamentul hipoglicemiei (<40 mg/dl) se va utiliza perfuzie continuă cu soluţie de glucoză cu un ritm de 4-6 mg/kg/min, uneori fiind necesar 10-15 mg/kg/min. Monitorizarea glicemiei se va face periodic, la 2-4 ore sau chiar mai frecvent (tabelul 3). În cazul hipoglicemiei severe se pot utiliza soluţii concentrate de glucoză (10%, 20%, 33% sau 50%). De asemenea, se vor administra soluţii de electroliţi şi bicarbonat pentru corecţia dezechilibrelor hidroelectrolitice şi acido-bazice. Pentru corecţia hiposodemiei se recomandă în primul rând restricţie de lichide, suplimentarea cu NaCl fiind de maximum 1 mEq/kg/zi. În caz de hipopotasemie se administrează soluţie de KCl până la 4-6 mEq/kg, în funcţie de nivelul seric(6,8,10). Hipofosfatemia, care poate apărea odată cu regenerarea hepatică, din cauza necesităţilor celulare crescute, necesită administrare de soluţie de fosfor (Glycophos®)(14).
IV. Tratamentul hemoragiei şi al tulburărilor de coagulare
O altă cauză importantă de deces la copiii cu IHA este hemoragia. Aceasta apare deoarece ficatul deţine un rol primordial în cascada coagulării. Aici este sediul principal al sintezei factorilor de coagulare, factorilor inhibitori ai coagulării şi al proteinelor fibrinolitice din plasmă. În IHA, atât factorii procoagulanţi (V, VII, X, fibrinogen), cât şi cei anticoagulanţi (antitrombina III, proteina C şi proteina S) sunt scăzuţi. Această scădere echilibrată explică frecvenţa relativ scăzută a sângerărilor importante, în lipsa unui factor provocator (infecţie)(14,15). Timpul de protrombină (PT) şi raportul internaţional de normalizare (INR) sunt utilizate pentru a evalua severitatea leziunilor hepatice în IHA la copil(2,6,10,11,16).
O doză unică de vitamină K (5-10 mg) administrată cu un ritm nu mai mare de 1 mg/min se recomandă empiric la toţi pacienţii cu IHA, însă nu se recomandă corecţia de rutină a tulburărilor de coagulare. Corectarea timpului de protrombină sau a INR este justificată doar în sângerările active sau înainte de manopere invazive. Administrarea de plasmă proaspătă congelată va îngreuna aprecierea evoluţiei coagulopatiei şi, în plus, poate duce la supraîncărcarea lichidiană şi proteică, astfel încât administrarea acesteia trebuie bine evaluată. Dacă există semne de hemoragie activă sau dacă INR>4 şi urmează să se efectueze manopere invazive (cateter venos central), se poate administra plasmă proaspătă congelată (PPC) în doză de 15-20 ml/kg la fiecare 4-6 ore sau în perfuzie continuă cu un ritm de 3-4 ml/kg/oră. Cazurile severe care nu se ameliorează după administrarea de PPC şi care prezintă ascită sau oligoanurie pot beneficia de complex protrombinic (FII+VII+IX+X) sau de factor VIIa (novoseven). Conform datelor de literatură, doza de novoseven folosită în IHA poate varia de la 20 până la 120 µg/kg/doză(4). O altă cauză a hemoragiei în IHA este trombocitopenia produsă prin sechestrare splenică. Procedurile invazive se pot efectua sub protecţia administrării de trombocite (<15.000/mm3 în absenţa hemoragiei sau <50.000/mm3 în prezenţa acesteia)(4,6,10,17-19).
V. Tratamentul ascitei
Hipoalbuminemia şi reducerea presiunii coloid-osmotice se tratează prin administrare de albumină (1 g/kg/zi) care să menţină albumina serică peste 2,5 g/dl. Se vor asocia la nevoie diuretice: furosemid (0,5-1 mg/kg/zi) şi spironolactonă (1 până la 8 mg/kg/zi), aceasta din urmă fiind de elecţie în edemele hipoproteinemice de cauză hepatică. Paracenteza se indică în cazurile de IHA cu ascită în cantitate mare, rezistentă la terapia cu diuretice şi albumină sau care determină dificultăţi respiratorii importante, prin creşterea presiunii intraabdominale(6,12,20).
VI. Tratamentul infecţiilor
Infecţia este una din cauzele importante de deces la copiii cu IHA, organismele implicate mai frecvent fiind cocii Gram-pozitivi (stafilococi, streptococi), bacilii Gram-negativi sau Candida albicans. Pentru prevenirea/tratarea infecţiilor se administrează antibiotice cu spectru larg, în doze ajustate pentru IHA sau insuficienţa renală acută (IRA) asociată. Ca primă linie se pot folosi amoxicilină (25 mg/kg/zi), cefalosporine de generaţia a II-a sau a III-a (cefuroxim, ceftriaxonă) sau metronidazol (8 mg/kg/doză), dacă se supectează o infecţie cu anaerobi. Pentru infecţiile fungice se administrează fluconazol (3 mg/kg/zi) sau caspofungin, mai ales dacă se are în vedere transplantul hepatic de urgenţă(2,6,12,21).
VII. Tratamentul etiologic
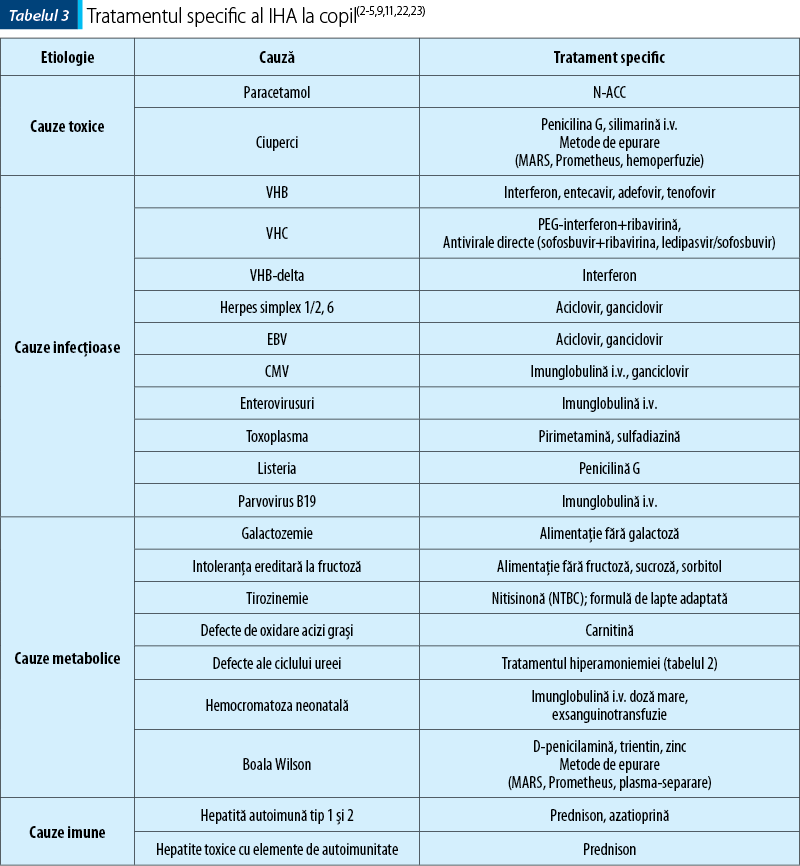
În cele mai multe cazuri, transplantul hepatic reprezintă singura opţiune salvatoare, dar există terapii specifice pentru diferite etiologii care pot reprezenta o variantă eficace în contextul urgenţei (administrarea de antidoturi, regimuri alimentare specifice, epurare extracorporală).
VIII. Metode de epurare extracorporală
1. Dializa hepatică
Este o metodă de epurare folosită până la realizarea transplantului hepatic de urgenţă sau în scop curativ pentru a elimina din sânge substanţele toxice şi în exces. Principalele indicaţii ale iniţierii dializei hepatice sunt reprezentate de IHA de cauză toxică, boala Wilson sau sindromul hepatorenal. Se utilizează sistemele MARS (Molecular Absorbent Recirculating System) şi Prometheus. Acestea reprezintă tehnici prin care sunt eliminaţi din organism metaboliţi care circulă legaţi de albumină şi care determină necroză centrolobulară: acizi biliari, bilirubină, acizi aromatici, amatoxină sau cupru. Sistemul de absorbţie moleculară şi recirculare (MARS) utilizează o membrană de dializă impregnată cu albumină care are rolul de a extrage toxinele legate de proteine(24). Ulterior, acest complex albumină-toxic trece printr-un filtru de cărbune activat care va reţine substanţa toxică şi va elibera albumina. Aceasta din urmă va fi recirculată preluând noi molecule toxice şi realizând astfel atât substituţia hepatică, cât şi cea renală(6,10,25). Sistemul Prometheus separă plasma cu ajutorul unor coloane adsorbante, ambele metode ameliorând parametrii hemodinamici şi encefalopatia hepatică(26-28).
2. Plasmafereza
Plasmafereza este o metodă de epurare utilizată în special în bolile în care se produc cantităţi mari de autoanticorpi (hepatită autoimună) sau proteine patogenice (lipoproteine, crioglobuline, complexe imune circulante). Secundar, separarea plasmei îndepărtează şi toxinele libere sau care sunt fixate de proteine, motiv pentru care această metodă este folosită la pacienţii cu IHA de cauză toxică (ciuperci) sau boală Wilson care nu au răspuns la terapia specifică(29).
3. Hemodiafiltrare
Principiul acestei metode este trecerea sângelui încărcat cu toxine printr-un sistem absorbant format din cărbune activ şi răşini schimbătoare de ioni care au rolul de a reţine toxine ca amatoxine, medicamente sau toxine endogene. Este o metodă care se poate combina cu hemodializa în cazul în care pacientul asociază şi insuficienţă renală acută (IRA)(30,31).
IX. Transplantul hepatic de urgenţă
Boala Wilson, bolile de metabolism, toxinele şi infecţiile reprezintă principalele indicaţii ale transplantului hepatic de urgenţă la copilul cu IHA. La nou-născut şi sugar se preferă efectuarea transplantului de la donator viu înrudit genetic, care implică prelevarea segmentelor lateral-stângi ale ficatului de la unul din părinţi. Este o tehnică utilizată în special în cazul bolilor metabolice hepatice (galactozemie, tirozinemie), în hemocromatoza neonatală sau în cauzele infecţioase (herpes, VHB). Pentru copilul mare cu IHA se efectuează transplant hepatic de la donator cadavru, această metodă reprezentând o treime din intervenţiile de transplant hepatic efectuate la copil în lume. Principalele indicaţii ale acestei proceduri sunt boala Wilson, intoxicaţiile cu ciuperci, hepatita autoimună şi cauzele infecţioase(6).
O valoare INR>4 sau nivelul factorului V<25% reprezintă indicaţii de transfer către un centru de transplant hepatic. Utilizarea scorului PELD la momentul diagnosticului poate avea valoare prognostică în cazul copiilor cu IHA şi să determine transferul în centre specializate(32,33). În cazul pacienţilor care îndeplinesc aceste criterii de transplant hepatic, dar care nu ajung la această intervenţie, supravieţuirea este de 10-15%(34). Contraindicaţiile transplantului hepatic sunt sepsisul refractar la tratament, insuficienţa cardiorespiratorie, insuficienţa multiplă de organ, bolile mitocondriale, determinările secundare extrahepatice, consumul de droguri şi encefalopatia hepatică severă cu leziuni neurologice ireversibile(35).
Concluzii
Insuficienţa hepatică acută la copil este asociată cu o înaltă mortalitate, în pofida îmbunătăţirii metodelor de tratament, a utilizării de antidoturi şi a utilizării metodelor de epurare extrarenală, dar în absenţa transplantului hepatic de urgenţă. Managementul acestor cazuri necesită o abordare multidisciplinară (pediatru, hepatolog, nefrolog, anestezist, chirurg) pentru stabilirea cât mai rapidă a etiologiei, pentru prevenirea sau tratarea complicaţiilor majore sau pentru efectuarea transplantului hepatic de urgenţă.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Mu-Ming C, Mei-Hwei C, Kai-Chi C et al. Prognostic parameters of pediatric acute liver failure and the role of plasma exchange. Pediatrics and Neonatology. 2018;XX:1-7.
- Squires RH. Acute Liver Failure in Children. Semin liver disease. 2008;28(2):153-66.
- Dhawan A. Etiology and Prognosis of Acute Liver Failure in Children. Liver transplantation. 2008;14(2):S80-S84.
- Bhatia V, Bavdekar A, Yachha KS. Management of Acute Liver Failure in Infants and Children: Consensus Statement of the Pediatric Gastroenterology Chapter, Indian Academy of Pediatrics. Indian Pediatr. 2013;50:477-482.
- Suchy JF. Fulminant hepatic failure in children. The Saudi Journal of Gastroenterology. 1996;2(1):39-43.
- Whitington PF, Alonso WA. Fulminant hepatitis and acute liver failure. In Deirdre K. (editor): Diseases of the Liver and Billiary System in Children, 3rd edition, Oxford, Wiley-Blackwell, 2008:92-123.
- Arya R, Gulati S, Deopujari S. Management of hepatic encephalopathy in children. Postgrad Med J. 2010 Jan; 86(1011):34-41; quiz 40.
- Naghi D, Ali-Akbar S, Farid I. Hepatic Encephalopathy: Early Diagnosis in Pediatric Patients With Cirrhosis. Iran J Child Neurol. 2014;8(1):1–11.
- Grama A, Blaga L, Nicolescu A, et al. Novel Mutation in GALT Gene in Galactosemia Patient with Group B Streptococcus Meningitis and Acute Liver Failure. Medicina. 2019; 55(4),91.
- Whitington PF, Alonso EM, Squires RH. Acute liver failure. In: Diseases of the Liver and Biliary System in Children. Kelly DA (eds). Oxford: Wiley-Blackwell; 2008:630.
- Devictor D, Tissieres P, Afanetti M, Debray D. Acute liver failure in children. In Poupon R, Arrive L, Ballet F et al (editori): Clinics and Research in Hepatology and Gastroenterology. 2011;35:430-437.
- Suchy FJ. Fulminant hepatic failure. In Behrman RE, Kliegman RM, Jenson HB (editori): Nelson Textbook of Pediatrics 17th edition, USA, Saunders, 2004:1048-1050.
- De Gasperi A, Corti A, Mazza E, Prosperi M, Amici O, Bettinelli L. Acute liver failure: managing coagulopathy and the bleeding diathesis. Transplant Proc. 2009;41(4):1256-1259.
- Mazumdera W, Begum F, Karim AB. Acute Liver Failure: Management Update. Banglaesh J Child Health. 2017;41(1):53-59.
- Munoz SJ, Stravitz RT, Gabriel DA. Coagulopathy of acute liver failure. Clin Liver Dis. 2009;13(1):98-102.
- Mouzaki M, Ng V. Acute liver failure in children. Clin Pediatr Emerg Med. 2010;11(3):198-206.
- Stravitz RT, Kramer AH, Davern T, Shaikh AO, Caldwell SH, Mehta RL, et al. Intensive Care of Patients with Acute Liver Failure: Recommendations of the U.S. Acute Liver Failure Study Group. Crit Care Med. 2007;35:2498-2508.
- Shami VM, Caldwell SH, Hespenheide EE, Arseneau KO, Bickston SJ, Macik BG. Recombinant activated factor VII for coagulopathy in fulminant hepatic failure compared with conventional therapy. Liver Transpl. 2003;9:138-143.
- Drews RE, Weinberger SE. Thrombocytopenic disorders in critically ill patients. Am J Respir Crit Care Med. 2000;162:347-351.
- Lentz K, Buder R, Kapun L, Volgmayr M. Treatment and management of ascites and hepatorenal syndrome. Therap Adv Gastroenterol. 2015;8(2):83-100.
- Herrine SK. Acute liver failure (fulminant liver failure). In Merk Mannual Professional Version, Hepatic and Biliary Disorders/Approach to the Patient With Liver Disease, disponibil pe www.merckmanuals.com/professional/hepatic-and-biliary-disorders.
- Altinbas A, Bechmann LP, Akkiz H, Gerken G, Canbay A. Acute liver failure. In Mauss S, Berg T, Sarazzin J, Wedemeyer H (editori): Hepatology- a Clinical Textbook, Sixth Edition, Germany, Flying Publisher, 2017:631-641.
- Pop TL. Colestaza la copil - ghid de diagnostic şi tratament. Cluj-Napoca, Casa Cărţii de Ştiinţă, 2009:58-66.
- Karvellas CJ, Gibney N, Kutsogiannis D, Wendon J, Bain VG. Bench-to-bedside review: current evidence for extracorporeal albumin dialysis systems in liver failure. Crit Care. 2007;11:215.
- Covic A, Goldsmith DJ, Gusbeth-Tatomir P, et al. Succesful use of Molecular Absorbent Regenerating System (MARS) dyalisis for the treatment of fulminant liver failure in children accidentally poisoned by toxic mushrooms ingestion. Liver Int. 2003; 23(Suppl 3):S21-S27.
- Lai WK, Haydon G, Mutimer D, Murphy N. The effect of molecular adsorbent recirculating system on pathophysiological parameters in patients with acute liver failure. Intensive Care Med. 2005;31:1544-1549.
- Schmidt LE, Wang LP, Hansen BA, Larsen FS. Systemic hemodynamic effects of treatment with the molecular adsorbents recirculating system in patients with hyperacute liver failure: a prospective controlled trial. Liver Transpl. 2003;9:290-297.
- Kantola T, Koivusalo AM, Hockerstedt K, Isoniemi H. The effect of molecular adsorbent recirculating system treatment on survival, native liver recovery, and need for liver transplantation in acute liver failure patients. Transpl Int. 2008;21:857-866.
- Ulu AC, Kuran S, Kurtaran B et al. Plasmapheresis in the treatment of acute liver failure: a case report and a review of the literature. Viral Hepatitis Journal. 2015;21(13):98-101.
- Winchester JF, Boldur A, Oleru C, Kitiyakara C. Use of dialysis and hemoperfusion in treatment of poisoning. In: Handbook of Dialysis, 4th ed., Daugirdas JT, Blake PG, Ing TS (Eds), Lippincott Williams & Wilkins, Philadelphia 2007:300.
- Winchester JF. Hemoperfusion. In Horl WH, Koch KM, Lindsay RM, Ronco C: Replacement of renal function by dialysis, Springar Netherlands, 2004:439-459.
- Núñez-Ramos R, Montoro S, Bellusci M, et al. Acute Liver Failure: Outcome and Value of Pediatric End-Stage Liver Disease Score in Pediatric Cases. Pediatr Emerg Care. 2018; 34(6):409-412.
- Pop TL, Grama A, Ştefănescu A, Delean D, Aldea CO, Bizo A. PELD Score as a Prognostic Factor in Fulminant Liver Failure Caused by Mushroom Poisoning in Children. J Hepatology. 2016; 64(2):S304-S305.
- Bhatia V, Bavdekar A, Yachha KS. Management of Acute Liver Failure in Infants and Children: Consensus Statement of the Pediatric Gastroenterology Chapter, Indian Academy of Pediatrics. Indian Pediatr. 2013;50:477-482.
- Spada M, Riva S, Maggiore G, Cintorino D, Gridelli B. Pediatric liver transplantation. World J Gastroenterol. 2009 Feb 14;15(6):648-674.
Articole din ediţiile anterioare
Febra medicamentoasă
Reacţiile adverse la medicamente reprezintă 10-15% dintre evenimentele nedorite la pacienţii spitalizaţi în SUA. Dintre acestea, aproximativ...
Factorii de risc social şi sănătatea copilului
Societatea actuală este caracterizată prin interacţiunea a noi factori, sociali şi de mediu, care au un anumit impact şi asupra sănătăţii copilului...
Febra - un prieten care ne poate trăda
Febra reprezintă simptomul cel mai frecvent, la toate vârstele copilului, dar în special la cel mic, care determină adresabilitatea către medicul p...
Factori legaţi de stilul de viaţă pentru obezitatea infantilă în preadolescenţă
Supraponderalitatea şi obezitatea sunt definite ca acumularea anormală sau excesivă de grăsime, care prezintă un risc pentru sănătate. Obezitatea a...