The requirements of dog owners regarding assisted reproduction have been gradually increasing over the last period of time. Artificial insemination in dog has become a common demand in veterinary clinics nowadays. The practitioner’s knowledge of the canine reproductive physiology and pathology associated with the skills required to perform specific procedures are essential to ensure success and to avoid problems in the use of artificial insemination in dogs. The aim of this paper is to revise the current knowledge about the techniques used in artificial insemination and some problems associated to these techniques.
Însămânţarea artificială la câine – tehnici şi probleme asociate
Artificial insemination in dog – techniques and associated problems
First published: 19 aprilie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.30.1.2018.1598
Abstract
Rezumat
Exigenţele proprietarilor de câini în domeniul reproducerii asistate au înregistrat o creştere continuă în ultima perioadă. Astfel, însămânţarea artificială la câine a devenit o solicitare uzuală în clinicile veterinare. Cunoştinţele medicului veterinar referitoare la fiziologia şi patologia reproducerii, asociate cu competenţele necesare pentru efectuarea procedurilor specifice sunt esenţiale pentru a asigura succesul şi pentru a evita problemele legate de utilizarea însămânţării artificiale la câine. Scopul acestui articol este de a revizui cunoştinţele actuale privitoare la tehnicile utilizate în însămânţarea artificială şi unele probleme asociate acestor tehnici.
Indicaţiile însămânţării artificiale (IA):
- dimorfismul accentuat în ceea ce priveşte talia sau greutatea corporală a celor doi parteneri;
- incompatibilitatea comportamentală între parteneri;
- absenţa experienţei sexuale la unul sau la ambii parteneri;
- evitarea sau reducerea riscului de îmbolnăvire;
- necesitatea evaluării calităţii spermei înainte de inseminare;
- probleme de ordin psihic sau fizic (patologie dobândită);
- distanţe geografice foarte mari între parteneri;
- opţiunea pentru un genotip disponibil doar în formă conservată, ca material seminal criocongelat.
Etapele însămânţării artificiale:
- Monitorizarea ciclului estral la căţea şi stabilirea perioadei optime pentru inseminare.
- Recoltarea spermei.
- Evaluarea calităţii spermei.
- Depunerea spermei în tractul genital al căţelei.
Monitorizarea ciclului estral şi stabilirea perioadei optime pentru inseminare
Variaţiile individuale ale duratei şi manifestării ciclului estral, precum şi variaţiile înregistrate între ciclurile estrale ale aceleiaşi căţele impun o activitate de monitorizare atentă a fiecărui ciclu, în scopul determinării momentului optim pentru inseminare.
Evenimentul biologic major pentru precizarea perioadei fertile la o femelă este ovulaţia. Câteva particularităţi ale ovulaţiei la căţea constituie elemente de bază în precizarea momentului optim pentru însămânţare artificială:
- ovulaţia se produce la 0-96 de ore de la vârful de LH;
- ovulaţia se derulează pe parcursul a 36-48 de ore, în funcţie de numărul foliculilor maturi(6);
- până la 20-30% dintre foliculi conţin mai multe ovocite – foliculi poliovulari(3);
- în momentul ovulaţiei se eliberează ovocite primare, aflate în profaza primei diviziuni meiotice(1,7), imature;
- maturarea ovocitelor se produce în oviduct, timp de 48-72 de ore postovulator(17);
- ovocitele mature îşi păstrează capacitatea de a fi fecundate, între două(11) şi trei sau chiar mai multe zile(1).
În literatura de specialitate sunt prezentate diferite tehnici utilizabile în precizarea momentului optim pentru IA, incluzând: citologia vaginală, analiza hormonală, endoscopia vaginală, ultrasonografia, cristalizarea mucusului cervico-vaginal. Deşi fiecare dintre acestea oferă o corelaţie cu perioada fertilă a femelei, până la ora actuală nu este recunoscută o singură tehnică, standardizată, cu acurateţe ridicată. Utilizarea combinată a două dintre aceste tehnici creşte rata succesului în cadrul managementului însămânţării artificiale. În practica veterinară, asocierile frotiu vaginal + dozare hormonală sau frotiu vaginal + vaginoscopie sunt combinaţiile cele mai utilizate.
Frotiul vaginal
Citologia vaginală reflectă profilul estrogenic al ciclului, permiţând monitorizarea şi precizarea stadiilor citologice ale ciclului sexual. Frotiul vaginal nu oferă elemente legate de profilul progesteronic al ciclului, ceea ce constituie o limitare în precizarea perioadei fertile a femelei utilizând această tehnică. Astfel, o dezvoltare foliculară normală, dar fără ovulaţie, nu poate fi decelată prin frotiu vaginal.
Tehnica efectuării frotiului vaginal
Realizarea frotiului vaginal include următoarele etape: prelevarea, etalarea, fixarea, colorarea şi examinarea microscopică/interpretarea.
Prelevarea materialului pentru realizarea frotiului vaginal se poate face prin mai multe metode: recoltare cu un beţişor cu vată; spălare; aspirare; raclare. Metoda de prelevare cu beţişorul este cea mai utilizată în practică, fiind rapidă şi uşor de realizat. Se impune atenţie în efectuarea acesteia, deoarece pasajul tamponului prin regiunea vestibulară sau prin fosa clitoridiană, unde morfologia celulelor diferă faţă de porţiunea anterioară a vaginului, poate genera erori în „citirea“ frotiului(5,13,14). Pentru evitarea acestei situaţii, se poate utiliza un speculum vaginal pentru ghidarea beţişorului cu vată, însă această variantă nu este recomandată, putând fi iritantă pentru căţea şi îngreunând procedura de prelevare(16).
Este important locul de prelevare a celulelor epiteliului vaginal: porţiunea anterioară sau cea posterioară a vaginului. Populaţia celulară prezentă în frotiurile realizate cu material prelevat din porţiunea anterioară a vaginului (tipuri de celule, distribuţie şi afinitate tinctorială) precedă în evoluţie, cu aproximativ 24-48 de ore, aspectele găsite în frotiurile realizate din material prelevat din vestibulul vaginal, deoarece porţiunea anterioară a vaginului este cea mai receptivă la acţiunea hormonilor ovarieni.
Etalarea se realizează prin rularea beţişorului pe suprafaţa lamei de microscop, evitându-se suprapunerile.
Fixarea se poate realiza cu agenţi fixatori fizici (căldură) sau chimici (alcool, alcool-eter, citofixator comercial etc.). Opţiunea pentru fixator se va corela cu metoda de colorare. Unele kituri de colorare (de exemplu, Diff-Quick, Harris Shorr) includ fixatorul.
Colorarea. Numeroase coloraţii sunt la dispoziţia realizatorului frotiurilor vaginale. Alegerea coloraţiei se face în funcţie de scopul urmărit, de posibilităţile şi facilităţile de execuţie, de rapiditatea realizării sau, în anumite cazuri, de stabilitatea coloraţiei în timp(13).
În practică, cele mai utilizate coloraţii sunt: Diff-Quik, Harris-Shorr, May-Grünwald-Giemsa (MGG) şi Papanicolau clasic.
Coloraţiile Diff-Quik şi MGG evidenţiază foarte bine celulele epiteliale vaginale şi nucleul acestora, celulele sangvine şi flora bacteriană. Aceste metode permit aprecierea populaţiei celulare prezente în frotiu doar după criteriul morfologic, evidenţierea afinităţii tinctoriale nefiind posibilă. Coloraţiile Harris-Shor şi Papanicolau (incluzând şi variantele acestora) permit evidenţierea afinităţii tinctoriale (celulele bazofile sunt albastre sau verzui, iar cele acidofile – roşii sau oranj) şi evidenţiază cheratinizarea. În monitorizarea ciclului sexual, utilizarea asociată a coloraţiilor Diff-Quik şi Harris-Shorr constituie o opţiune excelentă, reunind avantajele ambelor metode şi anulând dezavantajele fiecăreia. Sunt posibile astfel aprecierea morfologiei, afinităţii tinctoriale şi cheratinizării celulelor epiteliale, precizarea celulelor sangvine prezente şi aprecieri legate de flora bacteriană.
Interpretarea. Frotiul vaginal colorat este examinat la microscopul cu lumină transmisă, utilizându-se iniţial un obiectiv cu putere mică de mărire (x10), urmat de alegerea unui obiectiv mai mare (x40 sau x100).
Elementele de bază în „citirea“ frotiului vaginal sunt: tipurile de celule, modul de distribuţie a celulelor şi aspectul fondului frotiului.
În frotiurile vaginale se găsesc următoarele categorii de celule:
- celulele epiteliale vaginale;
- celulele sangvine (eritrocite, neutrofile).
Celulele epiteliale vaginale care se pot observa în frotiurile vaginale sunt:
- Celule parabazale – cele mai mici celule epiteliale observate pe un frotiu vaginal. Sunt rotunde şi au un nucleu mare, diametrul acestuia reprezentând 45-90% din cel al celulei.
- Celule intermediare – forma lor poate varia între rotundă şi ovală, dar majoritatea sunt elipsoidale, cu conturul regulat. Diametrul nucleului reprezintă 30-35% din diametrul maxim al celulei.
- Celule superficiale – sunt mari, aplatizate, colţuroase, cu contur neregulat. Nucleul este slab colorat sau picnotic şi dens. Intensitatea de colorare a citoplasmei variază în funcţie de gradul de cheratinizare şi degenerare al celulei.
- Celule metestrice – celule care conţin neutrofile în citoplasmă. Sunt prezente pe frotiu, în special în timpul metestrului.
- Celule „spumoase“ – celule care conţin vacuole intracitoplasmatice.
Aspectul frotiului vaginal în diferite stadii ale ciclului sexual
Proestru
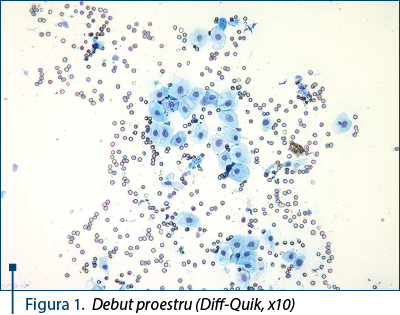
- Debut proestru: celule parabazale, intermediare şi câteva superficiale. Avansarea proestrului determină o diminuare a numărului de celulele parabazale şi intermediare şi o creştere a numărului de celulele superficiale. Eritrocitele sunt prezente în număr mare, iar neutrofilele lipsesc – figura 1. Frotiul are aspect „murdar“, ca urmare a prezenţei mucusului în cantităţi reduse şi a detritusurilor celulare. Coloraţia este bazofilă.
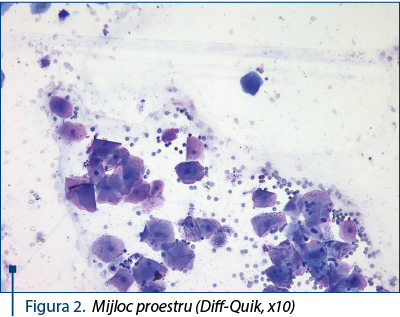
- Mijloc proestru: numărul celulelor intermediare scade, iar cel al celulelor superficiale, cu nucleu picnotic, creşte – figura 2. Există o echivalenţă între celulele bazofile şi acidofile. Eritrocitele sunt numeroase, iar neutrofilele lipsesc.
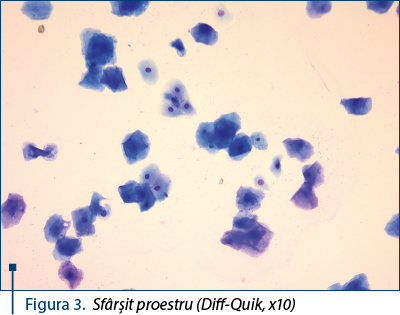
- Sfârşit proestru: aproape în exclusivitate celule superficiale anucleate sau cu nucleul picnotic – figura 3. Coloraţia predominantă este acidofilă. Eritrocitele sunt încă prezente, dar numărul lor este în descreştere evidentă.
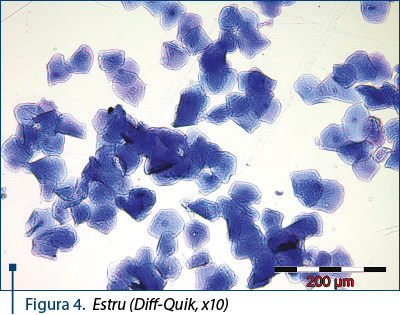
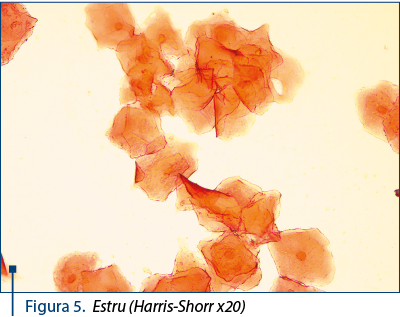
Estru: celule superficiale cheratinizate, anucleate, grupate în „ciorchine“. Coloraţia acidofilă este maximă. Cheratinizarea celulelor superficiale înregistrează o creştere progresivă. Utilizarea unei coloraţii tricrome (Harris-Shorr) evidenţiază acest proces. Eritrocitele sunt rare sau chiar absente. Fondul frotiului este „curat“, lipsit de mucus şi detritusuri celulare – figurile 4 şi 5.
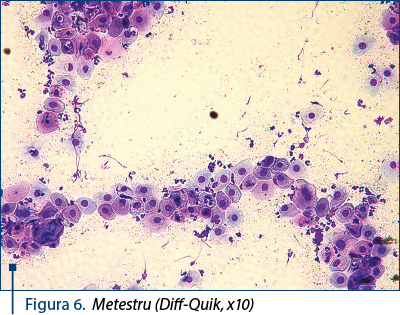
- Metestru: domină celulele parabazale şi intermediare, bazofile. Neutrofilele apar în frotiu în număr mare, în preajma celulelor epiteliale, legate de acestea sau chiar incluse în citoplasma acestora (celule metestrice). Se observă şi celulele cu vacuole în citoplasmă (celule spumoase). Aspectul frotiului este „murdar“, din cauza mucusului şi a detritusurilor celulare – figura 6.
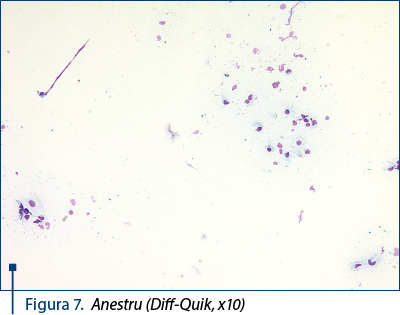
- Anestru: număr mic de celule, reprezentate de parabazale, intermediare şi câteva superficiale îmbătrânite. Celulele sunt grupate „în colonii“. Neutrofilele sunt prezente, dar în număr redus. Eritrocitele lipsesc – figura 7.
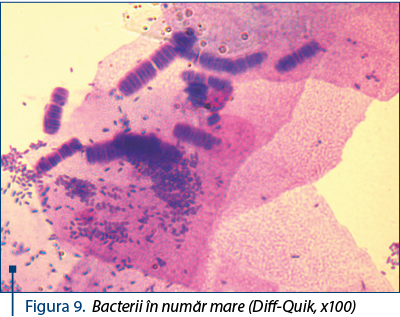
Pe frotiul vaginal pot fi observate şi bacterii, în general reprezentând floră vaginală normală.
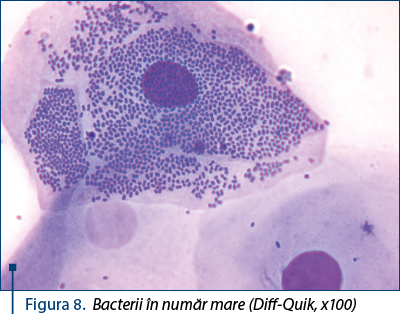
O examinare atentă, cu obiectivul x100, permite o evaluare a prezenţei unui număr foarte mare de bacterii – figurile 8 şi 9, ceea ce impune analize adiţionale şi tratament.
Vaginoscopia
Examinarea mucoasei vaginale prin intermediul unui endoscop vizează observarea aspectului faldurilor, culorii mucoasei vaginale şi evidenţierea secreţiilor, în special în porţiunea anterioară a vaginului. Vaginoscopia reflectă atât modificările induse de estrogeni, cât şi de progesteron asupra mucoasei vaginale, însă nu permite o estimare foarte sigură a momentului ovulaţiei. Dezavantajul major îl constituie costul echipamentului.
Tehnica efectuării vaginoscopiei
Examinarea endoscopică se realizează cu femela menţinută în poziţie patrupodală. Sedarea se impune doar în cazul femelelor agitate. Introducerea capătului endoscopului în vagin se face prin poziţionarea tijei endoscopului într-un unghi de 45-60º, în concordanţă cu particularităţile anatomice ale porţiunii caudale a vaginului şi vestibulului vaginal, urmată de avansarea în vagin şi orizontalizarea endoscopului.
La debutul proestrului, sub influenţa creşterii nivelului estrogenilor, faldurile mucoasei vaginale se edemaţiază, apar mărite, rotunjite şi au culoare roz. Se observă secreţia sero-sangvinolentă specifică proestrului. Lumenul vaginului este îngust în acest stadiu, aspect observabil în timpul avansării endoscopului prin canalul vaginal(15).
Sfârşitul de proestru şi debutul estrului sunt dominate de un declin preovulator al estrogenilor, creşterea LH-ului şi primul salt al concentraţiei de progesteron. Aceste modificări hormonale determină reducerea edemului şi o cutare progresivă a faldurilor mucoasei vaginale, însoţită de paloare. Cutarea mucoasei este însoţită de ascuţirea faldurilor, observându-se o angulaţie specifică şi o coloraţie albă cu aspect cremos(9). Lumenul vaginului este vizibil mai larg comparativ cu proestrul(15). Debutul perioadei fertile este asociat cu apariţia cutării mucoasei vaginale, iar apogeul perioadei fertile, cu apariţia angulaţiei specifice.
La începutul metestrului, mucoasa vaginală prezintă din nou cute rotunde şi mărite. Vaginul anterior prezintă o imagine asemănătoare unei rozete.
Pe parcursul anestrului, mucoasa vaginală este relativ plată, uscată şi roşiatică(10).
Pe parcursul examenului vaginoscopic trebuie evitată o avansare prea profundă, porţiunea delimitată de faldul precervical dorsal şi cervix (paracervixul) oferind elemente diagnostice mai reduse(15).
Analiza hormonală
Analiza hormonală reprezintă metoda cu cea mai mare acurateţe în monitorizarea ovulaţiei şi precizarea perioadei optime pentru IA. La ora actuală, doi hormoni sunt utilizaţi în practica veterinară ca markeri ai ovulaţiei: progesteronul şi LH-ul. Există opţiunea fie pentru determinarea cantitativă (măsurarea concentraţiilor hormonale serice sau plasmatice), fie pentru determinarea calitativă (teste rapide de diagnostic, care evidenţiază nivelul hormonului la un anumit prag considerat optim pentru IA).
La căţea, luteinizarea foliculară preovulatorie determină o creştere de la nivelul bazal (0,1-1 ng/ml) la valori cuprinse între 2 şi 3 ng/ml. Acest prim salt al progesteronului este corelat cu creşterea LH-ului, hormon implicat direct în producerea ovulaţiei. Declanşarea ovulaţiei corespunde cu valori ale progesteronului cuprinse între 4 şi 10 ng/ml(15).
După ovulaţie, valorile progesteronului continuă să crească progresiv, până la 50-80 ng/ml, şi se va menţine la valori ridicate pe toată durata gestaţiei sau pseudogestaţiei.
Eterogenitatea valorilor progesteronemiei, raportate în diverse studii de monitorizare a ciclului estral la căţea, reflectă existenţa unor factori de influenţă care generează diferenţe, uneori semnificative. Numărul foliculilor ovarieni şi gradul de luteinizare al acestora determină diferenţe importante ale concentraţiei progesteronului, astfel că, la aceeaşi valoare a concentraţiei de progesteron, unele căţele se găsesc în stadiu preovulator, iar altele se găsesc la mijlocul sau chiar la sfârşitul perioadei fertile. Diferenţe semnificative se pot înregistra şi între diverse metode de determinare a concentraţiei hormonale (teste radioimunologice RIA, teste imunoenzimatice EIA, ELISA, chemiluminiscenţă etc.). Variaţii semnificative se pot înregistra şi între laboratoarele de analiză, uneori chiar şi în cazul utilizării aceleiaşi metode de determinare hormonală. Aceste aspecte susţin necesitatea corelării rezultatelor determinărilor hormonale cu date furnizate de alte tehnici de monitorizare a ciclului estral, pentru a surprinde particularităţile fiecărui ciclu estral.
Determinarea concentraţiei LH-ului nu s-a extins în practica veterinară ca metodă curentă de precizare a perioadei fertile, deşi producerea ovulaţiei este corelată direct cu eliberarea acestui hormon. Dificultatea surprinderii vârfului preovulator de LH limitează aplicarea tehnicii în cadrul managementului IA. În cazul opţiunii pentru determinarea nivelului LH, inseminarea femelei este programată între patru şi şase zile după vârful de LH detectat, deoarece ovulaţia începe la două zile după descărcarea de LH, iar la patru zile după descărcarea de LH ovocitele sunt fecundabile.
Analiza critică a tehnicilor utilizate în stabilirea momentului optim pentru însămânţare artificială demonstrează că fiecare tehnică surprinde parţial dinamica ciclului estral al căţelei, dovedindu-se limitele fiecărei tehnici şi necesitatea asocierii acestora pentru un management reproductiv fiabil(10).
Recoltarea spermei
Tehnica cea mai utilizată pentru recoltarea spermei la câine este recoltarea prin manipularea manuală a penisului. Recoltarea spermei utilizând vaginul artificial şi recoltarea utilizând stimulii electrici sunt tehnici cu inconveniente majore asupra bunăstării masculului şi/sau asupra calităţii spermei recoltate.
Recoltarea spermei prin manipulare manuală a penisului
Recoltarea spermei se face într-un loc liniştit, în prezenţa proprietarului masculului şi cu un număr cât mai redus de persoane în preajmă. Pardoseala trebuie să fie antiderapantă, recomandându-se efectuarea recoltării „la sol“, unele animale intrând în panică dacă sunt plasate pe masă(2). Trebuie evitat orice factor de stres pentru mascul. Factorii stresanţi pot genera inhibiţie, făcând dificilă sau imposibilă recoltarea spermei.
Prezenţa unei femele în estru facilitează recoltarea spermei(2,3) şi este asociată cu o bună calitate a ejaculatului(16). În absenţa unei căţele în estru, se recomandă utilizarea unor tampoane de vată, tifon sau burete, impregnate cu secreţii vaginale prelevate de la o femelă în estru şi conservate prin congelare, în pungi de plastic, cu care se tamponează zona cozii unei femele, chiar şi ovariectomizate. Ca alternativă la prezenţa unei femele există şi „feromoni comerciali“.
Tehnica de recoltare
- Iniţial, prin traversul prepuţului, se execută mişcări ferme de comprimare şi masaj liniar cranio-caudal asupra bulbilor erectili ai penisului.
- Când începe erecţia, se împinge rapid prepuţul spre baza penisului, caudal de bulbii erectili. Concomitent acestor manopere, câinele execută mişcări caracteristice montei şi este eliminată, în jeturi, prima fracţiune a ejaculatului. Dacă recoltarea se face în prezenţa femelei, va încerca să facă saltul(2). În acest stadiu se recomandă exercitarea unei presiuni foarte ferme în jurul regiunii posterioare a bulbilor penieni până la terminarea ejaculării. Această procedură mimează mecanismele fiziologice din timpul captării vaginale a penisului şi totodată permite perceperea pulsaţiilor uretrei şi diferenţierea momentului eliminării fracţiunilor ejaculatului. În această fază pot fi observate contracţii ritmice ale anusului. În timpul sau după încetarea mişcărilor copulatorii este eliminată a doua fracţiune a ejaculatului (spermatică)(16) şi, după o pauză de câteva secunde, începe eliminarea ultimei fracţiuni. Această a treia fracţiune este eliminată în manieră pulsatilă.
- Se recomandă ca, atunci când masculul ridică unul dintre membrele posterioare, penisul să fie rotit cu 180° în plan orizontal, direcţionat caudal şi continuată recoltarea. Acest gest se pare că se realizează după eliminarea fracţiunii spermatice.
Hemoragii ale unor capilare peniene de suprafaţă se pot produce în timpul erecţiei. În general nu sunt periculoase pentru mascul şi nu constituie probleme persistente.
O erecţie prelungită, asociată cu eliminare prelungită de lichid prostatic, poate apărea în anumite situaţii. Se recomandă plimbarea masculului la distanţă mare de femela în estru şi, dacă este necesar, terapie cu apă rece, în care se introduce penisul masculului.
Evaluarea calităţii spermei
Examinarea spermei permite evaluarea potenţialului de fertilitate al masculului(22), identificarea cauzelor infertilităţii şi aprecierea calităţii materialului seminal.
În cadrul însămânţărilor artificiale, examinarea spermei are ca scop evaluarea calităţii şi implică o decizie imediată, împreună cu proprietarul căţelei, de utilizare sau nu a probei de spermă la inseminarea femelei.
Procedura de evaluare este particularizată în funcţie de categoria de material seminal: spermă proaspătă, spermă refrigerată şi spermă congelată.
Sperma conservată prin refrigerare sau prin congelare (crioconservare) implică, în general, evaluarea unui singur parametru: mobilitatea spermatozoizilor. Această conduită porneşte de la premisa că probele de spermă conservate au fost supuse analizei de calitate atât înainte de conservare, cât şi imediat după conservare, în cadrul evaluării de control.
Sperma proaspătă, recoltată de la un mascul în scopul inseminării unei femele în estru, parcurge două etape succesive: examenul macroscopic, prin care sunt apreciate volumul spermei recoltate, culoarea, prezenţa impurităţilor, şi examenul microscopic, prin care sunt determinate concentraţia spermei, mobilitatea şi morfologia spermatozoizilor. O cerinţă specială pentru aceste determinări este legată de timpul de execuţie, impunându-se alegerea unor tehnici rapide de examinare.
Tehnici de examinare a spermei
Volumul spermei se determină imediat după recoltare, prin citire directă în recipientul de recoltare gradat sau după transferul într-un cilindru gradat. Valoarea volumului poate fi opţiunea veterinarului, acesta stabilind în cursul recoltării cantitatea potrivită a celei de-a treia fracţiuni. Uneori, volumul total de spermă obţinut prin recoltare este foarte mic. Un volum mic de spermă constituie o problemă doar în situaţia asocierii cu o concentraţie scăzută. Determinarea volumului este necesară pentru calcularea numărului total de spermatozoizi în sperma recoltată.
Culoarea este evaluată prin examinarea probei de spermă în faţa unei surse de lumină. Culoarea este în corelaţie directă cu conţinutul spermei în spermatozoizi. În absenţa spermatozoizilor (azoospermie), aspectul spermei este apos, clar (incolor), uneori uşor gălbui, iar prezenţa unui număr foarte mare de spermatozoizi dă un aspect alb-lăptos.
Mobilitatea se evaluează cât mai rapid posibil după recoltare, la o temperatură apropiată de cea corporală. Evaluarea mobilităţii spermatozoizilor se face prin examinare microscopică, în câmp luminos sau în contrast de fază. Analiza mişcării spermatozoizilor include două aspecte: apreciere cantitativă, respectiv stabilirea procentului de spermatozoizi care se mişcă (mobilitatea totală – MT), şi apreciere calitativă, respectiv stabilirea parametrilor de calitate a mişcării, precum: procentul de spermatozoizi cu mişcare de înaintare (mobilitatea progresivă – MP) şi viteza de deplasare (velocitatea).
Aprecierea parametrilor de mişcare se face prin depunerea unei picături de spermă pe o lamă încălzită, acoperirea picăturii cu o lamelă şi examinarea microscopică. Se utilizează obiective cu capacitate de mărire variată (x10, x20, x40), în funcţie de parametrul evaluat. Valoarea minimă acceptabilă a mobilităţii spermatozoizilor este de 70% mobilitate progresivă.
Concentraţia spermei reprezintă numărul de spermatozoizi pe unitatea de volum (ml sau mm3) de spermă şi este un indicator important al calităţii spermei, fiind necesară pentru verificarea asigurării dozei de inseminare (numărul minim de spermatozoizi necesar pentru însămânţare artificială), în funcţie de tipul spermei (proaspătă sau conservată) şi de tipul de inseminare (intravaginală, intrauterină).
Determinarea rapidă a concentraţiei în condiţii de clinică se face cu spectrofotometrul precalibrat pentru spermă de câine. O alternativă este şi evaluarea microscopică, subiectivă, a unei picături de spermă şi estimarea indirectă a concentraţiei probei de spermă prin stabilirea desimii spermei.
Pentru a obţine numărul de spermatozoizi pe proba de spermă recoltată, se înmulţeşte concentraţia cu volumul ejaculatului.
Morfologia spermatozoizilor se evaluează prin examinarea spermatozoizilor coloraţi, utilizând microscopul cu lumină transmisă şi cuantificând spermatozoizii cu aspect morfologic normal (caracteristic speciei), spermatozoizii cu diferite anomalii morfologice şi spermatozoizii imaturi. O coloraţie optimă, în contextul inseminării imediate, este coloraţia cu Eozină sau Diff-Quik.
În cazul spermei de câine, valoarea considerată normală este >80% spermatozoizi cu morfologie normală(16).
Tehnici de inseminare a spermei
Depunerea spermei în căile genitale ale femelei se poate realiza intravaginal sau intrauterin.
Inseminarea intravaginală este o tehnică simplă, rapidă şi neinvazivă. Se aplică pentru sperma proaspătă şi sperma conservată prin refrigerare. Sunt descrise şi aplicate diverse procedee de realizare, diferenţele dintre acestea vizând, în general, instrumentarul utilizat.
Pipeta de inseminare se introduce pe la comisura superioară a vulvei, iniţial aproape în poziţie verticală, apoi prin mişcări de rotaţie se orientează orizontal şi se avansează până la faldul vaginal dorso-median care delimitează pseudocervixul sau până în proximitatea cervixului. Se ataşează seringa cu spermă la pipeta de inseminare, fie direct, fie prin intermediul unui tub de cauciuc. Prin refularea conţinutului seringii în vagin se realizează inseminarea. Timp de 10-15 minute postinseminare, căţeaua este menţinută cu trenul posterior ridicat sub un unghi de 40-45º, pentru a facilita pasajul gravitaţional al spermei prin căile genitale ale femelei(10).
Se poate utiliza pentru inseminare intravaginală şi pistoletul Osiris (un cateter subţire, prevăzut la capătul anterior cu un balonaş gonflabil), special conceput pentru IA la căţea. Acesta prezintă avantajul că stimulează contracţiile vaginale şi evită refluxul spermei din vagin(10).
Riscul major asociat acestei tehnici de inseminare este introducerea pipetei în vezica urinară. În scopul evitării introducerii accidentale a spermei în vezica urinară, se poate opta pentru utilizarea unui speculum vaginal sau pentru introducerea unui deget în vaginul căţelei, pentru a acoperi papila uretrală, ulterior fiind introdusă pipeta de inseminare prin glisarea acesteia peste degetul operatorului(16).
Inseminarea intrauterină poate fi realizată transcervical, laparoscopic şi chirurgical.
- Inseminarea prin pasaj transcervical ghidat endoscopic. Se introduce un endoscop în vaginul căţelei şi se identifică limita caudală al faldului dorso-medial postcervical. Se avansează cu endoscopul până când se observă o rozetă de falduri cervicale. Se introduce un cateter prin canalul de biopsie al endoscopului şi se împinge prin canal până când vârful cateterului trece de vârful endoscopului. Se avansează cu cateterul prin lumenul cervical. Seringa cu spermă se ataşează la capătul caudal al cateterului şi se inoculează sperma în uter, uşor, pentru a evita refluxul caudal de spermă. După inocularea spermei, se retrag cateterul şi endoscopul. Sunt semnalate cazuri în care particularităţi anatomice ale tractului genital nu permit pasajul transcervical al cateterului. În astfel de situaţii este recomandată inseminarea uterină chirurgicală sau inseminarea vaginală(16).
- Inseminarea uterină prin pasaj transcervical utilizând cateterul norvegian. Derivată din tehnicile utilizate în crescătoriile de vulpi, metoda s-a extins şi la căţea. Echipamentul este constituit dintr-o sondă metalică, un tub de plastic folosit pentru ghidaj şi o seringă. Cateterizarea se face pe femela menţinută în poziţie patrupodală, operatorul introducând ghidul tubular prin vagin până la extremitatea posterioară a pseudocervixului. Prin tubul de ghidaj se introduce sonda metalică, iar aceasta se dirijează prin palpaţie transabdominală prin canalul cervical(12). Înaintarea transcervicală este facilitată de tracţionarea transabdominală a cervixului în sens cranial şi alinierea canalului cervical cu sonda. Pentru reuşita metodei se impune mult exerciţiu şi o bună manualitate. Sunt situaţii în care, pentru fixarea transabdominală a cervixului, este nevoie de sedarea femelei. Metoda nu este aplicabilă la căţelele de talie mare, obeze sau cu temperament nervos.
- Inseminarea uterină prin laparoscopie. Laparoscopia abdominală reprezintă metoda cea mai puţin invazivă şi traumatizantă de abordare a coarnelor uterine pentru inocularea directă a spermei. Tehnica se realizează sub anestezie generală.
- efectuarea pneumo-abdomenului printr-o puncţie efectuată pe linia albă, la 1 cm deasupra ombilicului şi insuflarea aerului
- puncţia abdomenului cu un trocar, la 1 cm sub ombilic
- introducerea laparoscopului prin lumenul trocarului
- introducerea forcepsului de manipulare a uterului la 2-3 cm lateral de glandele mamare
- introducerea unui cateter de puncţionare a uterului, printr-un loc plasat pe linia albă, între mamelele 3 şi 5
- inocularea spermei în uter prin cateter(18).
-
Inseminarea uterină cu abordare chirurgicală. Tehnica se realizează sub anestezie generală. Pregătirile preoperatorii şi derularea timpilor operatori prezintă numeroase similarităţi cu operaţia de ovario-histerectomie. Succesiunea timpilor operatori este următoarea:
- aşezarea femelei în decubit dorsal şi pregătirea chirurgicală de rutină
- practicarea unei incizii cu o lungime de 4-6 cm la nivelul liniei albe, între ombilic şi pubis
- uterul este identificat şi adus la nivelul inciziei
- se injectează sperma în lumenul cornului uterin, lent
- uterul este repoziţionat în abdomen şi este suturată incizia abdominală, utilizând o procedură de rutină
- pe parcursul revenirii din anestezie, femela este poziţionată într-un plan înclinat, cu trenul posterior mai ridicat, pentru a evita refluxul spermei(8).
Sunt semnalate câteva dezavantaje majore ale inseminării uterine cu abordare chirurgicală: riscuri anestezice şi chirurgicale specifice, riscul infecţiilor postoperatorii, precum şi costul ridicat al intervenţiei(12).
Metoda se utilizează în special în cazul spermei crioconservate sau în situaţia în care este utilizată o spermă de calitate redusă, dar ar putea fi utilizată şi la femelele cu antecedente de subfertilitate(16).
În unele ţări ale Europei, tehnica inseminării uterine pe cale chirurgicală este analizată sub aspect etic, fiind considerată invazivă şi detrimentală pentru bunăstarea căţelei. Adoptarea unei politici de descurajare sau chiar interdicţie de utilizare a inseminării pe cale chirurgicală pare a fi agreată şi de asociaţiile chinologice sau organizaţii echivalente. Spre exemplificare, Royal College of Veterinary Surgeons (RCVS) a stabilit o poziţie etică, potrivit căreia inseminarea chirurgicală se justifică doar în cazuri excepţionale şi în aceste situaţii chirurgii veterinari sunt obligaţi să înregistreze motivele pentru care s-a recurs la procedura chirurgicală în locul alternativelor nechirurgicale. Aceeaşi poziţie este prezentată şi susţinută de Kennel Club (UK)(4,20).
Conflict of interests: The author declares no conflict of interests.
Bibliografie
- Concannon PW. Phisiology of canine ovarian cycles and pregnancy, Advances in Canine Reproduction. Mini-symposium at SLU. Editor Catharina Linde Forsberg. CRB Report 3. 1998;9-21.
- Dumon C, Fontbonne A. Reproduction du chien et du chat. Ed. Pract., Med., Chir., An., Comp. Paris. 1992.
- England GCW, Lofstedt R. Canine reproduction. Seminar Atlantic Vet. College. 2000.
- England GCW, Russo M, Freeman SL. Artificial insemination in dogs. In Practice. 2014 vol 36, pp 77-84.
- Fontbonne A. Le pigèes des frottis vaginaux chez la chienne. LePoint Vét. 1996;28, 176, 19.
- Guerin C. L’insemination artificielle dans l’espece canine. Le Point Vet. 1997;185, 33-42.
- Hewitt DA, England GC. Effect of preovulatory endocrine events upon maturation of oocytes of domestic bitches. J. Reprod. Fertil.Suppl. 1997;51, 83-91.
- Hutchison RV. Vaginal & surgical intra-uterine deposition of semen. Proceedings of the Canine Theriogenology Short Course. 1993;33-37.
- Igna V, Cernescu H, Mircu C, Ardelean V, Bnca Gh, Otavă G. Utilizarea endoscopiei vaginale în managementul reproducţiei la căţea. Lucr. St. USAMVB Timişoara, vol. XXXVII, seria Med.Vet., 2004;746-747.
- Igna V. Reproducţie, obstetrică şi ginecologie canină. Ed. Brumar, Timişoara. 2007.
- Karre I, Meyer-Lindenberg A, Urhausen C, Beineke A, Meinecke B, Piechotta M, Beyerbach M, Günzel-Apel AR. Distribution and viability of spermatozoa in the canine female genital tract during post-ovulatory oocyte maturation. Acta Vet Scand. 2012;54(1): 49.
- Linde-Forsberg C. Intra-uterine insemination in the dog using the Scandinavian trans-cervical catheter and comparison with other methods. In: Recent Advances in Small Animal Reproduction, sub red. Concannon PW, England GCW, Verstegen J. Publisher: International Veterinary Information Service (www.ivis.org), Ithaca, New York, USA, 2001.
- Neveux M. Les frottis vaginaux chez la chienne. Le Point Vet. 1999;30, 202, 37-44.
- Olson PNS, Thrall MA, Wykes PM, Husted PW, Nett TD, Sawyer HR. Vaginal cytology I: a useful tool for staging the canine oestrus cycle - its use in diagnosing canine disorders. Compendium of continuing education – VI, 1984;4-5, 208, 385, 391.
- Payan-Carreira R, Miranda S. and Nizanski W. Artificial Insemination in Dogs, Artificial Insemination in Farm Animals, Dr. Milad Manafi (Ed.), InTech. 2011; Available from:http://www.intechopen.com/books/artificial-insemination-in-farm-animals/artificial-insemination-in-dogs
- Root Kustritz MV. Clinical Canine and Feline Reproduction, Evidence-Based Answers. Wiley-Blackwell. 2010.
- Saint-Dizier M, Renard J, P Chastant-Maillard S. Induction of final maturation by sperm penetration in canine oocytes. Reproduction. 2001;121, 97-105.
- Silva LD, Onclin K, Snaps F, Verstegen J. Laparascopic intrauterine insemination in the bitch. Theriogenology. 1995;43, 615-623.
- Thomassen R, Farstad R. Artificial insemination in canids: A useful tool in breeding and conservation. Theriogenology 2009;71, 190–199.
- Thomassen R, Sanson G, Krogenaes A, Fougner JA, Berg KA, Farstad W. Artificial insemination with frozen semen in dogs: a retrospective study of 10 years using a non-surgical approach. Theriogenology. 2006;66:1645–50.
- Verstegen J, P Silva, LD, Onclin K. Determination of the role of cervical closure in fertility regulation after mating or artificial insemination in Beagle bitches. J. Reprod. Fertil. 2001;(Suppl.), 57, 31-36.
- Wang C. What is semen - How does semen analysis assist in understanding the reproductive status of the male? American Society of Andrology. 2001.
Articole din ediţiile anterioare
Diagnosticul şi managementul bolilor neuromusculare
Bolile manifestate prin tetrapareză acută flască reprezintă un procent redus din grupul pacienţilor neurologici. Cele mai frecvente prezentări clin...
Managementul clinic și de diagnostic al sindromului Cushing la câine
Sindromul Cushing (hiperadrenocorticismul) presupune o secreţie excesivă de cortizol, putând fi hipofizo-dependent (frecvent procese neoplazice de ...
Hipotiroidismul la câine – prevalenţă, factori de risc şi implicaţii neurologice
Hipotiroidismul reprezintă o endocrinopatie determinată de producţia insuficientă a hormonilor tiroidieni activi, respectiv triiodotironina (T3) şi...
Etapele examenului neurologic
Scopul examenului neurologic este de a determina exact localizarea leziunilor (diagnostic neuroanatomic) şi de a detecta semnele neurologice specif...