Exacerbările de astm induse viral
Viral-induced asthma exacerbations
Abstract
The COVID-19 pandemic has once again brought to the attention of researchers and medical practitioners the issue of viral infections in the management of chronic respiratory diseases, especially bronchial asthma. Viral infections, especially rhinovirus, are an important risk factor for asthma exacerbations. Asthma exacerbations are a major cause of asthma morbidity and mortality, leading to a progressive decline in lung function in some patients. The increased risk of exacerbation is a consequence of either a deficient antiviral response of the asthmatic patient, or the ability of some viruses to increase the Th2 inflammatory response, specific to the asthma phenotype. Understanding the pathophysiological mechanisms and clinico-epidemiological features of each viral infection may be crucial in developing a targeted therapy for the most common viral pathogens to effectively prevent asthmatic exacerbations.Keywords
exacerbationTh2 phenotypeviral infectionsrhinovirusCOVID-19Rezumat
Pandemia de COVID-19 a adus din nou în atenţia cercetătorilor şi a medicilor practicieni problematica infecţiilor virale în managementul bolilor cronice respiratorii, în special al astmului bronşic. Infecţiile virale, în special rinovirusul, reprezintă un factor important de risc de exacerbare a astmului bronşic. Exacerbările de astm reprezintă o cauză majoră de morbiditate şi mortalitate prin astm, la unii pacienţi determinând un declin progresiv al funcţiei pulmonare. Riscul crescut de exacerbare este dat, pe de o parte, de un răspuns antiviral deficitar al pacientului astmatic şi, pe de altă parte, de capacitatea unor virusuri de a augmenta răspunsul inflamator de tip Th2, specific fenotipului de astm. Înţelegerea mecanismelor fiziopatogenetice şi a caracteristicilor clinico-epidemiologice ale fiecărei infecţii virale poate fi crucială în dezvoltarea de terapii ţintite pentru cei mai comuni agenţi patogeni virali, pentru a preveni eficient exacerbările astmatice.Cuvinte Cheie
exacerbarefenotip Th2infecţii viralerinovirusCOVID-19Introducere
Astmul bronşic este cea mai frecventă boală respiratorie cronică a copilului, dar este prezentă cu o prevalenţă mare şi la adulţi(1). Se caracterizează printr-un proces inflamator cronic, creşterea secreţiei de mucus şi hiperreactivitate bronşică, ceea ce determină obstrucţie bronşică. Din punct de vedere clinic, evoluează cronic, cu episoade de exacerbare sau acutizare a simptomelor determinate de factori nespecifici. Boala este determinată de o serie de factori genetici şi de mediu. Incidenţa şi prevalenţa sa sunt în continuă creştere, acest lucru având multiple implicaţii terapeutice şi socioeconomice. Prevalenţa astmului bronşic a crescut semnificativ în ultimele două decade, afectând în prezent între 10% şi 15% din populaţia adultă(2,3).
Exacerbările de astm sunt o cauză majoră a morbidităţii bolii, a creşterii costurilor de îngrijire a sănătăţii şi la unii pacienţi determină un declin progresiv al funcţiei pulmonare(4). Costurile pentru tratamentul exacerbărilor de astm sunt semnificative, o analiză din 2007 relevând un cost total de 56 de miliarde de dolari pe an în SUA doar pentru tratamentul exacerbărilor(5). Mai mult, pacienţii care necesită prezentare în serviciile de urgenţă sau spitalizare pentru exacerbările de astm bronşic prezintă un risc semnificativ crescut de exacerbări viitoare, risc care este independent de alţi factori demografici şi clinici, de severitatea şi de controlul astmului(4,6). Exacerbările de astm necesită modificarea de urgenţă a tratamentului cronic, astfel încât identificarea pacienţilor cu risc de a dezvolta exacerbări şi realizarea unui plan de management corect pot îmbunătăţi semnificativ controlul bolii şi statusul pacienţilor.
Mai mulţi factori pot contribui la apariţia exacerbărilor de astm, inclusiv infecţiile, utilizarea insuficientă a medicamentelor necesare pentru controlul astmului sau expunerea la alergeni ori factori poluanţi. Infecţiile virale singure rareori produc exacerbări de astm, însă prezenţa unor cofactori, cum ar fi inflamaţia alergică şi prezenţa unor bacterii în căile respiratorii (Moraxella catarrhalis, Hemophilus influenza şi Streptococcus pneumoniae), pot creşte severitatea infecţiei şi probabilitatea de apariţie a exacerbărilor astmatice(7). În cele mai multe cazuri şi în special în exacerbările severe, se poate identifica mai mult de un factor care contribuie la exacerbare(1).
Infecţiile virale sunt însă incriminate şi în apariţia astmului bronşic, în special în populaţia pediatrică(8). Pe de altă parte, studii recente au arătat şi o asociere inversă între boala alergică respiratorie şi infecţiile virale. Prezenţa unei afecţiuni respiratorii alergice favorizează anumite infecţii virale, producând o augmentare a inflamaţiei şi agravând simptomele de astm(9).
Virusurile respiratorii şi exacerbările de astm
Virusurile respiratorii afectează nu numai pacienţii cu astm bronşic, ci şi oamenii sănătoşi. Cu toate acestea, se ştie că efectele infecţiei virale la pacienţii astmatici sunt mult mai accentuate decât la cei sănătoşi(9). Manifestările clinice ale infecţiei virale sunt determinate atât de modificările cauzate de virus în sine, cât şi de cele generate de răspunsul imun al gazdei.
Infecţiile respiratorii virale reprezintă un factor de declanşare a exacerbărilor de astm, atât la adult, cât şi la copil(9,11), fiind responsabile de aproximativ 90% din exacerbările de astm bronşic la copil(11,12) şi de 50% la adult(13). Rata spitalizărilor pentru exacerbările de astm este mai mare în sezonul specific pentru infecţiile respiratorii superioare, care în zonele temperate corespunde sezoanelor de iarnă şi primăvară(1,11).
Asocierea infecţii virale–exacerbări de astm a fost descrisă prima dată de Minor et al. în urmă cu 50 de ani(14). În studiul respectiv, în 90% din cazurile de infecţie respiratorie s-a observat şi o exacerbare a astmului, în peste 60% din cazuri fiind vorba de o infecţie cu rinovirus. Cu toate acestea, dificultăţile tehnice în detectarea virusurilor au subestimat impactul acestora asupra exacerbărilor de astm(15). Odată cu introducerea pe scară largă a tehnicilor de rt-PCR, metoda cu cea mai mare sensibilitate pentru detectarea virusurilor, mai ales din timpul pandemiei de COVID-19, s-a putut face o estimare reală a incidenţei infecţiilor virale în exacerbările de astm bronşic.
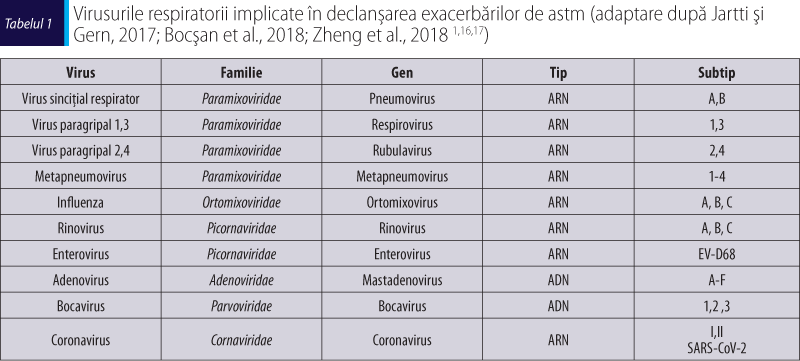
Pe lângă rinovirusuri, o multitudine de alte virusuri respiratorii sunt asociate cu dezvoltarea sau agravarea simptomelor de astm.
Factori de risc pentru exacerbări de astm induse de infecţii virale
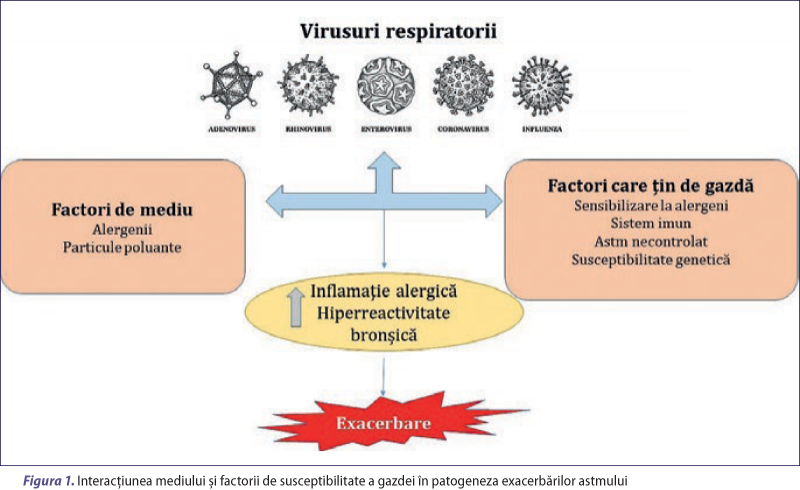
Există o serie de factori de susceptibilitate sau de risc care ajută medicul specialist în aprecierea dacă o infecţie respiratorie virală provoacă o exacerbare de astm sau nu. Infecţia virală influenţează răspunsul imun în diferite moduri în evoluţia astmului bronşic. Impactul infecţiilor virale asupra sistemului respirator depinde de sistemul imunitar al gazdei.
Factorii care influenţează manifestările clinice ale unei infecţii virale depind de virusul în sine (tipul şi virulenţa acestuia), gazdă (vârstă, susceptibilitate genetică, stare imunitară) şi mediu (temperatură, umiditate, poluare)(18). Interacţiunea dintre virusuri şi gazdă este redată în figura 1.
Factori dependenţi de virus
Aşa cum am arătat anterior, unele virusuri în particular pot determina mai frecvent exacerbări virale (rinovirusul sau virusul sinciţial respirator). În ceea ce priveşte rinovirusul, subtipurile A şi C sunt mai frecvent asociate cu afectare severă şi exacerbări de astm, faţă de subtipul B, care determină de obicei infecţii uşoare. Acest lucru se datorează unei virulenţe mai mari a subtipurilor A şi C şi capacităţii lor de a determina un răspuns imun mai amplu(19).
Şi în cazul virusului sinciţial respirator (VSR) s-au detectat o virulenţă şi o sezonalitate diferite ale celor două tipuri antigenic diferite, A şi B. Tipul A determină infecţii mai severe toamna şi la începutul iernii, în timp ce VSR-B este considerat a fi genotipul minor care determină infecţii uşoare la sfârşitul iernii sau primăvara(20). De asemenea, unele tulpini ale VSR sunt mai des implicate în infecţiile virale cu afectarea tractului respirator inferior(1).
Infecţiile virale pot să modifice, de asemenea, microbiomul căilor respiratorii superioare, atât cantitativ, cât şi calitativ, modificând probabilitatea ca infecţia să ducă la o exacerbare a astmului. Infecţia cu rinovirus (RV) la cei cu exacerbări de astm se asociază cu detectarea mai frecventă a unor specii de Moraxella, faţă de cei cu infecţie asimptomatică, unde se decelează mai ales specii de Corynebacterium(7).
Factori dependenţi de gazdă
Asocierea unui anumit tip de infecţie virală cu exacerbările de astm diferă în funcţie de vârsta pacientului, de populaţia studiată şi de regiunea geografică(17). La şcolari, cele mai frecvente exacerbări sunt determinate de infecţiile cu rinovirus, mai ales serotipurile A şi C, dar aceste infecţii sunt responsabile şi de creşterea numărului de spitalizări prin exacerbare de astm la adulţi(11). La adulţi, sunt mai frecvente infecţiile determinate de adenovirus, bocavirus, coronavirus, virusurile gripale şi paragripale, dar şi de virusul sinciţial respirator, mai ales la vârstnici(17,21). Această variabilitate a infecţiilor virale între adulţi şi copii poate fi explicată prin modificarea răspunsului de apărare antivirală pe parcursul vieţii(17).
Recent s-a dovedit că VSR reprezintă o cauză majoră de exacerbare a bolilor bronhoobstructive la pacienţii vârstnici sau la adulţi cu factori de risc multipli. Astfel, Griffith et al.(22) a arătat că VSR reprezintă a treia cauză de infecţie virală şi a doua cauză de spitalizare la pacienţii de peste 65 de ani. Populaţia vârstnică prezintă o susceptibilitate crescută pentru infecţia cu VSR, comparativ cu adulţii(22), mai probabil din cauza unui declin al sistemului imunitar.
Susceptibilitatea genetică joacă, de asemenea, un rol important în exacerbările de astm induse viral. Astfel, polimorfismul genei caderinei 3 (CDHR3), o proteină transmembranară care serveşte ca receptor pentru RV-C, creşte de zece ori riscul de infecţie cu acest virus şi de exacerbare severă de astm la copii, care necesită spitalizare(23,24).
Pacienţii cu sensibilizare la alergeni inhalatori şi manifestări respiratorii de alergie au un risc mai mare de a dezvolta infecţii virale, în special cu rinovirusuri. Încă nu este foarte clar dacă inflamaţia alergică creşte susceptibilitatea la infecţii sau doar creşte abilitatea virusurilor de a genera o inflamaţie mai puternică în căile aeriene(4,25). Există însă date care arată că pacienţii cu un răspuns imun de tip Th2 prezintă un răspuns imun deficitar în infecţiile virale, sinteza de interferon de tip I fiind invers corelată cu prezenţa eozinofilelor în căile aeriene, cu sinteza de IL-4 şi cu nivelul IgE totale(26).
Factori de mediu
Mai mulţi factori de mediu pot influenţa severitatea infecţiei virale şi pot creşte probabilitatea de exacerbare indusă de aceasta la pacienţii cu astm bronşic.
Expunerea la particule poluante (NO2) creşte severitatea manifestărilor de tract respirator inferior determinate de infecţiile virale şi reduce funcţia pulmonară la copiii cu astm(27). De asemenea, expunerea la concentraţii mari de alergeni a copiilor cu astm creşte riscul de exacerbări induse viral(28). Deşi nivelul plasmatic al vitaminei D se corelează negativ cu severitatea astmului, suplimentarea cu vitamină D la cei cu deficit nu a redus rata exacerbărilor de astm induse viral(29).
Relaţia infecţie virală–exacerbare de astm
Majoritatea persoanelor infectate cu virusuri respiratorii rămân asimptomatice sau dezvoltă simptome uşoare, iar infecţia este de obicei autolimitată, datorită răspunsului imun adecvat al gazdei. Pacientul astmatic poate să dezvolte însă un răspuns anormal faţă de antigenele virale, acest răspuns fiind diferit în funcţie de particularităţile infecţiei virale.
Cele mai multe cercetări experimentale şi clinice care au analizat modificările induse de virusuri în răspunsul imun din căile respiratorii derivă din studiile realizate în infecţiile cu RV.
Rinovirusuri
Infecţia cu rinovirusuri este cea mai frecventă infecţie respiratorie a copilăriei(1). RV este un virus cu ARN, neîncapsulat, din familia Picornaviridae, genul Enterovirus(15). Până în prezent au fost identificate trei specii de rinovirus (A, B şi C), cu peste 170 de serotipuri (A – 80 de tipuri, B – 32 de tipuri, C – 65 de tipuri)(1). Răspunsul imun generat de infecţia cu RV este diferit în funcţie de serotipul implicat; nu există reactivitate încrucişată între serotipuri în ceea ce priveşte sinteza de anticorpi. De asemenea, eterogenitatea genetică şi antigenică importantă constituie o limitare în producerea unui vaccin activ şi eficient împotriva tuturor tipurilor şi serotipurilor existente(30). Rinovirusul este prezent pe tot parcursul anului în majoritatea regiunilor geografice, deşi vârful de incidenţă al infecţiilor cu rinovirus este toamna, mai ales în septembrie, după reîntoarcerea copiilor în colectivităţi, şi primăvara târziu(1,11,31). Studiile epidemiologice au demonstrat că aproximativ 20 de tipuri de RV pot circula într-o anumită zonă geografică în timpul unui sezon de primăvară sau toamnă(7). Toate aceste aspecte explică astfel incidenţa crescută a infecţiilor cu rinovirus mai ales în populaţia pediatrică.
Rinovirusurile au capacitatea de infecta şi de a se replica atât în căile aeriene superioare, cât şi în cele inferioare(32), infecţia cu rinovirus fiind limitată în căile respiratorii, deşi uneori a fost detectat şi în circulaţie(33). Infecţia cu RV determină iniţierea răspunsului imun înnăscut la nivelul celulelor epiteliale, stimulând secreţia de chemokine şi factori de creştere, care determină recrutarea şi activarea leucocitelor PMN(34). În faza acută a infecţiei creşte numărul neutrofilelor şi monocitelor, în timp ce în faza de remisiune se observă o uşoară creştere a numărului de eozinofile(33). Este activată şi sinteza de interferon în răspunsul imun, ceea ce limitează replicarea virală şi creşterea severităţii infecţiei(35).
Aşa cum am arătat anterior, RV reprezintă cea mai frecventă infecţie virală care determină exacerbarea astmului(15,36,37). RV produc de obicei infecţii uşoare la copii. Infecţia cu RV care determină afectarea căilor inferioare este dependentă de vârstă, fiind mai frecvent întâlnită la copiii mai mari(38). La adult, asocierea exacerbări de astm–infecţie virală nu este atât de strânsă ca la copii, dar Coleman et al.(37) au arătat că RV alături de virusul gripal A sunt cel mai frecvent implicate virusuri în exacerbările de astm induse viral(37). Această asociere a fost recent dovedită şi de Patel et al., care au arătat că, la pacienţii cu exacerbări severe de astm care au necesitat oxigenare extracorporală (ECMO), virusurile respiratorii au fost factorul declanşator la 50% dintre pacienţi, iar RV este cel mai frecvent patogen izolat(39). Pacienţii cu astm necontrolat sau parţial controlat în momentul infecţiei virale au un risc mai mare de exacerbare severă(40).
Observaţiile din studiile clinice şi din cele epidemiologice au ridicat problema mecanismelor care stau la baza acestei interrelaţii. S-au identificat astfel două mecanisme disfuncţionale ale răspunsului imun la pacientul astmatic care favorizează infecţiile mai severe cu RV şi, implicit, exacerbările de astm(33,41).
Infecţia cu RV determină un răspuns imun de tip Th2 exagerat la pacientul astmatic
RV determină sinteza şi activarea unor factori specifici răspunsului de tip Th2, care este fenotipul inflamator dominant în astm. Astfel, determină activarea factorului de transcripţie STAT6 şi a chemokinelor eozinofilice (CCL11, CCL17, CCL22, CCL26), a citokinelor IL-4, IL-5, IL-13 şi a PGD, precum şi a alarminelor IL-25 şi IL-33(33,41,42). Dintre aceşti factori, IL-33, care este secretată de celulele epiteliale bronşice infectate şi este o citokină de alarmă implicată în fazele iniţiale ale răspunsului inflamator de tip Th2, se corelează cu severitatea simptomelor, cu inducerea secreţiei de IL-5 şi IL-3 şi cu viremia. Blocarea receptorului ST2 pentru IL-33 inhibă răspunsul Th2 indus de RV, ceea ce face din această moleculă o ţintă atractivă pentru dezvoltarea unui tratament specific(41).
Pe de altă parte, RV determină o creştere a eozinofilelor şi a celulelor limfoide înnăscute de tip 2 (ILC2) în căile respiratorii, acestea corelându-se cu severitatea exacerbării de astm, dar şi cu durata infecţiei cu RV(43).
Răspuns antiviral deficitar la pacienţii astmatici
La pacienţii astmatici, s-a observat un răspuns antiviral întârziat sau deficitar. Un răspuns rapid, prin activarea producţiei de interferon la începutul infecţiei, limitează probabil replicarea virală şi previne apariţia agravărilor(44). Însă răspunsul imun deficitar prin interferon observat la astmatici se corelează cu o încărcare virală mai mare la nivelul căilor respiratorii(41). Acest răspuns deficitar se observă atât la nivelul limfocitelor B (LB), cât şi în cele T reglatorii (LTreg)(33,41).
Deşi iniţial s-a crezut că cele două mecanisme disfuncţionale descrise anterior sunt independente, există tot mai multe date care arată conexiunile strânse dintre răspunsul antiviral deficitar şi exacerbarea răspunsului de tip Th2 la pacienţii astmatici infectaţi cu RV. Studiile experimentale au arătat o relaţie bidirecţională între IFN-β şi IL-33. IFN-β acţionează direct asupra celulelor ILC2 şi inhibă creşterea mediată de IL-33 a eozinofilelor din căile aeriene şi a hiperreactivităţii bronşice, în timp ce IL-33 atenuează răspunsul imun înnăscut şi adaptativ de tip Th1, inhibând producţia de IFN-β(45). De asemenea, deficienţa răspunsului antiviral prin interferon se corelează cu exprimarea crescută a receptorilor FcεRI la nivelul celulelor dendritice şi cu o producţie redusă de interferon dacă IgE specifice sunt fixate pe aceşti receptori(46). Mecanismele demonstrate în studiile experimentale sunt susţinute şi de observaţii clinice. Astfel, Busse et al. au raportat o reducere a exacerbărilor de astm induse viral în sezoanele specifice infecţiilor cu RV la pacienţii astmatici trataţi cu omalizumab(47).
Virusul sinciţial respirator
Infecţiile cu VSR apar mai ales la copilul mic, aproape toţi copiii prezentând cel puţin o infecţie cu VSR până la vârsta de 2 ani. Infecţia cu VSR nu determină imunitate pe termen lung, astfel încât pot să apară recurenţe, care sunt responsabile de rata mare de spitalizare ca urmare a acestei infecţii (50-90% din cazurile de bronşiolită şi 5-40% din cele de pneumonie)(48). Infecţiile severe produse de VSR se asociază mai degrabă cu apariţia wheezingului recurent, a astmului şi a sensibilizării la alergenii de mediu(1,38), dar alături de RV reprezintă o cauză majoră de exacerbare a astmului, dar şi a BPOC(49). Nu s-a dovedit o creştere a susceptibilităţii pentru infecţia cu VSR la adulţii astmatici, comparativ cu grupul de control(50). Mecanismele prin care infecţia cu VSR creşte susceptibilitatea de apariţie a astmului sau de exacerbări mai severe nu sunt încă pe deplin înţelese.
VSR poate induce o alterare a răspunsului imun antiviral normal, comutând spre un răspuns de tip Th2, cu secreţie crescută de chemokine, RANTES şi eotaxină, ceea ce determină creşterea eozinofilelor(51,52). Răspunsul antiviral Th1 este redus, nivelurile de IFN-γ şi TNF-α fiind semnificativ mai mici la pacienţii astmatici cu exacerbare indusă de VSR, comparativ cu alte infecţii virale(50), ceea ce scade clearance-ul viral şi prelungeşte durata şi severitatea exacerbării de astm(53).
În procesul de replicare, VSR utilizează ca receptori specifici pentru a pătrunde în celule TLR4 şi CX3CR1. Aceste molecule sunt supraexprimate la pacienţii cu astm sau BPOC(50) în cursul procesului inflamator, ceea ce în teorie ar avantaja replicarea virală. Cu toate acestea, nu s-a observat o diferenţă semnificativă a viremiei în epiteliul respirator la astmatici faţă de indivizii sănătoşi(50).
Alarminele joacă, de asemenea, un rol important în augmentarea răspunsului inflamator din căile aeriene. Astfel, studiile experimentale au arătat că RSV induce exprimarea IL-33 în căile aeriene la şoareci, dar mai ales la cei nou-născuţi, şi nu la şoarecii adulţi(54), ceea ce ar putea explica frecvenţa mai mare a infecţiei cu VSR la copiii mici. IL-33, prin stimularea receptorilor ST2 de la nivelul nuocitelor, creşte sinteza de IL-4, IL-5 şi IL-13, citokine implicate în apariţia astmului bronşic(22,54). Nu s-a evidenţiat o legătură directă între exprimarea IL-33, infecţia cu VSR şi severitatea exacerbărilor de astm. În cazul infecţiei cu VSR, IL-33 pare să joace un rol mai degrabă în apariţia astmului, şi nu în inducerea unor exacerbări severe de astm, ca în cazul RV.
Virusul gripal
Infecţia cu virus gripal este o infecţie sezonieră care determină frecvent exacerbări de astm, atât la copii, cât şi la adulţi. Virusul gripal joacă un rol important în inducerea unor exacerbări de astm severe la astmatici. Prevalenţa infecţiei cu virusul gripal la copiii cu wheezing poate ajunge până la 20%, în timp ce la adulţi este mai mare la cei cu exacerbări de astm (în jur de 25%). La pacienţii spitalizaţi pentru exacerbări de astm, prevalenţa infecţiei cu virusul gripal a fost între 2,4% şi 8%(17,55), fiind prezent în asociere cu alte virusuri respiratorii.
Astmul bronşic reprezintă un factor de risc pentru infecţia cu virusul gripal, atât la adult, cât şi la copii. Încă din 1964, Advisory Committee on Immunization Practices (ACIP) recomandă vaccinarea antigripală ca metodă profilactică la pacienţii cu astm(56). Vaccinarea antigripală la copiii astmatici nu reduce numărul exacerbărilor de astm sau severitatea acestora, dar reduce durata episodului infecţios(55).
Aceste date nu sunt valabile pentru virusul gripal de tip A H1N1. Prevalenţa acestei infecţii este mai mare la pacienţii cu astm, variind între 6% şi 50% la copii şi între 27% şi 46% la adult(17). De asemenea, astmul bronşic este un factor de risc pentru o infecţie severă cu virusul H1N1, cu o rată mai mare a spitalizărilor, inclusiv în secţiile de ATI, şi chiar cu o rată mai mare de decese. În timpul pandemiei din 2009, aproximativ 44% dintre copiii spitalizaţi pentru gripa A H1N1 au fost astmatici(57).
Virusul paragripal
Virusurile paragripale (serotipurile 1-4) determină simptome atât de afectare respiratorie superioară, cât şi inferioară („răceală” de sezon, laringotraheobronşită, bronşiolită sau penumonie) la copii şi adulţi(17,58). Infecţia cu aceste virusuri constituie un factor cauzal al exacerbărilor de astm(58), fără să existe diferenţe între cele patru serotipuri. La adult, prevalenţa infecţiei cu virusul paragripal de tip 3 este însă mai mare la cei cu exacerbare de astm (60%), dar determină exacerbări uşoare(59). Exacerbările de astm sunt determinate de sinteza de citokine şi chemokine indusă de infecţia virală. De asemenea, virusul paragripal de tip 3 induce o creştere a nivelului de CysLT la pacienţii cu exacerbare de astm indusă de acest virus(59).
Metapneumovirus
Metapneumovirusul este un paramixovirus care determină infecţii respiratorii acute în special la copiii mici. Formele sunt similare cu cele produse de VSR (infecţie uşoară de căi respiratorii superioare, pneumonie sau bronşiolită). Metapneumovirusul se asociază cu exacerbările de astm la copii şi la adult. În studiul lui Williams et al.(60), care a inclus 101 pacienţi de peste 18 ani, internaţi în spital cu exacerbare de astm, 6,9% au prezentat infecţie cu metapneumovirus. Un procentaj similar s-a raportat şi în studii la copii, infecţia cu metapneumovirus fiind detectată în 4-8% din cazurile de exacerbări acute de astm care au necesitat spitalizare(61). Infecţia cu metapneumovirus se asociază cu exacerbările de astm, însă cu o incidenţă mai mică în comparaţie cu celelalte infecţii cu virusuri respiratorii.
SARS-CoV-2 şi COVID-19
Infecţiile virale şi riscul de exacerbare de astm au revenit în atenţia medicilor şi cercetătorilor odată cu pandemia de COVID-19, între 2020 şi 2023. Infecţia cu SARS-CoV-2, care a generat pandemia de COVID-19, a ridicat mai multe preocupări în lumea medicală privind riscul de exacerbare şi de infectare pentru pacientul astmatic. Datele epidemiologice arată că astmul nu creşte riscul de infecţie cu SARS-CoV-2(62). Din contră, s-a ridicat ipoteza că astmul bronşic ar fi un factor protectiv faţă de infecţia cu SARS-CoV-2, fapt explicat prin exprimarea redusă a ACE-2, receptorul specific al virusului, la pacienţii cu astm trataţi cu corticosteroizi inhalatori.
Epidemiile anterioare provocate de coronavirusuri (SARS şi MERS) nu s-au asociat cu exacerbări ale astmului bronşic(63). Dar analiza datelor epidemiologice din primul val al pandemiei sunt discordante. Relaţia dintre astm şi COVID-19 este extrem de variabilă, prevalenţa infecţiei la pacienţii cu astm fiind în jur de 5% în China, dar de 17% în SUA(63). Această diferenţă ar putea fi explicată prin mai mulţi factori, inclusiv o vulnerabilitate diferită faţă de infecţia cu SARS-CoV-2 şi diferenţe în prevalenţa astmului bronşic în diferite populaţii sau grupuri etnice. Date mai recente arată că infecţia cu SARS-CoV-2 nu determină exacerbări mai severe decât alte infecţii la copiii cu astm(64). Cu toate acestea, societăţile profesionale recomandă menţinerea controlului astmului prin utilizarea tuturor tratamentelor disponibile existente în prezent, pentru a limita posibilitatea apariţiei unor exacerbări grave.
Alte virusuri
Aşa cum am arătat anterior, şi alte virusuri respiratorii pot determina exacerbări de astm, însă implicarea lor a fost mai puţin studiată.
Adenovirusul are un rol limitat în producerea exacerbărilor astmatice la adult, fiind implicat în 0,7-2,5% din cazuri(65). Dar infecţia cu adenovirus se asociază cu exacerbări severe de astm, care necesită spitalizare şi ventilaţie mecanică, cu risc crescut de deces(66). O particularitate a infecţiei cu adenovirus la copil este persistenţa acestuia în căile respiratorii mult timp după rezoluţia infecţiei, chiar până la 12 luni, fără a se corela însă cu manifestări clinice sau modificări morfofuncţionale secundare(67).
Enterovirusurile determină infecţii acute vara şi toamna în zona noastră geografică, însă în zonele tropicale pot fi active pe tot parcursul anului(17). Deşi au fost identificate peste 100 de tulpini, clasificate în patru specii (A-D), serotipul EDV-D68 a fost cel mai intens studiat în relaţie cu astmul bronşic. Infecţia cu EV-D68 este mai frecventă la copii, dar poate fi întâlnită şi la adulţi(16,17). La pacienţii cu astm bronşic, EV-D68 determină exacerbări de astm severe, care necesită internare în secţii ATI şi uneori ventilaţie mecanică(68).
Bocavirusul este un virus cu ADN, care provine din familia Parvoviridae şi determină infecţii de căi respiratorii inferioare, fiind implicat mai ales în exacerbările de astm la adult(16,17).
Concluzii
Infecţiile respiratorii virale reprezintă un factor de risc important de exacerbare a astmului bronşic atât la copii, cât şi la adulţi. Riscul de a dezvolta o exacerbare severă la un pacient cu astm este determinat în primul rând de tipul de infecţie virală, de vârsta pacientului şi de statusul imunitar. Rinovirusul, virusul sinciţial respirator şi cel gripal sunt cel mai frecvent implicate în inducerea exacerbărilor astmatice. Exacerbările de astm induse viral sunt favorizate de un răspuns imun de tip Th2 exagerat la pacientul astmatic şi de un răspuns antiviral prin secreţie de interferon deficitar. Întrucât măsurile terapeutice în infecţiile virale sunt limitate, ar trebui înţelese particularităţile epidemiologice, clinice şi fiziopatologice ale infecţiilor virale pentru a preveni exacerbările de astm, prin reducerea inflamaţiei alergice, care poate constitui un cofactor de agravare a infecţiei virale.
Autor corespondent:
Ioana‑Corina Bocsan
E-mail: corinabocsan@yahoo.com
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Jartti T, Gern JE. Role of viral infections in the development and exacerbation of asthma in children. J Allergy Clin Immunol. 2017;140(4):895-906.
- The International Study of Asthma and allergy in Childhood (ISAAC). Steering Commitee. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis and atopic eczema. Lancet. 1998;351.1225-1232.
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2023
- Castillo JR, Peters SP, Busse WW. Asthma Exacerbations: Pathogenesis, Prevention, and Treatment. J Allergy Clin Immunol Pract. 2017;5(4):918-927.
- Barnett SB, Nurmagambetov TA. Costs of asthma in the United States: 2002-2007. J Allergy Clin Immunol. 2011;127:145–152.
- Miller MK, Lee JH, Miller DP, Wenzel SE, Group TS. Recent asthma exacerbations: a key predictor of future exacerbations. Respir Med. 2007;101:481–489.
- Kloepfer KM, Lee WM, Pappas TE, Kang TJ, Vrtis RF, Evans MD, et al. Detection of pathogenic bacteria during rhinovirus infection is associated with increased respiratory symptoms and asthma exacerbations. J Allergy Clin Immunol. 2014;133:1301–1307
- Matsumoto K, Inoue H. Viral infections in asthma and COPD. Respir Investig. 2014;52(2):92-100.
- Murray CS, Poletti G, Kebadze T, Morris J, Woodcock A, Johnston SL, et al. Study of modifiable risk factors for asthma exacerbations: virus infection and allergen exposure increase the risk of asthma hospital admissions in children. Thorax. 2006;61:376–382.
- Kim SR. Viral Infection and Airway Epithelial Immunity in Asthma. Int J Mol Sci. 2022 Aug 31;23(17):9914.
- Johnston NW, Johnston SL, Norman GR, Dai J, Sears MR. The September epidemic of asthma hospitalization: school children as disease vectors. J Allergy Clin Immunol. 2006;117:557–562.
- Johnston SL, Pattemore PK, Sanderson G, Smith S, Lampe F, Josephs L, et al. Community study of role of viral infections in exacerbations of asthma in 9-11 year old children. BMJ. 1995;310:1225-1231.
- Nicholson KG, Kent J, Ireland DK. Respiratory viruses and exacerbations of asthma in adults. BMJ. 1993;307:982-986.
- Minor TE, Dick EC, DeMeo AN, Ouellette JJ, Cohen M, Reed CE. Viruses as precipitants of asthmatic attacks in children. JAMA. 1974;227:292–8.
- Kim CK, Callaway Z, Gern JE.V iral Infections and Associated Factors That Promote Acute Exacerbations of Asthma. Allergy Asthma Immunol Res. 2018;10(1):12-17.
- Bocşan IC, Feketea G, Muntean A. Infecţiile virale şi astmul bronşic. Alergologia. 2018;3:68-73.
- Zheng XY, Xu YJ, Guan WJ, Lin LF. Regional, age and respiratory-secretion-specific prevalence of respiratory viruses associated with asthma exacerbation: a literature review. Arch Virol. 2018;163(4):845-853.
- Dakhama A, Lee YM, Gelfand EW. Virus-induced airway dysfunction: pathogenesis and biomechanisms. Pediatr Infect Dis J. 2005;24(11 Suppl):S159–S169, discussion S166–S157.
- Choi T, Devries M, Bacharier LB, Busse W, Camargo CA Jr., Cohen R, et al. Enhanced Neutralizing Antibody Responses to Rhinovirus C and Age-Dependent Patterns of Infection. Am J Respir Crit Care Med. 2021;203:822–30.
- Papadopoulos NG, Gourgiotis D, Javadyan A, Bossios A, Kallergi K, Psarras S, et al. Does respiratory syncytial virus subtype influences the severity of acute bronchiolitis in hospitalized infants? Respir Med. 2004;98:879–882.
- Falsey AR, Hennessey PA, Formica MA, Cox C, Walsh EE. Respiratory syncytial virus infection in elderly and high-risk adults. N Engl J Med. 2005;352:1749–1759.
- Griffiths C, Drews SJ, Marchant DJ. Respiratory syncytial virus: infection, detection, and new options for prevention and treatment. Clin Microbiol Rev. 2017;30:277-319.
- Bochkov YA, Watters K, Ashraf S, Griggs TF, Devries MK, Jackson DJ, et al. Cadherin-related family member 3, a childhood asthma susceptibility gene product, mediates rhinovirus C binding and replication. Proc Natl Acad Sci U S A. 2015;112:5485–5490.
- Bonnelykke K, Sleiman P, Nielsen K, Kreiner-Moller E, Mercader JM, Belgrave D. A genome-wide association study identifies CDHR3 as a susceptibility locus for early childhood asthma with severe exacerbations. Nat Genet. 2014;46:51–55.
- Soto-Quiros M, Avila L, Platts-Mills TA, Hunt JF, Erdman DD, Carper H. High titers of IgE antibody to dust mite allergen and risk for wheezing among asthmatic children infected with rhinovirus. J Allergy Clin Immunol. 2012;129:1499–1505.e5.
- Baraldo S, Contoli M, Bazzan E, Turato G, Padovani A, Marku B. Deficient antiviral immune responses in childhood: distinct roles of atopy and asthma. J Allergy Clin Immunol. 2012;130:1307–1314.
- Chauhan AJ, Inskip HM, Linaker CH, Smith S, Schreiber J, Johnston SL. Personal exposure to nitrogen dioxide (NO2) and the severity of virus-induced asthma in children. Lancet. 2003;361:1939–1944.
- Murray CS, Poletti G, Kebadze T, Morris J, Woodcock A, Johnston SL. Study of modifiable risk factors for asthma exacerbations: virus infection and allergen exposure increase the risk of asthma hospital admissions in children. Thorax. 2006;61:376–382.
- Castro M, King TS, Kunselman SJ, Cabana MD, Denlinger L, Holguin F. Effect of vitamin D3 on asthma treatment failures in adults with symptomatic asthma and lower vitamin D levels: the VIDA randomized clinical trial. JAMA. 2014;311:2083–2091.
- Glanville N, McLean GR, Guy B, Lecouturier V, Berry C, Girerd Y, et al. Cross-serotype immunity induced by immunization with a conserved rhinovirus capsid protein. PLoS Pathog. 2013;9:e1003669.
- Monto AS. The seasonality of rhinovirus infections and its implications for clinical recognition. Clin Ther. 2002;24:1987–1997.
- Gern JE, Galagan DM, Jarjour NN, Dick EC, Busse WW. Detection of rhinovirus RNA in lower airway cells during experimentally induced infection. Am J Respir Crit Care Med. 1997;155:1159–1161.
- Jackson DJ, Gern JE. Rhinovirus Infections and Their Roles in Asthma: Etiology and Exacerbations. J Allergy Clin Immunol Pract. 2022;10(3):673-681.
- Bochkov YA, Hanson KM, Keles S, Brockman-Schneider RA, Jarjour NN, Gern JE. Rhinovirus-induced modulation of gene expression in bronchial epithelial cells from subjects with asthma. Mucosal Immunol. 2010;3:69–80.
- Becker TM, Durrani SR, Bochkov YA, Devries MK, Rajamanickam V, Jackson DJ. Effect of exogenous interferons on rhinovirus replication and airway inflammatory responses. Ann Allergy Asthma Immunol. 2013;111:397–401.
- Lemanske RF Jr. The childhood origins of asthma (COAST) study. Pediatr Allergy Immunol. 2002;13:38–43.
- Coleman AT, Jackson DJ, Gangnon RE, Evans MD, Lemanske RF, Gern JE. Comparison of risk factors for viral and nonviral asthma exacerbations. Journal of Allergy and Clinical Immunology. 2015;136:1127–9.e4.
- Jartti T, Lehtinen P, Vuorinen T, Österback R, van den Hoogen B, Osterhaus AD, et al. Respiratory picornaviruses and respiratory syncytial virus as causative agents of acute expiratory wheezing in children. Emerg Infect Dis. 2004;10:1095-1101.
- Patel S, Shah NM, Malhotra AM, Lockie C, Camporota L, Barrett N, et al. Inflammatory and microbiological associations with near-fatal asthma requiring extracorporeal membrane oxygenation. ERJ Open Research. 2020;6:00267–2019.
- Yang F, Busby J, Heaney LG, Menzies-Gow A, Pfeffer PE, Jackson DJ, et al. Factors Associated with Frequent Exacerbations in the UK Severe Asthma Registry. J Allergy Clin Immunol Pract. 2021;9:2691–701.e1.
- Jackson DJ, Makrinioti H, Rana BM, Shamji BW, Trujillo-Torralbo MB, Footitt J, Jerico Del-Rosario, Telcian AG, Nikonova A, Zhu J, Aniscenko J, Gogsadze L, Bakhsoliani E, Traub S, Dhariwal J, Porter J, Hunt D, Hunt T, Hunt T, Stanciu LA, Khaitov M, Bartlett NW, Edwards MR, Kon OM, Mallia P, Papadopoulos NG, Akdis CA, Westwick J, Edwards MJ, Cousins DJ, Walton RP, Johnston SL. IL-33-dependent type 2 inflammation during rhinovirus-induced asthma exacerbations in vivo. Am J Respir Crit Care Med. 2014 Dec 15;190(12):1373-82.
- Beale J, Jayaraman A, Jackson DJ, Macintyre JDR, Edwards MR, Walton RP, et al. Rhinovirus-induced IL-25 in asthma exacerbation drives type 2 immunity and allergic pulmonary inflammation. Science Translational Medicine. 2014;6:256ra134–256ra1.
- Dhariwal J, Cameron A, Wong E, Paulsen M, Trujillo-Torralbo MB, Del Rosario A, Bakhsoliani E, Kebadze T, Almond M, Farne H, Gogsadze L, Aniscenko J, Rana BMJ, Hansel TT, Jackson DJ, Kon OM, Edwards MR, Solari R, Cousins DJ, Walton RP, Johnston SL; MRC-GSK Strategic Alliance Consortium. Pulmonary Innate Lymphoid Cell Responses during Rhinovirus-induced Asthma Exacerbations In Vivo: A Clinical Trial. Am J Respir Crit Care Med. 2021 Dec 1;204(11):1259-1273.
- Altman MC, Gill MA, Whalen E, Babineau DC, Shao B, Liu AH, et al. Transcriptome networks identify mechanisms of viral and nonviral asthma exacerbations in children. Nat Immunol. 2019;20:637–51.
- Ravanetti L, Dijkhuis A, Dekker T, Sabogal Pineros YS, Ravi A, Dierdorp BS, et al. IL-33 drives influenza-induced asthma exacerbations by halting innate and adaptive antiviral immunity. Journal of Allergy and Clinical Immunology. 2019;143:1355–70.e16.
- Durrani SR, Montville DJ, Pratt AS, Sahu S, Devries MK, Rajamanickam V, et al. Innate immune responses to rhinovirus are reduced by the high-affinity IgE receptor in allergic asthmatic children. Journal of Allergy and Clinical Immunology. 2012;130:489–95.
- Busse WW, Morgan WJ, Gergen PJ, Mitchell HE, Gern JE, Liu AH, et al. Randomized Trial of Omalizumab (Anti-IgE) for Asthma in Inner-City Children. New England Journal of Medicine. 2011;364:1005–15.
- Hall CB. Respiratory syncytial virus and parainfluenza virus. N Engl J Med. 2001;344:1917-1928.
- Hewitt R, Farne H, Ritchie A, Luke E, Johnston SL, Mallia P. The role of viral infections in exacerbations of chronic obstructive pulmonary disease and asthma. Ther Adv Respir Dis. 2016;10:158–174.
- Patel DA, You Y, Huang G, Byers DE, Kim HJ, Agapov E, et al. Interferon response and respiratory virus control are preserved in bronchial epithelial cells in asthma. J Allergy Clin Immunol. 2014;134:1402–1412.
- Haeberle HA, Kuziel WA, Dieterich HJ, Casola A, Gatalica Z, Garofalo RP. Inducible expression of inflammatory chemokines in respiratory syncytial virus-infected mice: role of MIP-1α in lung pathology. J Virol. 2001;75:878–890.
- Kim CK, Kita H, Callaway Z, Kim HB, Choi J, Fujisawa T, et al. The roles of a Th2 cytokine and CC chemokine in children with stable asthma: potential implication in eosinophil degranulation. Pediatr Allergy Immunol. 2010;21:e697–e704.
- Matsuse H, Tsuchida T, Fukahori S, Kawano T, Tomari S, Matsuo N, et al. Differential airway inflammatory responses in asthma exacerbations induced by respiratory syncytial virus and influenza virus. Int Arch Allergy Immunol. 2013;161:378–382.
- Saravia J, You D, Shrestha B, Jaligama S, Siefker D, Lee GI, Harding JN, Jones TL, Rovnaghi C, Bagga B, DeVincenzo JP, Cormier SA. Respiratory syncytial virus disease is mediated by age-variable IL-33. PLoS Pathog. 2015;11:e1005217.
- Dulek DE, Peebles RS Jr. Viruses and asthma. Biochim Biophys Acta. 2011;1810(11):1080-1090.
- Centers for Disease Control and Prevention (CDC). Influenza vaccination coverage among children with asthma--United States, 2004-05 influenza season. MMWR Morb Mortal Wkly Rep. 2007;56(9):193-196.
- Dawood FS, Kamimoto L, D’Mello TA, et al. Children with asthma hospitalized with seasonal or pandemic influenza, 2003-2009. Pediatrics. 2011;128(1):e27–e32.
- Pawełczyk M, Kowalski ML. The Role of Human Parainfluenza Virus Infections in the Immunopathology of the Respiratory Tract. Curr Allergy Asthma Rep. 2017;17(3):16.
- Matsuse H, Kondo Y, Saeki S, et al. Naturally occurring parainfluenza virus 3 infection in adults induces mild exacerbation of asthma associated with increased sputum concentrations of cysteinyl leukotrienes. Int Arch Allergy Immunol. 2005;138(3):267–272.
- Williams JV, Crowe JE Jr, Enriquez R, Minton P, Peebles RS Jr, Hamilton RG, et al. Human metapneumovirus infection plays an etiologic role in acute asthma exacerbations requiring hospitalization in adults. J Infect Dis. 2005;192(7):1149-1153.
- Papadopoulos NG et al. Viruses and bacteria in acute asthma exacerbations – a GA(2) LEN-DARE systematic review. Allergy. 2011;66(4):458–468.
- Adir Y, Saliba W, Beurnier A, Humbert M. Asthma and COVID-19: an update. Eur Respir Rev. 2021;30(162):210152.
- Patrucco F, Benfante A, Villa E, Principe S, Scichilone N, Solidoro P. Severe asthma and COVID-19: lessons from the first wave. J Asthma. 2022;59(2):239-242.
- Abrams EM. Coronavirus disease 2019 and pediatric asthma: friend or foe? Curr Opin Allergy Clin Immunol. 2022;22(2):95-100.
- Teichtahl H, Buckmaster N, Pertnikovs E. The incidence of respiratory tract infection in adults requiring hospitalization for asthma. Chest. 1997;112(3):591–59.6
- Tan WC, Xiang X, Qiu D, Ng TP, Lam SF, Hegele RG. Epidemiology of respiratory viruses in patients hospitalized with near-fatal asthma, acute exacerbations of asthma, or chronic obstructive pulmonary disease. Am J Med. 2003;115(4):272–27.7
- Macek V, Sorli J, Kopriva S, Marin J. Persistent adenoviral infection and chronic airway obstruction in children. Am J Respir Crit Care Med. 1994;150(1):7–10.
- Midgley CM, Watson JT, Nix WA, Curns AT, Rogers SL, Brown BA, et al. Severe respiratory illness associated with a nationwide outbreak of enterovirus D68 in the USA (2014): a descriptive epidemiological investigation. Lancet Respir Med. 2015;3:879-887.




