Utilitatea probelor funcţionale în diagnosticul astmului alergic
Usefulness of functional tests in the diagnosis of allergic asthma
Abstract
Respiratory function tests are of crucial importance in the diagnosis, assessment and management of asthma. Asthma, a chronic respiratory condition characterized by inflammation and airway obstruction, affects millions of people globally. Respiratory function tests, such as spirometry and bronchial challenge tests, are vital tools in determining the severity and type of asthma, providing objective data on lung function. This article highlights how these tests help in personalizing treatment, allowing doctors to adjust medication regimens and monitor their effectiveness. It also discusses the role of the tests in identifying patients’ responses to various triggers and in the management of asthma exacerbations. Through the regular and strategic use of respiratory function tests, better asthma control can be achieved, significantly improving the patients’ quality of life.Keywords
asthmarespiratory function testsspirometrybronchial challenge testsRezumat
Probele funcţionale respiratorii au o importanță crucială în diagnosticarea, evaluarea şi managementul astmului. Astmul, o afecțiune respiratorie cronică, ce este caracterizată prin inflamația şi obstrucţia căilor respiratorii, afectează milioane de persoane la nivel global. Probele funcţionale respiratorii, cum ar fi spirometria şi testele de provocare bronşică, sunt instrumente vitale în stabilirea severităţii şi tipului de astm, oferind date obiective privind funcţionarea plămânilor. Articolul evidențiază cum aceste teste ajută în personalizarea tratamentului, permițând medicilor să ajusteze regimurile de medicație şi să monitorizeze eficacitatea acestora. De asemenea, se discută despre rolul testelor în identificarea răspunsurilor pacienţilor la diverşi factori declanşatori şi în managementul exacerbărilor astmului. Prin utilizarea regulată şi strategică a probelor funcţionale respiratorii, se poate obține un control mai bun al astmului, îmbunătățind semnificativ calitatea vieții pacienţilor.Cuvinte Cheie
astmprobe funcţionale respiratoriispirometrieteste de provocare bronşicăIntroducere
Astmul este o afecțiune eterogenă, caracterizată prin inflamația cronică a căilor respiratorii şi prin hiperreactivitate bronşică la stimuli direcți sau indirecți, definită printr-un istoric de simptome respiratorii, reprezentate de wheezing, dispnee, constricție toracică şi tuse, alături de limitarea variabilă a fluxului de aer. Simptomele sunt adesea induse de factori declanşatori precum expunerea la alergene (de exemplu, acarieni din praful de casă, animale de companie, gândaci, fungi, polenuri), infecții respiratorii (virale, bacteriene), poluanți atmosferici, substanțe iritante, fumul de țigaretă, factori ocupaționali, efort fizic, modificări meteorologice, stres şi unele medicamente (de exemplu, betablocantele, aspirina sau alte antiinflamatoare nesteroidiene). Simptomele şi limitarea fluxului de aer se pot remite spontan sau ca răspuns la tratament şi uneori pot fi absente timp îndelungat. Aceste caracteristici persistă chiar şi atunci când simptomele sunt absente sau funcţia pulmonară este normală, dar se pot normaliza în urma tratamentului. Pacienţii pot prezenta exacerbări care uneori pun viața în pericol şi care reprezintă o povară semnificativă pentru pacienţi şi sistemele de sănătate (GINA, 2023; Louis et al., 2022; Stanojevic et al., 2022).
Astmul are mai multe fenotipuri (caracteristici observabile care rezultă dintr-o asociere de factori ereditari şi de mediu) şi endotipuri (mecanisme fiziopatogenice distincte la nivel celular şi molecular). Astmul alergic este un fenotip aparte de astm, definit ca astmul asociat cu sensibilizarea la aeroalergene (GINA, 2023; Louis et al., 2022; Stanojevic et al., 2022). De asemenea, sensibilizarea la alimente poate preceda şi predispune la dezvoltarea astmului, cu inducerea simptomelor de astm şi a hiperreactivității bronşice (HRB) în cursul reacției anafilactice induse de alimente sau prin reacțiile încrucişate dintre alergene alimentare şi aeroalergene (Emons et al., 2018). Cele două criterii necesare pentru definirea astmului alergic sunt: (1) identificarea sensibilizării alergice (in vivo şi/sau in vitro) şi (2) asocierea dintre expunerea la aeroalergene şi simptomele de astm (Papapostolou et al., 2022).
Diagnosticul astmului
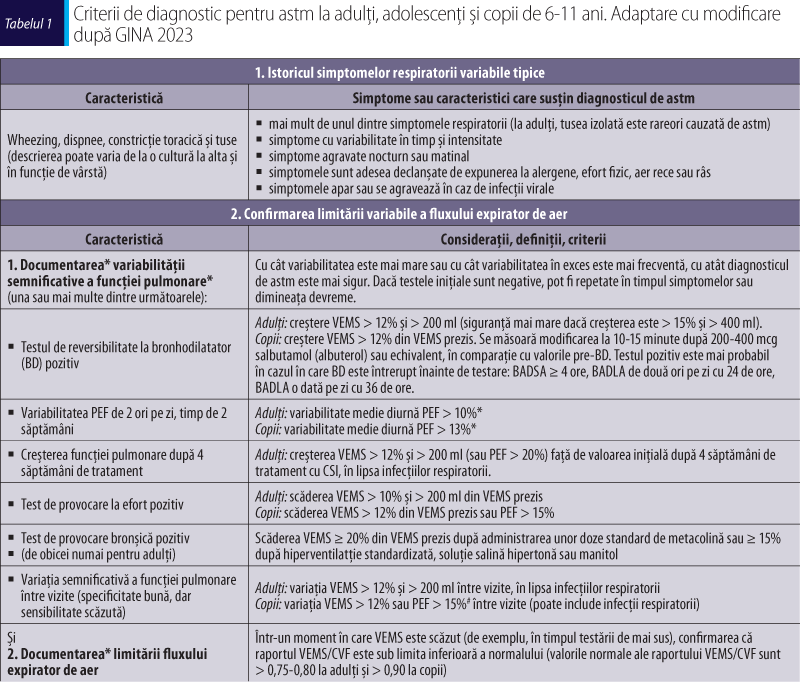
Simptomatologia caracteristică prezintă un rol important în diagnosticul astmului, deoarece acestea se pot datora unor afecțiuni acute sau cronice, altele decât astmul. Dovezile care susțin diagnosticul de astm (tabelul 1) trebuie documentate la prezentarea inițială a pacientului, deoarece trăsăturile caracteristice astmului se pot remite spontan sau ca răspuns la tratament. Diagnosticul de astm este mai dificil de confirmat după inițierea tratamentului cu corticosteroizi inhalatori (CSI), deoarece acesta poate reduce variabilitatea atât a simptomelor, cât şi a funcţiei pulmonare (GINA, 2023).
Probele funcţionale în diagnosticul astmului alergic
Astmul se caracterizează prin limitarea variabilă a fluxului expirator de aer, astfel că funcţia pulmonară expiratoare poate varia în timp şi intensitate, de la complet normală la obstrucţie severă în cazul aceluiaşi pacient. Istoricul şi semnele clinice sunt baza diagnosticului în astm, dar evaluarea simptomelor precum dispneea şi wheezingul este adesea dificilă. Evaluarea funcţiei pulmonare, cu evidențierea obstrucţiei bronşice variabile în timp şi după administrarea de substanțe bronhodilatatoare, confirmă diagnosticul de astm (GINA, 2023).
La un pacient cu simptome respiratorii caracteristice, determinarea variabilități excesive a funcţiei pulmonare expiratorii este o componentă esenţială a diagnosticului de astm. Câteva exemple specifice sunt:
- creşterea funcţiei pulmonare după administrarea unui BD sau sub terapie cu CSI
- scăderea funcţiei pulmonare după efort sau în timpul unui test de provocare bronşică
- variația funcţiei pulmonare în afara intervalului normal, când este repetată în timp, fie în cursul unor vizite repetate, fie în cursul monitorizării la domiciliu pe o perioadă de cel puțin 1-2 săptămâni (GINA, 2023).
Criteriile specifice pentru demonstrarea variabilității funcţiei pulmonare expiratorii sunt documentate cu ajutorul testelor de evaluare a funcţiei pulmonare şi includ (tabelele 1 şi 2; GINA, 2023; Stanojevic et al., 2022):

- Spirometria, prima etapă recomandată pentru confirmarea diagnosticului de astm, cu identificarea obstrucţiei căilor respiratorii şi a severităţii sale.
- Testul de reversibilitate la BD, la pacienţii cu suspiciune de astm şi obstrucţie bronşică confirmată spirometric (VEMS < 80% din VEMS prezis).
- Testarea variabilității PEF (PEF-metria):
- în lipsa disponibilității altor teste funcţionale pulmonare (spirometria, testul de provocare bronşică)
- test funcţional suplimentar în cazul confirmării HRB prin testul de provocare bronşică, în scopul monitorizării variabilității fluxului de aer peste intervalul normal < 8% a PEF-ului (Gallucci et al., 2019).
- Testul de provocare bronşică, la pacienţii cu simptome de astm şi spirometrie normală sau cu VEMS de bază >7 0% din VEMS prezis şi/sau valoare normală a PEF la examinarea inițială, cu demonstrarea hiperreactivității bronşice.
Spirometria
Caracteristica funcţională a astmului este reprezentată de obstrucţia reversibilă a căilor respiratorii şi documentarea acesteia este esenţială în diagnosticul bolii. Spirometria este principalul test pentru detectarea şi măsurarea obstrucţiei la adulţi şi la copiii de peste 5 ani (GINA, 2023; Stanojevic et al., 2022; Chowdhury et al., 2021). Dintre parametrii obţinuţi prin spirometrie, VEMS este cel mai fiabil indice funcţional, util în determinarea severităţii obstrucţiei pulmonare. Scăderea VEMS poate fi întâlnită în multe alte boli bronhopulmonare (sau în cazul unei tehnici spirometrice deficitare), dar un raport VEMS/CVF redus indică o limitare a fluxului expirator de aer. Obstrucţia bronşică este definită prin scăderea raportului VEMS/CVF sub limita inferioară a normalului; scăderea sub 0,7 este considerată definitorie pentru obstrucţia bronşică, deşi poate subestima obstrucţia la pacienţii mai tineri. Severitatea obstrucţiei este un factor de risc cunoscut pentru exacerbări, prin urmare monitorizarea funcţională este esenţială pentru a obține un control optim. Obstrucţia nu se corelează întotdeauna cu prezența sau cu intensitatea simptomelor. Severitatea obstrucţiei este determinată de valoarea VEMS exprimată procentual din valoarea prezisă (GINA, 2023; Gallucci et al., 2019):
- Uşoară: VEMS între 70% şi 79% din VEMS prezis
- Moderată: VEMS între 60% şi 69% din VEMS prezis
- Moderat-severă: VEMS între 50% şi 59% din VEMS prezis
- Severă: VEMS între 35% şi 49% din VEMS prezis
- Foarte severă: VEMS < 35% din VEMS prezis.
Severitatea obstrucţiei este un factor de risc cunoscut pentru exacerbări, prin urmare monitorizarea funcţională este esenţială pentru a obține un control optim, însă aceasta nu se corelează întotdeauna cu simptomele, astfel că o obstrucţie bronşică semnificativă poate fi prezentă şi la pacienţii asimptomatici (GINA, 2023, Stanojevic et al., 2022; Gallucci et al., 2019).
Scăderea VEMS-ului poate fi întâlnită în multe alte afecțiuni pulmonare (sau în cazul unei tehnici spirometrice deficitare), dar un raport scăzut VEMS/CVF, în comparație cu limita inferioară a normalului, indică o limitare a fluxului expirator de aer.
Testul de reversibilitate la bronhodilatator
După confirmarea spirometrică a obstrucţiei bronşice, reversibilitatea acesteia după administrarea unui bronhodilatator sau a unui corticosteroid este caracteristică astmului.
Variația limitării fluxului de aer este în general evaluată prin variația VEMS sau PEF:
- Variabilitatea se referă la îmbunătățirea şi/sau deteriorarea simptomelor şi a funcţiei pulmonare. Variabilitatea excesivă poate fi identificată pe parcursul unei zile (variabilitate diurnă), de la o zi la alta, de la o vizită la alta, sezonier sau printr-un test de reversibilitate.
- Reversibilitatea (numită actualmente responsivitate) se referă în general la rapiditatea îmbunătățirii VEMS-ului (sau a debitului expirator de vârf PEF), cu măsurarea modificărilor la 10-15 minute după inhalarea unui bronhodilatator cu acțiune rapidă, precum salbutamol (albuterol) 200-400 mcg, sau o ameliorare susținută în zile sau săptămâni după introducerea tratamentului cu CSI (GINA, 2023; Stanojevic et al., 2022).
La adulţi, un răspuns BD pozitiv este reprezentat de creşterea VEMS > 12% față de valoarea inițială şi cu > 200 ml post-BD după 10-15 minute de la administrarea inhalatorie a 200-400 mcg de salbutamol (albuterol) inhalator sau echivalent, în comparație cu valorile pre-BD. O creştere a VEMS >1 5% față de valoarea inițială şi cu 400 ml după BD este mult mai sugestivă pentru astm. La copii, răspunsul BD este pozitiv când VEMS creşte > 12% față de valoarea inițială pre-BD (GINA, 2023; Stanojevic et al., 2022). Probabilitatea unui test pozitiv creşte în cazul în care BD este întrerupt înainte de testare: BADSA ≥ 4 ore, BADLA de două ori pe zi cu 24 de ore, BADLA o dată pe zi cu 36 de ore.
Uneori, reversibilitatea după administrarea de bronhodilatator este absentă sau mică. În această situație, atitudinea va fi dictată de probabilitatea diagnosticului de astm, astfel (GINA, 2023):
- în cazul în care probabilitatea de astm este mică, se recomandă investigații pentru diagnostice alternative
- în cazul în care probabilitatea de astm este mare, se poate efectua un test terapeutic cu corticosteroid inhalator (budesonidă 200 mcg x 2/zi sau echivalent timp de 4 săptămâni) sau în obstrucţia severă în care există un grad de rezistență la CSI, cu corticosteroid oral (CSO) (prednison 30 mg/zi, timp de 7-14 zile). La adulţi, similar cu reversibilitatea după BD, creşterea VEMS > 12% şi > 400 ml față de valoarea inițială după 4 săptămâni de tratament este intens sugestivă de astm.
Testarea variabilității PEF
Determinarea variabilității PEF nu este un test de primă linie pentru diagnosticul astmului, dar poate fi utilizată în lipsa testelor funcţionale pulmonare (spirometria, testul de provocare bronşică) sau pentru evaluarea pacienţilor cu suspiciune de astm ocupațional (GINA, 2023; Louis et al., 2022; Gallucci et al., 2019). Totodată, poate fi utilizat ca test funcţional suplimentar în cazurile de diagnostic incert după o spirometrie inițială cu parametrii în limite normale sau de tip obstructiv sau în caz de obstrucţie ireversibilă a căilor respiratorii (test de reversibilitate la BD negativ) şi un nivel de FeNO ≥ 35 ppb, în scopul monitorizării variabilității fluxului de aer (GINA, 2023; Stanojevic et al., 2022; Kuruvilla et al., 2019). Este o metodă efort-dependentă şi necesită o bună cooperare a pacientului, întrucât este mai supusă erorilor comparativ cu spirometria şi are o sensibilitate redusă. Totodată, determinarea PEF nu confirmă prezența obstrucţiei bronşice, ci doar o reducere a funcţiei pulmonare (care poate fi prezentă şi în cazul unei restricții).
Determinarea PEF constă dintr-un expir forțat după un inspir complet şi se realizează cu ajutorul peakflowmetrului.
Variabilitatea zilnică diurnă PEF (ca expresie a variabilității obstrucţiei bronşice caracteristică astmului) este calculată prin măsurători de două ori pe zi (dimineața şi seara) şi este calculată după formula (GINA, 2023):
DPEF = (PEFmax–PEFmin)/[(PEFmax+PEFmin)/2]
Pentru fiecare măsurare PEF, se utilizează cea mai mare valoare dintre cele trei măsurători. Apoi se face media pe o săptămână. Se recomandă utilizarea aceluiaşi dispozitiv de măsurare PEF (PEF-meter) de fiecare dată, deoarece PEF poate varia cu până la 20% între aparate diferite. Testul variabilității PEF este pozitiv la o valoare DPEF > 10% la adulţi şi, respectiv, DPEF > 13% la copii.
Oscilometria de impuls
Oscilometria de impuls permite măsurarea pasivă a mecanicii pulmonare, prin utilizarea undelor de sunet, generate cu ajutorul unui microfon. Undele de sunet (unde de presiune) sunt suprapuse cu respiraţia normală, iar modificările de flux şi de presiune cauzate de undele externe sunt utilizate pentru calcularea parametrilor care descriu rezistența la fluxul de aer. Undele de frecvenţă mai joasă ajung mai în profunzime, până la nivelul alveolelor, iar cele cu frecvențe înalte, doar până în căile aeriene de mari dimensiuni (Kim et al., 2020; Mandilwar et al., 2023).
Această metodă prezintă câteva avantaje față de spirometrie (Galant et al., 2024; Jat et al., 2023; Menzella et al., 2023):
- Necesită cooperare minimă din partea pacientului, putând fi efectuată cu uşurință de către pacienţii care nu pot efectua spirometrie.
- Poate diferenția obstrucţia căilor mici de obstrucţia căilor aeriene mari.
- Este mai sensibilă decât spirometria în cazul afectării căilor aeriene periferice.
- Parametrii măsurați pot detecta modificări precoce în funcţia pulmonară, mai ales la fumători, respectiv pierderea controlului bolii la pacienţii astmatici.
Testul de provocare bronşică
Testul de provocare bronşică este indicat în cazul pacienţilor cu simptome de astm şi spirometrie normală sau cu VEMS de bază > 70% din VEMS prezis şi/sau valori normale PEF la examinarea inițială, în vederea documentării hiperreactivității căilor respiratorii. O caracteristică distinctă a astmului este capacitatea crescută de răspuns a căilor respiratorii la stimulii inhalați. Evaluarea răspunsului bronşic prin teste de provocare poate fi utilă nu numai în cercetare, ci şi în practica clinică (GINA, 2023; Stanojevic et al., 2022).
Testele de provocare bronşică sunt clasificate în funcţie de modul în care musculatura netedă a căilor respiratorii este stimulată pentru a determina bronhoconstricție, astfel:
- Provocări bronşice directe cu metacolină sau histamină, care acționează direct asupra musculaturii netede bronşice. Rezultatul poate fi exprimat fie sub formă de concentrație de provocare (PC20), reprezentând concentrația de metacolină/histamină care determină o scădere a VEMS ≥ 20%, fie ca doză de provocare (PD20) – doza de metacolină administrată care determină o scădere a VEMS ≥ 20%. Un rezultat pozitiv corespunde unui PC20-M sau PC20-H < 8 mg/ml la pacienţii fără tratament cu corticosteroizi şi sub 16 mg/ml la pacienţii tratați cu CSI (GINA, 2023). În funcţie de valoarea PC20, se apreciază severitatea HRB (cu cât este mai mică valoarea PC20, cu atât HRB este mai severă):
- PC20 > 16 mg/ml – responsivitate bronşică normală
- PC20 = 4-16 mg/m – hiperreactivitate bronşică la limită (borderline)
- PC20 = 1-4 mg/ml – hiperreactivitate bronşică uşoară (test pozitiv)
- PC20 < 1 mg/ml – hiperreactivitate bronşică moderată până la severă (Coates et al., 2017).
Testul de provocare bronşică la metacolină are o sensibilitate bună pentru diagnosticul de astm la pacienţii cu suspiciune de astm şi spirometrie (aproape) normală, superioară altor metode diagnostice (variabilitatea PEF, testul bronhodilatator). În populația generală, specificitatea testului este limitată, HRB fiind prezentă şi la pacienţii cu rinită alergică, fibroză chistică, displazie bronhopulmonară şi boala pulmonară cronică obstructivă (BPOC) (GINA, 2023). Un test de provocare pozitiv poate susține diagnosticul de astm, dar numai în combinație cu alte caracteristici de bază ale bolii.
Provocări bronşice indirecte la efort fizic, hiperventilație voluntară eucapnică, manitol, adenozina 5′-monofosfat şi alergeni acționează indirect prin eliberarea locală a factorilor constrictori şi se corelează mai bine cu inflamația căilor respiratorii. Un rezultat pozitiv este reprezentat de scăderea VEMS > 15% față de valoarea inițială, fiind specific pentru astm, dar metoda este mult mai puțin sensibilă decât provocarea bronşică cu metacolină. Aceste teste pot avea rol în monitorizarea răspunsului la terapia antiinflamatoare.
Provocarea bronşică la alergeni
Provocarea bronşică (TPB) la alergeni este în principal o metodă de atestare a etiologiei alergice a astmului utilizată mai mult în cercetare, nefiind utilizată de rutină în diagnosticul astmului alergic. În unele centre specializate, TPB la alergeni este utilizată pentru (1) confirmarea sensibilizării la alergeni; (2) pentru a soluționa discrepanțele dintre istoricul clinic şi rezultatele testelor de evaluare a sensibilizării (aşa cum sunt testele cutanate şi prezența de IgE alergen-specifice); (3) analiza relației de cauzalitate dintre expunerea la alergeni ocupaționali şi simptomele pacientului, în cazul astmului profesional (GINA, 2023; Kowalski et al., 2016).
Testul de bronhoprovocare cu alergen are ca indicație investigarea capacității unui alergen de a induce un răspuns astmatic la un pacient sensibilizat la acel alergen, când istoricul nu este concludent în ceea ce priveşte relevanța clinică a sensibilizării. Această clarificare este utilă în special în cazul pacienţilor astmatici sub tratament cu CSI/BADLA care continuă să aibă simptome sugestive de astm alergic, deoarece poate ghida o abordare terapeutică diferită (de exemplu, AIT şi măsuri de evitare a alergenului) pentru a obține şi menține controlul astmului. Reactivitatea bronşică specifică la alergen a fost, de asemenea, descrisă la pacienţii cu rinită alergică locală (negativă la SPT şi la IgE serice specifice, dar cu simptome determinate de alergenul respectiv) (Gavreau et al., 2022).
În cazul alergenilor sezonieri (polenuri), testul trebuie efectuat în afara sezonului polinic. Pentru alergenii pereni, testul trebuie efectuat în momentul în care încărcătura alergenică este minimă. La pacienţii polisensibilizați, testul trebuie efectuat când pacientul nu raportează simptome (conjunctivale, nazale sau bronşice) care ar putea fi atribuite altor alergeni la care este sensibilizat (Agache et al., 2022).
Toate medicamentele utilizate pentru tratamentul astmului, precum şi antihistaminicele afectează răspunsurile bronşice şi inflamația induse de alergeni, deci acestea ar trebui întrerupte înainte de efectuarea testului, cel puțin pentru o perioadă minimă, în funcţie de toleranța pacientului la întreruperea tratamentului.
Pentru bronhoprovocarea cu alergeni se recomandă utilizarea unor extracte alergenice standardizate fabricate special pentru această investigație. De obicei, extractele sunt comercializate sub formă de pulbere liofilizată care trebuie reconstituită cu un diluant (de exemplu, soluție salină 0,9%) înainte de administrare. Extractele alergenice pentru SPT nu sunt recomandate pentru bronhoprovocarea cu alergeni, deoarece sunt glicerinate şi pot irita mucoasa respiratorie.
La pacienţi cu astm şi când se utilizează un dispozitiv dozimetric modern pentru inhalare, este sigur şi reproductibil să se înceapă cu o doză de 10 unități biologice standardizate (SBU), urmată de patru concentrații duble (doză cumulativă: 10, 30, 70, 150 şi 310 SBU). Acest protocol cu cinci doze poate fi aplicat în siguranță la pacienţii cu VEMS normal la momentul inițial, pentru a induce un răspuns astmatic precoce. În cazul în care conținutul de alergen nu este furnizat în SBU, concentrația de pornire poate fi determinată prin titrarea punctului final al SPT (diluții de 1/10000, 1/1000, 1/100, 1/10 şi 1/1). Testul se începe cu cea mai redusă concentrație care induce o papulă cu diametrul ≥ 3 mm, urmată de inhalarea unor concentrații duble sau a unor concentrații care urmează o progresie geometrică, până la 1/1. Această abordare oferă, de asemenea, garanții suplimentare de siguranță şi ar trebui să fie prioritară la pacienţii cu astm moderat-sever (Diamant et al., 2013).
Înainte de administrarea alergenului, trebuie efectuată o spirometrie de referință, urmată de o inhalare de diluant (aceeaşi soluție utilizată pentru reconstituirea extractului de alergen). O a doua spirometrie trebuie efectuată la 10 minute după terminarea inhalării. Dacă provocarea cu diluant este negativă (VEMS post-diluant este > 80% din valoarea inițială), se administrează concentrații de alergen la intervale de 12 minute, cu câte două spirometrii la 10 minute după fiecare doză consecutivă de alergen. Pentru inhalarea alergenului se pot utiliza atât respirațiile de repaus (de exemplu, respirații timp de 2 minute/doză de alergen), cât şi dozimetrele cu respirații numărate (Frølund et al., 1987).
Criteriu de pozitivitate: apariția răspunsului astmatic precoce. Acesta se defineşte ca o scădere a VEMS ≥ 20% în comparație cu valoarea prealergen post-diluant, care apare până la 3 ore după inhalarea alergenului. Acesta apare, de obicei, în decurs de 10 minute, atinge un maxim între 10 şi 30 de minute şi se remite în decurs de 2 ore după inhalarea alergenului (Agache et al., 2022).
Unii pacienţi alergici dezvoltă, de asemenea, o scădere ulterioară a VEMS, care este determinată de fenomene inflamatorii (recrutarea şi activarea ILC2, a limfocitelor Th2, a limfocitelor B şi a eozinofilelor), alături de activarea epiteliului bronşic. Acesta este răspunsul astmatic tardiv, care se defineşte prin scăderea VEMS ≥ 15% în comparație cu valoarea prealergen post-diluant. Frecvența răspunsului astmatic tardiv este specifică alergenului şi variază de la 15% pentru alergenele sezoniere la 85-90% pentru acarienii din praful de casă. Răspunsul astmatic tardiv atinge, de obicei, un vârf la şapte ore după inhalarea alergenului, iar scăderea VEMS poate fi mai profundă decât în timpul răspunsului timpuriu. Apariția răspunsului astmatic tardiv nu reprezintă criteriu de pozitivitate (Stenberg et al., 2017; Agache et al., 2022).
Provocarea bronşică la aspirină
Provocarea bronşică cu o formă solubilă de aspirină (lizină – aspirină; L-ASA) este utilizată pentru a confirma antecedentele de reacții de hipersensibilitate induse de aspirină sau alte AINS la pacienţii cu boală respiratorie cronică subiacentă (astm/rinosinuzită/polipoză nazală) şi care se manifestă în primul rând cu obstrucţie bronşică, dispnee şi congestie nazală/rinoree. Este o alternativă la testul de provocare cu aspirină orală, care reprezintă standardul de aur pentru diagnostic, dar cu risc crescut de reacție sistemică.
Concentrațiile crescânde de L-ASA sunt administrate printr-un nebulizator cu jet controlat cu dozimetru, la intervale de 30 de minute şi cu măsurarea VEMS la 10, 20 şi 30 de minute după fiecare doză. Testul de provocare la L-ASA este considerat pozitiv la o scădere a VEMS cu cel puțin 20% în comparație cu valoarea inițială postsalină. De asemenea, există provocări de inhalare diagnostice cu alte AINS (indometacină, sulpirină, ketoprofen) (Kowalski et al., 2016).
TPB la L-ASA este mai rapid de efectuat decât testul oral, dar este mai puțin sensibil, iar rezultatul negativ al testării nu exclude hipersensibilitatea indusă de AINS. Valoarea diagnostică a testului de provocare la L-ASA a fost documentată numai la pacienţii cu antecedente de hipersensibilitate de tip respirator la aspirină/AINS – boala respiratorie exacerbată de aspirină (AERD) sau boala respiratorie exacerbată de AINS (NERD) – şi este considerată specifică, reproductibilă şi în general sigură pentru confirmarea NERD.
Deşi este asociată cu un anumit risc de reacții mai severe, provocarea bronşică la aspirină este în general considerată un instrument de diagnostic sigur, sensibil, specific şi fiabil pentru confirmarea atât a AERD, cât şi a NERD (Williams et al., 2016).
Recomandările internaționale cu privire la siguranța efectuării testului de provocare bronşică la aspirină sunt:
- efectuarea provocării bronşice întru-un cadru spitalicesc sau în ambulatoriu
- medicul este responsabil pentru supravegherea procedurii de provocare, care poate fi efectuată de o asistentă
- disponibilitatea echipamentului de urgență obligatoriu
- disponibilitatea personalului de urgență în 30 de minute.
Nu este necesar tratamentul preventiv, dar este esenţială ameliorarea imediată a simptomelor de reacție pozitivă cu β2-agonist cu acțiune de scurtă durată prin administrarea inhalatorie sau nebulizare (de exemplu, 2,5-5 mg salbutamol). În cazul reacțiilor mai severe se administrează corticosteroizi orali/i.v. sau epinefrină.
Pacientul trebuie să rămână sub observație în cabinet/spital timp de cel puțin o oră după terminarea unei provocări la aspirină. Este necesară îmbunătățirea valorii VEMS la 10% din valoarea de bază de dinaintea testării, înaintea plecării din spital. Pacientului trebuie să i se pună la dispoziție un PEF-metru, cu înregistrarea valorilor PEF înainte de a părăsi spitalul şi la fiecare 2-3 ore până seara târziu. În cazul apariției oricăror simptome respiratorii şi al unei scăderi a PEF de 20%, pacientul trebuie să îşi administreze un β2-agonist cu acțiune de scurtă durată şi să contacteze centrul (Izquierdo-Domínguez et al., 2019).
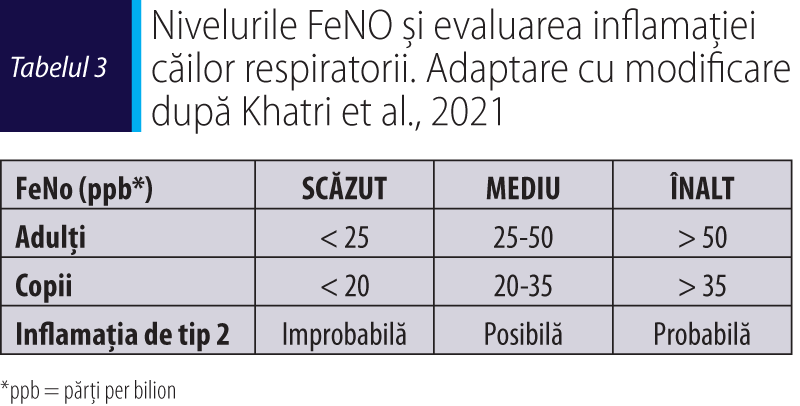
Determinarea fracției de oxid nitric în aerul exhalat (FeNO)
FeNO este produs de celulele epiteliale din căile respiratorii ca urmare a stimulării de către citokinele IL-4 şi IL-13 şi defineşte endotipul inflamator de tip T2 de astm.
FeNO este un test complementar, util în documentarea inflamației eozinofilice a căilor respiratorii cauzate de expunerea la alergene sau alți triggeri, cu valori considerate crescute de la FeNO > 25 ppb. Cu cât valoarea FeNO este mai mare, cu atât probabilitatea prezenței inflamației de tip 2 este mai mare. Conform ghidului ATS, inflamația de tip 2 este asociată cu valori ale FeNO > 50 ppb la adulţi, respectiv FeNO >3 5 ppb la copii (tabelul 3) (GINA, 2023; Louis et al., 2022; Stanojevic et al., 2022; Khatri et al., 2021).
Valori ale FeNO pot fi crescute în astm, dar şi în alte afecțiuni nonastmatice (de exemplu, bronşită eozinofilică, atopie, rinită alergică, eczeme), iar FeNO scăzut este întâlnit în unele fenotipuri de astm (de exemplu, astmul neutrofilic), la fumători, în bronhoconstricție şi în fazele imediate ale răspunsului alergic sau un FeNO crescut/scăzut în timpul infecțiilor respiratorii virale.
Concluzii
Probele funcţionale respiratorii reprezintă un instrument esenţial în diagnosticarea şi monitorizarea astmului. Aceste teste oferă o perspectivă detaliată asupra funcţionării plămânilor, permițând medicilor să evalueze severitatea astmului, să identifice tiparele de obstrucţie a căilor respiratorii şi să monitorizeze răspunsul la tratament. Prin spirometrie, teste de provocare bronşică şi alte teste specifice, clinicienii pot personaliza planurile de tratament, optimizând controlul astmului şi calitatea vieții pacienţilor. Mai mult, aceste probe contribuie la o mai bună înțelegere a mecanismelor subiacente astmului, facilitând identificarea factorilor declanşatori şi a comorbidităților potențiale. Prin urmare, ele nu sunt doar instrumente de diagnosticare, ci şi componente vitale în managementul pe termen lung al astmului. Pe măsură ce tehnologia avansează, se anticipează îmbunătățiri semnificative în precizia şi accesibilitatea acestor teste. Astfel, viitorul managementului astmului se anunță a fi unul în care probele funcţionale respiratorii vor juca un rol şi mai important în asigurarea unei îngrijiri personalizate şi eficiente pentru pacienţi.
Autor corespondent:
Laura Haidar
E-mail: haidar.laura@umft.ro
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Agache I, Antolin-Amerigo D, de Blay F, Boccabella C, Caruso C, Chanez P, Couto M, Covar R, Doan S, Fauquert JL, Gauvreau G, Gherasim A, Klimek L, Lemiere C, Nair P, Ojanguren I, Peden D, Perez-de-Llano L, Pfaar O, Rondon C, Rukhazde M, Sastre J, Schulze J, Silva D, Tarlo S, Toppila-Salmi S, Walusiak-Skorupa J, Zielen S, Eguiluz-Gracia I. EAACI position paper on the clinical use of the bronchial allergen challenge: Unmet needs and research priorities. Allergy. 2022 Jun;77(6):1667-1684. doi: 10.1111/all.15203.
- Chowdhury NU, Guntur VP, Newcomb DC, Wechsler ME. Sex and gender in asthma. Eur Respir Rev. 2021 Nov 17;30(162):210067. doi: 10.1183/16000617.0067-2021.
- Coates AL, Wanger J, Cockcroft DW, Culver BH; Bronchoprovocation Testing Task Force: Kai-Håkon Carlsen; Diamant Z, Gauvreau G, Hall GL, Hallstrand TS, Horvath I, de Jongh FHC, Joos G, Kaminsky DA, Laube BL, Leuppi JD, Sterk PJ. ERS technical standard on bronchial challenge testing: general considerations and performance of methacholine challenge tests. Eur Respir J. 2017 May 1;49(5):1601526. doi: 10.1183/13993003.01526-2016.
- Diamant Z, Gauvreau GM, Cockcroft DW, Boulet LP, Sterk PJ, de Jongh FH, Dahlén B, O’Byrne PM. Inhaled allergen bronchoprovocation tests. J Allergy Clin Immunol. 2013 Nov;132(5):1045-1055.e6. doi: 10.1016/j.jaci.2013.08.023.
- Emons JAM, Gerth van Wijk R. Food Allergy and Asthma: Is There a Link? Curr Treat Options Allergy. 2018;5(4):436-444. doi: 10.1007/s40521-018-0185-1.
- Frølund L, Svendsen UG, Nielsen NH, Weeke B, Madsen F. Bronchial allergen challenge: comparison between two different methods of provocation. Clin Allergy. 1987 Sep;17(5):439-48. doi: 10.1111/j.1365-2222.1987.tb02038.x.
- Galant SP, Morphew T. Adding oscillometry to spirometry in guidelines better identifies uncontrolled asthma, future exacerbations, and potential targeted therapy. Ann Allergy Asthma Immunol. 2024 Jan;132(1):21-29. doi: 10.1016/j.anai.2023.08.011.
- Gallucci M, Carbonara P, Pacilli AMG, di Palmo E, Ricci G, Nava S. Use of Symptoms Scores, Spirometry, and Other Pulmonary Function Testing for Asthma Monitoring. Front Pediatr. 2019 Mar 5;7:54. doi: 10.3389/fped.2019.00054.
- Gauvreau GM, Davis BE, Scadding G, Boulet LP, Bjermer L, Chaker A, Cockcroft DW, Dahlén B, Fokkens W, Hellings P, Lazarinis N, O’Byrne PM, Tufvesson E, Quirce S, Van Maaren M, de Jongh FH, Diamant Z. Allergen provocation tests in respiratory research: building on 50 years of experience. Eur Respir J. 2022 Aug 25;60(2):2102782. doi: 10.1183/13993003.02782-2021. .
- Global Initiative of Asthma. Global Strategy of Asthma Management and Prevention, 2023. Available from: https://ginasthma.org/reports/.
- Izquierdo-Domínguez A, Bobolea I, Doña I, Campo P, Segura C, Ortega N, González R, Delgado J, Torres MJ, Dordal MT; SEAIC Rhinoconjunctivitis Committee. Statement of the Spanish Society of Allergology and Clinical Immunology on Provocation Tests With Aspirin/Nonsteroidal Anti-inflammatory Drugs. J Investig Allergol Clin Immunol. 2020;30(1):1-13. doi: 10.18176/jiaci.0449. 1.
- Jat KR, Agarwal S. Lung Function Tests in Infants and Children. Indian J Pediatr. 2023 Aug;90(8):790-797. doi: 10.1007/s12098-023-04588-8.
- Khatri SB, Iaccarino JM, Barochia A, Soghier I, Akuthota P, Brady A, Covar RA, Debley JS, Diamant Z, Fitzpatrick AM, Kaminsky DA, Kenyon NJ, Khurana S, Lipworth BJ, McCarthy K, Peters M, Que LG, Ross KR, Schneider-Futschik EK, Sorkness CA, Hallstrand TS; American Thoracic Society Assembly on Allergy, Immunology, and Inflammation. Use of Fractional Exhaled Nitric Oxide to Guide the Treatment of Asthma: An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med. 2021 Nov 15;204(10):e97-e109. doi: 10.1164/rccm.202109-2093ST.
- Kim SR, Park KH, Son NH, Moon J, Park HJ, Kim K, Park JW, Lee JH. Application of Impulse Oscillometry in Adult Asthmatic Patients With Preserved Lung Function. Allergy Asthma Immunol Res. 2020 Sep;12(5):832-843. doi: 10.4168/aair.2020.12.5.832.
- Kowalski ML, Ansotegui I, Aberer W, Al-Ahmad M, Akdis M, Ballmer-Weber BK, Beyer K, Blanca M, Brown S, Bunnag C, Hulett AC, Castells M, Chng HH, De Blay F, Ebisawa M, Fineman S, Golden DB, Haahtela T, Kaliner M, Katelaris C, Lee BW, Makowska J, Muller U, Mullol J, Oppenheimer J, Park HS, Parkerson J, Passalacqua G, Pawankar R, Renz H, Rueff F, Sanchez-Borges M, Sastre J, Scadding G, Sicherer S, Tantilipikorn P, Tracy J, van Kempen V, Bohle B, Canonica GW, Caraballo L, Gomez M, Ito K, Jensen-Jarolim E, Larche M, Melioli G, Poulsen LK, Valenta R, Zuberbier T. Risk and safety requirements for diagnostic and therapeutic procedures in allergology: World Allergy Organization Statement. World Allergy Organ J. 2016 Oct 12;9(1):33. doi: 10.1186/s40413-016-0122-3. Erratum in: World Allergy Organ J. 2017 Jan 11;10 (1):6. .
- Kuruvilla ME, Lee FE, Lee GB. Understanding Asthma Phenotypes, Endotypes, and Mechanisms of Disease. Clin Rev Allergy Immunol. 2019 Apr;56(2):219-233. doi: 10.1007/s12016-018-8712-1.
- Louis R, Satia I, Ojanguren I, Schleich F, Bonini M, Tonia T, Rigau D, Ten Brinke A, Buhl R, Loukides S, Kocks JWH, Boulet LP, Bourdin A, Coleman C, Needham K, Thomas M, Idzko M, Papi A, Porsbjerg C, Schuermans D, Soriano JB, Usmani OS. European Respiratory Society Guidelines for the Diagnosis of Asthma in Adults. Eur Respir J. 2022 Feb 15:2101585. doi: 10.1183/13993003.01585-2021. .
- Mandilwar S, Thorve SM, Gupta V, Prabhudesai P. Role of impulse oscillometry in diagnosis and follow-up in bronchial asthma. Lung India. 2023 Jan-Feb;40(1):24-32. doi: 10.4103/lungindia.lungindia_251_22.
- Menzella F, Antonicelli L, Cottini M, Imeri G, Corsi L, Di Marco F. Oscillometry in severe asthma: the state of the art and future perspectives. Expert Rev Respir Med. 2023 Jul-Dec;17(7):563-575. doi: 10.1080/17476348.2023.2237872. 2.
- Papapostolou N, Makris M. Allergic Asthma in the Era of Personalized Medicine. J Pers Med. 2022 Jul 18;12(7):1162. doi: 10.3390/jpm12071162. .
- Stanojevic S, Kaminsky DA, Miller MR, Thompson B, Aliverti A, Barjaktarevic I, Cooper BG, Culver B, Derom E, Hall GL, Hallstrand TS, Leuppi JD, MacIntyre N, McCormack M, Rosenfeld M, Swenson ER. ERS/ATS technical standard on interpretive strategies for routine lung function tests. Eur Respir J. 2022 Jul 13;60(1):2101499. doi: 10.1183/13993003.01499-2021.
- Stenberg H, Diamant Z, Ankerst J, Bjermer L, Tufvesson E. Small airway involvement in the late allergic response in asthma. Clin Exp Allergy. 2017 Dec;47(12):1555-1565. doi: 10.1111/cea.13036.
- Williams AN. Diagnostic Evaluation in Aspirin-Exacerbated Respiratory Disease. Immunol Allergy Clin North Am. 2016 Nov;36(4):657-668. doi: 10.1016/j.iac.2016.06.003.




