The COVID-19 pandemic has proven to be a global catastrophe (from unknowns aspects related to SARS‑CoV-2 and its mutations, to the impact on public health, to its economic, social, and even political implications). In a relatively short time, major advances in the field have led to the decoding of the viral genome and modes of transmission, as well as the mechanisms of immune response to infection. Under the motto “From the secrets of longevity… nutraceuticals”, in the fifth part of the series we continue the theoretical presentation of viral pathogenesis, offering complementary some natural practical solutions, also.
Din secretele longevităţii… nutraceuticele – partea a V-a Patogeneza virală – abordări teoretice şi soluţii practice naturale
From the secrets of longevity... nutraceutics – part V. Viral pathogenesis - theoretical approaches and natural practical solutions
First published: 06 martie 2021
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.198.1.2021.4357
Abstract
Rezumat
Pandemia de COVID-19 s-a dovedit o catastrofă mondială (de la necunoscutele legate de coronavirusul SARS-CoV-2 şi mutaţiile acestuia la impactul asupra sănătăţii publice, la implicaţiile economice şi sociale, chiar şi politice). Într-un timp relativ scurt, progresele majore în domeniu au condus la decodarea genomului viral şi a modurilor de transmitere, precum şi a mecanismelor de răspuns imun la infecţie. Sub mottoul „Din secretele longevităţii… nutraceuticele”, în partea a V-a a seriei continuăm prezentarea teoretică a patogenezei virale, oferind complementar şi câteva soluţii practice naturale.
O întrebare-cheie referitoare la COVID-19 este de ce majoritatea persoanelor infectate nu dezvoltă forme severe, în timp ce altele se îmbolnăvesc critic. Ştim că această dihotomie este legată de sex, vârstă, rasă, imunosupresie şi comorbidităţi, dar multe persoane tinere şi fără comorbidităţi cedează virusului şi trebuie să ştim de ce(1).
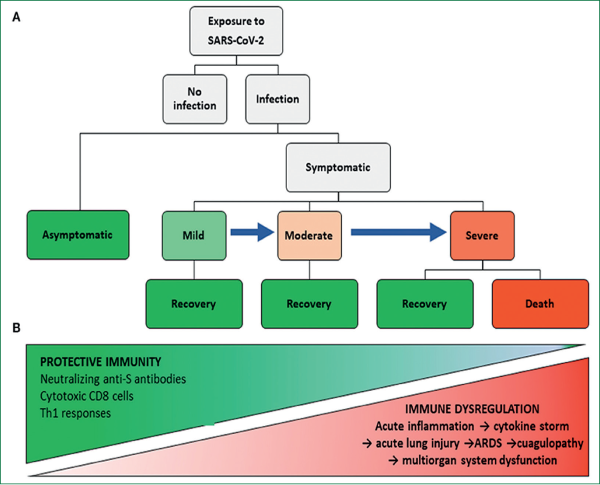
Un procent semnificativ dintre cazuri dezvoltă reacţii de apărare care nu reuşesc să elimine infecţia, ceea ce duce la sepsis, la insuficienţă multiorganică şi la moarte (figura 1)(2).
Spre deosebire de infecţiile cu SARS şi MERS, care au avut ca rezultat o morbiditate mai mare, COVID-19 se manifestă printr-un răspuns foarte variabil, bazat pe starea fiziopatologică a gazdei. Vârsta şi tulburările metabolice (obezitatea, bolile cardiovasculare – inclusiv HTA, diabetul de tip 2, bolile neurologice) sunt factori de risc majori pentru severitatea COVID-19(3).
Un factor comun asociat cu îmbătrânirea şi alţi factori de risc ai COVID-19 sunt reprezentaţi de disbioza microbiotei intestinale, când rezultă inflamaţii, cu pierderea funcţiei de barieră epitelială(4).
Obiceiurile dietetice şi cantitatea de alimente consumate modelează microbiomul. Flora microbiană specifică tractului gastrointestinal uman include bacterioide, firmicute, actinobacterii, fusobacterii, proteobacterii şi verrucomicrobiom. Dintre acestea, bacterioidele (Bacteroides, Prevotella) şi firmicutele (Eubacterii, Lactobacili) reprezintă mai mult de 90% din populaţia bacteriană din colon, ceea ce reprezintă o bună microbiotă pentru menţinerea homeostaziei. Cercetătorii francezi au analizat comportamentul populaţiilor microbiene din corpul uman pentru a verifica ipoteza că infecţia cu SARS-CoV-2 este una mixtă, atât virală, cât şi bacteriană (coronavirusul poate infecta bacteriile deja prezente în corp, iar acestea „ascund” virusul; aceste bacterii, numite Prevotella, provoacă inflamaţii care pot fi uneori fatale, inducând infecţii respiratorii acute). Această coinfecţie (bacterie cu virus) ar explica de ce, la un moment dat, acele persoane fac o formă severă, iar copiii, având o floră mai puţin reprezentată, fac forme uşoare. Cercetătorii francezi au observat o diferenţă între categoriile de persoane cu risc de îmbolnăvire şi cele care rămân sănătoase, concluzionând că s-ar putea folosi probiotice ca profilaxie şi terapie adjuvantă în lupta cu noul coronavirus (dacă ipotezele se vor confirma, atunci banalul kefir va juca un rol important în prevenirea infectării). Rezultatele studiilor realizate pe microflora din organismul uman şi pe probiotice ar putea sta la baza descoperirii tratamentului anti‑COVID-19(22).
Un studiu realizat de Li şi colab. în Wuhan a raportat un interval mediu de 9,1-12,5 zile între debutul bolii şi spitalizare. Această întârziere în evoluţia către o boală gravă sugerează că patogeneza COVID-19 implică factori specifici gazdei, ceea ce oferă o perioadă unică de oportunitate pentru intervenţie. O explicaţie posibilă este aceea că distrugerea epitelială cauzată de legarea virusului la receptorii ACE2 de pe enterocitele intestinale se adaugă la disfuncţia barierei, asociată cu comorbidităţi precum îmbătrânirea, obezitatea şi bolile de inimă(5).
Se ştie că virusurile corona au o formă variabilă, sferică sau ovoidală, diametrul de 120-160 nm, cu un înveliş extern pe care se află nişte proeminenţe glicoproteice, numite spike/spiculi (peplomere), foarte lungi (24 nm), pedunculate, cu extremităţi rotunjite, aranjate în aşa fel încât, la microscopul electronic, dau aspect de coroană solară (de unde şi denumirea de coronavirusuri). Spiculii au rolul de a se lega de receptorii celulari, favorizând infecţia celulelor susceptibile. Astfel, proteina structurală a spiculilor (glicoproteina S) este o ţintă cu rol în răspunsul imun la om. Spiculii de pe SARS-CoV-2 permit virusului să intre în celulele-gazdă prin intermediul receptorului enzimei de conversie a angiotensinei (ACE2), prezent în celulele de la nivelul plămânului(23).
Infecţia cu SARS-CoV-2 poate provoca inflamaţii excesive, cu o producţie sporită de citokine şi bradikinină, conducând la boli severe. Disbioza în intestin, nas, orofaringe şi plămâni poate iniţia şi agrava aceste procese patogene. Comorbidităţile bine cunoscute ale COVID-19 sunt toate asociate cu disbioză (figura 2).

Din cauza microbilor intestinali patogeni, sistemul imunitar induce un răspuns imun inadecvat, putându-se ajunge până la suprimarea răspunsului imun adaptativ. Există mai multe moduri în care microbiota influenţează acest proces imunopatogen(6,7,8).
La animalele cu un sistem imunitar deficitar, microbiota intestinală influenţează diseminarea agentului patogen, inflamaţia, deteriorarea organelor şi mortalitatea în pneumonia murină(7).
La polul opus, o dietă bogată în fibre stimulează dezvoltarea bacteriilor utile (saprofite) care fac ca FOXP3 (denumită şi scurfină – o proteină implicată în răspunsurile sistemului imunitar, care pare să influenţeze dezvoltarea şi funcţia celulelor T reglatoare) să inducă acizi graşi cu lanţ scurt (SCFA), care sporesc epigenetic producţia de limfocite reglatoare (celule Treg), cunoscute ca factori antiinflamatori(6).
Producţia SCFA este, de asemenea, legată de integritatea barierei intestinale. Schimbările în alimentaţie asociate îmbătrânirii pot influenţa producţia de acizi graşi cu lanţ scurt, afectând homeostazia imună şi funcţia de barieră, implicit severitatea COVID-19. De asemenea, microbiota comensală (microorganisme care există în mod natural, fără să facă rău gazdei) modulează producţia de interferon în plămâni şi s-a demonstrat că microbiota influenţează răspunsurile imune induse de TLR într-un studiu pe şoareci (furtuna de citokine)(8).
Studii recente au arătat că aproximativ 50% din populaţia generală are un răspuns al celulelor T la SARS-CoV-2, datorită reactivităţii încrucişate la virusurile comune de răceală, explicând astfel numărul mare de purtători asimptomatici ai virusului şi gradul ridicat de variaţie a severităţii COVID-19(9).
Cu toate acestea, în formele severe de COVID-19, răspunsul înnăscut, şi nu răspunsul imun adaptativ nereglat prin celulele T, este cel care duce la morbiditate şi deces. Deşi s-a demonstrat că SARS-CoV-2 infectează tractul gastrointestinal şi poate fi excretat şi transmis prin scaun, microbiomii orali, nazofaringieni şi pulmonari pot juca, de asemenea, un rol vital în accelerarea patogenezei COVID-19. În acest context, s-a demonstrat că agenţii patogeni orali induc colită în mod direct la loturile de şoareci studiate, ceea ce sugerează posibilitatea controlului la distanţă al inflamaţiei(10).
Se ştie că pierderea funcţiei de barieră epitelială la orice situs al mucoasei poate iniţia diseminarea sistemică, precum şi distrugerea la distanţă a organelor. În plus, mulţi pacienţi cu COVID-19 în stare critică primesc antibiotice şi au aportul alimentar modificat drastic, ceea ce influenţează dramatic populaţiile microbiene intestinale (microflora/microbiota). Influenţa microbiotei asupra proceselor imune în infecţia cu COVID-19 se poate evalua prin analiza metagenomică a comunităţilor nazale, orale, intestinale şi prin analiza parametrilor metabolici.
În concluzie, s-a demonstrat ştiinţific că există posibilitatea ca subiecţii cu risc neinfectaţi, dar şi persoanele infectate să poată lua măsuri care să le modifice microbiomul, reducând riscul de infectare, riscul de a dezvolta complicaţii severe ale pneumoniei COVID-19 (pe lângă alte tulburări virale), microbiota sănătoasă putând inhiba procesul inflamator excesiv şi favoriza un răspuns imun eficient.
Deci pot fi dezvoltate strategiile preventive şi de tratament naturale pentru îmbunătăţirea sănătăţii microbiomului, fiind important să apreciem influenţa potenţial pozitivă a microbiotei asupra infecţiilor cu SARS-CoV-2, existând numeroase moduri în care populaţiile microbiene pe care le posedăm pot fi modificate, implicând dieta şi suplimentele (prebiotice, probiotice, simbiotice).
Sub formă de soluţii orale (aplicate cu dop picurător sau spray) sau nazomeri (nebulizator), există deja pe piaţă noi combinaţii fitocomplexe care reduc infectarea şi replicarea virală, acţionând la nivelul porţilor naturale de intrare în organism (mucoasa nazoorală, epiteliul gastrointestinal şi cel pulmonar), cu impact pe loja/axa „intestin gros-plămân” (din medicina tradiţională chineză – MTC).
MicroARN2911 este un fragment de ARN vegetal (care se găseşte în caprifoi şi crucifere precum hreanul) care pătrunde în celulele umane, reducând simptomele asociate afecţiunilor virale. Studii recente arată că biodisponibilitatea acestui microARN vegetal creşte la prelucrarea prin decoct şi fermentare a plantelor (concentraţia compuşilor bioactivi creşte pe măsură ce ţesuturile se deteriorează)(11,12).
Caprifoiul conţine MIR2911 din clasa miRNA (nucleotide ARN necodate), care inhibă replicarea virală, constituind o soluţie terapeutică vegetală viabilă pentru prevenirea infecţiilor cu virusurile gripale A (IAV), inclusiv H1N1, H5N1, H7N9, SARS-CoV-2, herpex simplex etc.(13)
Hreanul are activitate antivirală (conţine de asemenea miRNA2911); are activitate antiinflamatorie pe macrofagele stimulate de LPS (lipopolizaharide – componente importante ale membranei externe a bacteriilor Gram-negative), iar izotiocianatul (ITC) extras din rădăcină are efect antimicrobian împotriva microorganismelor orale, fiind un antioxidant puternic(14,15,16).
Plantele din clasa Cruciferae/Brassiceae, precum broccoli, varza, conopida, muştarul şi hreanul, conţin compuşi biologic activi (glucozinolaţi) cu efecte benefice ale funcţiei de reglare în inflamaţie, răspuns la stres, activităţi antioxidante şi proprietăţi antimicrobiene directe(17,18).
6-metilsulfinilhexil izotiocianatul (MS-ITC), izolat din wasabi (Wasabia japonica, hrean domestic japonez), manifestă potenţial inhibitor al agregării plachetare umane in vitro. Induce activarea glutation S-transferazei (GST). Ca rezultat al inhibării agregării trombocitelor şi mecanismelor de inducere a GST, porţiunea izotiocianat are un important rol antiplachetar şi anticanceros datorită reactivităţii ridicate a grupărilor -SH din biomoleculele GSH. Hreanul conţine şi glucozinolaţi, compuşi care activează enzimele ce combat cancerul(17,18).
Extractele nobile (spagyric) din rădăcina de urzică, astragalus, lemn-dulce, herba de echinacea au efecte antivirale, antibacteriene, antioxidante şi imunomodulatoare (creştere limfocitară)(19,20).
Ciupercile medicinale fermentate (după modelul AHCC/Active Hexose Correlated Compound, un produs obţinut din miceliul unor ciuperci folosite în medicina tradiţională japoneză) influenţează răspunsul imunitar şi mecanismele antitumorale înnăscute (celule Natural Killer, macrofage)(24).
Colostrul bovin fermentat cu granule de kefir îmbunătăţite prin simbioză de drojdii şi bacterii, contribuie la formarea de biopeptide active cu dimensiuni extrem de mici, acţionând ca produs tribiotic (Colostrum fermentation process with improved kefir grains – OSIM nr. 1033542/22.09.2020). Exercită efecte antivirale (datorită compoziţiei sale complexe, bogată în lactoferină, imunoglobuline, factori de transfer şi factori de creştere, legându-se de receptorii ACE2, punctul de intrare în celulele umane pentru coronavirusuri, inclusiv SARS‑CoV-2), având capacitatea de a reechilibra şi modula imunitatea celulară.
Polenul poliflor fermentat aerob şi anaerob în cultură SCOBY reprezintă un produs extrem de bogat nutriţional, o sursă de proteină de calitate, cu un conţinut complex şi echilibrat de componente nutritive şi bioactive care intră în constituţia corpului uman.
Propolisul verde brazilian, cu un conţinut unic, bogat în polifenoli şi flavonoizi, contribuie la creşterea rezistenţei naturale a organismului împotriva stresului oxidativ, având un puternic efect imunomodulator (datorită acizilor fenolici), antiviral şi antibacterian.
Argintul coloidal are rol antiviral şi antibacterian natural, prin formarea unei pelicule protectoare la nivelul mucoasei nazale (principala cale de intrare a microparticulelor din aerul poluat şi a agenţilor patogeni).
Vitamina C este esenţială pentru imunitate, protejând celulele de stresul oxidativ, creşte absorbţia fierului, a vitaminei D, stimulează regenerarea formei reduse a vitaminei E şi reglează metabolismul energetic.
Vitamina D3 asigură absorbţia normală a micro şi macroelementelor cu rol în mecanismele antiinflamatoare, precum şi funcţionarea normală a sistemului imunitar la copii şi adulţi, fiind esenţială în protecţia împotriva infecţiilor respiratorii.
Administrarea diverselor combinaţii ale produselor naturale exemplificate sub formă nebulizată (nazomer) asigură menţinerea integrităţii mucoasei nazale şi favorizează hidratarea ei optimă (aspect extrem de important în simptomatologia infecţiilor virale). Aplicarea cu ajutorul pulverizatorului (spray) asigură o bună pătrundere în căile respiratorii (formulele, dacă sunt naturale, nu creează dependenţă).
Varianta de administrare ca soluţii orale (picături, spray) poate asigura modularea compoziţiei microbiotei, favorizând populaţiile bacteriene cu efecte sistemice pozitive, stimulând sistemul metabolic şi imunitar. n
Bibliografie
- García LF, Immune response, inflammation, and the clinical spectrum of COVID-19. Front Immunol. 2020;11 https://doi.org/10.3389/fimmu.2020.01441
- Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, Wu Y, Zhang L, Yu Z, Fang M, Yu T, Wang Y, Pan S, Zou X, Yuan S, Shang Y. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020. https://doi.org/10.1016/S2213-2600(20)30079-5
- Petrilli CM, Jones SA, Yang J, Rajagopalan H, O’Donnell L, Chernyak Y, Tobin KA, Cerfolio RJ, Francois F, Horwitz LI. Factors associated with hospital admission and critical illness among 5279 people with coronavirus disease 2019 in New York City: prospective cohort study. BMJ. 2020;(369: m1966) https://doi.org/10.1136/bmj.m1966
- Tilg H, Zmora N, Adolph T, Elinav E. The intestinal microbiota fuelling metabolic inflammation. Nat Rev Immunol. 2020. 40-54. https://doi.org/10.1038/s41577-019-0198-4
- Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, Ren R, Leung KSM, Lau EHY, Wong JY, Xing X, Xiang N, Wu Y, Li C, Chen Q, Li D, Liu T, Zhao J, Liu M, Tu W, Chen C, Jin L, Yang R, Wang Q, Zhou S, Wang R, Liu H, Luo Y, Liu Y, Shao G, Li H, Tao Z, Yang Y, Deng Z, Liu B, Ma Z, Zhang Y, Shi G, Lam TTY, Wu JT, Gao GF, Cowling BJ, Yang B, Leung GM, Feng Z. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. N Engl J Med. 2020. 382 1199-1207 https://doi.org/10.1056/NEJMoa2001316
- Furusawa Y, Obata Y, Fukuda S, Endo TA, Nakato G, Takahashi D, Nakanishi Y, Uetake C, Kato K, Kato T, Takahashi M, Fukuda N, Murakami S, Miyauchi E, Hino S, Atarashi K, Onawa S, Fujimura Y, Lockett T, Clarke JM, Topping DL, Tomita M, Hori S, Ohara O, Morita T, Koseki H, Kikuchi J, Honda K, Hase K, Ohno H. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature. 2013. 504: 446-450 https://doi.org/10.1038/nature12721
- Schuijt TJ, Lankelma JM, Scicluna BP, de Sousa e Melo F, Roelofs JJ, de Boer JD, Hoogendijk AJ, de Beer R, de Vos A, Belzer C, de Vos, van der Poll T, Wiersinga WJ. The gut microbiota plays a protective role in the host defence against pneumococcal pneumonia. Intestin. 2016. 65: 575-583 https://doi.org/10.1136/gutjnl-2015-309728
- Weaver LK, Minichino D, Biswas C, Chu N, Lee JJ, Bittinger K, Albeituni S, Nichols KE, Behrens EM. Microbiota-dependent signals are required to sustain TLR-mediated immune responses. JCI Insight. 2019. 4. https://doi.org/10.1172/jci.insight.124370
- Grifoni A, Weiskopf D, Ramirez SI, Mateus J, Moderbacher CR, Rawlings SA, Sutherland A, Premkumar L, Jadi RS, Marrama D, de Silva AM, Frazier A, Carlin AF, Greenbaum JA, Peters B, Krammer F, Smith DM, Crotty S, Setul A. Targets of T cell responses to SARS-CoV-2 coronavirus in humans with COVID-19 disease and unexposed individuals. Celula. 2020. 181: 1489-1501 https://doi.org/10.1016/j.cell.2020.05.015
- Kitamoto S, Nagao-Kitamoto H, Jiao Y, Gillilland III MG, Hayashi A, Imai J, Sugihara K, Miyoshi M, Brazilia JC, Kuffa P, Hill BD, Rizvi SM, Wen F, Bishu S, Inohara N, Eaton KA, Nusrat A, Lei YL, Giannobile WV, Kamada N. The intermucosal connection between the mouth and gut in commensal pathobiont-driven colitis. Celula. 2020. 182: 447-462 https://doi.org/10.1016/j.cell.2020.05.048
- Yang J, Kongchan N, Primo Planta C, Neilson JR, Hirschi KD. The atypical genesis and bioavailability of the plant-based small RNA MIR2911: bulking up while breaking down. Mol Nutr Food Res. 2017. Sep;61(9). 10.1002/mnfr.201600974, doi: 10.1002/mnfr.201600974, PMCID: PMC5583006, NIHMSID: NIHMS891224, PMID: 28319645 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5583006a
- Pribac Cingolani M, Pribac IL. The respiratory system, the microbiome and nutrition – new frontiers. Medic.ro. 2020; Dec. DOI: 10.26416/Med.138.6.2020.4000
- Zhou LK, et al. Cell Discovery. Absorbed plant MIR2911 in honeysuckle decoction inhibits SARS-CoV-2 replication and accelerates the negative conversion of infected patients. Cell Discovery https://doi.org/10.1038/s41421-020-00197-3 www.nature.com/celldisc,
- Marzocco S, Calabrone L, Adesso S, Larocca M, Franceschelli S, Autore G, Martelli G, Rossano R. Anti-inflammatory activity of horseradish (Armoracia rusticana) root extracts in LPS-stimulated macrophages. Food Funct. 2015 Dec;6 (12): 3778-88. / doi : 10.1039 / c5fo00475f. PMID: 26411988 / DOI: 10.1039 / c5fo00475f https://pubmed.ncbi.nlm.nih.gov/26411988/
- Park HW, Choi KD, Shin IS. Antimicrobial activity of isothiocyanates (ITCs) extracted from horseradish (Armoracia rusticana) root against oral microorganisms. Biocontrol Sci. 2013;18(3):163-8. DOI: 10.4265/bio.18.163
- Manuguerra S, Caccamo L, Mancuso M, Arena R, Rappazzo AC, Genovese L. The antioxidant power of horseradish, Armoracia rusticana, underlies antimicrobial and antiradical effects, exerted in vitro. Nat Prod Res. 2020 Jun;34(11):1567-1570
- Science News from research organizations (2016), Cancer-fighting properties of horseradish revealed, University of Illinois College of Agricultural, Consumer and Environmental Sciences (ACES), https://www.sciencedaily.com/releases/2016/05/160517122054.htm
- Morimitsu Y, Hayashi K, Nakagawa Y, Horio F, Uchida K, Osawa T. Antiplatelet and anticancer isothiocyanates in Japanese domestic horseradish, wasabi. Biofactors. 2000;13(1-4):271-6. / doi: 10.1002/biof.5520130141. PMID: 11237193 / 10.1002/biof.5520130141, https://pubmed.ncbi.nlm.nih.gov/11237193/, https://scholar.google.ro/scholar?q=urtica+dioica+root+antiviral&hl=en&as_sdt_vis=1&oi=scholart#d=gs_qabs&u=%23p%3D8E_cUmexa7oJ
- Esposito S, Bianco A, RussoR, Di Maro A, Isernia C, Pedone PV. Therapeutic Perspectives of Molecules from Urtica dioica Extracts for Cancer Treatment, University of Campania „Luigi Vanvitelli”. Italy, Academic Editor: Derek J. McPhee. Molecules. 2019;24(15), 2753; https://doi.org/10.3390/molecules24152753
- Şandru CD, Niculae M, Popescu S, Pastiu A. Urtica dioica alcoholic extract increases the cell-mediated innate immune potential in chickens, Industrial Crops and Products /j.indcrop. 2016.02.032, https://www.researchgate.net/publication/301316939_Urtica_dioica_alcoholic_extract_increases_the_cell-mediated_innate_immune_potential
- https://www.frontiersin.org/articles/10.3389/fimmu.2020.01441/full
- https://link.springer.com/article/10.1007/s12088-020-00908-0
- https://www.synevo.ro/imunitatea-si-sars-cov-2
- https://www.ncbi.nlm.nih.gov/books/NBK401261/
- Friedland RP, Haribabu B. The role for the metagenome in the pathogenesis of COVID-19. EBio Medicine. 2020 Nov;61:103019. doi: 10.1016/j.ebiom.2020.103019