Factorul de creștere insulin-like (IGF1), sarcina și retinopatia de prematuritate (ROP)
Insulin-like growth factor 1 (IGF1), pregnancy and retinopathy of prematurity (ROP)
Abstract
Background. Retinopathy of prematurity (ROP) is a late complication that affects the visual function of very low weight premature babies; it represents a disturbance in the retinal vascular proliferation caused by the intervention of pre- or postnatal factors on the immature retina. It is not yet known why apprroximately 90% of the cases evolves to spontaneous resolution and 10% of the cases progress to severe structural anomalies (retinal detachement) and blindness.Objective. To validate the hypothesis that nutritional status of the premature babies and blood level of insulin growth factor (IGF1) can contribute to the wide variability of this complication of prematurity.
Method. In the Neonatology Department of Bucharest University Hospital we performed a prospective 6-month study (February - July 2017) on a group of patients with gestational age of 34 weeks or below; all babies were submitted to the standard ophtalmologic examination and were also tested for blood level of IGF1. The comparison of the tests results aimed to confirm if there was a correlation between the blood level of IGF1 and the incidence or gravity of ROP.
Results. Serum values of IGF1 at birth and in the first week of life correlate with the nutritional status of the newborn, but do not correlate with the risk for developing ROP. Succesive weekly measurements showed that the values of IGF1 serum level are significantly different between patients with ROP compared with those who did not develop this complication.
Conclusion. The absolute values of serum IGF1 at any time cannot be considered predictive factors for ROP, but the failure of serum IGF1 to increase after birth and poor postnatal weight gain have proved to be correlated with higher risk. Although our study was performed on a small number of patients, due to financial and administrative constraints, we consider that it would be useful to validate its conclusions by future extended researches, involving regional or even national data.
Keywords
rethinopahy of prematurityIGF1postnatal weight gainRezumat
Context. Retinopatia de prematuritate (ROP) este o complicație tardivă oculară care survine la nou-născuții cu vârste de gestație și greutăți mici; ea constă în anomalii de dezvoltare a vascularizației retiniene cauzate de intervenția unor factori pre- și postnatali asupra retinei imature. Nu se cunoaște exact de ce în aproximativ 90% din cazuri boala apare și se vindecă spontan și de ce în restul de cazuri se produc modificări structurale grave, invalidante.Obiectiv. Validarea ipotezei că statusul nutrițional al prematurului și nivelul seric al factorului de creștere insulin-like (IGF1) reprezintă potențiali factori care contribuie la variabilitatea incidenței și gravității acestei complicații de prematuritate.
Metodă. În Secția de Neonatologie a Spitalului Universitar de Urgență București am efectuat un studiu prospectiv cu o durată de 6 luni (februarie - iulie 2017) pe un lot de pacienți format din nou-născuți cu vârsta de gestație mai mică sau egală cu 34 de săptămâni, la care, în paralel cu examinarea oftalmologică standard, am recoltat și probe de sânge pentru dozarea IGF1 seric, încercând să verificăm dacă există o legătură între valorile obținute și evoluția ROP.
Rezultate. Valorile IGF1 seric la naștere și la o săptămână de viață se corelează cu statusul nutrițional al prematurului, dar nu cu riscul de ROP. Măsurătorile săptămânale ulterioare relevă o diferență de creștere a nivelului seric al IGF1 între prematurii cu ROP și cei fără ROP.
Concluzii. Valorile absolute ale IGF1 nu pot fi interpretate ca predictive pentru riscul de apariție a ROP, dar modificările în dinamică, în paralel cu rata mai scăzută a creșterii ponderale, ar trebui să fie luate în considerare. Deși studiul nostru a fost realizat pe un lot limitat de pacienți, din cauza constrângerilor administrative și financiare, concluziile obținute merită a fi validate printr-o cercetare extinsă, pe o perioadă mai lungă, eventual multicentrică, regională sau chiar națională.
Cuvinte Cheie
retinopatie de prematuritateIGF1creștere ponderală postnatalăIntroducere
Retinopatia de prematuritate (ROP) este o afecțiune vasculară proliferativă, multifactorială, ce afectează nou-născuții cu vârste de gestație și greutăți mici; ea reprezintă o perturbare a dezvoltării vascularizației retiniene, care este incompletă la naștere și se definitivează postnatal, prin extensia vaselor sangvine dinspre discul optic spre periferie. Acest proces suferă interferența unor factori interni și externi mai mult sau mai puțin cunoscuți. Ca urmare, rezultă grade diferite de boală, de la prezența unor modificări retiniene periferice tranzitorii (absența vascularizației sau existența de vase de neoformație tortuoase) până la dezorganizări structurale retiniene (dezlipire de retină) și cecitate.
Clasic, această complicație este asociată cu vârsta de gestație și greutatea mică la naștere, dar, recent, s-a descoperit că și nou-născuții cu retard de creștere intrauterină (RCIU), independent de vârsta de gestație și greutate, au risc de a dezvolta această complicație(1,2,3,4).
Teorii fiziopatologice
Există două teorii fiziopatologice care explică apariția ROP, ce se completează reciproc. Teoria clasică are la bază variația oxigenării tisulare în perioada perinatală și presupune existența a două faze succesive: faza I - hiperoxică, survenită imediat postnatal, și faza a II-a - hipoxică, care generează, de fapt, leziunile morfopatologice clasice.
Consecutiv faptului că în mediul intrauterin presiunea parțială a oxigenului în vasele ombilicale este sub 50 mmHg(5), nașterea prematură înseamnă expunerea nou-născutului la concentrații mai mari de oxigen (majoritatea acestor copii primesc oxigenoterapie). Hiperoxia relativă indusă de mediul extrauterin determină supresia secreției de factor de creștere vascular endotelial (VEGF) și a eritropoietinei și generează oprirea vascularizației retiniene (faza I). În evoluție, necesitățile metabolice ale organismului nou-născutului încep să crească și, în condiții de vascularizație insuficientă, generează o hipoxie locală(6). Se stimulează astfel producția endogenă de VEGF și eritropoietină și se inițiază o proliferare vasculară și o neovascularizație retiniană, ce reprezintă, de fapt, reversul fazei I(5). Din cauza condițiilor diferite ale mediului extrauterin comparativ cu cel intrauterin, acest proces se desfășoară aberant, rezultând vase de sânge voluminoase, tortuoase, ce formează o creastă vasculară, vizibilă la examinarea oftalmologică, ce pune diagnosticul de boală. Aceste vase de neoformație pot prezenta și deficiențe de endoteliu, ce permit extravazarea sângelui și formarea de cicatrice fibroase care tracționează retina și conduc la detașarea acesteia în stadiile avansate(5).
Trecerea de la faza I la faza a II-a are loc independent de vârsta de gestație la naștere, în jurul vârstei postconcepționale de 32-37 de săptămâni, cu un vârf la 34-36 de săptămâni de gestație(5); trecerea de la o fază la alta nu se face brusc, ci printr-o perioadă de tranziție, în care probabil alternează hipoxia cu hiperoxia, modificări care pot fi foarte semnificative și importante pentru evoluția ROP. Cu cât nou-născutul este mai bolnav, cu atât mai greu de delimitat sunt cele două faze și oxigenarea mai variabilă(6).
O ipoteză fiziopatologică mai nouă statuează rolul factorului de creștere insulin-like (IGF-1) în determinismul ROP. IGF1 este un hormon anabolizant, implicat în stimularea proliferării celulare, protecția mitocondrială, creșterea și diferențierea tisulară, cu rol antiinflamator, antioxidant, antifibrinogenic și vasodilatator. El joacă un rol important în procesul creșterii fetale și placentare, dar și a nou-născutului. În organismul uman, acest hormon este secretat majoritar de către ficat (aproximativ 75%), sub acțiunea hormonului de creștere, dar, practic, orice țesut este capabil să secrete IGF1 ca secreție autocrină sau paracrină(7). În ochi, ARNm pentru IGF1 a fost identificat în sclera și corneea feților avortați încă din săptămânile 16-20 de gestație(8). Pe timpul gestației, placenta este cea mai importantă sursă de IGF1(7).
Nașterea prematură generează scăderea bruscă a nivelului seric al factorului de creștere insulin-like IGF1 din cauza pierderii sursei materne și a producției endogene insuficiente. Alterarea nivelului seric al IGF1 (factor de creștere somatic) la prematur se asociază cu deficitul de factor de creștere vasculo-endotelial (VEGF), ambele necesare pentru dezvoltarea normală a vascularizației retiniene; IGF1 pare că are și rol permisiv pentru acțiunea VEGF la nivelul retinei. Din acest motiv, scăderea nivelului seric de IGF1 obstrucționează dezvoltarea normală a vascularizației retinei, generează hipoxie locală și acumulare de VEGF, în timp ce nevoile metabolice ale retinei în curs de dezvoltare cresc. Cu timpul, producția endogenă de IGF1 crește, permițând intervenția VEGF și creșterea vasculară retiniană(6).
De cele mai multe ori, prematurul este supus unor multiple dezechilibre în mediul extrauterin: hipotermie, hipoxie, hipotensiune, dezechilibre hidoelectrolitice, anemie, infecții, intoleranță alimentară etc., toate acestea influențând procesele metabolice și endocrine și, consecutiv, dezvoltarea vascularizaței retiniene. Cel mai frecvent incriminați factori de risc pentru apariția ROP sunt considerați oxigenoterapia prelungită, hemoragia intraventriculară, anemia și necesarul de transfuzii, enterocolita ulceronecrotică, sepsisul neonatal. Cu excepția oxigenoterapiei, majoritatea acestor condiții acționează printr-un mecanism fiziopatologic comun, reprezentat de reducerea nivelului seric al IGF1(9,10).
În afară de prematuri, deficitul de IGF1 este semnalat și la nou-născuții cu restricție de creștere intrauterină (RCIU), niveluri scăzute de insulină, IGF1, IGF2 și proteine care leagă IGF (IGFBP3) fiind demonstrate la nou-născuții proveniți din sarcini cu disfuncție placentară(7). Ca o consecință, există și nou-născuți cu vârstă de gestație mai mare, dar cu greutate mică la naștere, susceptibili de a dezvolta ROP. În studiile noastre anterioare am demonstrat o corelație mai bună a incidenței ROP cu greutatea decât cu vârsta gestațională(11). Dacă greutatea mică în sine sau suferința cronică intrauterină sunt determinante pentru nivelul seric scăzut al IGF1, și riscul de apariție al ROP rămâne de investigat.
Consecințe clinico-evolutive
ale deficitului de IGF1
Așa cum am precizat, IGF1 are mai multe efecte, împărțite în două mari categorii: efecte acute metabolice și efecte pe termen lung. Efectele pe termen scurt sunt similare cu cele ale insulinei și se referă la modificările metabolismului glucidic și proteic, cu scopul producerii rezervelor de energie, în timp ce efectele pe termen lung vizează creșterea, diferențierea și proliferarea celulară. La nivelul creierului nou-născutului, IGF1 este un factor neurotrofic și neuroprotector care modulează permeabilitatea barierei hemato-encefalice(7). Retina, ca parte a sistemului nervos central, este profund influențată și ea de variațiile hormonale și metabolice.
Consecințele deficitului de IGF1 la nou-născut se referă la greutate și statură mică, dar și la afectări neurologice tardive, cum ar fi: tulburări de comportament, patternuri de somn anormale, incapacitatea de fixare vizuală, hiperactivitate, tulburări motorii. S-a observat că nou-născuții prematuri și cu RCIU au un risc crescut de a dezvolta paralizie cerebrală(7).
Analiza urmăririi pe termen lung a nou-născuților cu greutate mică la naștere a demonstrat că deficitul ponderal la nou-născut, în special din cauza unei restricții de creștere intrauterină, este responsabil pentru afectări tardive neurologice, structurale și funcționale. Mecanismul prin care structurile nervoase, printre care și retina, sunt afectate se pare că ar consta într-un răspuns inflamator exacerbat și persistent la copiii cu suferință cronică intrauterină(12,13,14).
Studii medicale din ultimii ani au încercat să demonstreze că există o relație invers proporțională între ritmul de creștere ponderală postnatală a nou-născutului prematur sau cu greutate mică la naștere și riscul său de a dezvolta complicații, inclusiv retinopatie de prematuritate. Substratul acestei interacțiuni ar fi creșterea nivelului seric al IGF1, paralel cu aportul nutritiv și sporul ponderal. Ca o consecință, creșterea ponderală postnatală rapidă ar fi considerată un factor benefic, protector, iar evaluarea periodică a curbelor de creștere ar putea fi utilizată în scop predictiv pentru aprecierea riscului de a devolta ROP(15). O echipă de cercetători din Suedia a calculat că sensibilitatea unei astfel de metode poate fi de aproximativ 95% și pledează pentru înregistrarea creșterii ponderale postnatale și pentru utilizarea acesteia ca modalitate de screening, cu scopul de a reduce numărul examinărilor oftalmologice la prematurii cu risc de ROP(16,17).
Strategii medicale
Aceste ipoteze au suscitat interesul neonatologilor și pediatrilor din întreaga lume privind strategia nutrițională pentru nou-născuții prematuri sau cu RCIU. Protocoalele de îngrijire actuale vizează o recuperare rapidă în greutate și implicit o rație alimentară hipercalorică postnatal, cu beneficii pe termen imediat și cu mai puține complicații pe termen lung.
Există teorii care arată că originea bolilor adultului s-ar afla în copilăria foarte mică; mai mult, interacțiunea dintre genomul fetal și mediul intrauterin ar conduce la o programare fetală, reprezentată de apariția unor mecanisme adaptative ce înlesnesc pe termen scurt supraviețuirea, dar care se permanentizează și vor continua să acționeze și în perioada postnatală, realizând o predispoziție spre anumite afecțiuni, cum este diabetul de tip 2 sau bolile cardiovasculare(7,18,19). Nou-născutul cu RCIU, de exemplu, schimbă mediul intrauterin, cu resurse puține, cu mediul extrauterin, unde aportul alimentar este crescut; în condițiile unei funcții a insulinei alterate rezultă o creștere accelerată și excesivă care generează o probabilitate crescută de apariție a unor fenomene epigenetice, a căror consecință pe termen lung o reprezintă boala pulmonară cronică, diabetul, afecțiunile cardiace etc.(18,19) Deprivarea cronică intrauterină determină la nou-născuții cu RCIU o programare genetică discordantă cu condițiile mediului extern, impunând un efort deosebit pentru o nouă adaptare, care să modifice direcția de dezvoltare indusă intrauterin (programare perinatală)(19). Încercările postnatale de a anula consecințele programării fetale - de exemplu, recuperarea ponderală forțată - pot genera premise pentru dezvoltarea sindromului metabolic în perioada de adult(7,19).
De aceea, este extrem de important pentru medicul neonatolog să acționeze prin strategiile terapeutice și nutriționale echilibrate, în concordanță cu nevoile personalizate ale nou-născuților, astfel încât să nu fie perturbate mecanismele adaptative perinatale, cu consecințe nefaste mai târziu în viață. Dieta nou-născuților cu greutate mică la naștere trebuie să fie diferită, în funcție de vârsta de gestație, echilibrată din punct de vedere caloric și mai ales nutritiv, tinzând nu spre o creștere rapidă în greutate, ci spre o corectare lentă, cât mai puțin agresivă, a deficitelor din viața intrauterină.
Cea mai bună soluție ar fi prevenirea pe cât posibil a prematurității și a RCIU printr-o cât mai atentă supraveghere a sarcinii, a eliminării condițiilor favorizante (materne, fetale, placentare) și, acolo unde este cazul, o abordare multidisciplinară a sarcinilor cu risc.
Cercetarea noastră
Metodologie. În Secția de Neonatologie a Spitalului Universitar de Urgență București am efectuat un studiu prospectiv, cu o durată de 6 luni (februarie - iulie 2017), pe un eșantion format din 50 de nou-născuți prematuri, cu vârstă de gestație egală sau mai mică de 34 de săptămâni, la care s-au recoltat probe de sânge pentru determinarea valorii serice a factorului de creștere insulin-like (IGF1); măsurătorile au fost realizate în dinamică, la naștere, apoi la intervale săptămânale, până la momentul primului consult oftalmologic cu valoare diagnostică (de obicei, acesta are loc la aproximativ o lună de viață).
Un criteriu de includere suplimentar față de vârsta de gestație au fost durata de spitalizare, estimată de 3-4 săptămâni, pentru a putea participa la toate etapele de diagnostic prevăzute de studiul nostru, precum și acordul parental pozitiv. În mod evident, nou-născuții prematuri care au decedat până la acest moment au fost excluși din studiu, la fel ca și cazurile în care nu am obținut acordul parental. Probele de sânge au fost prelevate în aceleași condiții, transportate și lucrate la același laborator. Examinările oftalmologice au fost făcute de către același medic specialist oftalmolog, care nu a cunoscut rezultatele investigațiilor de laborator anterioare.
Pentru acest studiu, de mai mică anvergură, nu am luat în considerare alți factori de risc general acceptați pentru apariția ROP, ci ne-am focalizat asupra modelului de creștere, atât antenatal, cât și postnatal, încercând să analizăm cât de mult au cântărit acestea în apariția ROP.
Rezultate. În perioada 1.02.2017 - 31.07.2017 au fost internați în Secția de Neonatologie a Spitalului Universitar de Urgență București 85 de prematuri cu vârsta egală sau mai mică de 34 de săptămâni de gestație. Decesele au reprezentat cinci cazuri (5,8%). Dintre cei 50 de pacienți incluși în lot, 26 de nou-născuți au fost diagnosticați cu ROP la examenul oftalmologic, ceea ce corespunde unei proporții de 52%. Dintre aceștia, 14 au avut ROP1, (28%), 6 - ROP2 (12%) și 6 - ROP3 (12%) (n=50).
Repartiția pe vârste de gestație a lotului analizat este evidențiată în tabelul 1. Vârsta de gestație medie a fost de 31,04 săptămâni la pacienții fără ROP și 28,68 săptămâni la pacienții cu ROP (t=3,60, p<0,01).
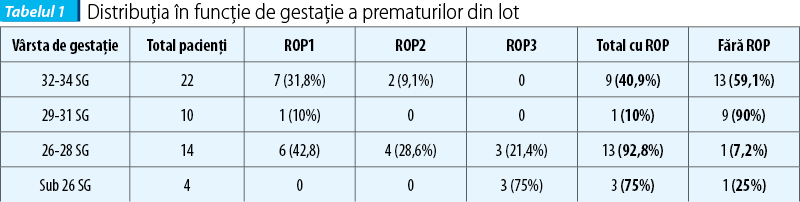
Repartiția în funcție de greutate a pacienților din lotul studiat este prezentată în tabelul 2. Greutatea medie a pacienților fără ROP a fost de 1614,58 g, iar în grupul pacienților cu ROP a fost de 1208,46 g (t=3,28, p<0,01).
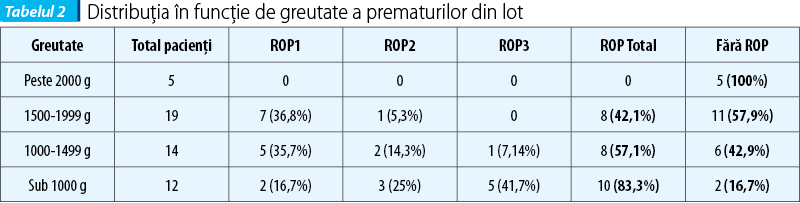
Dorind să investigăm în ce măsură sporul ponderal postnatal se corelează cu apariția ROP, am înregistrat numărul de zile după care pacienții au prezentat curbă ponderală ascendentă, cu scopul de a verifica dacă redresarea curbei ponderale a fost diferită la prematurii care nu au dezvoltat ROP, față de cei la care această complicație a apărut. Am observat că a fost nevoie de mai multe zile de viață pentru nou-născuții cu ROP pentru a realiza creștere ponderală, față de ceilalți, diferența fiind semnificativă din punct de vedere statistic (tabelul 3).
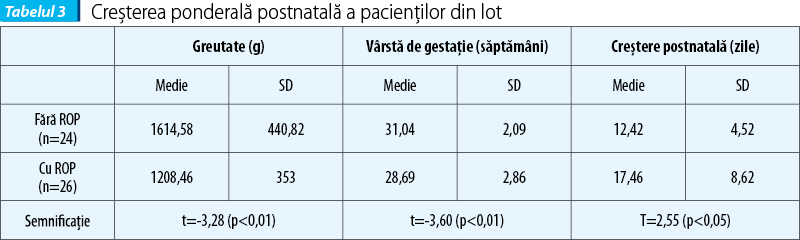
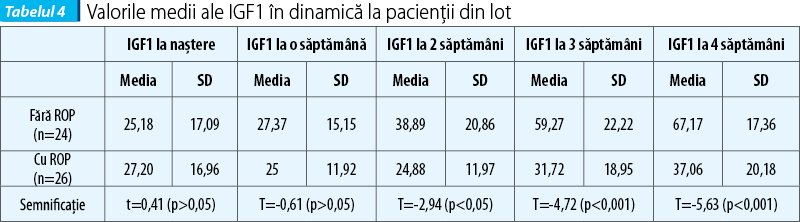
În ceea ce privește semnificația IGF1 în predicția apariției ROP, valorile obținute la determinarea nivelului seric al acestuia pentru pacienții selecționați s-au încadrat în majoritate în limite normale, raportat la referința laboratorului cu care am colaborat (11-100 ng/ml). Cele câteva valori sub limita normală nu au fost regăsite la pacienții cu formele cele mai severe de boală și nici încadrarea lor temporală nu este sistematic la fel la toți pacienții. Ceea ce am încercat în aceste condiții a fost să analizăm valorile medii săptămânale ale determinărilor și să apreciem deviațiile semnificative față de medie (tabelul 4).
Dintre cei 50 de pacienți incluși în lot, 13 (26%) au avut greutatea la naștere situată sub percentila 10 pe curbele de creștere intrauterină (raportat la datele Organizației Mondiale a Sănătății)(20), sau au fost diagnosticați antenatal cu retard de creștere intrauterină. Valoarea IGF1 seric la naștere în cazul lor a fost în 11/13 cazuri (84,6%) sub valorile medii, confirmând legătura între statusul metabolic deficitar și valoarea IGF1 la acest moment. Din punctul de vedere al predicției ROP însă, dintre cei 13 pacienți, numai 7 (53,8%) au avut ROP (4 pacienți - stadiul 1; 3 pacienți - stadiul 2), inclusiv cei doi pacienți cu valori peste medie, ceea ce face ca aceste determinări să nu fie utile ca indicatori de risc pentru complicația oculară. De asemenea, nu există concordanță între cele mai mici valori ale IGF1 la naștere, greutatea sau vârsta de gestație ori gravitatea ROP (tabelul 5).
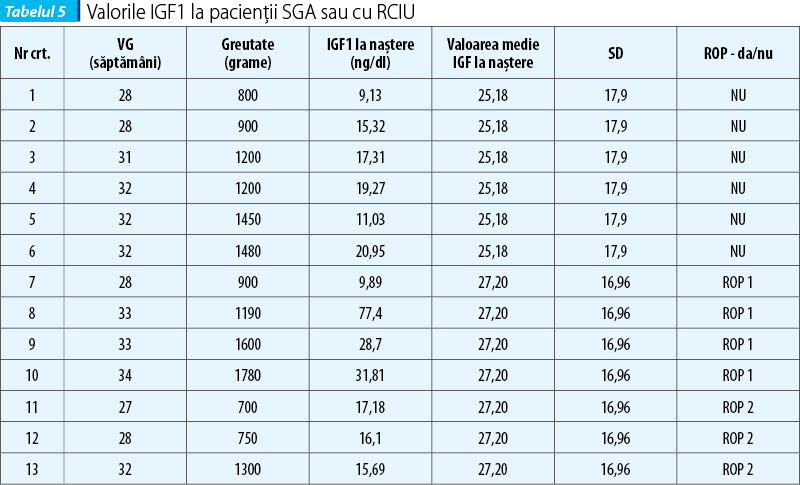
Discuții și analiza rezultatelor. Este considerat cert că factorul de creștere insulin-like (IGF1) are un rol important atât antenatal, cât și postnatal pentru creșterea somatică și cerebrală. Endocrinologii pediatri utilizează nivelul seric al IGF1 ca marker pentru aprecierea deficitelor de creștere, considerat mai stabil decât dozarea plasmatică a hormonului de creștere (GH), ce suferă variații circadiene și nu se corelează cu greutatea sau lungimea la naștere; sunt citate cazuri de copii cu nanism hipofizar (insuficiență de GH) care au avut greutate și lungime normală la naștere. IGF1 prezintă însă o accelerare constantă a secreției endogene, începând cu 33 de săptămâni de gestație, nivelul său triplându-se până la termen. Există, în general, o corelație între greutatea la naștere, lungimea și nivelul IGF1 din cordonul ombilical(21,22).
Ceea ce reiese la o primă evaluare din analiza rezultatelor studiului de față este că apariția ROP se corelează semnificativ cu vârsta de gestație și greutatea mică la naștere.
Valoarea IGF1 seric la naștere nu este strict corelată cu greutatea, însă nou-născuții cu deficit de creștere intrauterină (diagnosticat antenatal sau apreciat prin valoarea greutății situată sub percentila 10 pe curbele de creștere) au într-adevăr o valoare mai scăzută a nivelului seric al IGF1 la naștere, comparativ cu media, excepțiile putând fi datorate unei încadrări eronate a pacienților ca având RCIU, sau aparținând unor nou-născuți mici pentru vârsta de gestație (SGA) constituțional.
Există puține date privind valorile serice normale ale IGF1 la copiii sub 18 luni; analiza comparativă a unui număr mare de studii care au vizat identificarea valorilor normale ale IGF1 la naștere și la copilul cu vârsta cuprinsă între 0 și 6 luni relevă diferențe destul de mari și din cauza metodelor de diagnostic utilizate. IGF1 liber în ser reprezintă un procent mic din IGF1 total, restul fiind legat de proteine serice (IGFBP). Metodele utilizate pentru determinarea nivelului seric al IGF1 au la bază separarea din aceste legături prin diferite mecanisme (imunologice, cromatografie, extracție cu etanol), care generează o mare variabilitate a rezultatelor(21).
Și în studiul de față am întâmpinat această problemă, valorile obținute fiind în majoritate cuprinse între limitele normale ale laboratorului (11-100 ng/ml), valori probabil de la adult. A fost nevoie de o raportare a valorilor obținute față de medie, întrucât nu am avut alte referințe. Beneficiul acestei cercetări îl reprezintă și documentarea unor valori ale nivelului seric al IGF1 la nou-născuții prematuri, greu accesibile în literatura de specialitate.
Rezultatele obținute în studiul de față la dozarea nivelului seric al IGF1 la naștere și în prima săptămână de viață nu se corelează semnificativ cu riscul de apariție a ROP. Conform teoriilor fiziopatologice prezentate anterior, nivelul IGF1 seric ar trebui să fie scăzut la pacienții cu ROP în faza I (hiperoxică); această fază este greu de delimitat în timp din punct de vedere clinic, de aceea valorile mai mari pe care le-am obținut la prematurii care au dezvoltat ROP pot reflecta, de fapt, tranziția la faza a II-a fiziopatologică.
Literatura de specialitate consemnează că, spre deosebire de nou-născutul la termen, sănătos, la care IGF1 crește rapid după naștere, la prematur, nivelul său seric rămâne scăzut mult timp (până spre 44 de săptămâni postconcepțional), interferând cu diverse procese fiziologice, pe care le perturbă(2,5,9,10). Acest lucru pare să fie legat fie de rația calorică limitată, fie de o incapacitate a utilizării la maximum a aportului nutritiv de către prematuri(22). Ceea ce a relevat și studiul nostru este o diferență semnificativă statistic între valorile IGF1 la 2, 3 și 4 săptămâni, între pacienții cu ROP și cei fără ROP, ceea ce susține ipoteza menționată că, indiferent de nivelul IGF1 din cordonul ombilical (care nu s-a corelat cu riscul de ROP), valorile ulterioare reflectă evoluția postnatală a prematurului (toleranța alimentară, creșterea în greutate) și semnalează riscul de a dezvolta ROP; acest lucru sugerează că factorii postnatali influențează mai mult apariția acestei complicații comparativ cu factorii prenatali.
Analiza creșterii ponderale a pacienților incluși în lot a fost concordantă cu dinamica IGF1 în relație cu ROP, în sensul că statusul anabolic s-a dovedit un factor de protecție împotriva acestei complicații; prematurii fără ROP au avut creștere ponderală mai rapidă și niveluri serice mai mari ale IGF1 în evoluție.
Concluzii. Conform cercetării noastre, nivelul seric al IGF1 la naștere se corelează mai puțin cu vârsta de gestație și mai bine cu greutatea mică, în special cu restricția de creștere intrauterină asociată prematurității.
Valorile absolute ale IGF1 seric nu s-au dovedit a fi predictori pentru riscul de ROP, însă dinamica lui și lipsa creșterii cu vârsta sunt semnificative; această dinamică predispune la apariția mai frecventă a ROP și poate fi utilizată teoretic ca factor predictiv de risc crescut.
Ritmul de creștere ponderală postnatală este, de asemenea, corelat invers proporțional cu riscul prematurului de a face ROP și ar putea înlocui dozarea sangvină de IGF1, mai costisitoare, în estimarea acestui risc.
Însă, deoarece perioada studiului și dimensiunea lotului au fost foarte mici, aceste concluzii trebuie verificate la o scară mai mare. Până atunci, consultul oftalmologic rămâne standardul de aur pentru diagnosticul ROP.
Bibliografie
1. Kara L. Calkins, Sherin U. Devaskar, Intrauterine growth restriction, in Fanaroff Valsamakis & Martin s Neonatal-Perinatal Medicine, Diseaes of the Fetus and Infant, 10th Ed, Elsevier Saunders, 2015, 1, 16:227-235.
2. Zakaria M., Hassan M., Rafaat M., Correlation Between Serum Insulin Growth Factor I Deficiency and Occurrence of Retinopathy of Prematurity, Austral J Basic Appl Sci, 2012,6(9): 577-82.
3. Bardin C., Zelkowitz P., Papageorgiou A. Outcome of small for gestational age and appropriate for gestational ageinfants born before 27 weeks of gestation. Pediatrics, 1997,100(2):E4.
4. Rădulescu L., Munteanu A., Munteanu O. Retinopathy of Prematurity, Ginecologia.ro, 2016;4(11):36-40.
5. Sun Y, Hellstrom A, Lois E, Smith H. Retinopathy of Prematurity. In: Fanaroff Valsamakis & Martin`s Neonatal-Perinatal Medicine, Diseaes of the Fetus and Infant, 10th Ed, Elsevier Saunders, 2015, 2, 104:1767-73.
6. Reynolds J.D. Retinopathy of Prematurity. In: Pediatric Retina, Reynolds JD, Olitzky SE, Springer, 2012;4:85-111.
7. Martin del Estal I., Garcia de la Garza R., Castilla-Cortazar Larrea I. Intrauterine Growth Retardation (IUGR), as a Novel Condition of Insulin Like Growth Factor1 (IGF-1) Defficiency, Rev Physiol, Biochem Pharmacol, 2015;170:1-35.
8. Banjac L., Bokan V. ROP and serum level of IGF1, Acta Clin Croat 2012; 51:209-13.
9. Hellstrom A., Ley D., Hanssen Pupp I., Hallberg B., Ramenghi L.A., Lofquist C., Smith L.E.H., Hard A.L. IGF1 in the clinics: Use in Retinopathy of prematurity, Growth Hormone & IGF Research 2016; 30-31:75-80.
10. Hellstrom A. et al. Postnatal serum insulin like growth factor I deficiency is associated with retinopathy of prematurity and other complications of premature birth, Pediatrics, 2003; 112(5):1016-20.
11. Dan A., Horhoianu V. Actualităţi în retinopatia de prematuritate, Ginecologia.ro, 2017;5(17):53-60.
12. Tyler C.P., Paneth N., Allred E.N., Hirtz D., Kuban K., McElrath T., O`Shea T.M., Miller C., Leviton A. Brain damage in premature newborns and maternal medication. The ELGAN study, Am J Obstet Gynecol, 2012; 207(3): 192.e1–192.e9.
13. bmc.org, ELGAN 1, Research Study Results.
14. McElrath T.F., Allred E.N., Van Marter L., Fichorova R.N., Leviton A. Perinatal systemic inflamatory responses of IUGR peterm newborn, Acta Paediatr, 2013;102 e439-42.
15. Binenbaum G., M.D., M.S.C.E., Algorithms for the Prediction of Retinopathy of Prematurity based upon Postnatal Weight Gain. Clin Perinatol. 2013;40(2):261–70.
16. Lundgren P., Stoltz Sjöström E., Domellöf M., Källen K., Holmström G., Hård A.L., Smith L.E., Löfqvist C., Hellström A., WINROP identifies severe retinopathy of prematurity at an early stage in a nation-based cohort of extremely preterm infants, PloS One, 2013;12;8(9): e73256.
17. www.winrop.com, WINROP algorithm.
18. Thorn S.R., Rozance P.J., Brown L.D., Hay W.W.Jr. The IUGR phenotype: fetal adaptation and potential implications for later life insulin-resistance and diabetes, Semin. Reprod. Med. 2011;29:225-36.
19. Dessi A., Vassilios F. Phisiopathology of intrauterine growth restriction: From classic data to metabolomics. J Matern Fetal Neonatal Med, 2012;25:13-8.
20. WHO, Weight percentiles calculator-WHO, derived from 2004-2008 WHO Global Survey on Maternal and Perinatal Health, http//:www.weight percentiles calculator who.int.
21. Hawkes C.P., Grimberg A. Measuring Growth Hormone and Insulin Growth Factor 1 in Infants: what is Normal? Pediatr Endocrinol Rev, 2013;11(2):126-46.
22. Hård A.L., Smith L.E., Hellström A. Nutrition, insulin-like growth factor-1 and retinopathy of prematurity. Semin Fetal Neonatal Med, S1744-165X(13)00007-3 10.1016/j.siny.2013.01.006.

