Malformaţiile pulmonare fetale - principii de diagnostic şi conduită terapeutică
Fetal pulmonary malformations - diagnosis and therapeutic conduct guidelines
Abstract
The most common fetal pulmonar lesions diagnosed antenatally are pulmonary sequester and congenital cystic adenomatoid malformation. They can be diagnosed by ultrasound between 18-25 weeks of gestation. They usually evolve in dimensions until 28 weeks of gestation, after which they may stagnate in size, can regress, or can increase further. The symptomatology is variable, depending on their size: small lesions can remain asymptomatic even after birth, others can lead to pulmonary hypoplasia with mediastinal shift, vena cava obstruction, impaired venous return and cardiac compression, ultimately leading to fetal hydrops. If for asymptomatic lesions we can adopt an attitude of expectation until symptoms appear, in case of symptomatic ones a close monitoring of the pregnancy and surgery in case of the appearance of the aforementioned complications are recommended.Keywords
congenital cystic adenomatoid malformation (CCAM)pulmonary sequester (PS)antenatal diagnosisRezumat
Cele mai frecvente leziuni pulmonare fetale diagnosticate antenatal sunt reprezentate de sechestrul bronhopulmonar şi malformaţia chistică adenomatoidă pulmonară. Acestea pot fi diagnosticate ecografic între 18 şi 25 de săptămâni de gestaţie. În mod uzual, ele evoluează în dimensiuni până la vârsta de 28 de săptămâni, după care pot stagna, pot involua sau îşi pot continua creşterea. Simptomatologia variază în funcţie de dimensiunea acestora: cele mici pot rămâne asimptomatice, inclusiv după naştere, altele pot duce la hipoplazie pulmonară, cu devierea mediastinului, obstrucţia venei cave, tulburări de întoarcere venoasă şi compresie cardiacă, în cele din urmă conducând la hidrops fetal. Dacă pentru leziunile asimptomatice se poate adopta o atitudine expectativă până la apariţia simptomatologiei, în cazul celor simptomatice se recomandă o monitorizare atentă a sarcinii şi intervenţie chirurgicală dacă apar complicaţiile menţionate anterior.Cuvinte Cheie
malformaţie chistică adenomatoidă pulmonarăsechestru bronhopulmonardiagnostic antenatalIntroducere
Majoritatea tumorilor pulmonare fetale sunt reprezentate de tumori benigne relativ rare, cu o incidenţă de aproximativ 1 la 15.000 de nou-născuţi vii. Acestea pot fi chistice sau solide şi includ o gamă largă de malformaţii congenitale: malformaţia chistică adenomatoidă pulmonară (MCAP), sechestrul bronhopulmonar (SBP), chistul bronhogenic, emfizemul lobar congenital şi atrezia bronşică segmentară(1).
Evoluţia naturală a unei mase pulmonare fetale este variabilă, depinzând de dimensiunea şi de tulburările fiziologice cauzate de compresia acesteia pe structurile din jur(1,2). Aceste leziuni apar între 18 şi 25 săptămâni de gestaţie şi pot creşte până la 28 de săptămâni, când pot înregistra o fază de platou, se opresc din creştere sau scad în mărime în raport cu dimensiunea totală a fătului. Un procent mare dintre acestea sunt asimptomatice în perioadele ante- şi postnatală, în schimb, un procent mic din aceste leziuni vor înregistra o creştere dramatică în raport cu limitele cavităţii toracice fetale. Acest lucru poate duce la comprimarea mediastinului, a venei cave şi a cordului, cu afectarea întoarcerii venoase, mergând până la apariţia hidropsului, a insuficienţei cardiace şi, în cele din urmă, la moartea fătului, dacă nu sunt diagnosticate şi tratate la timp.
Opţiunile de tratament includ tratamente medicale (administrarea maternă de steroizi), decompresie percutanată (toracocenteză sau şunt toracoamniotic) sau rezecţia chirurgicală deschisă a masei tumorale pulmonare fetale(2).
Sechestrul bronhopulmonar
Sechestrul bronhopulmonar (SBP) poate fi descris ca un segment pulmonar nefuncţional ce nu comunică cu arborele bronşic normal, fiind vascularizat de una sau mai multe artere aberante. Incidenţa acestuia este cuprinsă între 0,15% şi 1,8% şi ocupă locul al doilea între tumorile pulmonare congenitale(2,3) (figurile 1 şi 2).

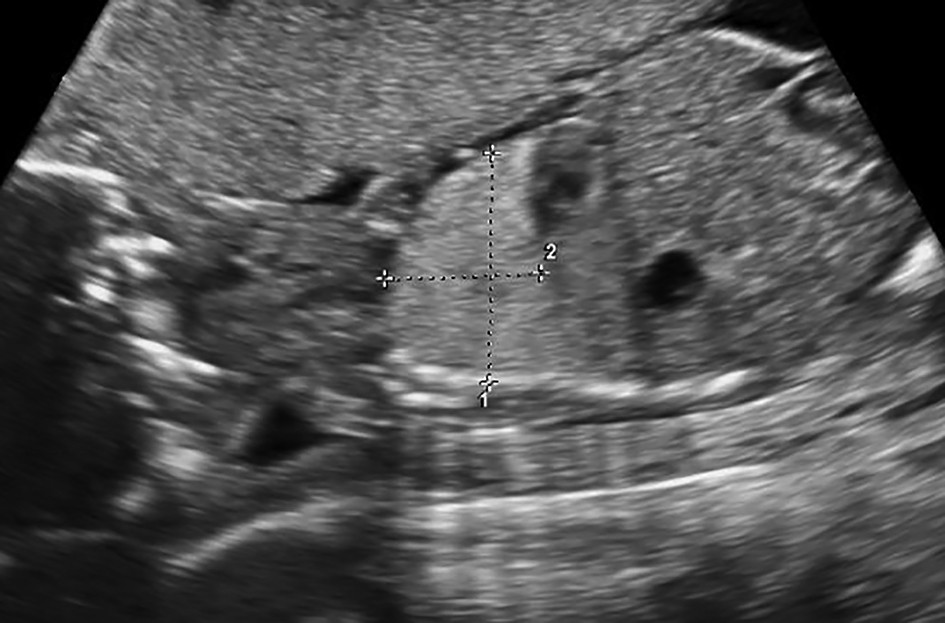
Acestea se clasifică antenatal în supra- sau infradiafragmatice, sau postnatal în extra- sau intralobare. Sechestrul extralobar reprezintă o masă tumorală în parenchimul pulmonar ce are o foiţă pleurală distinctă, menţinând o separare anatomică a acesteia de ţesutul pulmonar normal. Sechestrul intralobar reprezintă o masă tumorală adiacentă ţesutului pulmonar normal, având aceeaşi foiţă pleurală.
În literatură sunt descrise mai multe teorii în ceea ce priveşte etiologia, însă cea mai acceptată este aceea conform căreia sechestrul bronhopulmonar se dezvoltă dintr-un mugure pulmonar caudal accesor celor normali. Arborele bronşic primitiv începe să se dezvolte ca un diverticul ventral aproximativ la trei săptămâni, apoi se bifurcă în mugurele pulmonar drept şi stâng după 26 de zile. Lobii pulmonari definitivi se formează între săptămânile 5 şi 8 de gestaţie, prin urmare, SBP poate să apară între săptămânile 4 şi 8(3).
Aproximativ 60% dintre pacienţii diagnosticaţi cu SBP extralobar asociază şi alte malformaţii, precum hernie diafragmatică congenitală, hipoplazie pulmonară, malformaţie chistică adenomatoidă, emfizem lobar congenital, chist bronhogenic, pectus excavatum, defecte pericardice, truncus arteriosus, dextrocardie, anomalii ale vertebrelor sau splină accesorie(3,4).
Cel mai frecvent, apare la nivelul hemitoracelui stâng, între lobul inferior şi diafragm. 10-15% dintre acestea pot apărea şi mai jos de diafragm, fiind necesar diagnosticul diferenţial cu cel al tumorilor suprarenale(3,4,5).
În 80% din cazuri, circulaţia arterială provine din aorta abdominală sau toracică, în 15% din artere sistemice, iar în 5% din arterele pulmonare. Venele se varsă în circulaţia sistemică sau în venele pulmonare (15%), parţial sau total(5).
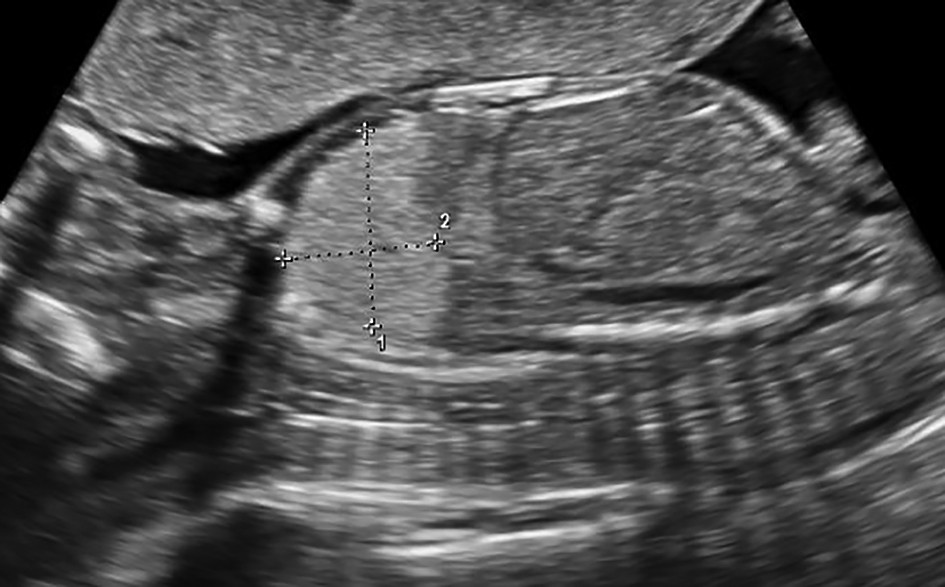
Sechestrul intralobar este mult mai frecvent decât cel extralobar şi ajunge destul de rar să fie simptomatic înainte de 2 ani. Cel mai frecvent, apare la nivelul hemitoracelui stâng, după episoade de pneumonie recurentă sau cronică; sunt anomalii izolate şi apar aproape întotdeauna la nivelul segmentului bazal medial sau posterior al lobilor pulmonari inferiori. Vascularizaţia arterială provine în 73% din cazuri din aorta descendentă, iar în 20% din cazuri din aorta abdominală. Venele se varsă direct în venele pulmonare în 95% din cazuri(5,6).
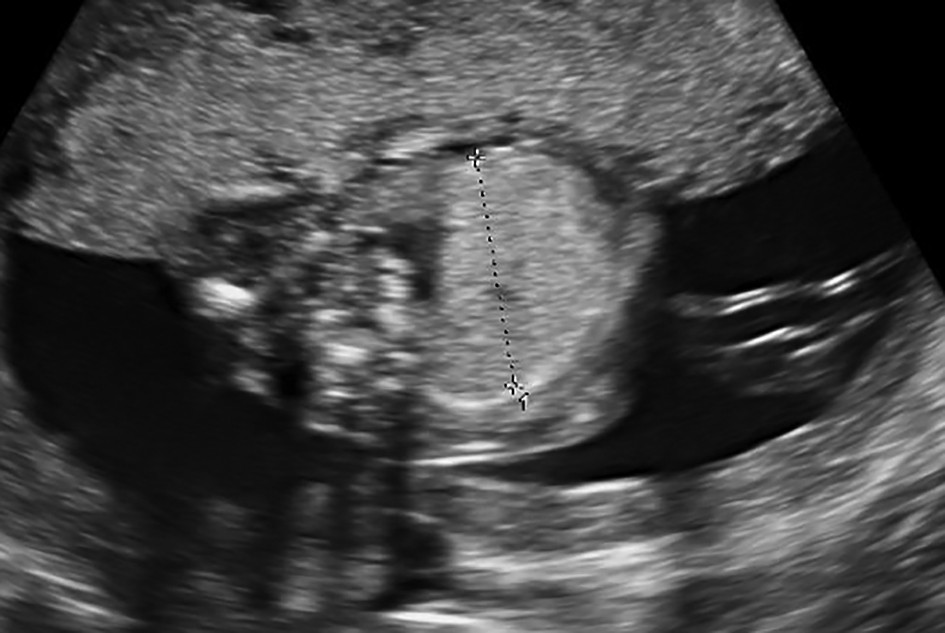
Malformaţia chistică adenomatoidă pulmonară
Malformaţia chistică adenomatoidă pulmonară (MCAP) este caracterizată prin zone multichistice de proliferare, cu dilatarea bronhiolelor respiratorii terminale şi lipsa alveolelor normale. MCAP sunt leziuni intrapulmonare care conţin diverse tipuri de celule ce menţin comunicarea cu arborele normal traheobronşic şi păstrează o circulaţie normală a sângelui. Incidenţa acestora este între 1/10.000 şi 1/35.000 de nou-născuţi vii(6).
Majoritatea MCAP se dezvoltă la nivelul hemitoracelui stâng. De cele mai multe ori, acestea sunt de mici dimensiuni şi din acest motiv există puţine date despre MCAP bilaterală. Dezvoltarea MCAP bilaterale poate avea legătură cu o problemă de semnalizarea intercelulară ce poate creşte predispoziţia spre modificarea malignă ulterioară a celulelor din cadrul MCAP sau oriunde în plămân(6,7).
În practica medicală există două tipuri de clasificări ale MCAP. Prima clasificare, după Stocker, împarte chisturile în 5 categorii, după mărime şi tipul de celularitate.
Malformaţia macrochistică adenomatoidă/tip 1 poate fi identificată antenatal sau poate apărea în copilăria timpurie sub formă de chisturi mari ce captează aerul cu devierea mediastinului, dând naştere la detresă respiratorie la nou-născuţi. În cazuri extreme, precum hernia diafragmatică, se poate asocia cu hipoplazie pulmonară sau hipertensiune pulmonară din cauza efectului de masă al chistului. De obicei afectează un singur lob, comunică proximal cu căile aeriene, iar distal cu parenchimul pulmonar. Prognosticul acestor leziuni este excelent, acestea asociindu-se extrem de rar cu hidropsul, hipoplazia pulmonară sau moartea fetală(7).
A fost sugerat că majoritatea MCAP apar ca urmare a unei obstrucţii a căilor aeriene în cursul dezvoltării (de exemplu, atrezia bronşică sau sechestrarea extralobară). În cazul malformaţiei macrochistice adenomatoide/tip 2, aceste leziuni înlocuiesc o regiune distală a parenchimului pulmonar cu o zonă multichistică. Cele mai multe dintre chisturile mici sunt căptuşite cu epiteliu cuboidal ciliat sau columnar. Părţile solide ale plămânilor sunt umplute cu bronhiolele respiratorii dilatate şi material alveolar. Tipul microchistic este cel mai frecvent întâlnit(7,8).
Chisturile solide/tip 3 sunt leziuni ce au fost iniţial raportate la nou-născuţi morţi, de unde s-a tras concluzia că acestea au cel mai grav prognostic. Sunt formate dintr-o masă solidă de ţesut fără aer ce conţine, aproape în întregime, bronhiole mărginite de epiteliu cuboidal parţial ciliat şi unele elemente alveolare, aşa cum se găseşte şi în plămânul fetal normal(8).

Acest sistem de clasificare a fost criticat pentru incapacitatea de a recunoaşte leziunile hibride, ce au caracteristici MCAP şi SP, şi de a se aplica leziunilor detectate antenatal. Statistic, există o corelare a tipului 1 cu carcinomul bronhoalveolar, iar al tipului 4 cu blastoamele pleuro-pulmonare(7,8,9).
A doua clasificare folosită în practică este cea a lui Adzick, ce împarte chisturile diagnosticate antenatal(39).
Simptomatologie
Majoritatea leziunilor din cadrul SBP şi MCAP evoluează până la aproximativ 27 de săptămâni, după care ating o fază de platou, iar de la 29 de săptămâni se resorb spontan sau înregistrează o scădere a volumului acesteia în raport cu masa corporală fetală(9,10).
Cele mai multe dintre sechestrele extralobare sunt diagnosticate la 6 luni după naştere. O pătrime din nou-născuţi prezintă la scurt timp după naştere detresă respiratorie sau dificultăţi în alimentaţie. Copiii mai mari pot prezenta simptologie respiratorie şi, rar, asocierea insuficienţei cardiace congestive. Sechestrele intralobare sunt mult mai frecvente decât cele extralobare. În cele mai multe cazuri, manifestările clinice apar după vârsta de 2 ani(11). Simptomatologia se caracterizează prin episoade de pneumonie cronică sau recurentă. Sunt puţine cazurile în care pacienţii prezintă o formă severă de insuficienţă cardiacă, hemoptizie sau hemotorax masiv. Din cauza complicaţiilor asociate, rata mortalităţii perinatale este crescută, iar cei care supravieţuiesc adesea necesită resuscitare agresivă şi spitalizare îndelungată în secţia de terapie intensivă neonatală(11,12). Simptomatologia copiilor diagnosticaţi cu malformaţia chistică adenomatoidă pulmonară poate varia în funcţie de dimensiunea acesteia. Formele uşoare pot prezenta detresă respiratorie sau dificultăţi la inspir. Defectele mari duc la apariţia simptomatologiei încă din prima zi de viaţă: pneumotorax, infecţii respiratorii recurente, embolie pulmonară(12). Ambele tipuri de tumori pot produce compresie pe trahee, cu dificultăţi de deglutiţie, ceea ce duce la apariţia polihidramniosului (15-35% din cazuri). Efectul de masă al tumorii poate acţiona şi la nivelul ţesutului pulmonar, ducând la restricţia de creştere a acestuia, cu apariţia hipoplaziei pulmonare şi a devierii mediastinului (45% din cazuri)(12,13). De asemenea, poate cauza obstrucţia venei cave, tulburări de întoarcere venoasă şi compresie cardiacă, în cele din urmă conducând la hidrops fetal.
Diagnostic
Sechestrul extralobar reprezintă 23% din leziunile pulmonare diagnosticate antenatal. Poate fi observat ecografic de la 16 săptămâni şi se caracterizează printr-o formă triunghiulară bine definită, localizată la nivelul inferior al toracelui sau în zona suprarenală(12,14). Diagnosticul este susţinut de vizualizarea arterei nutritive a sechestrului, ce provine cel mai frecvent din aortă.
Diagnosticul diferenţial ecografic dintre SBP şi MCAP este dificil de efectuat antenatal, acesta bazându-se pe vizualizarea arterei ce alimentează formaţiunea tumorală. Odată sesizată, ar trebui stabilite localizarea, dimensiunea şi tipul acesteia (macro- sau microchist). De asemenea, evaluarea iniţială ar trebui să includă o examinare ecocardiografică, deoarece s-a observat o asociere frecventă cu anomaliile structurale şi funcţionale cardiace(13).
Ecografia este principala metodă de diagnostic prenatal al leziunilor pulmonare. Este sigură, uşor accesibilă, ieftină, ajută la evaluarea evoluţiei acestora şi la alegerea momentului naşterii, însă este limitată prin câmpul vizual mic, contrastul limitat al ţesuturilor moi, ţesutul adipos matern şi experienţa operatorului(13,14).
Necesitatea de a identifica cât mai corect leziunile pulmonare diagnosticate ecografic prenatal a introdus în practică RMN-ul fetal. Acesta oferă un câmp vizual mai mare, o imagine mai bună a ţesuturilor moi, iar imaginile nu sunt afectate de habitat, poziţia fetală sau de nivelul lichidului amniotic. RMN-ul fetal poate fi realizat fără sedare sau substanţă de contrast(14). Sechestrul bronhopulmonar se caracterizează ca fiind o leziune omogenă vascularizată, iar malformaţia chistică adenomatoidă pulmonară ca fiind o leziune neomogenă avasculară. Leziunile pulmonare neomogene vascularizate mai sunt denumite şi leziuni hibride şi se caracterizează prin asocierea elementelor SBP şi MCAP. În cazul MCAP, se stabilesc numărul şi localizarea leziunilor. În semnal T2, chisturile se prezintă ca o leziune cu centru hiperintens şi un inel periferic hipointens(14,15).
Postnatal, radiografia toracică poate fi utilă în diagnosticarea unor tumori la copiii care prezintă simptomatologie respiratorie. Tumorile pulmonare pot avea aspect chistic, solid sau mixt şi se pot asocia frecvent cu devierea mediastinului(15). În acest caz, tomografia computerizată (CT) aduce mai multe informaţii despre tipul şi extinderea acestora, ajută la diagnosticarea unor malformaţii asociate, precum şi la realizarea unui plan chirurgical(16). CT multidetector (CTMD) a schimbat modalitatea de studiu al căilor aeriene şi al vaselor toracice din cauza extinderii anatomice, a contrastului crescut, a achiziţiilor izotrope ce permit reconstrucţii multiplanare, de înaltă rezoluţie spaţială şi temporală, cu mai puţine artefacte, ale inimii şi ale plămânilor(16,17).
Management
După cum am precizat anterior, leziunile pulmonare fetale apar uzual între 18 şi 25 de săptămâni de gestaţie şi pot creşte până în trimestrul al treilea, când pot înregistra o fază de platou, după care se opresc din creştere sau scad. Diagnosticul diferenţial poate fi dificil de realizat, mai ales în situaţia în care nu este identificată sursa de vascularizaţie a SBP (figurile 5, 6). O parte dintre acestea pot ajunge nedetectabile în timpul examinărilor ecografice, însă au fost observate ulterior pe CT postnatal(17).
Majoritatea copiilor sunt asimptomatici după naştere, ceea ce face ca managementul acestui grup de pacienţi să fie intens discutat: o parte dintre autori consideră că supravegherea este suficientă (până la apariţia simptomatologiei), alţii susţin necesitatea rezecţiei elective în vederea prevenirii suprainfectării leziunilor, a progresiei simptomatologiei respiratorii şi din cauza posibilelor asocieri dintre MCAP cu rabdosarcomul(17,18). În decizia de a interveni sau nu chirurgical în leziunile asimptomatice sau de mici dimensiuni, se pun în balanţă riscurile chirurgicale versus riscurile tumorii în sine. Deşi sunt rare, riscurile menţinonate în literatură pentru excizia unui SBP asimptomatic sunt de pneumonie, emfizem pulmonar, fistulă bronhopulmonară şi reintervenţie pentru modificări persistente la nivelul parenchimului. Singura alternativă realistă a rezecţiei este realizarea de CT-uri seriate de supraveghere, ce au ca efect negativ expunerea repetată la radiaţii cu nivel crescut. Radiografiile simple omit şi subestimează multe dintre leziuni şi nu e recomandat să fie folosite în monitorizarea leziunilor(18).
Cu toate acestea, o parte dintre aceste leziuni pot înregistra o creştere semnificativă, cu efecte secundare asupra dezvoltării fetale. Îmbunătăţirea calităţii imaginii ecografice a permis diagnosticarea acestora şi monitorizarea efectelor secundare, precum a polihidramniosului, a deplasării mediastinului şi a hidropsului fetal. Monitorizarea evoluţiei SBP are la bază măsurarea dimensiunii acestuia ecografic, iar a MCAP prin calcularea raportului volumetric: CVR = [înălţimea (cm) x lăţimea (cm) x grosimea (cm) x 0,523]/circumferinţa craniului fetal corespunzătoare vârstei de gestaţie. CVR <1,6 se corelează cu o rată a supravieţuirii de peste 95%, iar a riscului de hidrops, de <3%(18,19).
Expansiunea MCAP duce la deplasarea mediastinului, cu tulburări în întoarcerea venoasă, hidrops şi insuficienţă cardiacă. Uneori, SBP hipervascularizat poate duce la acumularea exsudatului pleural, cu apariţia suferinţei fetale. Tocmai din cauza acestor complicaţii, s-a simţit nevoia introducerii unor intervenţii terapeutice prenatale. Acum există o paletă variată de posibilităţi: de la simpla amniocenteză pentru reducerea polihidramniosului, şunt toracoamniotic, ablaţia percutană cu laser până la rezecţia formaţiunii tumorale(19).
După naştere, simptomul-cheie este detresa respiratorie precoce, din cauza diminuării funcţiei parenchimului pulmonar normal şi a compresiei secundare expansiunii masei tumorale. Există şi în acest caz posibilitatea de deviere a mediastinului şi de compromitere a întoarcerii venoase. În afara perioadei neonatale, chisturile şi zonele de parenchim pulmonar anormal pot acţiona ca un punct de plecare al sepsisului, cu apariţia pneumoniei, abceselor şi emfizemului(19,20). Alimentarea cu sânge specifică BPS poate duce la dezvoltarea unui şunt arteriovenos de dimensiuni mari. În unele cazuri, până la 25% din debitul cardiac poate fi redirecţionat către segmentul sechestrat, ceea ce poate duce la insuficienţă cardiacă severă. CCAM, probabil nu şi BPS, are potenţial de transformare malignă mai târziu, atât în timpul copilăriei, cât şi după aceea(20).
În cazul în care diagnosticul de CCAM a fost făcut antenatal şi este încă evident în trimestrul al 3-lea de sarcină, se recomandă naşterea într-o unitate cu experienţă neonatală şi chirurgicală adecvată, deoarece o proporţie relativ mare din nou-născuţi devin simptomatici la scurt timp după naştere (aproximativ 45%). Dacă se observă o regresie ecografică antenatală sau rezoluţia aparentă a formaţiunii, se poate prezice absenţa insuficienţei respiratorii şi, în acest caz, naşterea poate fi efectuată într-o unitate teritorială(20,21).
Managementul postnatal este dictat de starea clinică la naştere. Evaluarea radiologică de urgenţă include radiografii simple şi, în mod ideal, un CT pentru a planifica o intervenţie chirurgicală. Evaluarea radiologică a nou-născuţilor asimptomatici ar trebui, de asemenea, să includă o radiografie simplă de torace în prima zi după naştere, iar CT-ul de torace poate fi efectuat în prima lună de viaţă(21).
Tratamentul SBP simptomatic constă în rezecţia acestuia. În cazul sechestrului intralobar, se poate practica excizia unui segment pulmonar înaintea debutului unei infecţii sau rezecţia întregului lob pulmonar după apariţia acesteia. În cazul sechestrului extralobar, sechestrectomia este suficientă. În timpul intervenţiei chirurgicale este important ca operatorul să identifice şi să controleze corect sursa de alimentare a sechestrului. Rata mortalităţii postoperatorii este între 13% şi 25%, din cauza persistenţei hipertensiunii pulmonare şi a anomaliilor coexistente(21,22).
De asemenea, şi în cazul MCAP, tratamentul constă în excizia întregului lobul afectat (lobectomie) sau îndepărtarea limitată a segmentelor bronhopulmonare implicate (segmentectomie). În cazul în care CCAM este limitată la un singur lob pulmonar, este preferabilă lobectomia, pentru a realiza rezecţia completă şi pentru a evita pericolul unui pneumotorax timpuriu observat în cazul segmentectomiei. În cazul în care şi lobii adiacenţi sunt afectaţi, se recomandă efectuarea lobectomiei pentru excizia leziunii predominante, cu segmentectomie pentru excizia celorlalte zone. Pneumonectomia ar trebui evitată, deoarece aceasta poate duce la apariţia simptomatologiei respiratorii şi a altor complicaţii pe termen lung, cum ar fi scolioza şi perturbări în întoarcerea venoasă(22).
Complicaţiile pot fi împărţite în două categorii: pe termen scurt şi pe termen lung. Complicaţiile pe termen scurt pot include sepsis, pneumotorax şi fistule bronhopleurale. Din cele pe termen lung fac parte astmul, pneumonia recurentă, excizia incompletă sau recurenţa. Morbiditatea este cu siguranţă mult mai frecventă în cazurile chirurgicale, comparativ cu cele care nu au fost diagnosticate antenatal şi ulterior au devenit simptomatice. Marshall şi colab. au raportat rezultate mai bune în ceea ce priveşte rata complicaţiilor şi o mai scurtă perioadă de spitalizare în cazurile la care s-a intervenit chirurgical precoce, în timp ce acestea erau încă asimptomatice(22,23). Comparând şi alte serii, s-a observat o rată mică a morbidităţilor şi a mortalităţii pe termen lung după o intervenţie chirurgicală în cazul CCAM diagnosticat antenatal asimptomatic(23). Sechestrul pulmonar are tendinţa de a provoca perturbări mai puţin severe şi poate regresa prenatal, însă majoritatea lor ar trebui excizate şi vor avea un prognostic excelent(24).
O altă opţiune în tratamentul chirurgical al MCAP este toracoscopia. Tehnica necesită ventilarea unui singur plămân şi este posibilă chiar şi la nou-născuţi. Cu toate că majoritatea patologiilor pulmonare pot fi tratate toracoscopic, unele leziuni, cum ar fi emfizemul lobar, pot provoca dificultăţi din cauza procesului inflamator local şi a accesului dificil într-o cavitate toracică mică. Se recomandă precauţie la cei cu antecedente de pneumonie din cauza riscului de aderenţe şi a pierderii planului anatomic. Rezecţia prin toracoscopie a CCAM are dezavantajul unui timp operator mai mare, dar avantajele unei spitalizări mai scurte, ale unui aspect estetic mai bun şi scăderea durerii postoperatorii. Nu există studii solide care să compare toracoscopia cu toracotomiile convenţionale până în prezent(25).
Embolizarea arterei ce alimentează sechestrul pulmonar poate fi o alternativă la intervenţia chirurgicală. Probabil nu există avantaje superioare intervenţiei clasice deoarece implică, de asemenea, anestezie generală, iar rezultatele pe termen lung lipsesc pentru moment. Comparaţii între cele două tehnici nu au fost documentate(26).
Este dovedită predispoziţia MCAP de transformare în neoplasme pulmonare. Rabdomiosarcomul şi blastomul pleuropulmonar sunt tumori pulmonare comune la copii(27). Carcinomul bronhoalveolar se poate dezvolta din tipul 1 de MCA la adulţi tineri(28). MCAP poate fi considerată o leziune preinvazivă pentru carcinomul mucinos bronhoalveolar, ce poate fi foarte lent progresiv, iar rezecţia profilactică a tumorilor nu poate împiedica dezvoltarea blastomului pleuropulmonar(29).
După o intervenţie chirurgicală, capacitatea de respiraţie pe termen lung depinde de gradul de rezecţie pulmonară. Posibilitatea creşterii compensatorii a parenchimului pulmonar la sugari şi copii de vârstă mică reprezintă una dintre principalele argumente pentru rezecţia leziunilor asimptomatice(30). Potenţialul de creştere al alveolelor şi, prin urmare, capacitatea sugarilor şi a copiilor foarte mici de a înlocui parenchimul pulmonar pierdut par să scadă odată cu vârsta(31). La om, procesul de creştere a numărului de alveole pulmonare are loc în primii doi ani de viaţă(32). Având în vedere aceste aspecte, este recomandată supravegherea copiilor diagnosticaţi cu MCAP până la adolescenţă.
Discuţii
Malformaţia chistică adenomatoasă pulmonară (MCAP) şi sechestrul bronhopulmonar (SBP) sunt leziuni pulmonare fetale benigne relativ rare.
Principala metodă de diagnostic antenatal rămâne ecografia. Diagnosticul diferenţial dintre SBP şi MCAP este dificil de efectuat antenatal, acesta bazându-se pe vizualizarea arterei ce alimentează sechestrul brohopulmonar. Necesitatea de a identifica cât mai corect leziunile pulmonare a introdus în practică RMN-ul fetal, ce oferă informaţii detaliate despre caracteristicile acestora.
Concluzii
Cu toate că majoritatea leziunilor pulmonare înregistrează o stagnare sau regresie în dimensiune, o mică parte poate evolua dramatic către hidrops şi decesul fătului. Din acest motiv sunt necesare o monitorizare atentă a sarcinii şi un tratament prompt în vederea scăderii complicaţiilor perinatale.
Bibliografie
1. Cass DL, Olutoye OO, Cassady CI, Moise KJ, Johnson A, Papanna R, Lazar DA, Ayres NA, Belleza-Bascon B. Prenatal diagnosis and outcome of fetal lung masses. J Pediatr Surg. 2011;46(2):292-8.
2. Stocker JT. Cystic lung disease in infants and children. Fetal Pediatr Pathol, 2009;28:155-84.
3. Langston C. New concepts in the pathology of congenital lung malformations. Semin Pediatr Surg, 2003;1:17-37.
4. Miniati DM, Chintagumpala M, Langston C, et al. Prenatal presentation and outcome of children with pleuropulmonary blastoma. J Pediatr Surg, 2006;41:66-71.
5. Adzick NS. Management of fetal lung lesions. Clin Perinatol 2009;36:363-76.
6. Kunisaki SM, Barnewolt CE, Estroff JA, et al. Large fetal congenital cystic adenomatoid malformations: growth trends and patient survival. J Pediatr Surg, 2007;42:404-10.
7. Morris LM, Lim FY, Livingston JC, et al. High-risk fetal congenital pulmonary airway malformations have a variable response to steroids. J Pediatr Surg, 2009;44:60-5.
8. Peranteau WH, Wilson RD, Liechty KW, et al. Effect of maternal betamethasone administration on prenatal congenital cystic adenomatoid malformation growth and fetal survival. Fetal Diagn Ther, 2007;22:365-71.
9. Curran PF, Jelin EB, Rand L, et al. Prenatal steroids for microcystic congenital cystic adenomatoid malformations. J Pediatr Surg, 2010;45:145-50.
10. Chan YF, Oldfield R, Vogel S, Ferguson S. Pulmonary sequestration presenting as a prenatally detected suprarenal lesion in a neonate. J Pediatr Surg, 2000; 35:1367-9.
11. Lakhoo K. Management of congenital cystic adenomatous malformations of the lung. Arch Dis Child Fetal Neonatal Ed, 2009;94(1):F73-6.
12. Davenport M, Warne SA, Cacciaguerra, Patel S, Greenough A, Nicolaides K. Current outcome of antenatally diagnosed cystic lung disease. J Pediatr Surg 2004; 39:549-56.
13. Calvert JK, Boyd PA, Chamberlain PC, Said S, Lakhoo K. Outcome of antenatally suspected congenital cystic adenomatoid malformation of the lung: 10 years experience 1991–2001. Arch Dis Child fetal Neonatal Ed, 2006; 91:F26-F28.
14. Ierullo AM, Ganapathy R, Crowly S, Craxford L, Bhide A, Thilaganathan B. Neonatal outcome of antenatally diagnosed congenital cystic adenomatoid malformations. Ultrasound Obstet Gynecol, 2005; 26:150-3.
15. Langston C. New concepts in the pathology of congenital lung malformations. Sem Pediatr Surg, 2003; 12:17-37.
16. Njinimbam CG, Hebra A, Kicklighter SD et al. Persistent pulmonary hypertension in a neonate with cystic adenomatoid malformation of the lung following lobectomy: survival with prolonged extracorporeal membrane oxygenation therapy. J Perinatol, 1999; 19:64-7.
17. Clements BS. Congenital malformations of the lungs and airways. In: Taussig LM, Landau LI, eds: Pediatric Respiratory Medicine. St Louis: Mosby, 1999:1106-36.
18. MacSweeney F, Papagiannopoulos K, GoldstrawP, Sheppard MN, Corrin B, Nicholson AG. An assessment of the expanded classification of congenital cystic adenomatoid malformations and their relationship to malignant transformation. Am J Surg Pathol, 2003;27(8):1139-46.
19. Crushell E, Said A, Al-Hassan A, Walsh K. Occlusion of an aberrant artery to a pulmonary sequestration using a duct occluder. J Interv Cardiol, 2002; 15:415-6.
20. Adzick NS, Flake AW, Crombleholme TM. Management of congenital lung lesions. Sem Pediatr Surg, 2003; 12:10-6.
21. Davenport M, Warne SA, Cacciaguerra S, Patel S, Greenough A, Nicolaides K. Current outcome of antenatally diagnosed cystic lung disease. J Pediatr Surg, 2004;39(4):549-56.
22. Sauvat F, Michel JL, Benachi A, Emond S, Revillon Y. Management of asymptomatic neonatal cystic adenomatoid malformations. J Pediatr Surg, 2003;38(4):548-2.
23. Bolck F. Zur Frage der Ent stechung von Nebenlungen. Virchows Arch, 1950; 319:20-43.
24. Hubbard AM, Adzick NS, Crombleholme TM et al. Congenital chest lesions: diagnosis and characterization with prenatal MR imaging. Radiology, 1999;212:43-8.
25. Levine D, Barnewolt CE, Mehta TS et al. Fetal thoracic abnormalities: MR imaging. Radiology, 2003;228:379-88.
26. Breysem L, Bosmans H, Dymarkowski S et al. The value of fast MR imaging as an adjunct to ultrasound in prenatal diagnosis. Eur Radiol, 2003;13:1538-48.
27. Pacharn P, Kline-Fath B, Calvo-Garcia M, Linam LE, Rubio EI, Salisbury S, Brody AS. Congenital lung lesions: prenatal MRI and postnatal findings Pediatr Radiol, 2013;43:1136-43.
28. Hadchouel A, Benachi A, Revillon Y, et al. Factors associated with partial and complete regression of fetal lung lesions. Ultrasound Obstet Gynecol, 2011;38:88-93.
29. Saeed A, Kazmierski M, Khan A, et al. Congenital lung lesions: preoperative three dimensional reconstructed CT scan as the definitive investigation and surgical management. Eur J Pediatr Surg, 2013;23:53-6.
30. Stanton M, Davenport M. Management of congenital lung lesions, Early Human Development, 2006; 82:289-95.
31. Mann S, Wilson RD, Bebbington MW, Adzick NS, Johnson MP. Antenatal diagnosis and management of congenital cystic adenomatoid malformation, Seminars in Fetal & Neonatal Medicine, 2007;12:477e48.
32. Marshall KW, Blane CE, Teitelbaum DH, van LK. Congenital cystic adenomatoid malformation: impact of prenatal diagnosis and changing strategies in the treatment of the asymptomatic patient. Am J Roentgenol, 2000;175(6):1551-4.
