Rolul examenului ecografic în evaluarea cauzelor ovariene de infertilitate
Role of ultrasound evaluation of ovarian causes of infertility
Abstract
Infertility is usually defined as “failure to achieve a clinical pregnancy after 12 months or more of regular unprotected sexual intercourse”, but in couples with advanced female age (>35 years), most practitioners initiate diagnostic evaluation after failure to conceive within 6 months. The ovarian factor is a key element in the evaluation of infertile patients. Ovulatory defects are present in 40% of infertile women and in approximately 15% of couples with infertility. The World Health Organization (WHO) classifies ovulation disorders into three groups: Group I - hypothalamic pituitary failure (hypothalamic amenorrhea or hypogonadotrophic hypogonadism), Group II - hypothalamic-pituitary-ovarian dysfunction (predominately polycystic ovarian syndrome) and Group III - ovarian failure. At ovarian level, within the process of ovulation, there is a micro folicullar stage of development (the anomalies of this stage are divided into two groups - micropolycystic ovaries and multifolicullar ovaries) and a macro follicular stage (with three different types of anomalies: macropolicystic ovaries, functional ovarian cysts and LUF syndrome). All of these anomalies can be assessed today using ultrasound techniques, especially transvaginal ultrasound. The term “ovarian reserve” has been used to describe the capacity of ovaries to respond to stimulation with gonadotropins and therefore to predict the fertility potential. There are 4 morphological markers used to appreciate the ovarian reserve: ultrasound evaluation of antral follicles, measurements of ovarian volume, average ovarian diameter and the evaluation of blood flow al the level of the ovarian stroma. Ultrasound examination plays a key role within the evaluation of the ovarian structure by being able to asses the ovulation/dysovulation processes and other causes of ovarian infertility (endometrioma, tumors).Keywords
folliculogenesiscorpus luteumovulation failureovarian reserveRezumat
Infertilitatea este în general definită ca inabilitatea de a concepe după un an de relaţii sexuale neprotejate, dar în cuplurile cu vârsta de peste 35 de ani a femeii majoritatea practicienilor iniţiază evaluarea diagnostică după 6 luni de eşec în concepţie. Factorul ovarian este un element-cheie în evaluarea femeilor infertile. Defecte ale ovulaţiei sunt prezente la 40% din femeile infertile şi la aproximativ 15% din cuplurile cu infertilitate. OMS clasifică defectele de ovulaţie în trei categorii: grupa I - insuficienţa hipotalamo-hipofizară (amenoree hipotalamică sau hipogonadism hipogonadotrop), grupa a II-a - disfuncţia hipotalamo-hipofizo-ovariană (mai ales sindromul polichistic ovarian) şi grupa a III-a - insuficienţa ovariană. La nivelul ovarului, în cadrul procesului de ovulaţie, se desfăşoară un stadiu microfolicular (anomaliile acestui stadiu îmbracă două forme - ovare micropolichistice şi ovare multifoliculare) şi un stadiu macrofolicular (anomaliile acestui stadiu se traduc prin trei entităţi: ovare macropolichistice, chisturi funcţionale ovariene - foliculare, luteale şi sindromul LUF). Toate aceste aspecte pot fi actualmente evaluate prin ultrasonografie, mai ales transvaginală. Termenul de „rezervă ovariană“ este folosit pentru a descrie capacitatea ovarelor de a răspunde la stimularea cu gonadotropine, adică predicţia potenţialului fertil. Există 4 markeri morfologici utilizaţi în aprecierea rezervei ovariene: evaluarea ecografică a numărului de foliculi antrali, măsurarea volumului ovarian, măsurarea diametrului ovarian mediu şi evaluarea fluxului sanguin la nivelul stromei ovariene. Examenul ultrasonografic deţine astfel un rol esenţial în aprecierea structurii ovarului, a ovulaţiei şi disovulaţiei şi a altor condiţii de infertilitate ovariană (endometriom, tumori).Cuvinte Cheie
foliculogenezăcorp galbeneşecuri ovulaţierezervă ovarianăIntroducere
Ecografia reprezintă un mijloc de investigaţie uşor de utilizat, accesibil, neinvaziv şi eficient în evaluarea potenţialului de fertilitate şi în aplicarea multora dintre tratamentele folosite pentru ameliorarea fertilităţii. Imagistica ultrasonografică ocupă un loc aparte în evaluarea cauzelor ovariene de infertilitate.
Foliculogeneza
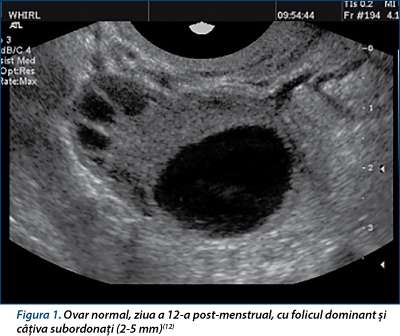
Începe prin recrutarea unui grup sau cohorte de foliculi în faza luteală târzie(16,17,24,26). După ce un folicul primar părăseşte starea de repaus vor fi necesare 85 de zile sau 3 cicluri menstruale complete pentru a ajunge la punctul de ovulaţie(21). Creşterea foliculilor are loc în faza foliculară, iar la mijlocul fazei foliculare, aproximativ în ziua a 7-a, un singur folicul devine dominant. Foliculii cresc de la 1-2 mm în ziua întâi la 4-6 mm în ziua a cincea - a şasea şi continuă să crească cu aproximativ 2 mm/zi(8). Numărul de foliculi antrali care definesc printre altele rezerva ovariană reprezintă numărul de foliculi mai mici de 10 mm diametru, detectaţi în faza foliculară precoce cu ecografia transvaginală(21).
În faza preovulatorie, foliculul dominant măsoară de obicei cam 18-20 mm, moment în care un val de LH se revarsă din hipofiză pentru a declanşa ovulaţia (aproximativ la 36 de ore după valul de LH)(10,18). Acest model al „teoriei momentului propice” este caracteristic unui ciclu de 28 de zile, când un singur folicul dominant a crescut într-un singur val de foliculi, ovulaţia a apărut în ziua a 14-a şi faza luteală se termină 14 zile mai târziu.
Dar acest model nu explică de ce femeile au lungimi diferite ale ciclurilor menstruale sau foliculi anovulatori. În 2003, acest model a fost abandonat, când s-a demonstrat că creşterea foliculară apare în valuri(4,5). Două sau trei valuri de foliculi au fost demonstrate în cicluri menstruale unice la femei(4,5,6). Fiecare val folicular este compus dintr-un grup de foliculi antrali care cresc sincron(4,5). Tipic, un folicul creşte mai mult şi devine lider în grup. Noi valuri foliculare apar la intervale regulate în cadrul ciclului şi fiecare val este precedat de o mică creştere a FSH. În cadrul fiecărui ciclu, valurile precoce sunt constant anovulatorii, în timp ce valul final se încheie cu ovulaţia. În acest mod, un al doilea val de foliculi creşte, iar primul val de foliculi regresează fără ovulaţie. Astfel, ovulaţia va apărea din foliculul dominant al celui de-al doilea val. În modelul cu 3 valuri, primele două valuri sunt compuse doar din foliculi anovulatori şi unda finală se încheie cu ovulaţia. A fost demonstrat chiar un model cu 5 valuri(12).
În valurile anovulatorii, foliculii cresc la un diametru maxim şi regresează. Undele anovulatorii sunt clasificate ca minore dacă foliculii antrali sunt mici, sub 8 mm diametru, şi majore dacă cel mai mare folicul are >10 mm diametru. Are importanţă informaţia că ecostructura şi dimensiunile multor foliculi anovulatorii (14-20 mm) din undele anovulatorii majore sunt comparabile cu foliculul care progresează spre ovulaţie în ultimul val(12).
Existenţa valurilor foliculare oferă explicaţia persistenţei unor foliculi anovulatorii mari în faza foliculară precoce, recrutarea lor apărând din faza luteală şi persistând în următorul ciclu menstrual. Valurile foliculare explică diferenţele de lungime ale ciclurilor menstruale(12).
Ecografia nu poate evalua dacă un folicul mare este competent pentru ovulaţie sau nu (figurile 1 şi 2)(14,15). Se adaugă totuşi apariţia unei reţele vasculare fine în teaca internă a peretelui folicular în foliculul preovulator, faţă de peretele subţire, avascular şi hiperecogen al unui folicul destinat atreziei(12,21,30). Prin identificarea defectelor subtile, repetitive, în creşterea foliculară, selecţie şi maturare, o etiologie ovariană pentru infertilitate poate înlocui un diagnostic anterior de infertilitate idiopatică.
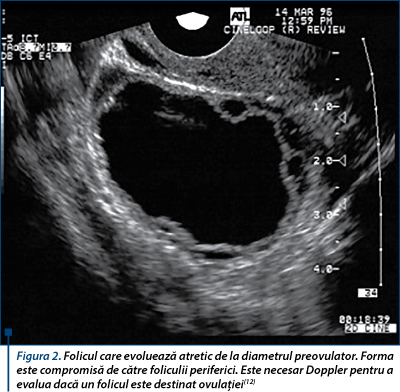
Foliculii destinaţi ovulaţiei tind să aibă pereţi vasculari, lichid antral clar şi produc o cantitate exponenţial tot mai mare de estradiol(12).
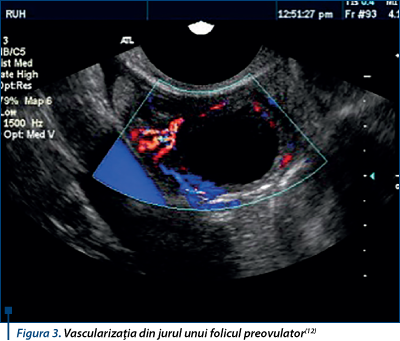
Creşte treptat vascularizaţia şi scade rezistivitatea până la debutul ovulaţiei(1,12,21) (figura 3).
Ovulaţia
Are loc în zile variabile ale ciclului menstrual, putând fi urmărite în timp real prin ecografie transvaginală de înaltă rezoluţie procesul de rupere foliculară şi evacuarea lichidului folicular, împreună cu complexul cumulus-ovocit(19,28). Acest proces durează 1-20 minute, cu o medie de 10 minute(12,21) şi are loc în zile variabile ale ciclului(4,5,7,19,28).
Corpul galben
Corpul galben este o glandă endocrină care joacă un rol important în reglarea foliculogenezei, în stabilirea şi menţinerea sarcinii(12).
Există două tipuri de corp galben: cu şi fără cavitate centrală plină cu lichid. Lichidul este sânge scurs din vasele înconjurătoare. Fluidul poate fi observat imediat după ovulaţie şi poate scădea ulterior, poate rămâne constant sau creşte în volum(12). Un aspect este însă constant: inelul vascular ca un „cerc de foc” la examinarea power Doppler(12,21) (figura 4).
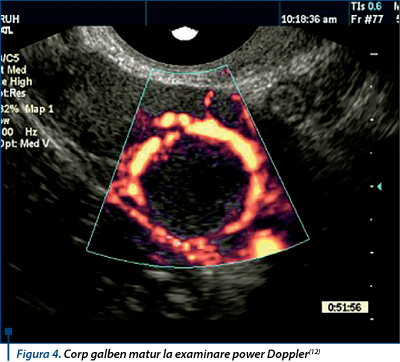
Diferenţierea între un corp galben chistic şi foliculul anovulator poate fi dificilă(12). Cel mai bun moment este identificarea corpului galben la scurt timp după ovulaţie, căutând punctul de rupere pe suprafaţa exterioară a ovarului(7,12). Corpul galben suferă o marcată neovascularizaţie în primele 24 de ore după ovulaţie. De asemenea, fluxul vascular mai mare în peretele corpului galben comparativ cu foliculul preovulator poate fi de ajutor(12).
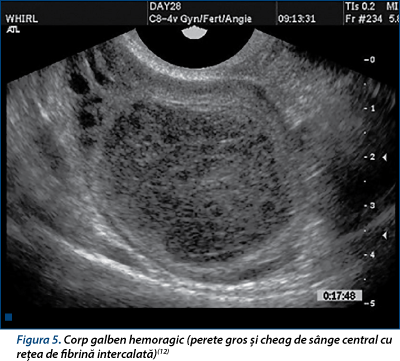
Corpul galben hemoragic este cu hiperecogenitate variabilă a fluidului(7,12,13,22,29) (figura 5).
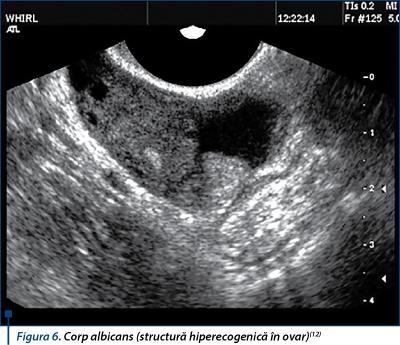
Corpul galben regresează în corp albicans, care poate fi vizualizat până la ovulaţia ulterioară(7) (figura 6). Ocazional, mai mulţi corpi albicans pot fi vizualizaţi de la cicluri menstruale anterioare(12).
Eşecuri ale ovulaţiei
1. Foliculul luteinizat nerupt (LUF-sindrom)
Reprezintă o transformare fără ruptură foliculară în corp galben. Faza luteală apare normală (decalaj termic, creşterea progesteronului), dar ovocitul rămâne în interiorul foliculului, fără posibilitate de fecundare(27,11,23). LUF-sindromul poate apărea şi în cadrul ciclurilor normale (5-10%). Dar constituirea sa în repetiţie în cursul monitorizării succesive poate fi considerată patologică. Mecanismul de formare este incert(12).
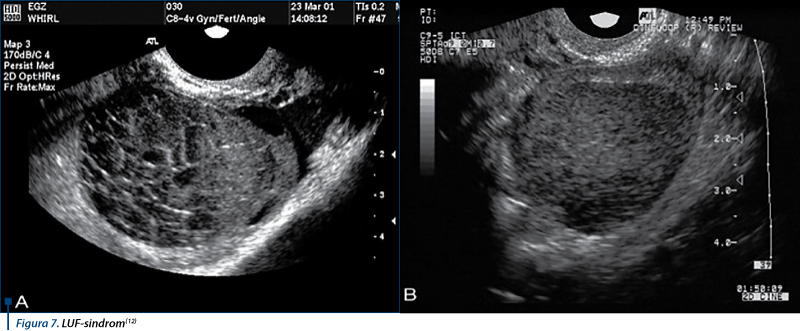
Este un folicul de mărime preovulatorie, cu modificările corpului luteal, fără eliminarea complexului oophorus. Ecografic apare ca o structură cu pereţi groşi, plină de lichid cu aspect hipoecogen şi cu bună vascularizaţie periferică, poate să atingă 4-5 cm diametru, fără colecţie în Douglas, putând persista în ciclul următor(21) (figura 7). Creşte şi ecogenitatea endometrului în corelaţie cu creşterea titrului de progesteron.
2. Foliculul anovulator persistent (chistul folicular)
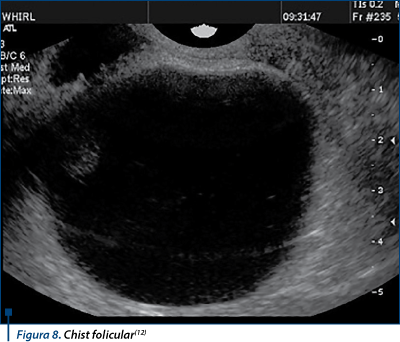
Reprezintă creşterea unui folicul dominant dincolo de diametrul preovulator(27). Nu are loc luteinizarea, aşa că peretele foliculului este subţire, foarte puţin vascularizat, conţinutul lichidian apare pur, hipoecogen. Pot exista false imagini de cloazonare date de exfolierea celulelor granuloase (figura 8). Se presupune că produce în continuare estrogeni care duc la creşterea în grosime a endometrului(12).
Poate rămâne static în diametru (≤8 cm) una sau mai multe zile înainte de regresie, până la mai multe luni. Se impune repetarea examenului ecografic după 2-3 luni, în primele 8 zile ale ciclului, pentru a evita noile imagini foliculare.
Scăderea producerii de estrogeni, urmată de regresia unui folicul anovulator, va duce la apariţia menstruaţiei. Astfel, un diagnostic de anovulaţie poate fi ratat în cazul în care debutul menstruaţiei coincide cu lungimea ciclului tipic al femeii(12).
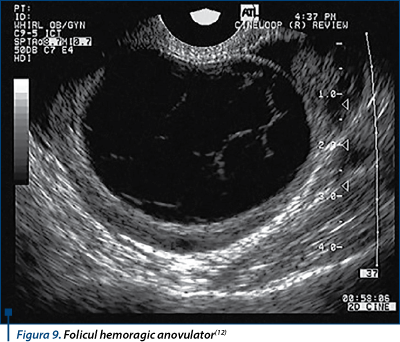
Rar poate apărea şi folicul hemoragic anovulator prin extravazare de sânge din capilarele peretelui folicular (fine pete ecogene sau sedimente în straturi), fără să apară luteinizarea, iar nivelurile de progesteron sunt mici(12,21) (figura 9).
3. Supresia hipotalamică
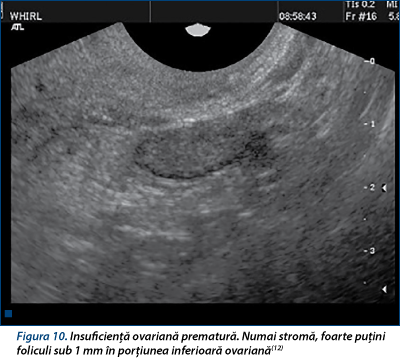
Poate fi idiopatică, câştigată (în anorexia mentală, exerciţii fizice excesive, stres) sau genetică (sindrom Kallman)(12,21). Se înregistrează niveluri scăzute de FSH şi LH în absenţa dezvoltării foliculare. De obicei, ovarele apar mai mici din cauza lipsei de creştere a foliculilor antrali şi a volumului stromal redus (figura 10).
4. Sindromul de ovare polichistice
Femeile (6-10%) cu acest sindrom pot prezenta anovulaţie şi amenoree, deseori coexistând. Pot fi observaţi numeroşi foliculi (mai mult de 12 pe ovar) cu diametrul ≤10 mm. Stroma ovariană apare abundentă şi uşor hiperecogenă. Volumul ovarian este crescut (mai mult de 9 cm3) datorită numeroşilor foliculi şi stromei(3,9,20,25).
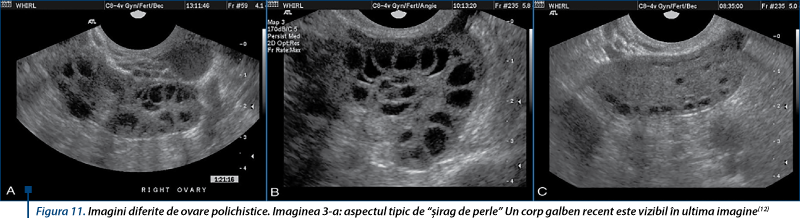
Ovarul polichistic este detectat prin ecografie transvaginală la 75% din femeile cu acest sindrom, iar rata rezultatelor fals-pozitive este ridicată(21). Criteriile Rotterdam din 2003 afirmă că diagnosticul acestui sindrom poate fi validat când există cel puţin două din următoarele trei elemente: dereglări menstruale, hiperandrogenism clinic sau biochimic şi un aspect tipic de ovar polichistic ultrasonografic (figura 11). Oligomenoreele şi ovarele aparent polichistice ecografic, dar fără hiperandrogenism nu se încadrează în acest sindrom. La fel, pot exista alte cauze de hiperandrogenism şi anovulaţie(21).
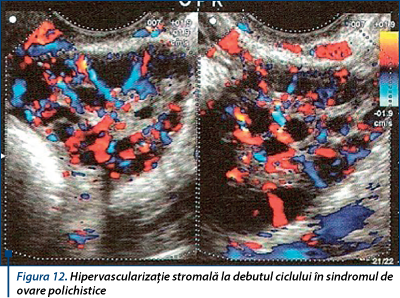
În ovarul normal, stroma este puţin vascularizată, fluxul vascular intraovarian fiind dificil de evidenţiat înainte de zilele 8-10 ale ciclului. În sindromul de ovare polichistice, la debutul ciclului se decelează o hipervascularizaţie stromală - fluxuri lente cu IR <0,55. Hipervascularizaţia este legată de acţiunea locală a LH (corelaţie inversă între IR şi LH/ FSH) (figura 12).
Sindromul de ovar polichistic trebuie diferenţiat de ovarul multifolicular, definit ca având 6 sau mai mulţi foliculi de 4-10 mm şi stroma ovariană normală, caracteristic fazei foliculare normale şi altor situaţii ca pubertatea, amenoreea hipotalamică şi hiperprolactinemia(21). Clinic, tabloul aparţine unei tinere, slabe, cu amenoree, fără hiperandrogenie.
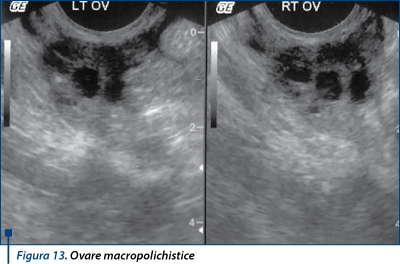
5. Ovare macropolichistice
Se caracterizează prin prezenţa în interiorul unuia sau al ambelor ovare a mai multor macrofoliculi cu dimensiuni de peste 15 mm (până la 1,5-8 cm), în absenţa unui tratament stimulator. Se adaugă asimetria ovarelor, creşterea volumului ovarian şi variabilitatea imaginilor ecografice de la un ciclu la altul. Parenchimul ovarian poate fi tasat şi apare riscul de a confunda acest ovar cu un chist mare multiocular (chistadenom) sau cu o colecţie peritoneală cloazonată. Evoluează cu dureri pelviene ciclice sau permanente, ceea ce îl diferenţiază de sindromul de ovare polichistice. Se descoperă şi un context inflamator pelvin: post-infecţios, endometrioză, post-chirurgical (figura 13)
6. Endometriomul
Se estimează că 10-25% din femei sunt afectate de endometrioză şi aceasta se găseşte la 40% din femeile infertile(2,31).
Endometriomul conduce la aberaţii ale foliculogenezei. Apare ca un chist ovarian persistent, de diferite mărimi, unic sau multiplu, afectând unul sau ambele ovare, cu conţinut lichidian hiperecogen omogen (scala de gri variază cu grosimea conţinutului şi conţinutul de apă al resturilor celulare)(12) (figura 14). Când există un chist ovarian persistent cu conţinut luminal hiperecogen se pune problema fie a endometriomului, fie a unui chist dermoid sau teratom chistic(12).

7. Alte tumori ovariene benigne
Rezerva ovariană
Termenul de „rezervă ovariană” a fost folosit pentru a descrie capacitatea ovarelor de a răspunde la stimularea cu gonadotropine, prin urmare prezice potenţialul de fertilitate. Evaluarea rezervei ovariene cuprinde, pe lângă markeri biochimici, evaluarea prin ultrasonografie a numărului de foliculi antrali, a volumului ovarian şi a vascularizaţiei ovariene(12,21).
Numărarea foliculilor antrali se face între ziua a 3-a şi a 7-a după menstruaţie(12). Volumul ovarian se estimează în ecografia 2D şi 3D în faza foliculară precoce şi se consideră patologic la valori de sub 3 şi peste 8 cm3(21). Vascularizaţia se apreciază utilizând ecografia Doppler pulsat color(21). În cazul ovarului normal, stroma este puţin vascularizată înainte de ziua a 8-a a ciclului. Ulterior, foliculul dominant şi corpul galben prezintă flux vascular periferic. Prezicerea momentului ovulaţiei cu ajutorul ecografiei este superioară analizei temperaturii bazale sau utilizării de teste LH urinare(12).
Concluzii
Ecografia a adus o contribuţie importantă în lărgirea cunoştinţelor noastre privind fiziologia reproducerii umane şi a permis progrese terapeutice remarcabile în managementul infertilităţii. A fost inclusă în protocoalele de diagnostic al infertilităţii şi în protocoalele terapeutice pentru infertilitate. Ne-a permis să înţelegem foliculogeneza, ovulaţia, funcţia luteală, concepţia, răspunsul uterin, nidaţia şi de a aplica aceste cunoştinţe în explorarea infertilităţii şi în tehnologiile contraceptive. Examenul ultrasonografic deţine un rol esenţial şi în aprecierea altor condiţii de infertilitate ovariană (endometriom, tumori).
Bibliografie
Abramowicz J. S., Jaffe R. et al. (1994). Transvaginal Color dopppler Ultrasonography in the Assessment of Uterine and Ovarian Blood Flow. In: Imaging in Infertility and Reproductive Endocrinology. R. Jaffe, R. A. Pierson and J. A. Abramowicz. Philadephia, J.B. Lippincott: 167-178.
ASRM, The Practice Committee of the American Society for Reproductive Medicine (2006). „Endometriosis and infertility.” Fertility Sterility 86(suppl4): s156-60.
Atiomo W.U., Pearson S. et al. (2000). „Ultrasound criteria in the diagnosis of polycystic ovary syndrome (PCOS).” Ultrasound Med Biol 26(6): 977-80.
Baerwald A.R., Adams G.P. et al. (2003). „A new model for ovarian follicular development during the human menstrual cycle.” Fertil Steril 80(1): 116-22.
Baerwald A.R., Adams G.P. et al. (2003). „Characterization of ovarian follicular wave dynamics in women.” Biol Reprod 69(3): 1023-31.
Baerwald A.R., Pierson R.A. (2004). „Endometrial development in association with ovarian follicular waves during the menstrual cycle.” Ultrasound Obstet Gynecol 24(4): 453-60.
Baerwald A.R., Adams G.P. et al. (2005). „Form and function of the corpus luteum during the human menstrual cycle.” Ultrasound Obstet Gynecol 25(5): 498-507.
Baerwald A.R., Walker R.A., Pierson R.A. (2009).” Growth rates of ovarian follicles during natural menstrual cycles, oral contraception cycles, and ovarian stimulation cycles”. Fertil Steril 91(2): pp. 440-9.
Balen A.H., Laven J.S. et al. (2003). „Ultrasound assessment of the polycystic ovary: international consensus definitions.” Hum Reprod Update 9(6): 505-14.
Bomsel-Helmreich O. (1985). „Ultrasound and the preovulatory human follicle.” Oxford Rev Reprod Biol 7: 1-72.
Brannstrom M., Zackrisson U. et al. (1998). „Preovulatory changes of blood flow in different regions of the human follicle.” Fertil Steril 69: 435-442.
Chizen D, Pierson R, (2010) “Transvaginal ultrasonography and female infertility”, Glob. libr. women’s med.,(ISSN: 1756-2228); DOI 10.3843/GLOWM.10326.
Geisthovel F., Skubsch U. et al. (1983). „Ultrasonographic and endocrinological studies of ovarian function.” Ultrasound Med Biol Suppl 2: 603-8.
Ginther O.J. (2000). „Selection of the dominant follicle in cattle and horses.” Anim Reprod Sci 60-61: 61-79.
Ginther O.J., Beg M.A. et al. (2001). „Follicle selection in monovular species.” Biol Reprod 65(3): 638-47.
Gougeon A, Lefevre B (1983). „Evolution of the diameters of the largest healthy and atretic follilces during the human menstrual cycle.” Reproduction and Fertility 69: 497-502.
Gougeon A. (1993). Dynamics of human follicular growth: a morphologic perspective. Comprehensive Endocrinology: The Ovary. E. Adashi and P. Leung. New York, Raven Press: 21-39.
Hanna M.D., Chizen D.R. et al. (1994). „Characteristics of follicular evacuation during human ovulation.” J Ultrasound Obstet Gynaecol 4: 488-493.
Hanna M.D., Chizen D.R. et al. (1994). „Characteristics of follicular evacuation during human ovulation.” J Ultrasound Obstet Gynaecol 4: 488-493.
Jonard S., Robert Y. et al. (2003). „Ultrasound examination of polycystic ovaries: is it worth counting the follicles?” Hum Reprod 18(3): 598-603.
Kurjac A, Chervenak F.A., Vladareanu R (2012). “Donald School. Tratat de ultrasonografie în obstetrică şi ginecologie”, Ed Med. Amaltea, Bucureşti, pg 784-789.
Lenz S. (1985). „Ultrasonic study of follicular maturation, ovulation and development of corpus luteum during normal menstrual cycles.” Acta Obstet Gynecol Scand 64(1): 15-9.
Martinuk S.D., Chizen D.R. et al. (1992). „Ultrasonographic morphology of the human preovulatory follicle wall prior to ovulation.” Clin Anat 5: 1-14.
McGee E , Hsueh A (2000). „Initial and Cyclic Recruitment of Ovarian Follicles.” Endocrine Reviews 21(2): 200-214.
Pache T.D., Wladimiroff J.W. et al. (1992). „How to discriminate between normal and polycystic ovaries: transvaginal US study.” Radiology 183(2): 421-3.
Pellicer A, Gaitin P et al. (1998). „Ovarian Follicular Dynamics: from basic science to clinical practice.” Journal of Reproductive Immunology 39: 29-61.
Pierson R., Chizen D.R. (1994). Ultrasonography of Normal and Aberrant Ovulation. Imaging in Infertility and Reproductive Endocrinology. R. Jaffe, R. Pierson and J. Abramowicz. Philadelphia, J.B. Lippincott: 155-166.
Pierson R., Martinuk S. et al. (1990). Ultrasonographic visualization of human ovulation. 7th Reinier de Graaf Symposium, Maastricht, Netherlands, Excerpta Medica.
Queenan J.T., O’Brien G.D. et al. (1980). „Ultrasound scanning of ovaries to detect ovulation in women.” Fertil Steril 34: 99-105.
Rezaei E., Baerwald A.R. et al. (2007). Ultrasonographic Image Analysis of Human Dominant and 1st Subordinate Ovarian Follicles. Proceedings of the 53rd Annual Conference of the Canadian Fertility and Andrology Society, Halifax, Nova Scotia, Canada, Canadian Fertility and Andrology Society.
Zalel Y., Caspi B. et al. (1997). „Doppler flow characteristics of dermoid cysts: unique appearance of struma ovarii.” J Ultrasound Med 16(5): 355-8.
