Particularităţi etiopatogenice şi de prognostic ale enterocolitei ulceronecrozante la nou-născuţii din sarcina gemelară - prezentare de caz
Etiopathogenic and prognostic features of necrotizing enterocolitis in neonates from twin pregnancy - case report
Abstract
This article presents the case of a premature newborn from a twin pregnancy who developed necrotizing enterocolitis (NEC). There are some issues about NEC ethiopatogeny that must be understood within the first day of a newborn’s life. NEC is an inflammatory disease of multifactorial etiology, incompletely understood, characterised by variable damage of the intestinal wall, starting with the injury of intestinal mucosa and continuing with necrosis and perforation of all the intestinal layers. Ischaemia or reperfusion of immature bowel lead to bacterial invasion of the wall layers. Furthermore, bacteria start an inflammatory process which leads to local destruction, intestinal perforation and sepsis. NEC is typically developed in small for gestation age preterm and very low birth weight babies, but it can also occur in near term or in term babies. Even though a lot of progress has been made in the NICU technology, NEC still has an increasing incidence, with a high rate of morbidity and mortality. If diagnosed early, a loc of NEC cases respond to specific medical treatment; however, most of them become surgical emergencies which require high costs. The survival rate of surgical treated patients can reach up to 95%, although the incidence of complications such as stenosis or short bowel syndrome remains high. Knowing the risk factors which lead to NEC can lead to early NEC diagnosis and choosing the right treatment. Strategies of decreasing risk factors (antenatal corticosteroids, breastfeeding, standardised feeding guidelines, probiotics) can contribute to lower the NEC incidence in preterm babies.Keywords
NECtwinsnecrosisperforationRezumat
În această prezentare aducem în discuţie cazul unui născut prematur provenit din sarcină gemelară, care a dezvoltat enterocolită ulceronecrozantă (EUN) din primele zile de viaţă, încercând să subliniem câteva aspecte legate de etiopatogenia EUN în rândul nou-născuţilor gemeni. EUN este o boală inflamatorie, de etiologie multifactorială şi încă neelucidată pe deplin, caracterizată prin afectarea variabilă a peretelui intestinal, mergând de la injuria mucoasei intestinale până la necroza şi perforaţia întregului perete intestinal. Afectarea ischemică/de reperfuzie a intestinului imatur contribuie, după naştere, la invazia peretelui intestinal de către bacterii. Bacteriile, la rândul lor, iniţiază o cascadă inflamatorie care duce la distrucţie până la perforaţie intestinală şi mai departe la infecţie sistemică. EUN, o afecţiune caracteristică prematurilor mici de vârstă gestaţională şi celor cu greutate mică la naştere, poate să apară şi la nou-născuţii la termen şi near-term. Cu o incidenţă în creştere, EUN se menţine şi în prezent la o rată ridicată de morbiditate şi mortalitate, în ciuda progreselor înregistrate în tehnicile imagistice şi de îngrijire intensivă neonatală. Recunoscute la timp, multe dintre cazurile de EUN ajung să răspundă la tratamentul medical specific, dar o mare parte dintre ele ajung urgenţe chirurgicale, pentru rezolvarea cărora este nevoie de costuri ridicate de îngrijire. Supravieţuirea copiilor trataţi chirurgical poate ajunge până la 95%, dar incidenţa complicaţiilor date de structura intestinală şi sindromul de intestin scurt rămâne ridicată. Cunoaşterea factorilor de risc care conduc la lanţul de evenimente care concură la producerea EUN poate contribui la sporirea vigilenţei de a detecta semnele precoce de EUN şi la aplicarea unui tratament cât mai precoce. Strategiile de reducere a factorilor de risc (steroizi antenatali, alimentaţie cu LM, ghiduri de alimentaţie standardizate, probiotice) pot contribui la reducerea incidenţei EUN la prematuri.Cuvinte Cheie
EUNgemeninecrozăperforaţieIntroducere
Enterocolita ulceronecrozantă (EUN) este o boală inflamatorie acută, de etiologie multifactorială şi încă neelucidată pe deplin, caracterizată prin afectarea variabilă a peretelui intestinal, mergând de la injuria mucoasei până la necroza şi perforaţia întregului perete intestinal. Este considerată cea mai frecventă urgenţă gastrointestinală, ameninţătoare de viaţă, întâlnită în secţiile de Terapie Intensivă Neonatală (TINN)(1). Este întâlnită mai frecvent la prematuri şi la nou-născuţii cu greutate mică la naştere (LBW) care primesc alimentaţie cu formulă de lapte praf. Cu o incidenţă de 2-5% la prematuri, care poate ajunge la 10-13% în cazul nou-născuţilor cu G <1500 g la naştere, numărul de cazuri de EUN este în creştere în prezent, ca urmare a creşterii ratei de supravieţuire a prematurilor VLBW. Cu toate progresele actuale în ceea ce priveşte tehnicile de îngrijire a nou-născuţilor din secţiile TINN, această afecţiune înregistrează şi în prezent o rată ridicată a mortalităţii şi morbidităţii, mortalitatea putând ajunge până la 20-40% în stadiile avansate ale bolii. Debutul EUN la prematuri apare în mod tipic la o vârstă medie de viaţă de 12 zile şi pare să fie invers proporţională cu VG şi greutatea la naştere(2). EUN poate să apară şi la nou-născuţii la termen, cu un debut mult mai devreme, frecvent în primele trei zile de viaţă, dar se pot întâlni şi cazuri cu debut mai întârziat, chiar şi la o lună de viaţă(2). Cel mai frecvent sunt interesate segmente ale ileonului terminal şi ale colonului ascendent proximal, dar orice alt segment intestinal poate fi afectat(2). Triada caracteristică este distensie abdominală, scaune cu sânge şi pneumatoză intestinală.
Etiopatogenie
Singurii factori epidemiologici consideraţi cerţi pentru EUN sunt prematuritatea şi avansarea rapidă în alimentaţia enterală cu formula de lapte cu osmolaritate crescută(2). Un număr mare de alţi factori pot fi de asemenea incriminaţi: transfuzii de ME, scor Apgar scăzut, orarul şi volumul alimentaţiei, cateterizarea ombilicală, injuriile hipoxic-ischemice, PDA, precum şi anumite medicamente utilizate frecvent în terapia prematurului (xantine, indometacin, vitamină E, ranitidine, vasopresori)(3). La nou-născuţii la termen, debutul EUN, mult mai precoce, este adesea asociat cu factori de risc neonatali, precum istoric de asfixie la naştere, boală cardiacă congenitală cianogenă, detresă respiratorie, sepsis, anomalii metabolice, retard de creştere intrauterină, policitemia, anomalii congenitale intestinale, precum gastroschizisul, dar şi factori de risc materni care duc la reducerea fluxului sangvin către intestinul fătului, cum ar fi insuficienţa placentară cauzată de hipertensiunea de sarcină, diabetul sau abuzul de cocaină. Mecanismul este preponderent ischemic, iar zona afectată cu predilecţie este colonul(2). Patogenia incriminată în producerea EUN la prematuri se consideră a fi rezultatul interacţiunii dintre imaturitatea intestinală (explicată prin creşterea permeabilităţii epiteliumului intestinal, scăderea motilităţii, un strat mucos subţire, nivelul scăzut de Ig A şi sistemul imun mucosal intestinal deficitar), injuria mucoasei intestinale (printr-un răspuns excesiv şi inadecvat inflamator intestinal la invazia bacteriană prin intermediul mediatorilor inflamatori: PAF, endotoxina bacteriană, lipopolizaharide, TNF, interleukine proinflamatorii şi oxid nitric, ciclooxigenaza, specii de oxigen reactiv, TNF-a, IL-18) şi dezechilibrul colonizării bacteriene (scăderea colonizării cu flora saprofită benefică preponderent de tip Lactobacillus spp., Bifidobacteria spp., Bacteroides spp., Eubacterium spp. şi exacerbarea creşterii florei potenţial patogene). Secvenţa colonizării bacteriene intestinale după naştere asigură protecţie faţă de proliferarea agenţilor potenţial patogeni. Au fost făcute studii prospective multicentrice comparative şi s-au găsit diferenţe semnificative în ceea ce priveşte secvenţa colonizării microbiene a nou-născuţilor internaţi în secţiile de TINN faţă de nou-născuţii sănătoşi, precum şi a celor alimentaţi cu formulă de lapte (FL) versus cei alimentaţi cu lapte matern (LM)(4). Un astfel de studiu a găsit o creştere de aproximativ 10 ori în incidenţa EUN la nou-născuţii prematuri alimentaţi cu FL comparativ cu cei alimentaţi cu LM(4). Efectele benefice ale LM sunt date mai ales de varietatea de produşi antimicrobieni conţinuţi, nivelurile ridicate de prebiotice, precum fructooligozaharide şi lactoferină, cu rol de scădere a translocaţiei bacteriene. LM conţine, de asemenea, factori celulari (leucocite, macrofage, neutrofile, limfocite), care probabil facilitează dezvoltarea şi maturarea sistemului imun. Intestinul prematurilor internaţi este mai probabil a fi colonizat cu bacterii patogene precum Klebsiella spp., Enterobacter spp. şi Clostridium spp., cu o marcată paucitate a bifidobacteriilor(4). Pe baza datelor de literatură, raportate în ultimii 30 de ani, deşi numeroşi patogeni bacterieni şi virali au fost asociaţi cu EUN, nu se cunoaşte niciun agent individual responsabil pentru această boală(4). În plus, aceeaşi bacterie izolată din coprocultura nou-născuţilor afectaţi a fost de asemenea izolată de la nou-născuţi sănătoşi(2), ceea ce sugerează că translocarea florei intestinale prin bariera mucoasei intestinale este favorizată de vulnerabilitatea dată de ischemia şi imaturitatea intestinală. Agenţii bacterieni implicaţi adesea includ Enterobacteriaceae, în special Escherichia coli, Klebsiella pneumoniae şi Enterobacter cloacae tipul 3305573(5). S-au raportat câteva cazuri severe de meningită neonatală şi sepsis în care a fost implicat Enterobacter cloacae; în cele mai multe dintre aceste cazuri FL a fost suspectată a fi sursa infecţiei prin contaminarea pudrei de lapte(6). Enterobacter spp., de obicei comensal în flora tractului intestinal uman, obişnuit izolat din scaunul nou-născutului, recent o cauză importantă de infecţie dobândită în spital, a devenit mai rezistent la antibiotice, în special la cefalosporine (CFS) de generaţie a III-a, rezistenţa la CFS fiind dată de mutanţi hiperproductori de b-lactamază(7). Colonizarea intestinală anormală cu agenţi bacterieni rezistenţi este prevalentă în special la prematuri şi nou-născuţi LBW ca urmare a răspândirii sale nosocomiale în secţiile de TINN(7) şi a utilizării frecvente a antibioticelor. Se discută rolul probioticelor în promovarea mecanismelor de apărare intestinală care pot atenua sau preveni secvenţele patogene care conduc la EUN(4) prin maturarea sistemului imun mucozal sau prin simpla excludere a patogenilor de la locurile de nidare din intestin(4). Au fost realizate, de asemenea, şi studii care compară efectele factorilor genetici şi de mediu asupra patogeniei EUN în cazul nou-născuţilor din sarcina gemelară. În urma unui astfel de studiu s-au remarcat următoarele constatări(8):
- Există în mod remarcabil o incidenţă mai crescută a EUN în rândul gemenilor.
- Niciodată nu au dezvoltat EUN ambii gemeni; în mod universal, EUN a apărut la primul geamăn, ceea ce sugerează că influenţele hormonale ale mamei şi fătului la momentul naşterii afectează primul geamăn într-o măsură mai mare decât pe al doilea, atât ocitocina, cât şi epinefrina, principalii hormoni ai naşterii, putând provoca un vasospasm important la nivel splahnic. Răspunsul hormonal maternal şi fetal la procesul naşterii şi influenţa lui asupra integrităţii barierei intestinale necesită în continuare studii
- Preponderenţa feminină.
- N-au fost înregistrate diferenţe de scor Apgar între nou-născuţii din sarcina gemelară şi nou-născuţii proveniţi din sarcina unică.
- Greutatea la naştere, momentul debutului EUN, numărul de zile de spitalizare, mortalitatea şi prognosticul au fost similare în rândul nou-născuţilor din sarcinile gemelare faţă de cei proveniţi din sarcini unice.
- Fenomenul de furt vascular în cadrul sindromului transfuzor-transfuzat (TTS) poate predispune geamănul donor la riscul de EUN.
- Stresorii antenatali, precum şi influenţele vasculare şi hormonale prenatale asupra permeabilităţii membranare intestinale şi a rezistenţei sale la acţiunea patogenilor sunt consideraţi a fi factori importanţi cauzatori de EUN.
- Sistemul imun nu pare a fi un proces iniţiator în EUN chiar şi în cazul gemenilor dizigoţi, întrucât gemenii, chiar şi cei dizigoţi, împart în comun un număr mare de gene.
- Colonizarea intestinală anormală pare să se producă în timpul naşterii sau imediat post-partum.
- Preponderenţa alimentaţiei de start cu FL în detrimentul LM este mai frecvent întâlnită în cazul gemenilor nou-născuţi, putând fi incriminată în patogenia EUN.
- Deşi dezvoltarea microbiomului intestinal n-ar trebui să fie diferită între acelaşi set de gemeni, ambii gemeni având o predispoziţie egală de dezvoltare a EUN, un dezechilibru în microbiomul intestinal a fost cauza majoră de EUN.
Prognostic
Odată cu îmbunătăţirea îngrijirii suportive intensive neonatale, incluzând suport ventilator, tehnici de anestezie, nutriţie parenterală totală, supravieţuirea nou-născuţilor cu EUN s-a îmbunătăţit continuu începând de la sfârşitul secolului XX(2). Supravieţuirea nou-născuţilor trataţi chirurgical a ajuns la 95% în centrele bine dotate din ţările dezvoltate. Dintre pacienţii care supravieţuiesc, 50% dezvoltă complicaţii pe termen lung. Cele mai frecvente două complicaţii sunt strictura intestinală şi sindromul de intestin scurt, care interferează considerabil cu prognosticul de dezvoltare şi creştere(2).
Prezentare de caz
Vă prezentăm cazul a doi gemeni, de sex diferit, proveniţi din sarcină gemelară diamniotică-dicorială, obţinută prin fertilizare in vitro (FIV), născuţi prematur la 36 de săptămâni de gestaţie, în Clinica de Obstetrică-Ginecologie a Spitalului Universitar de Urgenţă „Elias”, prin operaţie cezariană, ambii din prezentaţie craniană, cu o diferenţă semnificativă de greutate, de 600 g. Ambii au prezentat din primele zile de viaţă colonizare intestinală cu floră potenţial patogenă, dar numai primul geamăn cu manifestări de boală digestivă, şi anume enterocolită ulceronecrotică (EUN).
Date despre mamă: P.A.C., 34 de ani, IIG, IIIP, AII pozitiv, cu HTA indusă de sarcină, fără patologie infecţioasă în sarcină, la internare cultura din secreţia cervicală necrescută, tratament în sarcină cu Euthyrox 25 ug/zi; a primit profilactic dexametazonă la 28 de săptămâni de sarcină; la internare cu membrane intacte şi debut de travaliu.
Date nou-născuţi. Primul geamăn extras, P.A.G., de sex masculin, AII pozitiv, indice Apgar 9, Gn 2720 g, L 46 cm, Pc 33 cm, Pt 32 cm, lichid amniotic clar, circulară pericervicală de cordon ombilical, membrane rupte intraoperator. Al doilea geamăn extras, P.A.G., de sex feminin, indice Apgar 8, Gn 2120 g, L 45 cm, Pc 31 cm, Pt 29 cm, AII pozitiv, lichid amniotic clar, membrane rupte intraoperator.
Evoluţie în maternitate. În prima zi de viaţă, amândoi gemenii au avut o adaptare lentă, corespunzătoare vârstei gestaţionale (VG), cu o formă uşoară de detresă respiratorie, semne de hipoperfuzie periferică şi hipotensiune arterială (tegumente şi mucoase palid-rozate cu acrocianoză, TRC uşor prelungit, TAM 30 mmHg în cazul primului geamăn şi, respectiv, 34 mmHg la geamănul al doilea, uşoară tahicardie - AV 170 bpm). Cu tratament suportiv (confort termic, încărcare volemică cu 10 ml/kg SF bolus i.v. lent, PEV 60 ml/kg/zi cu SG 10% şi Ca gluc. 10% şi suport vasopresor cu dopamină 5 ug/kg/min) tegumentele şi mucoasele devin rozate pe fond discret marmorat; TAM creşte la 40-45 mmHg; AV 130-165 bpm. S-a observat în cazul primului geamăn o corectare mai lentă a TA (iniţial 30-33-40 mmHg). Sindromul funcţional respirator se remite cu oxigenoterapie sub cort cefalic (FiO2 40%) şi SpO2 se menţine >95%. Cel de-al doilea geamăn a necesitat şi ventilaţie cu NeoPuff (PIP 20 mmHg, PEEP 5 mmHg şi FiO2 50%) în primele 20 de minute de viaţă. Ambii se menţin cu abdomen suplu, elimină meconiu, diureză prezentă, tonus axial uşor diminuat şi reactivitate corespunzătoare VG. Amândoi şi-au îmbunătăţit treptat toleranţa digestivă şi au primit din prima zi de viaţă alimentaţie orală cu FL pentru prematuri, ajungând în a doua zi de viaţă să primească exclusiv alimentaţie orală, cu sistarea aportului parenteral. Ambii au prezentat paraclinic: glicemii menţinute >50 mg%; EAB arterial recoltat la o oră de viaţă a evidenţiat hipoxemie, fără acidoză respiratorie sau metabolică. În ziua a doua de viaţă, ambii nou-născuţi s-au menţinut cu adaptare bună, echilibraţi cardiorespirator şi digestiv, au tolerat alimentaţia orală mixtă (au primit şi LM). Paraclinic, cu hemogramă şi glicemie normale şi CRP <6 mg/L. Fiind internaţi în secţia de TINN, au primit profilactic antibioterapie cu spectru larg de prima treaptă: ampicilină 100 mg/kg/dz i.v. la 12 h şi gentamicină 4 mg/kg/la 24 h. Cel de-al doilea geamăn s-a menţinut cu evoluţie bună până la externare, cu mucoase şi extremităţi rozate, icter tegumentar fiziologic, echilibrat cardiorespirator şi digestiv, alimentat mixt, cu scaune de aspect normal (galben-pai, grunjos), fiind externat la 12 zile de viaţă cu greutatea de 2330 g. Paraclinic în dinamică a prezentat hemogramă cu tendinţă către uşoară anemie (Hb 11g% la externare), leucocite şi trombocite menţinute normale şi CRP <5 mg/L; coprocultură pozitivă pentru Klebsiella pn. la 5 zile de viaţă, cu sensibilitate largă pe antibiogramă şi pozitivă, de asemenea, pentru Enterobacter cloacae rezistent la cefalosporine şi gentamicină, intermediar sensibil la piperacilină/tazobactam şi sensibil la amikacină, netilmicină, ciprofloxacină şi carbapeneme. Alte analize: glicemie normală, ETF cu uşoară hiperecogenitate periventriculară, remisă în evoluţie. Antibioterapia menţionată a fost menţinută patru zile şi a necesitat fototerapie discontinuă. La externare s-a prescris tratamentul anemiei de prematuritate cu preparat oral de fier. Primul geamăn a prezentat la aproximativ 72 de ore de viaţă modificarea bruscă a stării generale, cu facies suferind, tegumente palide, extremităţi reci, criză de apnee reversibilă la stimulare tactilă şi administrare de O2 în flux liber, vărsături bilioase repetate, stază gastrică bilioasă, abdomen destins de volum, sensibil la palpare, fără tranzit spontan pentru gaze şi materii fecale, scaun melenic după tuşeul rectal. Paraclinic: EAB arterial în limite normale, hemograma cu leucopenie şi neutropenie (L1920/mmc, N 1290/mmc, N 67,2%); hemocultură necrescută; procalcitonină mult crescută (42,6 ng/ml), coprocultură pozitivă cu Klebsiella pn. cu sensibilitate largă. Rx. abdominal: fără pneumoperitoneu, anse destinse de conţinut aeric, mai ales în hipocondrul stâng, fără niveluri hidroaerice. Ecografie abdominală: anse mult destinse, peristaltică scăzută, fără lichid interileal. ETF normal. În următoarele ore, nou-născutul, pus în repaus digestiv, cu nutriţie parenterală, dopamină 5 ug/kg/min, antibioterapie empirică pentru suspiciune debut de EUN, continuă să verse bilios în cantitate mare, abdomenul devine sensibil la palpare, meteorizat, prezintă geamăt dureros şi paloare tegumentară. La circa 5 ore de la modificarea bruscă a stării generale este trimis în consult chirurgical la Spitalul Clinic Central de Copii „Gr. Alexandrescu”, unde se prezintă cu: abdomen moderat destins, sensibil, sonda nazogastrică cu aspirat bilios, la tuşeul rectal se evidenţiază sânge vechi şi mucus, fără scaun. Se suspicionează ocluzie intestinală şi este transferat în secţia de TINN. Aici, investigaţiile de laborator şi imagistice în dinamică au arătat: hemogramă cu leucopenie şi neutropenie (L 1330/mmc, N 790/mmc, N 59%, Segm 65% pe frotiu, Hb 13,8 g%, Ht 39 %, T 186000/mmc); CRP crescut la 7,07 mg/dl (VN <0,5); biochimie: AST crescută la 93U/L; Ca ionic scăzut, 3,99 mmol/l, Ca total scăzut, 7,3 mg %, Glu 59 mg%, proteine totale scăzute, 4,56 g%, uree crescută uşor, 49 mg%; ionograma normală; EAB arterial normal (pH 7,46, pCO2 35, pO2 82, HCO3 24,6). Hemocultură pozitivă cu Staphylococcus epidermidis, culturile periferice din lavajul gastric pozitive cu Enterobacter cloacae (rezistent la cefalosporine, ciprofloxacină şi gentamicină, sensibil la carbapeneme); cultura de pe tegumente şi din secreţia otică pozitivă cu stafilococ auriu meticilino-rezistent (sensibil la ciprofloxacină şi rezistent la gentamicină şi oxacilină); imunologie negativă pentru Ac. anti-HIV, Ag. HBS, Ac. anti-HCV, RPR, TPHA.
Rx. abdominală la internare: anse intestinale de calibru crescut periombilical, fără pneumoperitoneu.
Ecografie abdominală la internare: cantitate mică de lichid interileal, anse intestinale cu calibru crescut, aperistaltice, cu pereţi subţiri, aerocolie, aeroenterie. Tranzitul baritat şi irigografia la internare exclud malrotaţia şi volvulusul intestinal. La reevaluarea radiologică abdominală din ziua a patra de viaţă se evidenţiază pneumoperitoneu şi se intervine chirurgical (figurile 1 şi 2).
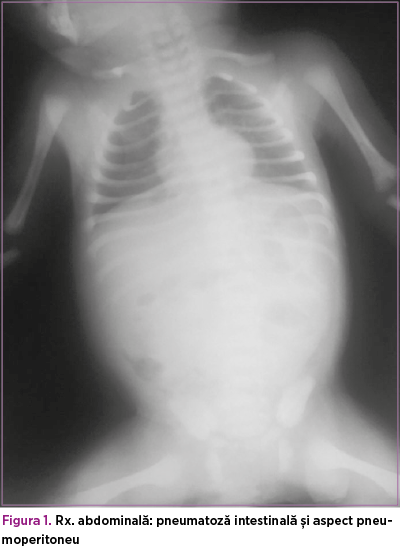
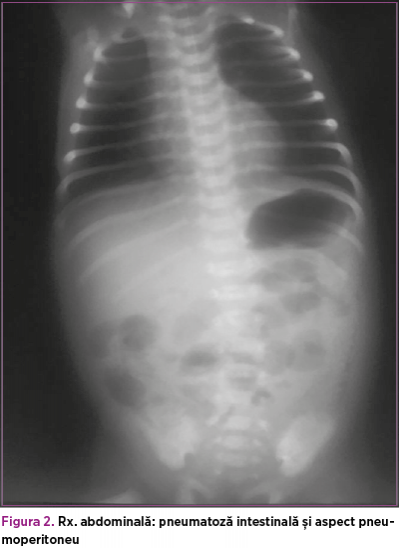
Se practică laparotomie exploratorie cu visceroliză, lavaj şi debridare, rezecţie segmentară de ileon cu ileostomie. Intraoperator: la nivelul ultimei anse ileale, pe o porţiune de 8-10 cm, pornind de la circa 3-4 cm de valvula ileocecală, se constată două perforaţii ileale, cu macerarea peretelui pe circa 5 cm.
Se practică rezecţie segmentară de ileon între cele două perforaţii şi exteriorizarea capetelor la tegument. Culturile din lichidul peritoneal au fost pozitive pentru Enterobacter cloacae, sensibil la carbapeneme şi rezistent la cefalosporine şi gentamicină, intermediar sensibil la amikacină şi ciprofloxacină.
Evoluţia ulterioară a fost favorabilă, cu scăderea treptată a aspiratului gastric, realimentare treptată orală şi scaun prezent pe ileostomă. Paraclinic în evoluţie: hemograma se normalizează treptat, probele inflamatorii scad treptat, biochimia se îmbunătăţeşte treptat. Examen ETF: fără aspecte patologice. Ecografie cord: SIA cu foramen ovale patent cu şunt stânga-dreapta. Se externează cu stare generală bună, abdomen suplu, se alimentează, tranzit intestinal şi diureză prezente.
Discuţii
În prezentarea de caz se regăsesc aspecte etiopatogenice cunoscute ale EUN. Ca şi în studiile amintite, doar primul geamăn a prezentat manifestări de EUN, deşi ambii au avut o adaptare imediată postnatală şi o evoluţie clinică în primele 48 de ore de viaţă asemănătoare. Amândoi cu scor Apgar bun, fără factori de risc infecţioşi. Pot fi însă incriminaţi factorii de risc materni legaţi de HTA maternă, posibil şi modificări hormonale (sarcina obţinută prin FIV), care ar fi putut să afecteze în special primul făt, conform studiilor amintite. Alţi factori neonatali de risc ar fi putut fi hipotensiunea arterială iniţială, care s-a corectat mai lent la primul geamăn. Startul precoce al alimentaţiei orale cu FL, în detrimentul LM, şi avansarea rapidă în volumul de lapte administrat la o masă ar fi putut să fie un factor de luat în seamă în producerea EUN.
De asemenea, tratamentul antibiotic precoce, administrat profilactic, ar putea să explice dismicrobismul intestinal care a facilitat proliferarea florei patogene. Se remarcă acelaşi dezechilibru al colonizării intestinale la ambii gemeni, cu proliferarea florei patogene reprezentate de Enterobacter cloacae, cu rezistenţă crescută la antibiotice, germene întâlnit frecvent în secţiile de TINN, şi a florei mai puţin patogene, reprezentată de Klebsiella pn., frecvent întâlnită şi ea în secţiile de TINN. Este greu de explicat de ce, cu acelaşi start şi evoluţie precoce neonatală, cu aceeaşi colonizare patogenă, doar primul geamăn a manifestat semne de boală. Se remarcă de asemenea şi prognosticul bun după corecţia chirurgicală, în condiţiile unui transfer şi management prompt, odată cu recunoaşterea gravităţii situaţiei clinice.
Concluzii
EUN, o afecţiune gastrointestinală gravă, frecvent legată de prematuritate, apare şi la nou-născuţii near-term şi la termen, cu o incidenţă mai mare în cazul naşterilor gemelare, afectând de obicei primul geamăn, poate deveni o urgenţă chirurgicală, ameninţătoare de viaţă. Pentru prevenirea EUN trebuie cunoscuţi factorii de risc perinatali şi neonatali, un loc important ocupând promovarea alimentaţiei cu LM şi avansarea lentă în alimentaţia orală la prematuri. Pentru un prognostic bun, EUN trebuie recunoscut şi tratat prompt prin măsuri suportive, antibioterapie şi direcţionare către consultul chirurgical.
Bibliografie
1. Peter CS, Feuerhahn M, Bohnhorst B, Schlaud M, Ziesing S, von der Hardt H, Poets CF. Necrotising enterocolitis: is there a relationship to specific pathogens? Eur J Pediatr. 1999;158:67–70. [PubMed]
2. Shelley C Springer, Ted Rosenkrantz. Necrotizing Enterocolitis, Medscape.
3. Sheila M. Gephart, Jacqueline M. McGrath, Judith A. Effken, Melissa D. Halpern. Necrotizing Enterocolitis Risk. State of the Science, Adv Neonatal Care. 2012 Apr; 12(2): 77–89.
4. Panigrahi P. Probiotics and prebiotics in neonatal necrotizing enterocolitis: New opportunities for translational research. Pathophysiology. 2014; 21:35-46. [PubMed]
5. Powell J, Bureau MA, Paré C, Gaildry ML, Cabana D, Patriquin H. Necrotizing enterocolitis. Epidemic following an outbreak of Enterobacter cloacae type 3305573 in a neonatal intensive care unit, Am J Dis Child. 1980 Dec; 134(12):1152-4.
6. Jos van Acker, Francis de Smet, Gaëtan Muyldermans, Adel Bougatef, Anne Naessens, Sabine Lauwers. Outbreak of Necrotizing Enterocolitis Associated with Enterobacter sakazakii in Powdered Milk Formula, Journal of Clinical Microbiology 39(1), 2001, 293-297.
7. Fok TF, Lee CH, Wong EM, Lyon DJ, Wong W, Ng PC, Cheung KL, Cheng A. Risk factors for Enterobacter septicemia in a neonatal unit: case-control study, Clin Infect Dis. 1998 Nov;27(5):1204-9.
8. Sathyaprasad C Burjonrappa, Brian Shea, Diya Goorah. NEC in Twin Pregnancies: Incidence and Outcomes, J Neonatal Surg. 2014 Oct 20; 3(4):45. eCollection 2014 Oct-Dec.
