Perianaesthetic anaphylaxis is rare, but often a severe condition. Common causative culprits are neuromuscular blocking agents, antibiotics and latex. The allergologic survey of the patient with perianaesthetic anaphylaxis includes skin prick and intradermal tests, in vitro tests (specific IgE measurements, basophil activation tests) and, in selected cases, drug provocation tests, and identifies the substances responsible for the perianaesthetic anaphylaxis. It also offers safe alternative substances for subsequent anaesthesia. The experienced allergist has a central role in the allergoanaesthesic team, taking into account that the skin tests are the primary tools for diagnosis and in vitro tests are not a substitute for skin tests.
Abordarea clinică practică a pacientului cu risc de reacţie alergică perianestezică – perspectiva alergologului
A practical clinical approach to the patient at risk of perianaesthetic anaphylaxis – the allergist perspective
First published: 01 martie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.2.1.2018.1469
Abstract
Rezumat
Anafilaxia perianestezică reprezintă un eveniment rar, însă adesea sever. Agenţii etiologici cel mai frecvent implicaţi sunt curarele, antibioticele şi latexul. Bilanţul alergologic al pacientului cu anafilaxie perianestezică include teste cutanate prick şi intradermice, teste in vitro (dozări de IgE specifice, teste de activare a bazofilelor) şi, în situaţii selecţionate, teste de provocare la medicamente. Demersul identifică substanţele incriminate în declanşarea accidentului anafilactic perianestezic. De asemenea, bilanţul oferă şi alternative sigure pentru pacient în cazul unei intervenţii ulterioare. Alergologul cu experienţă în efectuarea şi interpretarea testelor la medicaţia specifică anestezică are un rol central în echipa de alergoanestezie, dat fiind faptul că testele cutanate reprezintă teste de referinţă în cadrul bilanţului şi nu pot fi substituite de către testele in vitro.
Introducere
Bilanţul alergologic al pacientului cu risc de anafilaxie perianestezică reprezintă o etapă importantă în stabilirea dignosticului şi contribuie la reducerea riscului de anafilaxie la pacientul chirurgical. La acest demers participă o echipă multidisciplinară care cuprinde anestezişti, alergologi cu training în alergoanestezie şi medici de laborator cu experienţă în realizarea şi interpretarea tehnicilor de laborator, cum sunt dozările de IgE specifice la agenţi farmacologici, dozări de mediatori ai anafilaxiei sau teste celulare, cum ar fi activarea bazofilului în citometrie de flux. Bilanţul alergologic are rolul de a identifica prin teste alergologice specifice substanţa/substanţele care sunt incriminate în reacţia anafilactică perianestezică şi de a oferi alternative sigure care vor putea fi utilizate cu ocazia unei noi intervenţii. Bilanţul se realizează de către alergolog cu ajutorul testelor cutanate prick şi intradermice şi este completat cu rezultatele testelor in vitro la medicamente. Sinteza rezultatelor este înmânată medicului anestezist, care va folosi informaţiile pentru alegerea unei tehnici anestezice cu risc minim pentru pacient. Identificarea unor factori de risc semnificativi pentru anafilaxia perioperatorie de către anestezist în cursul consultaţiei preanestezice constituie motivaţia pentru efectuarea bilanţului alergologic şi a altor investigaţii în cadrul unui seviciu de alergoanestezie(1).
Manifestări clinice
Reacţiile anafilactice perianestezice, ca şi reacţiile anafilactice apărute în context diferit, sunt în principal consecinţa eliberării masive de mediatori din mastocitele şi bazofilele sensibilizate. O parte dintre reacţiile alergice anafilactice sunt IgE mediate, iar altele sunt non-IgE mediate, după cum arată nomenclatura revizuită pentru alergii pentru uz global, în Raportul Comitetului pentru Revizuirea Nomenclaturii al Organizaţiei Mondiale a Sănătăţii (OMS), încă din 2003(2). Aproximativ 60-70% dintre reacţiile anafilactice perioperatorii sunt IgE mediate(3). Manifestările clinice cele mai sugestive pentru reacţiile IgE mediate sunt urticaria, angioedemul, bronhospasmul şi şocul anafilactic. În cazul agenţilor medicamentoşi, se acceptă un interval de până la 6 ore din momentul contactului cu alergenul până la declanşarea manifestărilor clinice, deşi uzual ele au loc în prima oră de la contact(4). Treptele de severitate pentru reacţiile de hipersensibilitate de tip imediat sunt ilustrate în tabelul 1. În general, reacţiile cu mecanism IgE mediat tind să fie mai severe decât cele non-IgE mediate. Simptomele apar frecvent imediat după administrarea medicaţiei care induce anestezia; simptomele care apar mai târziu (până la o oră sau mai mult) pot fi cauzate de latex sau coloranţi(3).

Date epidemiologice
Şocul anafilactic perianestezic nu constituie o manifestare frecventă. Conform datelor publicate de către autorii australieni, şocul anafilactic este raportat în 1/10000-20000 de proceduri anestezice(5), iar unele date anterioare menţionează o incidenţă a şocului anafilactic între 1/900 şi 1/22000 (Boston Drug Surveillance)(6). În Franţa, frecvenţa reacţiilor este cuprinsă între 1/3500 şi 1/13000 de intervenţii(7,8). Cu toate că şocul anafilactic perianestezic este relativ rar, el reprezintă o manifestare cu o severitate deosebită, ameninţătoare de viaţă(9,10). Mortalitatea în şocul anafilactic perianestezic este de 4%, iar 2% dintre pacienţii afectaţi prezintă leziuni severe ale sistemului nervos central(5).
Etiologie
Agenţii care pot să declanşeze reacţii de hipersensibilitate perianestezice de tip imediat sunt multipli. În declanşarea reacţiilor IgE mediate au fost identificate antibiotice, agenţi blocanţi neuromusculari (curare), latex, unele antiinflamatoare nesteroidiene, gelatine, dezinfectanţi, coloranţi, hipnotice, heparine, substanţe de contrast şi anestezice locale. În reacţiile non-IgE mediate (aşa-zis anafilactoide), pot fi incriminate unele curare, opioide, antiinflamatoare nesteroidiene sau unele substanţe de contrast(11). Există diferenţe semnificative între rapoartele diferitelor ţări în ceea ce priveşte implicarea substanţelor în declanşarea anafilaxiei. Curarele au fost implicate în 93,2% din cazuri în Norvegia, 58,08% în Franţa, 37% în Spania şi în 11,1% din cazuri în SUA. Pentru antibiotice, raportările sunt de 50% în SUA, 44% în Spania, de 12,85% în Franţa şi lipsesc pentru Norvegia. Pentru latex, avem 19,65% în Franţa, 16,6% în SUA, 7,4% în Spania şi 5% în Norvegia(12). În România, agenţii cauzali identificaţi au fost curarele (50%), hipnoticele (17%), latexul (11%), antibioticele (11%) şi anestezicele locale (6%)(13).
Factori de risc
Se recomandă identificarea sistematică a factorilor care favorizează materializarea unei reacţii anafilactice perianestezice în cursul consultaţiei preanestezice(1,3,12). Pacienţii care sunt alergici la una dintre substanţele care ar putea fi administrate în cursul anesteziei şi al căror diagnostic a fost stabilit prin investigaţii alergologice, pacienţii care au avut semne sugestive de reacţie alergică în cursul anesteziilor anterioare, cei care au dezvoltat manifestări clinice de alergie când au fost expuşi la latex (inclusiv cei care relatează alergii la fructe exotice), copiii cu spina bifida sau alte intervenţii multiple în antecedente şi pacienţii cu alergii la factori care pot da reacţii încrucişate cu substanţele folosite în perioada perioperatorie sunt consideraţi a fi la risc din punct de vedere alergologic în cursul unei anestezii(1,3,12,14,15). De asemenea, istoricul personal de anafilaxie de orice origine ar putea fi un factor de risc semnificativ pentru alergia perianestezică(16) şi ar putea fi inclus în anamneza din cadrul consultaţiei preanestezice. Episoadele alergice severe perianestezice şi reacţiile neexplicate în cursul anesteziei reprezintă factori de risc pentru anafilaxia perianestezică(17). Comorbidităţile pot predispune la declanşarea reacţiilor perioperatorii sau pot influenţa nefavorabil evoluţia acestora(1). Mastocitoza predispune la reacţii non-IgE mediate, iar deficitul de C1 inhibitor predispune la apariţia de edeme laringiene, cutanate sau ale peretelui intestinal în cursul intervenţiilor chirurgicale(18). Astmul bronşic la pacienţii operatori nu creşte frecvenţa reacţiilor anafilactice perianestezice, dar astmul necontrolat creşte riscul de deces prin anafilaxie, dacă aceasta apare în cursul anesteziei(19). Cardiomiopatia ischemică şi insuficienţa cardiacă sunt agravate de un episod anafilactic(20). Tratamentele cu -blocante, inhibitori ai enzimei de conversie a angiotensinei sau inhibitori de angiotensină II modifică răspunsul la tratamentul de urgenţă al şocului anafilactic(1).
Algoritm decizional la pacientul care raportează o reacţie anafilactică perianestezică
Bilanţul alergologic nu este recomandat populaţiei chirurgicale în general, ci se adresează numai acelui subset de pacienţi la care se identifică factori de risc semnificativi(1,3). Pacienţii care au prezentat reacţii anafilactice documentate cu ocazia unor operaţii anterioare sau pacienţii care au prezentat reacţii suspecte, sugestive pentru o posibilă anafilaxie perianestezică, reprezintă grupul la care bilanţul alergologic este obligatoriu(1,3,17).
Situaţiile întâlnite în practica medicală, referitoare la pacienţii cu istoric de anafilaxie perianestezică, pot fi diferite, iar acest lucru implică o abordare diferenţiată.
În cazul unei intervenţii chirurgicale în regim de urgenţă, atunci când timpul nu permite efectuarea unui bilanţ alergologic, se recomandă un mediu fără latex, alegerea anesteziei locale/regionale sau, dacă anestezia generală este obligatorie, evitarea substanţelor histamino-eliberatoare şi evitarea curarelor.
În cazul unei intervenţii programate, există timpul şi resursele necesare pentru un bilanţ alergologic standardizat. Întotdeauna se va cere protocolul anestezic de la intervenţia în cursul căreia s-a declanşat reacţia anafilactică perianestezică relatată în istoric. Acesta oferă informaţii clare asupra tuturor substanţelor administrate şi cronologia administrării, precum şi asupra momentului declanşării reacţiei în raport cu expunerea la medicaţia specifică anestezică. Putem să întâlnim două situaţii posibile:
Situaţia în care protocolul anestezic nu este disponibil. În acest caz, după consultaţia de alergoanestezie, se vor testa obligatoriu cutanat (prick, intradermic) toate curarele în uz şi latexul, iar opţional se pot efectua şi determinări de IgE specifice pentru acestea.
Situaţia în care avem acces la protocolul anestezic. În acest caz, se verifică dacă istoricul este compatibil cu un diagnostic de anafilaxie, iar dacă răspunsul este afirmativ, după consultaţia de alergoanestezie, se efectuează testele alergologice specifice. Se vor testa obligatoriu cutanat (prick, intradermic) toate substanţele utilizate şi latexul. În cazul în care testul cutanat este pozitiv pentru curara menţionată în protocolul anestezic, trebuie testate cutanat toate curarele în uz, pentru identificarea reactivităţilor încrucişate posibile. Opţional se pot efectua dozări de IgE specifice. Pentru anestezicele locale, dacă testele cutanate (prick, intradermice) sunt negative, este necesară efectuarea testului de provocare subcutanat(3).
Deşi ghidurile de specialitate încă nu recomandă de rutină efectuarea testelor de activare a bazofilelor în citometrie de flux(3,21), această metodă de diagnostic câştigă din ce în ce mai mult teren şi este utilă în identificarea medicamentului incriminat în reacţie, în special în situaţiile în care testele cutanate sunt negative(22, 23).
Investigaţii recomandate în cadrul bilanţului alergologic perianestezic
Pacientul care a reprezentat subiectul unei reacţii clinice sugestive pentru anafilaxie perianestezică trebuie să efectueze atât investigaţii imediate, care se realizează în momentul reacţiei, după recunoaşterea şi tratamentul prompt al acesteia, cât şi investigaţii la distanţă, ideal la 4-6 săptămâni de la reacţie (această perioadă reprezintă o fereastră negativă, în care testele cutanate pot să fie fals negative), dar nu mai mult de 6 luni de la reacţie, dacă este posibil(3,21,24).
Investigaţiile imediate se referă în special la dozarea de mediatori specifici ai anafilaxiei, şi anume triptaza şi histamina, însă opţional se pot doza şi IgE specifice(3,18,21,24).
Dozarea triptazei în plasmă este recomandată de rutină(1). Triptaza este o serinprotează neutră cu origine mastocitară. Structural, este o moleculă tetramerică ce se găseşte sub două forme, şi , care prezintă o omologie de 90% în secvenţa lanţului de aminoacizi. Pro- triptaza este secretată constituţional de către mastocite şi poate servi la aprecierea numerică a acestora. -triptaza matură reflectă activarea mastocitară. Bazofilele conţin o cantitate de triptază de 300-700 de ori mai redusă decât mastocitele, astfel că dozarea triptazei plasmatice arată în special activarea mastocitelor în cursul anafilaxiei sistemice(1,25). În cursul anafilaxiei, triptaza realizează un peak la 15-60 de minute de la debutul reacţiei. Timpul de înjumătăţire al triptazei în ser este de aproximativ 90 de minute. Momentul optim pentru recoltarea probei este între 60 şi 120 de minute de la debutul reacţiei(3,26). Valorile net crescute (peste 25 µg/ml) comparativ cu valoarea bazală, determinată după rezoluţia completă a reacţiei, sugerează un mecanism IgE mediat. Valorile normale ale triptazei nu exclud total anafilaxia(3).
Investigaţiile la distanţă în raport cu momentul anafilaxiei au ca obiectiv diagnosticul etiologic al reacţiilor anafilactice perinestezice şi se realizează prin determinări in vivo, cum sunt testele cutanate şi testele de provocare, şi teste in vitro, cum sunt IgE specifice sau activarea bazofilelor(1,3,21,24). Descrierea testelor in vitro nu reprezintă obiectivul acestei lucrări, acestea nefiind realizate în mod nemijlocit de către specialistul alergolog, care foloseşte rezultatele testelor de laborator pentru optimizarea diagnosticului.
Testele cutanate la medicaţia specifică anestezică reprezintă la ora actuală testele de referinţă pentru identificarea substanţei/substanţelor implicate în declanşarea anafilaxiei perianestezice(1,3,21). Aceste teste trebuie efectuate numai de către medicul specialist alergolog cu experienţă în interpretarea testelor cutanate la medicamente, şi în special în alergoanestezie, efectuarea lor de către personal neexperimentat nefiind recomandată(3,21). De asemenea, testarea cutanată la medicaţia anestezică specifică nu este un mijloc de screening pentru populaţia chirurgicală în general(3,21,27).
Pentru toate investigaţiile alergologice realizate este obligatorie obţinerea consimţământului informat al pacientului, etapă în cadrul căreia i se explică pacientului riscurile şi beneficiile acestor metode diagnostice(1,3,21). Efectuarea testelor in vivo se face numai în unităţi cu facilităţi de terapie intensivă, ţinând cont de faptul că aceste teste prezintă un risc de a declanşa reacţii sistemice severe(1,3,21). Tehnica de realizare a TCP şi TCID respectă recomandările din ghidurile de specialitate(3,4,21,27). Se testează numai produse comerciale sigilate, cu termen de valabilitate neexpirat şi cu documentaţie ataşată, în condiţii de asepsie(1).
Testul cutanat prick presupune aşezarea unei picături din soluţia de testat pe faţa anterioară a antebraţului, urmată de înţeparea superficială, strict epidermică, a tegumentului, prin picătura de soluţie. Înţeparea se realizează cu o lantetă prick, dar poate fi realizată şi cu vârful unui ac de 25G(21,28). Diluţiile de alergen se realizează pornind de la preparatul comercial, cu ajutorul soluţiei saline fiziologice, până la concentraţia dorită. Interpretarea rezultatelor se realizează la 15-20 de minute de la aplicarea testului, prin măsurarea papulei rezultate. Aceasta se compară cu un martor de control negativ, respectiv soluţia salină fiziologică, şi un martor de control pozitiv, în cazul nostru histamină clorhidrat 1% sau codeină fosfat 9%. Un test se apreciază ca fiind pozitiv dacă dimensiunea papulei este cu cel puţin 3 mm mai mare decât controlul negativ sau măsoară cel puţin jumătate din dimensiunea martorului pozitiv(3,4). Formarea papulei este însoţită frecvent de eritem şi prurit.
Testul cutanat intradermic se realizează prin injectarea unui volum de soluţie test de 0,02-0,03 ml strict intradermic, cu formarea unei papule de injecţie (PI) de 3-4 mm, pe faţa anterioară a antebraţului. Pentru test se utilizează seringi gradate de 1 ml, cu ace intradermice de 29-29½ G, care produc o traumă minimă la nivelul pielii. Interpretarea testului se face după 15-20 de minute de la injectare, prin măsurarea papulei rezultate, numită şi papula edem (PO), şi a haloului de eritem care înconjoară papula. Un test este considerat pozitiv dacă diametrul papulei edem măsoară cel puţin dublul diametrului papulei de injecţie. Controlul negativ este reprezentat de soluţia salină fiziologică. Testarea cutanată începe cu testul prick, iar dacă acesta este negativ, se continuă cu testul intradermic, mai sensibil. Se recomandă realizarea unor diluţii succesive a soluţiilor de test până la atingerea concentraţiei maximale nonreactive(1,3,4,21).
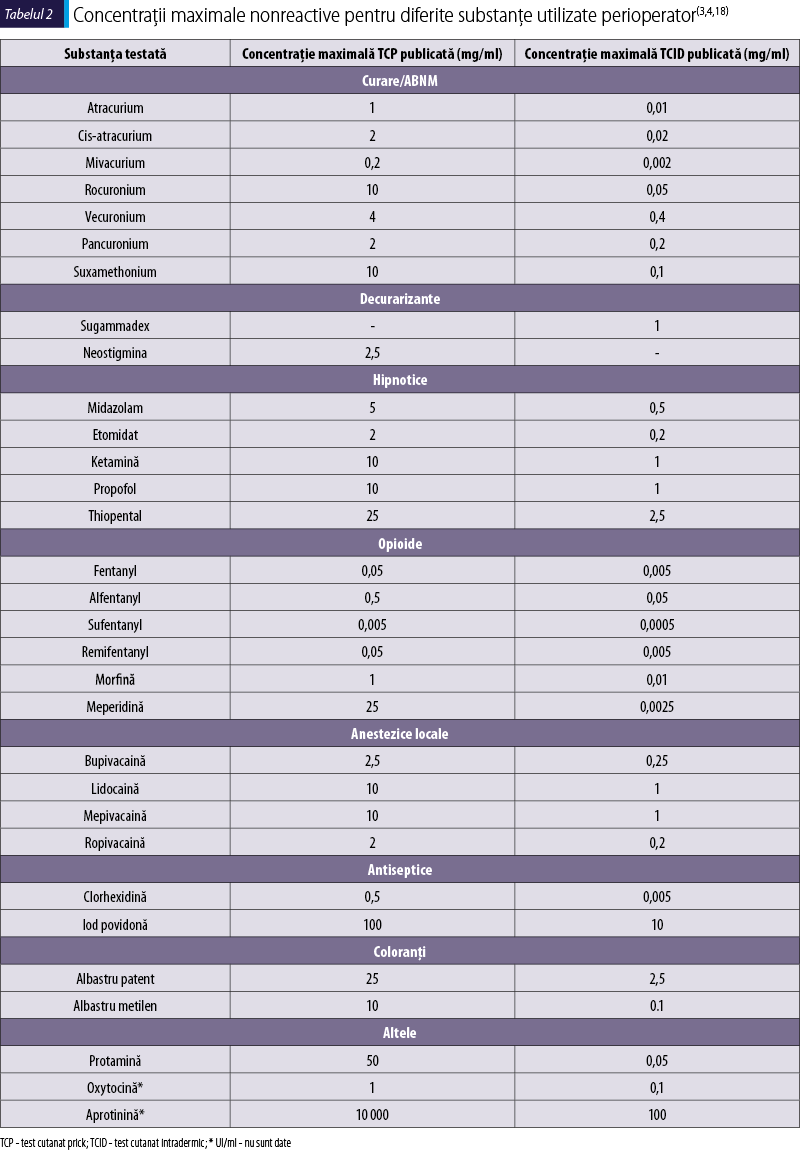
Concentraţiile maximale nonreactive sunt acele concentraţii maxime ale soluţiilor de medicament pentru care nu apar reacţii pozitive la pacienţii nealergici. Depăşirea acestora conduce la reacţii fals pozitive(17). Concentraţiile maximale nonreactive pentru TCP şi TCID la principalele substanţe utilizate perianestezic sunt prezentate în tabelul 2. Concentraţiile recomandate pentru alte clase, cum ar fi antibioticele, se regăsesc în alte publicaţii(29). Chiar dacă există recomandări ferme, pot exista diferenţe de reactivitate cutanată, probabil la nivel populaţional. Unele studii de stabilire a concentraţiilor maximale nonreactive la medicamente pe voluntari sănătoşi pot să arate valori diferite în raport cu ghidurile. De exemplu, pentru midazolam şi ketamine, valoarea de 100 µg/ml respectă definiţia pentru concentraţia maximală nonreactivă pentru TCID la un grup studiat în ţara noastră(30), aceeaşi cu cea sugerată pentru TCID în ghidul ANZAAG, cea mai recentă publicaţie-ghid referitoare la testarea cutanată în anafilaxia perianestezică(21). În cazul în care pacientul utilizează medicaţie care modifică reactivitatea cutanată, aceasta trebuie oprită înainte de test, intervalul de timp depinzând de substanţa utilizată, de pildă antihistaminice, medicaţie de uz psihiatric sau altele(3,21).
Identificarea unor teste cutanate sau a unor IgE specifice pozitive la anumite substanţe, la pacienţi fără istoric de reacţie, poate să arate o sensibilizare latentă. Acest fapt se poate observa, de exemplu, la curare. În ţările în care se depistează sensibilizare latentă la substanţe care conţin ion de amoniu substituit (suxamethoniu, morfină) se observă şi o prevalenţă crescută a anafilaxiei perianestezice cauzată de curare(31,32). Administrarea de sirop de tuse care conţine pholcodină (induce sinteză de Ac antiamoniu) în doze terapeutice la pacienţi cu anafilaxie la curare în antecedente a produs creşterea dramatică a titrului de Ac anti-pholcodină, antimorfină şi antisuxamethoniu(33).
Retragerea pholcodinei de pe piaţă a condus în timp la reducerea prevalenţei sensibilizării la curare şi a numărului de cazuri de anafilaxie la curare(34), ceea ce arată importanţa sensibilizării latente la curare ca posibil factor predispozant pentru anafilaxia perianestezică indusă de curare. Inducerea sensibilizării la un grup de substanţe cum sunt curarele de către epitopi cross-reactivi este bine studiată şi explicată(35). Cu toate acestea, în literatură, singurul factor predictiv pentru pozitivitatea TCP la medicaţia specifică anestezică la pacienţii chirurgicali a fost istoricul pozitiv de alergie la medicamente, altele decât anestezicele(36). Tot în acest sens, istoricul de alergie la alte medicamente decât anestezicele (în special antibiotice) se corelează cu o prevalenţă semnificativă a sensibilizării latente la curare, evidenţiată prin teste cutanate pozitive şi teste pozitive de activare a bazofilelor la curare(37,38). Chiar dacă datele legate de sensibilizarea latentă la medicamente sunt foarte interesante, relevanţa clinică a acestora nu este bine cunoscută şi va reprezenta o provocare pentru aprofundare în viitor.
Testele de provocare au o indicaţie limitată în alergoanestezie şi sunt recomandate pentru anestezice locale, antibiotice, antiinflamatoare şi antialgice, şi nu la toate substanţele folosite în anestezie. Se stabileşte dacă testele cutanate sunt negative şi, în general, pentru identificarea de alternative sigure pentru pacient(3,21).
Rezultatele testelor realizate de către alergolog sunt înmânate într-un format clar anestezistului, care le va utiliza pentru selectarea tehnicii anestezice şi a substanţelor adecvate, pentru a se reduce cât mai mult riscul de anafilaxie perianestezică în cursul unei intervenţii chirurgicale(3).
Impactul realizării bilanţului alergologic, cu identificarea substanţei incriminate în reacţie şi oferirea spre utilizare a unor alternative sigure care permit reducerea riscului la reexpunere, este benefic pentru pacient(39).
Concluzii
Rolul alergologului în echipa multidisciplinară de alergoanestezie este esenţial în identificarea substanţei incriminate în anafilaxie. Testele cutanate sunt teste de referinţă în diagnosticul alergiei de tip imediat la medicaţia specifică anestezică (testele de provocare nu sunt etic acceptate la curare) şi au rol important în diagnosticul alergiei la alte medicamente. Concentraţiile corecte sunt esenţiale pentru un rezultat valid la testarea cutanată şi în acest sens există recomandări ferme în ghiduri. Testele biologice susţin, completează, dar nu înlocuiesc rezultatele de la testele cutanate. Testele de provocare la medicamente, unde este cazul, sunt efectuate de o echipă alergolog – anestezist, în condiţii de siguranţă (facilităţi ATI). Impactul bilanţului alergologic sistematizat asupra anesteziilor ulterioare este benefic, reducând riscurile pacientului legate de reexpunere. Mai mult, o consultaţie complexă, cu o discuţie pertinentă între anestezist şi alergolog, legată de caz, ajută la o interpretare cu o acurateţe optimă a testelor cutanate alergologice.
Bibliografie
- Gherman-Ionică N, Bologa R, Indrei C, Hagău D, Dîrzu D, Trancă S, Hagău N. The allergologic survey of the patient at risk of perioperative anaphylaxis. Romanian Journal of Anaesthesia and Intensive Care, 2009,16(1):44-54.
- Johansson SG, Bieber T, Dahl R et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol 2004;113:832-836.
- Mertes PM, Malinovsky JM, Jouffroy L; Working Group of the SFAR and SFA, Aberer W, Terreehorst I, Brockow K, Demoly P; ENDA; EAACI Interest Group on Drug Allergy. Reducing the risk of anaphylaxis during anesthesia: 2011 updated guidelines for clinical practice. J Investig Allergol Clin Immunol. 2011; 21(6):442-53.
- P. Demoly, N. F. Adkinson, K. Brockow et al., International Consensus on drug allergy. Allergy. 2014 Apr; 69(4):420-37.
- Fisher MM, Baldo BA. The incidence and clinical features of anaphylactic reactions during anaesthesia in Australia. Ann Fr Anesth Reanim 1993; 12:97-104.
- Porter J, Jick H. Drug related deaths among medical inpatients. JAMA 1977; 237:879-881.
- Murat I. Anaphylactic reactions during paediatric anaesthesia; results of the survey of the French Society of Paediatric Anaesthetists (ADARPEF). Paediatr Anaesth 1993; 3:339-343.
- Laxenaire MC. Epidemiology of anesthetic anaphylactoid reactions. Fourth multicenter survey (July 1994-December 1996). Ann Fr Anesth Reanim 1999; 18:796-809.
- Levy JH, Yegin A. Anaphylaxis: what is monitored to make a diagnosis? How is therapy monitored? Anesthesiol Clin North Am 2001; 19:705-715.
- Moss J. Allergy to anesthetics. Anesthesiology 2003; 99:521-523.
- Trautmann A, Seidl C, Stoevesandt J, Seitz CS, General anaesthesia-induced anaphylaxis: impact of allergy testing on subsequent anaesthesia. Clin Exp Allergy. 2016 Jan;46(1):125-32.
- Galvăo VR, Giavina-Bianchi P, Castells M. Perioperative anaphylaxis. Curr Allergy Asthma Rep. 2014 Aug; 14(8):452.
- Gherman-Ionică N, Brezoski ES, Sfichi M, Bologa R, Hagau N. Perianaesthetic anaphylaxis. Initial results of the first Romanian allergo-anaesthesia center. Romanian Journal of Anaesthesia and Intensive Care, 2011, 18:87-94.
- Mertes PM, Laxenaire MC, Lienhart A, et al. Reducing the risk of anaphylaxis during anaesthesia: guidelines for clinical practice. J Investig Allergol Clin Immunol 2005; 15(2): 91-101.
- Ewan PW, Dugué P, Mirakian R, Dixon TA, Harper JN, Nasser SM; BSACI. BSACI guidelines for the investigation of suspected anaphylaxis during general anaesthesia. Clin Exp Allergy. 2009; 40(1): 15-31.
- Freundlich RE, Duggal NM, Housey M, Tremper TT, Engoren MC, Kheterpal S. Intraoperative medications associated with hemodynamically significant anaphylaxis. J Clin Anesth. 2016 Dec;35:415-423.
- Fisher MM, Doig GS. Prevention of anaphylactic reactions to anaesthetic drugs. Drug Safety 2004; 27(6): 393-410.
- Ebo DG, Fisher MM, Hagendorens MM, Bridts CH, Stevens WJ. Anaphylaxis during anaesthesia: diagnostic approach. Allergy 2007; 62: 471-487.
- Simons FER. Anaphylaxis, killer allergy: Long-term management in the community. J Allergy Clin Immunol 2006; 117: 367-377.
- Pascale Dewachter. Perioperative Anaphylaxis. Pichler WJ (ed). Drug Hypersensitivity. Basel, Karger, 2007: 204-215.
- Kolawole H, Marshall SD, Crilly H, Kerridge R, Roessler P. Australian and New Zealand Anaesthetic Allergy Group/Australian and New Zealand College of Anaesthetists Perioperative Anaphylaxis Management Guidelines. Anaesth Intensive Care. 2017 Mar; 45(2):151-158.
- Eberlein B, Wigand S, Lewald H, Kochs E, Ring J, Biedermann T, Darsow U. Utility of basophil activation testing to assess perioperative anaphylactic reactions in real-world practice. Immun Inflamm Dis. 2017 Dec; 5(4):416-420.
- Petrişor C, Sfichi M, Gherman N, Cocis M, Hagau N. The performance of flowcytometry-assisted basophil activation tests in the diagnosis of drug-induced immediate-type hypersensitivity reactions. In Proof and Concepts in Rapid Tests and Technologies. Ed. InTech Open 2016 Croatia. http://dx.doi.org/10.5772/64178.
- Dong SW, Mertes PM, Petitpain N, Hasdenteufel F, Malinovsky JM; GERAP . Hypersensitivity reactions during anesthesia. Results from the ninth French survey (2005-2007). Minerva Anestesiol. 2012 Aug; 78(8):868-78.
- Caughey GH. Tryptase genetics and anaphylaxis. J allergy Clin Immunol 2006; 117: 1411-1414.
- Laroche D, Vergnaud MC, Sillard B, Soufarapis H, Bricard H. Biochemical markers of anaphylactoid reactions to drugs. Comparison of plasma histamine and tryptase. Anesthesiology 1991; 75: 945-949.
- Ewan PW, Dugué P, Mirakian R, Dixon TA, Harper JN, Nasser SM; BSACI. BSACI guidelines for the investigation of suspected anaphylaxis during general anaesthesia. Clin Exp Allergy. 2010 Jan; 40(1):15-31.
- Fisher MM, Bowey CJ. Intradermal compared with prick testing in the diagnosis of anaesthetic allergy. Br J Anaesth 1997; 79: 59-63.
- Brockow K, Garvey LH, Aberer W, et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI DrugAllergy Interest Group position paper. Allergy. 2013 Jun;68(6):702-12.
- Hagau N, Bologa R, Indrei C, Longrois D, Dirzu D, Gherman-Ionică N. Maximum non-reactive concentration of midazolam and ketamine for skin testing study in nonallergic healthy volunteers. Anaesth Intensive Care 2010; 38:513-518.
- Floorvaag E, Johansson SG, Oman H et al. Prevalence of IgE antibodies to morphine. Relation to the high and low incidences of NMBA anapylaxis in Norway and Sweden, respectively. Acta Anaesthesiol Scand 2005; 49: 437-444.
- Florvaag E, Johansson SG. IgE-mediated anaphylactic reactions to neuromuscular blocking agents: can they be prevented? Curr Allergy Asthma Rep. 2008 Sep; 8(5):375-6.
- Harboe T, Johansson SG, Florvaag E, Oman H. Pholcodine exposure raises serum IgE in patients with previous anaphylaxis to neuromuscular blocking agents. Allergy. 2007 Dec; 62(12):1445-50.
- de Pater GH, Florvaag E, Johansson SG, Irgens Å, Petersen MN, Guttormsen AB. Six years without pholcodine; Norwegians are significantly less IgE-sensitized and clinically more tolerant to neuromuscular blocking agents. Allergy. 2016 Nov 9. doi: 10.1111/all.13081.
- Baldo BA, Fisher MM, Pham NH. On the origin and specificity of antibodies to neuromuscular blocking (muscle relaxant) drugs: an immunochemical perspective. Clin Exp Allergy. 2009 Mar;39(3):325-44.
- Tamayo E, Alvarez FJ, Rodriguez-Ceron G, Gomez-Herreras JI, Castrodeza J. Prevalence of positive prick test to anaesthetic drugs in the surgical population. Allergy 2006; 61(8): 952–953.
- Hagau N, Gherman-Ionică N, Hagau D, Petrisor C, Tranca S, Sfichi M, Longrois D. Is a positive history of non anaesthetic drug allergy a predictive factor for positive allergy tests to anaesthetics? Br J Clinical Pharmacology 2012.
- Hagău N, Gherman N, Cociş M, Petrişor C. Antibiotic-induced immediate type hypersensitivity is a risk factor for positive allergy skin tests for neuromuscular blocking agents. Allergology International 2016;65:52-55.
- Trautmann A, Seidl C, Stoevesandt J, Seitz CS, General anaesthesia-induced anaphylaxis: impact of allergy testing on subsequent anaesthesia. Clin Exp Allergy. 2016 Jan; 46(1):125-32.