Dificultăţi în evaluarea sindroamelor de activare mastocitară în practica clinică
Difficulties in evaluating mast cell activation syndromes in clinical practice
Abstract
Mast cell activation syndromes (MCAS) represent a heterogeneous clinical entity caused by recurrent episodes of mast cell activation and degranulation, with polymorphic clinical manifestations and variable severity. Mast cell activation is a rather frequent phenomenon and occurs in a wide range of disorders, including IgE-mediated or non-IgE-mediated allergic diseases, autoimmune diseases and mastocytosis. In most of the cases, neither the cause nor the trigger factors of mast cell activation can be identified. Some of these conditions have definitions and diagnostic criteria similar to those of MCAS and can manifest simultaneously, which poses diagnostic and treatment problems in clinical practice. The correct diagnosis of MCAS, as well as the identification of all comorbidities and underlying diseases are critical in developing a management plan. We aim to evaluate and update the latest published data on mast cell activation syndromes and highlight the main difficulties in the diagnosis and management of this complex pathology.Keywords
mast cellsmastocytosismast cell activation syndromesserum tryptaseRezumat
Sindroamele de activare mastocitară (MCAS) reprezintă un grup eterogen de boli, caracterizate prin episoade recurente de activare şi degranulare mastocitară, având manifestări clinice polimorfe şi severitate variabilă. Activarea mastocitară este un fenomen relativ frecvent şi apare într-un număr mare de afecţiuni, în special bolile alergice IgE mediate sau non-IgE mediate, boli autoimune şi mastocitoze. Într-o mare parte dintre cazuri nu se poate identifica nici cauza şi nici factorii declanşatori ai activării mastocitare. O parte dintre aceste afecţiuni au definiţii şi criterii de diagnostic asemănătoare cu ale MCAS şi se pot manifesta concomitent, ceea ce pune probleme de diagnostic şi de tratament în practica clinică. Diagnosticarea corectă a MCAS şi identificarea tuturor comorbidităţilor şi a patologiilor subiacente au o importanţă crucială în stabilirea planului de management. Ne propunem evaluarea şi actualizarea celor mai recente date publicate despre sindroamele de activare mastocitară şi evidenţierea principalelor dificultăţi în diagnosticul şi managementul acestei patologii complexe.Cuvinte Cheie
mastocitemastocitozesindroame de activare mastocitarătriptază sericăIntroducere
Mastocitele (mast cells – MC) reprezintă celulele-cheie efectoare în reacţiile de hipersensibilitate sistemică şi locală şi sunt, de asemenea, implicate în diverse patologii inflamatorii acute sau cronice(1). Acestea prezintă receptori de mare afinitate pentru IgE (FcεRI) şi produc numeroşi mediatori inflamatori şi vasoactivi, în special histamină, triptază, prostaglandine D2 (PGD2) şi diverse chemokine şi citokine, care sunt depozitate în mod fiziologic în granulele secretoare ale MC(2).
O parte dintre aceşti mediatori, cum este alfa-triptaza, sunt eliberaţi în condiţii fiziologice în mod constant, ceea ce duce la o concentraţie serică bazală scăzută(1). Bazofilele se comportă într-un mod asemănător mastocitelor şi pot interveni în mecanismele reacţiilor alergice şi inflamatorii, dar MC sunt considerate celulele principale implicate în reacţiile anafilactice severe(3).
Capacitatea mastocitelor de a elibera mediatori ai anafilaxiei în prezenţa unui trigger specific determină severitatea reacţiilor anafilactice şi este influenţată de factori cum sunt: numărul de MC implicate, natura şi numărul factorilor declanşatori şi care intervin concomitent, tipul şi cantitatea de IgE, prezenţa comorbidităţilor, factori epigenetici şi alte caracteristici individuale ale pacientului (statusul cardiovascular, efortul fizic, nutriţia, consumul de alcool şi medicamente)(4,5).
Activarea acută a MC se produce în timpul reacţiilor de hipersensibilitate IgE mediată şi poate duce la anafilaxie, în situaţiile în care încărcătura mastocitară este mare şi/sau majoritatea MC sunt hiperactivate şi eliberează masiv şi rapid mediatorii mastocitari sau în prezenţa unor comorbidităţi (de exemplu, boli cardiovasculare sau pulmonare)(4,6).
În cazul reacţiilor de hipersensibilitate sistemice, severe şi recurente (de exemplu, anafilaxie recurentă) diagnosticul de sindrom de activare mastocitară (MCAS) poate fi luat în considerare. Deşi anafilaxia este prezentă în multe cazuri de MCAS, există şi pacienţi care îndeplinesc toate criteriile pentru diagnosticul de MCAS, dar nu prezintă caracteristicile clinice ale anafilaxiei.
Diagnosticul de sindrom de activare mastocitară a fost propus prima dată ca patologie idiopatică distinctă în 2010, iar în ultimii zece ani au fost stabilite criteriile de diagnostic şi clasificare pentru MCAS de către un grup internaţional de experţi(7,8). Cu toate acestea, există încă neconcordanţe referitoare la utilizarea termenului de MCAS în cazul unor categorii particulare de pacienţi, cum sunt cei care prezintă semne de activare mastocitară, dar care nu îndeplinesc toate criteriile de diagnostic. Unii dintre aceşti pacienţi pot avea boli datorate activării mastocitare sau reacţii nespecifice de activare mastocitară, care implică activarea mastocitară locală, mai puţin severă, şi un număr limitat de mediatori(9,10).
Manifestări clinice ale MCAS
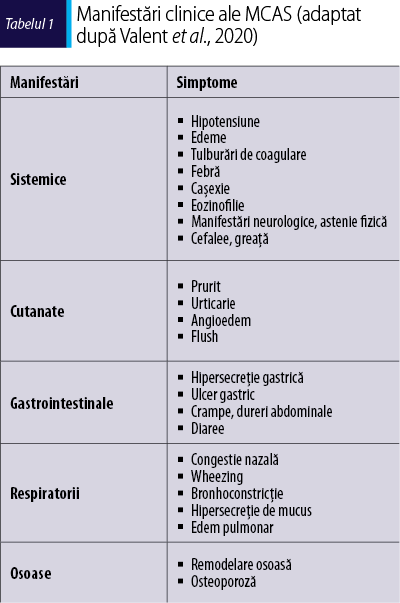
Tabloul clinic al sindroamelor de activare mastocitară este polimorf, cu implicarea mai multor sisteme şi organe, având severitate variabilă, de la forme uşoare (locale) până la manifestări sistemice severe (tabelul 1). Cea mai frecventă patologie asociată activării mastocitare este reprezentată de alergiile IgE mediate. În formele severe, mai multe organe şi sisteme pot fi implicate, iar simptomele corespund de obicei diferitelor grade de anafilaxie. Alte simptome sugestive pentru activarea mastocitară sunt: hipotensiune arterială (sincopă), urticarie, episoade de flush, angioedem, wheezing, cefalee, greaţă, dureri abdominale şi diaree(11).



Valoarea diagnostică a triptazei serice
Concentraţiile serice ale triptazei totale cresc semnificativ în timpul unui episod de anafilaxie, peste valoarea bazală iniţială a individului, atingând vârful plasmatic la aproximativ două ore de la episodul acut şi revine la valoarea iniţială după 4-12 ore de la remisiunea completă a simptomelor(12). Alţi mediatori produşi şi depozitaţi în granulele mastocitare, cum sunt histamina, PGD2 şi metaboliţi ai acestora, sunt eliberaţi, de asemenea, în timpul unui episod de anafilaxie, dar au specificitate mai scăzută comparativ cu triptaza serică şi sunt mai puţin validaţi în contextul MCAS. Majoritatea experţilor sunt de acord că o creştere rapidă a nivelului triptazei serice este specifică activării mastocitare şi este considerată un parametru fiabil de diagnostic. Dacă nu este disponibilă valoarea bazală iniţială a triptazei serice, aceasta poate fi evaluată după cel puţin 24-48 de ore de la remisiunea completă a simptomelor(11,13).
Criterii de diagnostic şi clasificarea sindroamelor de activare mastocitară
Diagnosticul de MCAS poate fi luat în considerare când sunt prezente următoarele manifestări clinice: simptome severe, sistemice şi recurente, cu implicarea a cel puţin două organe diferite, cel mai frecvent sub forma anafilaxiei recurente şi poate fi confirmată degranularea mastocitară(7,10). Se consideră că pentru confirmarea diagnosticului de MCAS trebuie să fie îndeplinite toate cele trei criterii de diagnostic propuse de grupul de experţi (tabelul 2).
După confirmarea diagnosticului de MCAS, următorul pas constă în stabilirea etiologiei şi clasificarea acestuia. În funcţie de patologia subiacentă, sindromul de activare mastocitară poate fi clasificat în: primar (monoclonal), secundar şi idiopatic. În MCAS primare, mastocitele prezintă mutaţia KIT D816V, au caracter clonal (exprimă CD25 frecvent) şi sunt îndeplinite criteriile de diagnostic pentru mastocitoză. În MCAS secundar, elementele de clonalitate sunt absente, cea mai frecventă patologie fiind alergia IgE mediată, iar în MCAS idiopatic nu sunt identificate elemente de clonalitate sau patologii subiacente responsabile pentru activarea mastocitară (tabelul 3)(14).
MCAS monoclonale pot fi identificate şi în cazul pacienţilor care prezintă mutaţia cKIT, dar care nu îndeplinesc criteriile pentru mastocitoză, iar o parte dintre aceşti pacienţi pot evolua către mastocitoză(7,15). În situaţia în care MCAS monoclonal (primar) şi cel secundar coexistă, termenul propus este de MCAS mixt. În cazul acestor pacienţi, riscul de a dezvolta reacţii anafilactice severe, ameninţătoare de viaţă, este foarte mare şi necesită atenţie sporită, alături de un plan terapeutic individualizat (de exemplu, pacienţii cu mastocitoză sistemică şi alergie la veninul de albină). Aceşti pacienţi au recomandare pentru imunoterapie pe tot parcursul vieţii şi, în anumite cazuri, se poate lua în considerare terapia cu omalizumab, pentru prevenirea evenimentelor severe(16). Un aspect important şi încă insuficient clarificat este reprezentat de clasificarea pacienţilor diagnosticaţi cu MCAS şi cu alfa-triptazemie ereditară (HαT), termenul propus fiind de HαT asociată MCAS(14).
Dificultăţi de confirmare a diagnosticului de MCAS
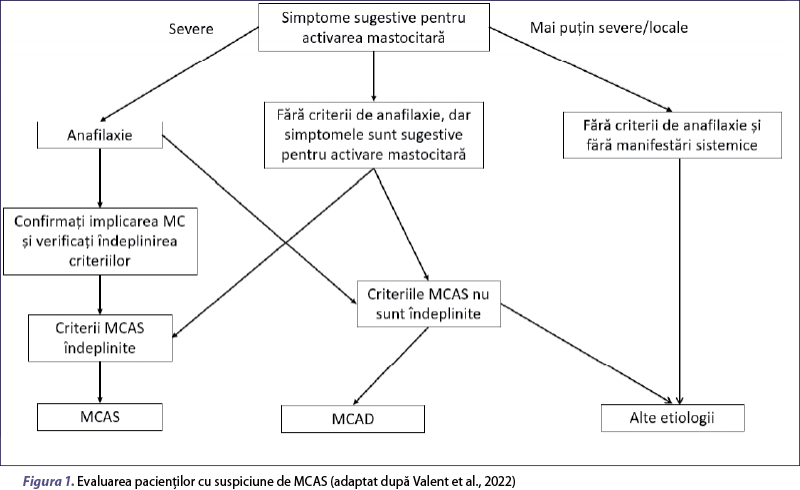
Confirmarea diagnosticului de MCAS necesită timp îndelungat, abordare multidisciplinară şi poate supune pacientul unor proceduri diagnostice laborioase. Există pacienţi care prezintă simptome induse de mediatorii mastocitari, dar la care nu pot fi identificate de la început toate criteriile de MCAS şi care necesită confirmare ulterioară, după completarea investigaţiilor sau în funcţie de răspunsul terapeutic (figura 1)(11). Unii pacienţi pot avea simptomatologie neclară, cu reacţii locale sau sistemice uşoare/moderate, implicând un singur organ, care prezintă doar unele caracteristici ale activării mastocitare, dar care nu corespund criteriilor MCAS. De exemplu:
simptome gastrointestinale izolate (diaree, crampe abdominale, intoleranţe alimentare)
simptome cutanate izolate (flush, prurit, angioedem, erupţii cutanate nespecifice)
manifestări neurologice şi psihiatrice izolate (cefalee, astenie, tulburări de concentrare/brain fog, depresie, deficite neurologice focale sau psihoze).
În majoritatea acestor cazuri, nivelurile serice ale triptazei sau ale celorlalţi mediatori mastocitari nu cresc semnificativ în timpul unui eveniment acut. Unii dintre aceşti pacienţi pot avea, de asemenea, comorbidităţi alergice, cum ar fi rinoconjunctivită alergică sau dermatită atopică, care sunt frecvente în populaţia generală. Diagnosticarea sindroamelor de activare mastocitară la aceşti pacienţi nu este justificată şi ar trebui să determine medicul să caute criterii suplimentare, mai concrete, pentru activarea mastocitară(9,10,17). O altă problemă de diagnostic este reprezentată de pacienţii care sunt trataţi în secţiile de terapie intensivă pentru reacţii anafilactice severe, fără a se doza triptaza serică, iar răspunsul la tratamentul cu antihistaminice sau antimediatori este incert. Recomandarea este ca aceşti pacienţi să fie diagnosticaţi iniţial cu anafilaxie şi ulterior confirmaţi cu MCAS, când toate criteriile de diagnostic sunt îndeplinite(14).
Patologii asociate care pot contribui la manifestrile clinice ale MCAS
Mai multe condiţii patologice, boli genetice şi comorbidităţi sunt considerate triggeri ai activării mastocitare, cele mai importante fiind alergiile IgE mediate şi bolile mastocitare clonale, în special când acestea coexistă. Pe lângă acestea au fost identificaţi şi alţi cofactori responsabili pentru activarea mastocitelor, cum sunt: alergiile non-IgE mediate, stimulii fizici (efort fizic, vibraţii, variaţii de temperatură), reacţiile inflamatorii locale şi infecţiile virale sau bacteriene.
Diagnosticul diferenţial al MCAS
O serie de afecţiuni şi condiţii medicale, cum sunt bolile infecţioase, autoimune, cardiace, endocrine sau neurologice şi tulburările psihiatrice, pot avea tablou clinic asemănător cu al MCAS. Principala problemă de diagnostic diferenţial între MCAS şi aceste patologii o reprezintă suprapunerea simptomelor, în absenţa confirmării activării mastocitare prin dozarea biomarkerilor specifici. În tabelul 4 sunt prezentate principalele afecţiuni care pot fi confundate cu MCAS pe baza criteriului clinic, ceea ce sugerează importanţa aplicării tuturor criteriilor de diagnostic pentru MCAS şi abordarea multidisciplinară, în cazul patologiilor preexistente(18).
Abordarea terapeutică în MCAS
Dovezile acumulate în ultimii ani sugerează că pacienţii cu MCAS necesită o abordare multidisciplinară şi un tratament individualizat, adecvat fiecărui caz(11,19). Este foarte importantă identificarea patologiilor subiacente care contribuie semnificativ la severitatea simptomelor de activare mastocitară. Toţi pacienţii cu boli mastocitare ar trebui să primească tratament de fond cu blocanţi ai receptorilor de histamină (anti-H1, anti-H2) şi stabilizatori ai membranei mastocitare, cum este cromoglicatul de sodiu, în doze optime necesare pentru controlul simptomelor(20). În cazul pacienţilor cu comorbidităţi sau patologii asociate (alergii IgE mediate, infecţii, boli inflamatorii cronice), tratamentul acestora poate include imunoterapie (de exemplu, pentru alergia la veninul de himenoptere), tratament antiinfecţios sau antiinflamator. Corticoterapia poate fi utilizată în bolile inflamatorii severe(21). Prin urmare, diagnosticarea corectă şi completă a sindroamelor de activare mastocitară şi identificarea patologiilor asociate ar trebui să ofere baza pentru dezvoltarea unei strategii terapeutice individualizate, pentru cea mai mare parte a cazurilor de MCAS.
Concluzii
Sindroamele de activare mastocitară reprezintă o patologie relativ rară, cu manifestari clinice datorate implicării multiorganice induse de mastocitele activate, caracterizate adesea prin semne şi simptome acute de tip anafilaxie sau patologie asociată. Confirmarea diagnosticului şi managementul sindroamelor de activare mastocitară sunt dificile în practica clinică, necesită timp şi o abordare multidisciplinară şi personalizată. Evaluarea pacienţilor cu suspiciune de MCAS trebuie făcută în centre specializate, de către echipe de specialişti cu experienţă clinică în domeniul bolilor mastocitare, pentru a îmbunătăţi colaborarea interdisciplinară şi expertiza în acest domeniu medical.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Valent P, Akin C, Hartmann K, Nilsson G, Reiter A, Hermine O, Sotlar K, Sperr WR, Escribano L, George TI, Kluin-Nelemans HC, Ustun C, Triggiani M, Brockow K, Gotlib J, Orfao A, Kovanen PT, Hadzijusufovic E, Sadovnik I, Horny HP, Arock M, Schwartz LB, Austen KF, Metcalfe DD, Galli SJ. Mast cells as a unique hematopoietic lineage and cell system: From Paul Ehrlich’s visions to precision medicine concepts. Theranostics. 2020 Aug 29;10(23):10743-10768. doi: 10.7150/thno.46719.
- Mukai K, Tsai M, Saito H, Galli SJ. Mast cells as sources of cytokines, chemokines, and growth factors. Immunol Rev. 2018 Mar;282(1):121-150. doi: 10.1111/imr.12634.
- Gibbs BF. Human basophils as effectors and immunomodulators of allergic inflammation and innate immunity. Clin Exp Med. 2005 Jul;5(2):43-9. doi: 10.1007/s10238-005-0064-5.
- Theoharides TC, Valent P, Akin C. Mast Cells, Mastocytosis, and Related Disorders. N Engl J Med. 2015 Jul 9;373(2):163-72. doi: 10.1056/NEJMra1409760.
- Valent P. Risk factors and management of severe life-threatening anaphylaxis in patients with clonal mast cell disorders. Clin Exp Allergy. 2014 Jul;44(7):914-20. doi: 10.1111/cea.12318.
- Peavy RD, Metcalfe DD. Understanding the mechanisms of anaphylaxis. Curr Opin Allergy Clin Immunol. 2008 Aug;8(4):310-5. doi: 10.1097/ACI.0b013e3283036a90.
- Akin C, Valent P, Metcalfe DD. Mast cell activation syndrome: Proposed diagnostic criteria. J Allergy Clin Immunol. 2010 Dec;126(6):1099-104.e4. doi: 10.1016/j.jaci.2010.08.035.
- Hamilton MJ, Hornick JL, Akin C, Castells MC, Greenberger NJ. Mast cell activation syndrome: a newly recognized disorder with systemic clinical manifestations. J Allergy Clin Immunol. 2011 Jul;128(1):147-152.e2. doi: 10.1016/j.jaci.2011.04.037.
- Valent P, Bonadonna P, Hartmann K, Broesby-Olsen S, Brockow K, Butterfield JH, Triggiani M, Lyons JJ, Oude Elberink JNG, Arock M, Metcalfe DD, Akin C. Why the 20% + 2 Tryptase Formula Is a Diagnostic Gold Standard for Severe Systemic Mast Cell Activation and Mast Cell Activation Syndrome. Int Arch Allergy Immunol. 2019;180(1):44-51. doi: 10.1159/000501079.
- Valent P, Akin C, Hartmann K, Alvarez-Twose I, Brockow K, Hermine O, Niedoszytko M, Schwaab J, Lyons JJ, Carter MC, Elberink HO, Butterfield JH, George TI, Greiner G, Ustun C, Bonadonna P, Sotlar K, Nilsson G, Jawhar M, Siebenhaar F, Broesby-Olsen S, Yavuz S, Zanotti R, Lange M, Nedoszytko B, Hoermann G, Castells M, Radia DH, Muñoz-Gonzalez JI, Sperr WR, Triggiani M, Kluin-Nelemans HC, Galli SJ, Schwartz LB, Reiter A, Orfao A, Gotlib J, Arock M, Horny HP, Metcalfe DD. Updated Diagnostic Criteria and Classification of Mast Cell Disorders: A Consensus Proposal. Hemasphere. 2021 Oct 13;5(11):e646. doi: 10.1097/HS9.0000000000000646.
- Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, Brockow K, Siebenhaar F, Triggiani M, Arock M, Romantowski J, Górska A, Schwartz LB, Metcalfe DD. Diagnosis, Classification and Management of Mast Cell Activation Syndromes (MCAS) in the Era of Personalized Medicine. Int J Mol Sci. 2020 Nov 27;21(23):9030. doi: 10.3390/ijms21239030.
- Valent P, Hartmann K, Bonadonna P, Niedoszytko M, Triggiani M, Arock M, Brockow K. Mast Cell Activation Syndromes: Collegium Internationale Allergologicum Update 2022. Int Arch Allergy Immunol. 2022;183(7):693-705. doi: 10.1159/000524532.
- Leru PM. Evaluation and Classification of Mast Cell Disorders: A Difficult to Manage Pathology in Clinical Practice. Cureus. 2022 Feb 13;14(2):e22177. doi: 10.7759/cureus.22177.
- Valent P, Hartmann K, Bonadonna P, Gülen T, Brockow K, Alvarez-Twose I, Hermine O, Niedoszytko M, Carter MC, Hoermann G, Butterfield JH, Lyons JJ, Sperr WR, Greiner G, Sotlar K, Kluin-Nelemans HC, Schwaab J, Lange M, George TI, Siebenhaar F, Broesby-Olsen S, Jawhar M, Nedoszytko B, Castells M, Orfao A, Gotlib J, Reiter A, Horny HP, Triggiani M, Arock M, Metcalfe DD, Akin C. Global Classification of Mast Cell Activation Disorders: An ICD-10-CM-Adjusted Proposal of the ECNM-AIM Consortium. J Allergy Clin Immunol Pract. 2022 Aug;10(8):1941-1950. doi: 10.1016/j.jaip.2022.05.007.
- Sonneck K, Florian S, Müllauer L, Wimazal F, Födinger M, Sperr WR, Valent P. Diagnostic and subdiagnostic accumulation of mast cells in the bone marrow of patients with anaphylaxis: Monoclonal mast cell activation syndrome. Int Arch Allergy Immunol. 2007;142(2):158-64. doi: 10.1159/000096442.
- Castells M, Butterfield J. Mast Cell Activation Syndrome and Mastocytosis: Initial Treatment Options and Long-Term Management. J Allergy Clin Immunol Pract. 2019 Apr;7(4):1097-1106. doi: 10.1016/j.jaip.2019.02.002.
- Gülen T, Akin C, Bonadonna P, Siebenhaar F, Broesby-Olsen S, Brockow K, Niedoszytko M, Nedoszytko B, Oude Elberink HNG, Butterfield JH, Sperr WR, Alvarez-Twose I, Horny HP, Sotlar K, Schwaab J, Jawhar M, Zanotti R, Nilsson G, Lyons JJ, Carter MC, George TI, Hermine O, Gotlib J, Orfao A, Triggiani M, Reiter A, Hartmann K, Castells M, Arock M, Schwartz LB, Metcalfe DD, Valent P. Selecting the Right Criteria and Proper Classification to Diagnose Mast Cell Activation Syndromes: A Critical Review. J Allergy Clin Immunol Pract. 2021 Nov;9(11):3918-3928. doi: 10.1016/j.jaip.2021.06.011.
- Khokhar D, Akin C. Mast Cell Activation: When the Whole Is Greater than the Sum of Its Parts. Med Clin North Am. 2020 Jan;104(1):177-187. doi: 10.1016/j.mcna.2019.09.002.
- Leru PM, Anton VF, Ureche C, Zurac S, Bratu O, Neagoe CD. Mast cell activation syndromes – evaluation of current diagnostic criteria and laboratory tools in clinical practice (Review). Exp Ther Med. 2020 Sep;20(3):2348-2351. doi: 10.3892/etm.2020.8947.
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, Butterfield JH, Carter M, Fox CC, Maitland A, Pongdee T, Mustafa SS, Ravi A, Tobin MC, Vliagoftis H, Schwartz LB. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management.
- J Allergy Clin Immunol. 2019 Oct;144(4):883-896. doi: 10.1016/j.jaci.2019.08.023.
- Bonadonna P, Bonifacio M, Lombardo C, Zanotti R. Hymenoptera Allergy and Mast Cell Activation Syndromes. Curr Allergy Asthma Rep. 2016 Jan;16(1):5. doi: 10.1007/s11882-015-0582-5.





