Sindromul de activare mastocitară – tablou clinic şi criterii de diagnostic
Mast cell activation syndrome — clinical presentation and diagnostic criteria
Abstract
The Mast Cell Activation Syndrome (MCAS) is considered to be a chronic multisystem disease, understudied and underdiagnosed, which stems from the improper mast cell activation and the high quantity of released mediators.The clinical manifestations vary and involve at least one system. In order to rule out other potential pathologies with similar clinical presentation, it is important to perform a thorough differential diagnosis.
Establishing an early correct diagnosis represents a challenge for the clinician.
Avoiding the exposure to individual triggers and the chronic treatment against mast cell mediators such as antihistamines represent the main therapeutic goal.
Keywords
mast cell activation syndromechemical mediatorshistamine receptor antagonistsRezumat
Sindromul de activare mastocitară (SAM) este o tulburare multisistemică cronică, insuficient recunoscută şi diagnosticată, rezultat al activării necorespunzătoare a mastocitelor din organism şi al cantităţii mari de mediatori chimici eliberaţi.Tabloul clinic este unul polimorf, afectând cel puţin un sistem. Acest fapt impune efectuarea unui diagnostic diferenţial amănunţit pentru excluderea altor patologii care se pot prezenta cu manifestări clinice similare. Stabilirea unui diagnostic corect într-un timp cât mai scurt de la debutul simptomelor reprezintă o adevărată provocare pentru clinician.
Managementul terapeutic se adresează în principal măsurilor de evitare a expunerii la factori declanşatori individuali, alături de administrarea cronică a terapiei împotriva mediatorilor mastocitari, precum antagoniştii receptorilor de histamină.
Cuvinte Cheie
sindromul de activare mastocitarămediatori chimiciantagoniştii receptorilor de histaminăIntroducere
Sindromul de activare mastocitară (SAM) cuprinde un spectru larg de patologii, cu etiologii diferite, dar cu acelaşi mecanism fiziopatologic sau cu mecanisme fiziopatologice asemănătoare, manifestate prin aceeaşi constelaţie de semne şi simptome, secundare activării/degranulării mastocitare(1).
Din cauza lipsei unor determinări fezabile ale metaboliţilor mediatorilor mastocitari (histamină, prostaglandină, leukotriene etc.) şi a stabilirii unor criterii de diagnostic bazate pe studii clinice randomizate, până în prezent nu s-a putut stabili prevalenţa exactă a SAM în populaţia generală(2).
Fiziopatologie
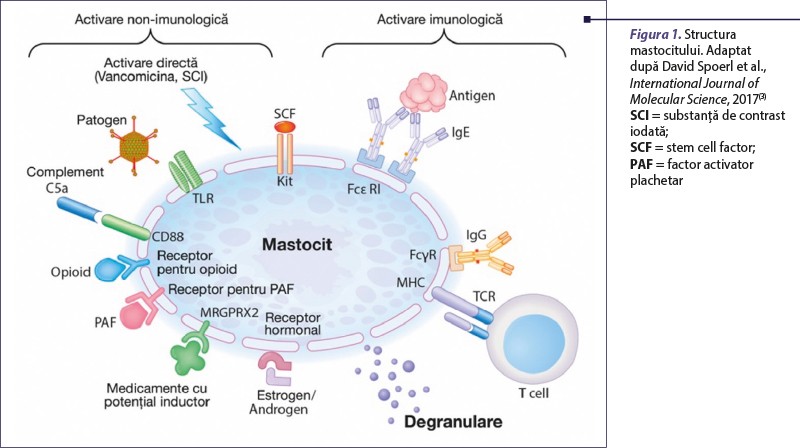
Celulele mastocitare cuprind o populaţie eterogenă de celule cu ultrastructură, morfologie şi conţinut în substanţe mediatoare diferite. Acestea cuprind o întreagă constelaţie de receptori, care pot fi activaţi atât de antigene şi superantigene, cât şi de o gamă largă de stimuli imunologici şi nonimunologici (figura 1)(3).
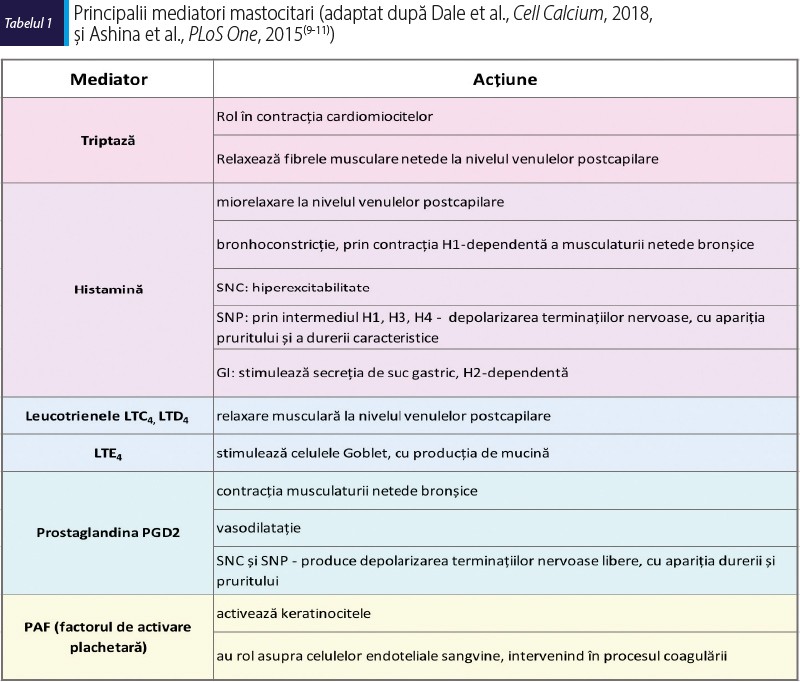
În funcţie de stimulul perceput şi de receptorul stimulat, mastocitul răspunde prin eliberarea de mediatori chimici preformaţi (depozitaţi în granulocitele acestora) şi/sau de mediatori sintetizaţi de novo (tabelul 1)(4,5).
Principalii receptori mastocitari sunt:
-
FcεRI – receptorul de înaltă afinitate pentru imunoglobulina E
-
FcγRIIA – receptorul de înaltă afinitate pentru imunoglobulina G
-
MRGPRX2 – receptor membranar cuplat cu proteina G tip X2/Mas-related G-protein coupled receptor member X2
-
TCR – receptorul pentru limfocitul T (implicat în reacţiile mediate celular, cu manifestare clinică de tip întârziat)
-
TLR (toll‑like receptor) – receptor pentru structuri bacteriene, virale, parazitare(3,4,6).
Mastocitele iau naştere din celula stem hematopoietică pluripotentă, apoi sunt eliberate din măduva hematogenă în circulaţia sistemică sub formă de celule mononucleare nediferenţiate (CD34+, CD117+). Ulterior, sub influenţa unor semnale şi factori chemoatractanţi, acestea migrează în ţesuturi-ţintă(7).
Ţesuturile-ţintă sunt reprezentate în principal de tegument şi mucoase care tapetează structuri anatomice care comunică direct cu exteriorul organismului (ochi, tract respirator, tract digestiv)(7). Această poziţie strategică a mastocitelor le permite să adopte atitudinea unor „gardieni ai sistemului imunitar”, cu capacitatea de a percepe rapid stimulii şi de a declanşa diverse mecanisme biochimice, ca răspuns la modificările metabolice şi/sau imunologice din micromediul înconjurător(5).
Aici se diferenţiază (maturează), orchestrate de citokinele locale, de matricea tisulară şi de celulele rezidente precum fibroblastele. Fibroblastele, prin secreţia de SCF (stem cell factor), participă la proliferarea şi maturarea mastocitelor(4). SCF, factor de creştere indispensabil pentru supravieţuirea celulei mastocitare, reprezintă ligandul receptorului kit (CD117), receptor codificat de o protooncogenă, c-Kit(8).
Manifestări clinice
Ca urmare a legăturii intime şi extrem de complexe dintre celula mastocitară şi majoritatea sistemelor organismului uman, tabloul clinic este unul polimorf(12). Severitatea simptomatologiei poate varia, de la forme uşoare până la forme ameninţătoare de viaţă.
Principalele manifestări clinice sunt: eritem generalizat/urticarie, angioedem, diaree, wheezing, sincopă.
Manifestări generale: fatigabilitate, transpiraţii profuze, flushing, pletoră/paloare, prurit migrator(13).
Tegumentare: dermografism, erupţii cutanate (maculopapulare/urticaria pigmentosa, mono‑ sau polimorfe), telangiectazii, xeroză, foliculită, angioedem, alopecie, onicodistrofii(13).
Pulmonare: tuse, dispnee (de regulă uşoară, episodică, cu imposibilitatea de inspir profund şi cu probe funcţionale respiratorii normale), wheezing recurent(13).
Cardiovasculare: presincopă, hipotensiune, tahicardie, palpitaţii, angină pectorală(13).
Gastrointestinale: reflux gastrointestinal, greaţă, emeză (uneori ciclică), diaree şi/sau constipaţie (deseori alternând), disfagie, meteorism abdominal (de regulă, postprandial şi cu caracter acut/subacut, uneori cu distensie abdominală importantă), durere abdominală migratorie (secundară inflamaţiei luminale/transmurale şi distensiei organelor) (13).
Alte manifestări clinice:
-
conjunctivită(13);
-
simptome de otită externă/medie sterilă/infecţioasă, hipoacuzie şi/sau tinitus, rinoree, congestie nazală, epistaxis(13);
-
adenopatie, splenomegalie(13);
-
dureri musculare/articulare/osoase migratorii, hipermobilitate/laxitate articulară(13);
-
cefalee, neuropatii senzitive (cel mai frecvent: parestezii migratorii la nivelul extremităţilor distale), ataxie episodică (deşi neuropatia motorie este rar dovedită), disautonomie, convulsii epileptice, convulsii pseudoepileptice (probabil în context disautonomic), disfuncţii cognitive (memorie, concentrare şi găsirea cuvintelor), tulburări de somn (insomnie, treziri frecvente, hipersomnolenţă, somn neodihnitor; mai rar: apnee de somn, somnambulism, somnilocvie, paralizie în somn, pavor nocturn)(13);
-
tulburări ale stării de dispoziţie (depresie, iritabilitate, labilitate emoţională), tulburări anxioase (anxietate, atacuri de panică), deficit de atenţie/hiperactivitate, psihoză francă (rară)(13).
Din punct de vedere imunologic, apar reacţii de hipersensibilitate, risc crescut pentru malignităţi şi autoimunitate, susceptibilitate crescută la infecţii, niveluri crescute/scăzute ale imunoglobulinelor de orice tip, gamapatie monoclonală cu semnificaţie clinică incertă (uneori)(13).
Clasificare SAM şi etiologii
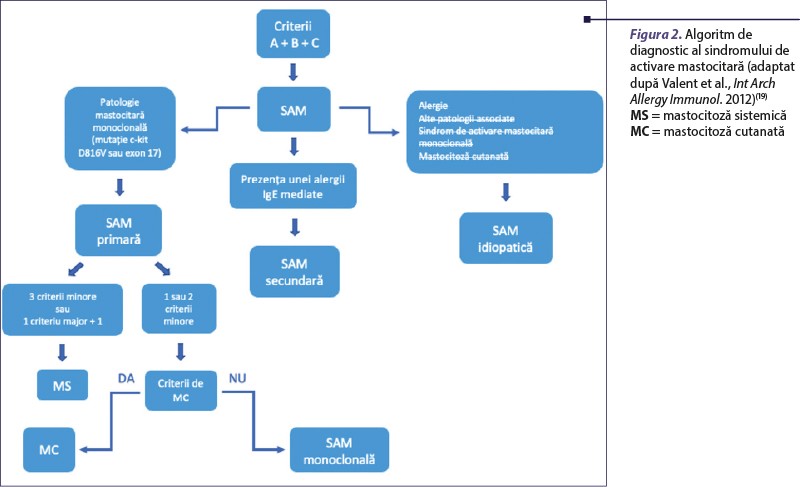
În funcţie de etiologie, SAM poate fi primar, secundar sau idiopatic.
În SAM primar, celulele mastocitare prezintă mutaţia KIT D816V şi exprimă CD25. Cauzele primare de activare mastocitară sunt rare şi sunt reprezentate de mastocitoză (forma sistemică sau cutanată) şi sindromul de activare mastocitară monoclonal (SAMM)(14).
Datele genetice disponibile sugerează că mastocitoza sistemică şi sindromul de activare mastocitară ar reprezenta două entităţi cu prezentări/manifestări clinice variate, ale unui proces genetic comun care implică disfuncţia receptorului KIT al celulei mastocitare. Din acest motiv, unii autori propun clasificarea sindromului de activare mastocitară în SAM clonal şi de clonalitate nedeterminată (în loc de actuala clasificare acceptată – SAM nonclonal) până la introducerea secvenţierii întregului genom, ca investigaţie de rutină la această categorie de pacienţi(15).
Mastocitoza, atât sub formă cutanată, cât şi sub formă sistemică, poate pune probleme de diagnostic în contextul unei afectări multisistemice şi al prezentării clinice eterogene. Pacienţii prezintă simptome datorate degranulării mastocitare, în urma expunerii la anumiţi stimuli fizici, psihici, la medicamente sau alimente(2). Unii pacienţi pot prezenta urticaria pigmentosa, manifestare cutanată tipică, numită şi mastocitoză cutanată maculopapulară(16). O formă particulară de prezentare a mastocitozei sistemice este anafilaxia indusă de veninul de himenoptere, în lipsa IgE specifice(17).
Diagnosticul se confirmă în prezenţa criteriului major şi a unuia minor sau când sunt prezente cel puţin trei criterii minore de diagnostic(18).
Criteriul major de diagnostic: infiltrate multifocale dense de mastocite în secţiunile de biopsie din măduva osoasă şi/sau alte organe extracutanate (≥15 celule mastocitare în agregate)(13).
Criteriile minore de diagnostic:
-
≥25% dintre mastocite prezintă anomalii morfologice în secţiunile de biopsie din măduva osoasă sau alte organe extracutanate/≥25% dintre mastocitele de pe frotiul obţinut din aspirat medular sunt imature/atipice(18);
-
detecţia unor mutaţii activatoare ale c-KIT la nivelul mastocitelor din măduva osoasă, sânge sau din alte ţesuturi(18);
-
mastocitele din măduva osoasă, sânge sau din alte organe extracutanate exprimă CD25 şi/sau CD2(18);
-
triptaza serică totală persistent >20 ng/mL (excluzând cazurile cu boală hematologică mielodidă asociată) (18).
Sindromul de activare mastocitară monoclonal reprezintă o entitate specială, în care mastocitele clonale sunt identificate, dar nu sunt îndeplinite criteriile pentru mastocitoză. În dinamică, acesta poate evolua către mastocitoză(19).
În SAM secundar, anomaliile markerilor de suprafaţă ai celulelor mastocitare sunt absente. Cauzele secundare de activare mastocitară sunt mai frecvente şi sunt reprezentate de condiţii în care atât numărul, cât şi funcţia mastocitelor sunt aparent normale, dar există anumiţi stimuli identificabili care provoacă degranularea acestora (alergeni, anticorpi, medicamente, infecţii, factori fizici)(19).
Cele mai frecvente cauze sunt:
-
alergii IgE mediate sau non-IgE mediate (la alimente, anumite medicamente, înţepătură de himenoptere);
-
urticariile induse de stimuli fizici;
-
boli inflamatorii cronice/autoimune, care asociază creşterea numărului de mastocite şi infiltrarea diferitelor organe şi ţesuturi (poliartrită reumatoidă, lupus eritematos, psoriazis, dermatită atopică, fibroză pulmonară);
-
procese neoplazice, în care poate fi crescut numărul mastocitelor la nivel tisular (neoplasm mamar, limfom Hodgkin, cancere ale ţesutului conjunctiv/pielii) sau poate fi crescută expresia SCF, care duce la proliferarea celulelor mastocitare în măduva osoasă – anemia aplastică(20);
-
infecţii cronice(26).
-
Principalii factori cu potenţial inductor al degranulării mastocitare:
-
Etanolul. Acetaldehida, metabolit al etanolului, poate stimula degranularea nespecifică a mastocitului in vitro(21-23).
-
Clase de medicamente cu potenţial inductor al degranulării mastocitare: anestezice locale (lidocaină), anestezice generale, opiozi, blocanţi neuromusculari, antiinflamatoare nesteroidiene, antibiotice (fluorochinolone(24)), substanţe de contrast iodate sau adenozină(25,26).
-
Alergene alimentare: lactate, cereale, fructe de mare, aditivi alimentari, condimente(25).
-
Excesul hormonal de: estrogen, progesteron, CRH (hormonul eliberator al corticotropinei), α-MSH (hormon stimulant al melanocitelor)(26).
-
Glifosat – erbicid utilizat pe scară largă în agricultură(27).
-
Stresul emoţional şi privarea de somn(28).
-
Stimuli fizici: căldura/frigul în exces, presiunea, fricţiunea(29).
SAM poate fi considerat idiopatic când sunt îndeplinite criteriile stabilite de grupul de consens, dar nu poate fi identificat un stimul extern, un proces inflamator sau neoplazic şi nu sunt detectate mastocite clonale(14,30).
Algoritm de diagnostic
În 2010, un grup de experţi alcătuit din specialişti din domeniile alergologiei, dermatologiei, hematologiei şi patologiei clinice au elaborat pentru prima dată un consens în care au fost propuse terminologia, clasificarea şi criteriile de diagnostic ale sindromului de activare mastocitară(13,19).

Este important de ştiut faptul că alte patologii, precum sepsisul, furtuna citokinică asociată administrării tratamentelor biologice, intoxicaţia acută şi urgenţele endocrinologice, pot mima sindromul de activare mastocitară şi trebuie excluse înainte de a stabili acest diagnostic(31,14).
Criteriile de diagnostic stabilite de grupul de consens, în baza cărora poate fi confirmat diagnosticul de sindrom de activare mastocitară (tabelul 2)(13,19):
1. Semne şi simptome recurente sugestive pentru activare mastocitară, cu implicarea a două sau mai multor organe.
2. Modificări biologice caracteristice degranulării mastocitare/eliberării mediatorilor (creşterea triptazei serice cu 20%+2ng/mL peste valoarea bazală individuală).
3. Răspuns la agenţii terapeutici stabilizatori ai mastocitelor sau care vizează mediatorii eliberaţi.
Caracterul multisistemic şi de lungă durată al simptomelor întâlnite în sindromul de activare mastocitară subliniază importanţa efectuării unei anamneze amănunţite şi a obţinerii unui istoric medical complet la pacienţii cu boli cronice nediagnosticate(32).
Abordarea diagnostică în faţa unui pacient cu suspiciune de SAM se face într-o primă etapă în baza tabloului clinic sugestiv pentru activare mastocitară (flushing, urticarie, angioedem, dispnee, diaree, sincopă etc.). În lipsa leziunilor cutanate caracteristice mastocitozei, care ar putea orienta clinicianul, trebuie excluşi factorii declanşatori ai unei reacţii alergice sau alte cauze secundare de activare mastocitară (figura 2)(14).
Investigaţiile de laborator au un rol important în cazul unei suspiciuni clinice de SAM, pentru a completa tabloul clinic sugestiv cu dovada unor modificări biologice. Simptomele SAM se datorează degranulării mastocitelor, cu eliberarea mediatorilor şi acţiunea acestora asupra organelor-ţintă. Pentru susţinerea diagnosticului, nivelul acestora în lichidele biologice (plasmă, ser, urină) trebuie cuantificat(33). Triptaza serică reprezintă markerul specific al activării mastocitelor. Valoarea serică de bază în condiţii fiziologice poate varia între 0 şi 11,4 ng/mL(19). Creşterea nivelului seric atinge peakul în termen de 1-4 ore de la degranularea mastocitelor.
Cunoaşterea nivelului bazal este necesară pentru aprecierea dinamicii. În caz contrar, o nouă dozare ar trebui repetată la 24-48 de ore de la remiterea simptomelor(34). Pentru confirmarea criteriilor de diagnostic este necesară creşterea acută cu 20% + 2 ng/mL. Nivelul persistent ridicat orientează către diagnosticul de mastocitoză sau către alte patologii care asociază triptaza serică crescută (hipertriptasemia familială, anomalii hematologice, boală renală cronică)(35). Sensibilitatea metodei scade în raport cu severitatea simptomelor şi cu intervalul de timp dintre debutul simptomelor şi colectarea probelor biologice(19).
Alţi mediatori care pot fi dozaţi pentru orientarea diagnostică, cu sensibilitate crescută, dar specificitate scăzută comparativ cu triptaza serică, sunt reprezentaţi de: histamină, metaboliţii urinari ai histaminei, PGD2, metaboliţii urinari ai acesteia, LTE4. O creştere în plasmă sau în urină a două ori a mai multor metaboliţi ai histaminei sau PGD2 ori o creştere cu cel puţin 50% a LTE4 pot indica o activare mastocitară(36). Dezavantajul acestor metode în practică este reprezentat de dificultăţile în colectarea probelor biologice, unii metaboliţi necesitând urina colectată pe 24 de ore(36).
Examinarea măduvei osoase poate fi realizată dacă nicio cauză secundară de activare mastocitară nu a putut fi identificată şi au fost excluse posibile alergii, infecţii, medicamente, stimuli fizici sau neoplazii cunoscute. Indicaţii pentru efectuarea puncţiei-biopsie medulare:
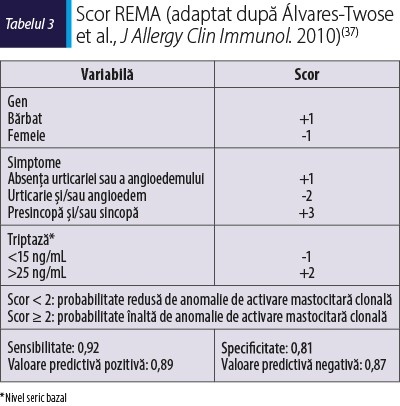
Triptaza serică bazală >25 ng/mL (cut-off = 11,4 ng/mL)(26).
Triptaza serică bazală între 15 şi 25 ng/mL şi un scor REMA (tabelul 3) ≥2 sau mutaţia KIT D816V detectată în sângele periferic(26).
Diagnostic diferenţial
Variabilitatea prezentării clinice a SAM impune excluderea altor patologii care pot mima activarea mastocitară (tabelul 4). În cazul pacienţilor care se prezintă cu hipotensiune, şoc sau sincopă, diagnosticul diferenţial trebuie făcut cu bolile cardiovasculare/cerebrovasculare, septicemie, urgenţe endocrinologice, intoxicaţii, dezechilibre hidroelectrolitice sau evenimente psihiatrice acute(14). Pentru a putea diferenţia între acestea, criteriile clinice trebuie coroborate cu modificările biologice. De asemenea, diagnosticul de SAM nu trebuie să excludă alte patologii care pot mima SAM. Acestea pot coexista, astfel încât abordarea unui pacient cu tablou clinic complex trebuie să fie multidisciplinară(38).
În lipsa semnelor sistemice de severitate, diagnosticul diferenţial se face în contextul manifestărilor de la nivelul anumitor organe (tulburări digestive, leziuni cutanate, manifestări neurologice etc.). Manifestările de tip presincopă/sincopă, hipotensiune, palpitaţii sau angină pectorală impun investigarea pacienţilor pentru excluderea sindromului de tahicardie posturală ortostatică, sindromului Kounis sau a tulburărilor de ritm cardiac. Simptomele mai rar întâlnite, precum mialgiile, artralgiile, hiperlaxitatea articulară, necesită efectuarea diagnosticului diferenţial cu fibromialgia sau cu sindromul Ehler-Danlos(13).
Modificările biologice pot necesita, de asemenea, diferenţierea între posibilii factori etiologici. Investigarea nivelului seric al triptazei în cadrul evenimentului clinic acut sau la distanţă de acesta direcţionează diagnosticul către anomaliile clonale ale mastocitelor (mastocitoza sistemică/cutanată, SAMM) sau către alte patologii care pot asocia un nivel crescut al triptazei serice, cum ar fi triptasemia familială, anomaliile hematologice (leucemii acute, leucemia eozinofilică cronică, sindroame mielodisplazice), supresia medulară susţinută sau insuficienţa renală cronică. Biopsia de măduvă osoasă şi investigarea funcţiei renale sunt necesare în aceste situaţii(38).
Unii pacienţi cu SAM confirmat pot asocia eozinofilie sangvină şi tisulară, relaţie care trebuie analizată pentru identificarea unor boli alergice, infecţii parazitare sau chiar şi alte condiţii cardiovasculare, neoplazice sau inflamatorii(2).
Management terapeutic
Tratamentul sindromului de activare mastocitară are ca scop ameliorarea simptomelor episodului acut şi prevenirea reapariţiei tabloului clinic, atât prin măsuri de evitare a expunerii la factori declanşatori individuali, cât şi prin administrare cronică a terapiei împotriva mediatorilor mastocitari(26,29).
Primul pas în obţinerea controlului simptomelor este identificarea şi evitarea factorilor generali şi specifici (individuali) care duc la apariţia tabloului clinic sugestiv(28).
Tratament simptomatic
Antihistaminice
Administrarea blocanţilor de receptori histaminici (AH1 şi AH2) reprezintă prima linie de tratament simptomatic. Sunt preferate antihistaminicele nonsedative, de generaţia a doua (loratadină, cetirizină, fexofenadină), datorită capacităţii reduse de traversare a barierei hematoencefalice şi de a induce efecte adverse cardiovasculare (aritmii), comparativ cu prima generaţie de antihistaminice(29). Doza de administrare este de 1 cp/zi, cu creştere până la 4 cp/zi pentru AH1 şi de 2 cp/zi pentru AH2, optând pentru doza minimă necesară controlului simptomelor(28).
Stabilizatori ai membranei mastocitare – cromona
Cromoglicatul de sodiu este cel mai utilizat agent din această clasă de medicamente, deşi s-a observat că mecanismul prin care acţionează nu este cel de stabilizare a membranei mastocitului, ci prin inhibarea excitării fibrelor nervoase de tip C(39).
Acesta ameliorează simptomele cutanate, digestive şi cele neuropsihiatrice. Se administrează pe cale orală, în doze de 100 mg/zi, cu creşterea treptată a acesteia până la 800 mg/zi (4 x 200 mg/zi), în 8 săptămâni(28,29).
Antagonişti de receptori de leucotriene
Montelukastul poate fi utilizat la pacienţii cu simptome refractare la administrarea de antihistaminice şi în mod deosebit la pacienţii cu afectarea tractului respirator (astm, wheezing)(29).
Acidul acetilsalicilic
Unii pacienţi cu eritem facial recurent şi cu niveluri urinare crescute de 11b-PGF2 (metabolit al prostaglandinei PGD2) în urina colectată pe 24 de ore pot beneficia de tratamentul cu acid acetilsalicilic, în lipsa unui istoric de reacţie de hipersensibilitate la antiinflamatoare nesteroidiene(29). Doza recomandată este de 81 mg de două ori pe zi, însă poate fi crescută la 500-650 mg de două ori pe zi, sub supravegherea medicului alergolog(28).
Dacă pacientul a tolerat anterior administrarea de acid acetilsalicilic cu beneficiu terapeutic şi a dezvoltat apoi o reacţie de hipersensibilitate la AINS, se poate tenta administrarea aspirinei, aplicând un protocol de desensibilizare(40).
Omalizumab
Omalizumab, un medicament biologic aprobat în prezent pentru tratamentul astmului alergic şi al urticariei cronice, poate să scadă reactivitatea mastocitului faţă de diverşi factori cu potenţial inductor, prin scăderea expresiei receptorului FcεRI (receptor de înaltă afinitate pentru IgE) de pe suprafaţa acestuia(29). Doza de administrare este de 300 mg la fiecare 28 de zile, pe o perioadă nedeterminată, pentru prevenirea episoadelor de reacţii sistemice severe şi pentru controlul formelor de activare mastocitară rezistente la terapia convenţională(28).
Vitamina D
Deşi controversată, vitamina D ar putea avea un rol în stabilizarea membranei mastocitare. Un studiu realizat pe şoareci de laborator a arătat că, în lipsa unei cantităţi suficiente de vitamina D, celulele mastocitare se pot activa automat(41).
Situaţii particulare
În situaţia în care pacientul, diagnosticat fie cu o formă secundară de SAM, fie cu o formă primară, clonală, asociază în antecedente episoade de alergie documentată la venin de himenoptere, se recomandată iniţierea cât mai precoce a imunoterapiei alergen specifice pentru veninul de himenoptere. Durata acestui tratament va fi pe tot parcursul vieţii, fiind singurul tratament modificator al bolii la această categorie de pacienţi. De asemenea, aceşti pacienţi vor beneficia de instructajul utilizării trusei de urgenţă, care trebuie să includă cel puţin două injectoare automate de adrenalină, alături de blocanţi ai receptorilor de histamină (H1+H2) şi corticosteroizi sistemici(26,28,29,42,43).

Pentru pacienţii cu patologie neoplazică asociată care necesită administrare de chimioterapeutic cu potenţial inductor al degranulării mastocitare (de exemplu, taxani), se poate administra medicaţia în regim de desensibilizare (administrarea dozelor în concentraţii crescânde la intervale diferite de timp, în funcţie de protocolul ales), cu utilizarea în prealabil a unei scheme de premedicaţie anterior administrării chimioterapiei(44,45).
În plus, unii autori (J. Romantowski, M. Castells şi
J. Butterfield) propun ca toţi pacienţii care suferă de sindrom de activare mastocitară să beneficieze de regim de premedicaţie cu blocanţi ai receptorilor histaminici de tip H1 şi H2, blocanţi de receptor de leucotriene şi corticoterapie sistemică (0,5-1 mg/kg) înainte cu 12 ore, respectiv cu o oră anterior procedurilor medicale invazive. Aceste proceduri sunt reprezentate de intervenţii din sfera chirurgicală/stomatologică, efectuarea unei endoscopii digestive, expunerea la substanţa de contrast iodată şi administrarea de vaccinuri(25,28).
Concluzii
SAM reprezintă o entitate clinică dificil de manageriat în contextul unei afectări multisistemice. Confirmarea diagnosticului într-un timp cât mai scurt de la debutul simptomelor poate reprezenta o adevărată provocare pentru clinician, utilizarea criteriilor stabilite de grupul de consens fiind esenţială. Clasificarea în funcţie de etiologie necesită obţinerea unui istoric medical complet şi efectuarea investigaţiilor paraclinice specifice. Managementul terapeutic variază în funcţie de severitatea simptomelor şi de patologiile identificate.
Glosar de termeni
CD34 = marker al celulei stem.
CD117 = kit = receptor transmembranar tirozin-
kinazic.
Protooncogenă = genă implicată în stimularea creşterii celulare. Mutaţii la nivelul unei protooncogene o poate transforma într-o oncogenă capabilă să stimuleze dezvoltarea celulelor tumorale(46).
Superantigen = antigen (toxină sau structură bacteriană – de exemplu, stafilococul auriu) care, în cantităţi mici, are capacitatea de a stimula un răspuns imun suficient de puternic pentru a crea clone de limfocite T. n
Bibliografie
- Akin C. Mast cell activation syndromes. J Allergy Clin Immunol [Internet]. 2017;140(2):349–55. Available from: http://dx.doi.org/10.1016/j.jaci.2017.06.007
- Leru P, Anton V, Ureche C, Zurac S, Bratu O, Neagoe C. Mast cell activation syndromes ‑ evaluation of current diagnostic criteria and laboratory tools in clinical practice (Review). Exp Ther Med [Internet]. 2020 Jun 25 [cited 2021 Feb 14];20(3):2348. Available from: /pmc/articles/PMC7401950/
- Spoerl D, Nigolian H, Czarnetzki C, Harr T. Reclassifying anaphylaxis to neuromuscular blocking agents based on the presumed Patho-Mechanism: IgE-Mediated, pharmacological adverse reaction or “innate hypersensitivity”? [Internet]. Vol. 18, International Journal of Molecular Sciences. MDPI AG; 2017 [cited 2021 Feb 25]. p. 1223. Available from: www.mdpi.com/journal/ijms
- Bradding P, Saito H. Biology of Mast Cells and Their Mediators. In: Middleton’s Allergy: Principles and Practice: Eighth Edition. 2014. p. 228–51.
- Varricchi G, Rossi FW, Galdiero MR, Granata F, Criscuolo G, Spadaro G, et al. Physiological Roles of Mast Cells: Collegium Internationale Allergologicum Update 2019 [Internet]. Vol. 179, International Archives of Allergy and Immunology. S. Karger AG; 2019 [cited 2021 Feb 13]. p. 247–61. Available from: www.karger.com/iaa
- Varricchi G, Galdiero MR, Loffredo S, Marone G, Iannone R, Marone G, et al. Are mast cells MASTers in cancer? [Internet]. Vol. 8, Frontiers in Immunology. Frontiers Media S.A.; 2017 [cited 2021 Feb 24]. p. 1. Available from: /pmc/articles/PMC5388770/
- Elieh Ali Komi D, Wöhrl S, Bielory L. Mast Cell Biology at Molecular Level: a Comprehensive Review. Clin Rev Allergy Immunol. 2020;58(3):342–65.
- Ribatti D. The Staining of Mast Cells: A Historical Overview. Int Arch Allergy Immunol [Internet]. 2018 May 1 [cited 2021 Feb 14];176(1):55–60. Available from: https://www.karger.com/Article/FullText/487538
- Varricchi G, De Paulis A, Marone G, Galli SJ. Future needs in mast cell biology. Int J Mol Sci. 2019;20(18):1–24.
- Dale P, Head V, Dowling MR, Taylor CW. Selective inhibition of histamine-evoked Ca2+ signals by compartmentalized cAMP in human bronchial airway smooth muscle cells. Cell Calcium [Internet]. 2018 May 1 [cited 2021 Feb 24];71:53–64. Available from: https://pubmed.ncbi.nlm.nih.gov/29604964/
- Ashina K, Tsubosaka Y, Nakamura T, Omori K, Kobayashi K, Hori M, et al. Histamine Induces Vascular Hyperpermeability by Increasing Blood Flow and Endothelial Barrier Disruption In Vivo. Komarova Y, editor. PLoS One [Internet]. 2015 Jul 9 [cited 2021 Feb 24];10(7):e0132367. Available from: https://dx.plos.org/10.1371/journal.pone.0132367
- Molderings GJ, Kolck UW, Scheurlen C, Brüss M, Homann J, Von Kügelgen I. Multiple novel alterations in Kit tyrosine kinase in patients with gastrointestinally pronounced systemic mast cell activation disorder. Scand J Gastroenterol [Internet]. 2007 [cited 2021 Feb 24];42(9):1045–53. Available from: https://pubmed.ncbi.nlm.nih.gov/17710669/
- Akin C, Valent P, Metcalfe DD. Mast cell activation syndrome: Proposed diagnostic criteria. J Allergy Clin Immunol [Internet]. 2010;126(6):1099-1104.e4. Available from: http://dx.doi.org/10.1016/j.jaci.2010.08.035
- Valent P, Akin C, Bonadonna P, Hartmann K, Brockow K, Niedoszytko M, et al. Proposed Diagnostic Algorithm for Patients with Suspected Mast Cell Activation Syndrome [Internet]. Vol. 7, Journal of Allergy and Clinical Immunology: In Practice. American Academy of Allergy, Asthma and Immunology; 2019 [cited 2021 Feb 13]. p. 1125-1133.e1. Available from: https://doi.org/10.1016/j.jaip.2019.01.006
- Molderings GJ. The genetic basis of mast cell activation disease – looking through a glass darkly. Crit Rev Oncol Hematol [Internet]. 2015;93(2):75–89. Available from: http://dx.doi.org/10.1016/j.critrevonc.2014.09.001
- Hartmann K, Escribano L, Grattan C, Brockow K, Carter MC, Alvarez-Twose I, et al. Cutaneous manifestations in patients with mastocytosis: Consensus report of the European Competence Network on Mastocytosis; The American Academy of Allergy, Asthma & Immunology; and the European Academy of Allergology and Clinical Immunology. J Allergy Clin Immunol [Internet]. 2016 Jan 1 [cited 2021 Feb 25];137(1):35–45. Available from: http://dx.doi.org/10.1016/j.jaci.2015.08.034
- Bonadonna P, Zanotti R, Pagani M, Caruso B, Perbellini O, Colarossi S, et al. How much specific is the association between hymenoptera venom allergy and mastocytosis? Allergy [Internet]. 2009 Sep 1 [cited 2021 Feb 24];64(9):1379–82. Available from: http://doi.wiley.com/10.1111/j.1398-9995.2009.02108.x
- Pardanani A. Systemic mastocytosis in adults: 2019 update on diagnosis, risk stratification and management. Am J Hematol [Internet]. 2018 Dec 8 [cited 2021 Feb 24];94(3):ajh.25371. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1002/ajh.25371
- Valent P, Akin C, Arock M, Brockow K, Butterfield JH, Carter MC, et al. Definitions, Criteria and Global Classification of Mast Cell Disorders with Special Reference to Mast Cell Activation Syndromes: A Consensus Proposal. Int Arch Allergy Immunol [Internet]. 2012 Feb [cited 2021 Feb 13];157(3):215–25. Available from: https://www.karger.com/Article/FullText/328760
- Akin C, Saini S, Feldweg AM. UpToDate Mast cell disorders: An overview [Internet]. [cited 2021 Feb 24]. Available from: https://www.uptodate.com/contents/mast-cell-disorders-an-overview/contributors
- Matsuse H, Fukushima C, Shimoda T, Asai S, Kohno S. Effects of acetaldehyde on human airway constriction and inflammation. In: Novartis Foundation Symposium. 2007; p. 97–106.
- Shimoda T, Kohno S, Takao A, Fujiwara C, Matsuse H, Sakai H, et al. Investigation of the mechanism of alcoholinduced bronchial asthma. J Allergy Clin Immunol. 1996 Jan 1;97(1 I):74–84.
- Varricchi G, Marone G. Mast cells: Fascinating but still elusive after 140 years from their discovery [Internet]. Vol. 21, International Journal of Molecular Sciences. MDPI AG; 2020 [cited 2021 Feb 14]. Available from: https://pubmed.ncbi.nlm.nih.gov/31940755/
- McNeil BD, Pundir P, Meeker S, Han L, Undem BJ, Kulka M, et al. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature [Internet]. 2015;519(7542):237–41. Available from: http://dx.doi.org/10.1038/nature14022
- Romantowski J, Górska A, Niedoszytko M, Gulen T, Gruchała-Niedoszytko M, Nedoszytko B, et al. A challenge for allergologist: Application of allergy diagnostic methods in mast cell disorders [Internet]. Vol. 22, International Journal of Molecular Sciences. MDPI AG; 2021 [cited 2021 Feb 14]. p. 1–14. Available from: https://pubmed.ncbi.nlm.nih.gov/33535634/
- Romantowski J, Gorska A, Lange M, Nedoszytko B, Gruchała-Niedoszytko M, Niedoszytko M. How to diagnose mast cell activation syndrome: Practical considerations. Polish Arch Intern Med. 2020;130(4):317–23.
- Kumar S, Khodoun M, Kettleson EM, McKnight C, Reponen T, Grinshpun SA, et al. Glyphosate-rich air samples induce IL-33, TSLP and generate IL-13 dependent airway inflammation. Toxicology [Internet]. 2014;325:42–51. Available from: http://dx.doi.org/10.1016/j.tox.2014.08.008
- Castells M, Butterfield J. Mast Cell Activation Syndrome and Mastocytosis: Initial Treatment Options and Long-Term Management. J Allergy Clin Immunol Pract [Internet]. 2019;7(4):1097–106. Available from: https://doi.org/10.1016/j.jaip.2019.02.002
- Theoharides TC, Tsilioni I, Ren H. Recent advances in our understanding of mast cell activation–or should it be mast cell mediator disorders? Expert Rev Clin Immunol [Internet]. 2019;15(6):639–56. Available from: https://doi.org/10.1080/1744666X.2019.1596800
- Valent P. Mast cell activation syndromes: definition and classification. Allergy [Internet]. 2013 Apr 1 [cited 2021 Feb 24];68(4):417–24. Available from: http://doi.wiley.com/10.1111/all.12126
- Valent P, Akin C, Bonadonna P, Hartmann K, Broesby-Olsen S, Brockow K, et al. Mast cell activation syndrome: Importance of consensus criteria and call for research. J Allergy Clin Immunol [Internet]. 2018;142(3):1008–10. Available from: https://doi.org/10.1016/j.jaci.2018.06.004
- Afrin LB, Self S, Menk J, Lazarchick J. Characterization of Mast Cell Activation Syndrome. Am J Med Sci [Internet]. 2017 [cited 2021 Feb 19];353(3):207–15. Available from: /pmc/articles/PMC5341697/
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, et al. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management. J Allergy Clin Immunol [Internet]. 2019;144(4):883–96. Available from: https://doi.org/10.1016/j.jaci.2019.08.023
- Butterfield J, Weiler CR. The Utility of Measuring Urinary Metabolites of Mast Cell Mediators in Systemic Mastocytosis and Mast Cell Activation Syndrome. J Allergy Clin Immunol Pract. 2020 Sep 1;8(8):2533–41.
- Lyons JJ, Sun G, Stone KD, Nelson C, Wisch L, O’Brien M, et al. Mendelian inheritance of elevated serum tryptase associated with atopy and connective tissue abnormalities. J Allergy Clin Immunol [Internet]. 2014 [cited 2021 Feb 24];133(5):1471–4. Available from: https://pubmed.ncbi.nlm.nih.gov/24472624/
- Butterfield JH, Weiler CR. Prevention of Mast Cell Activation Disorder-Associated Clinical Sequelae of Excessive Prostaglandin D2 Production. Int Arch Allergy Immunol [Internet]. 2008 Nov [cited 2021 Feb 24];147(4):338–43. Available from: https://www.karger.com/Article/FullText/144042
- Álvarez-Twose I, González de Olano D, Sánchez-Muñoz L, Matito A, Esteban-López MI, Vega A, et al. Clinical, biological, and molecular characteristics of clonal mast cell disorders presenting with systemic mast cell activation symptoms. J Allergy Clin Immunol [Internet]. 2010 Jun 1 [cited 2021 Feb 26];125(6):1269-1278.e2. Available from: www.jacionline.org
- Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, et al. Diagnosis, classification and management of mast cell activation syndromes (Mcas) in the era of personalized medicine. Int J Mol Sci. 2020;21(23):1–14.
- Vieira Dos Santos R, Magerl M, Martus P, Zuberbier T, Church MK, Escribano L, et al. Topical sodium cromoglicate relieves allergen- and histamine-induced dermal pruritus. Br J Dermatol. 2010;162(3):674–6.
- Butterfield JH, Kao PC, Klee GG, Yocum MW. Aspirin Idiosyncrasy in Systemic Mast Cell Disease: A New Look at Mediator Release During Aspirin Desensitization. Mayo Clin Proc. 1995;70(5):481–7.
- Liu Z-Q, Li1 X-X, Qiu S-Q, Yu Y, Li M-G, Yang L-T, et al. Vitamin D contributes to mast cell stabilization. Exp Allergy Immunol. 2017; 72(8):1184-1192.
- Bonadonna P, Gonzalez-de-Olano D, Zanotti R, Riccio A, De Ferrari L, Lombardo C, et al. Venom Immunotherapy in Patients with Clonal Mast Cell Disorders: Efficacy, Safety, and Practical Considerations. J Allergy Clin Immunol Pract [Internet]. 2013;1(5):474–8. Available from: http://dx.doi.org/10.1016/j.jaip.2013.06.014
- Sturm GJ, Varga EM, Roberts G, Mosbech H, Bilò MB, Akdis CA, et al. EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy Eur J Allergy Clin Immunol. 2018;73(4):744–64.
- Lythgoe MP, Krell J, McNeish IA, Tookman L. Safe administration of chemotherapy in mast cell activation syndrome. J Oncol Pharm Pract. 2020 Oct; 107815520953879.
- Prospect Paclitaxel – Agenţia Naţională a medicamentului [Internet]. [cited 2021 Feb 19]. Available from: https://www.anm.ro/_/_PRO/PRO_8588_04.02.16.pdf
- Definition of proto-oncogene – NCI Dictionary of Cancer Terms – National Cancer Institute [Internet]. [cited 2021 Feb 18]. Available from: https://www.cancer.gov/publications/dictionaries/cancer-terms/def/proto-oncogene





