Allergic diseases have experienced an increasing prevalence in recent decades throughout the world, including in Romania. They affect a large number of people, generating high costs for the public health system, absenteeism from the workplace and altering the patient’s quality of life, including an increased risk of death. Currently, specific molecular and laboratory tests are increasingly used for the diagnosis of allergic conditions, as they present multiple advantages over traditional in vivo tests. Molecular tests are based on the use of purified or recombinant natural allergens, and there are several singleplex or multiplex testing platforms. These platforms contain the main respiratory and food allergens that are responsible for producing allergic reactions. The molecular diagnosis of allergies was included in the diagnostic algorithm according to the EAACI guide, being subsidized in some states of the European Union, which is why we propose a set of precision paraclinical investigations for the diagnosis and monitoring of IgE-mediated allergic diseases with severe forms, and/or with risk and/or with comorbidities through specific molecular and laboratory tests of patients with allergic conditions, based on the EAACI recommendations.
Teste moleculare şi de laborator specifice în bolile alergice
Specific molecular and laboratory tests in allergic diseases
First published: 18 octombrie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.6.3.2022.7162
Abstract
Rezumat
Bolile alergice au cunoscut o prevalenţă crescândă în ultimele decenii în întreaga lume, inclusiv în România. Acestea afectează un număr mare de persoane, fiind şi generatoare de costuri mari pentru sistemul de sănătate publică, absenteism de la locul de muncă şi alterarea calităţii vieţii pacientului, inclusiv risc de deces. În prezent, pentru diagnosticul afecţiunilor alergice se utilizează tot mai mult teste moleculare şi de laborator specifice, care prezintă multiple avantaje faţă de testele in vivo tradiţionale. Testele moleculare se bazează pe utilizarea alergenelor naturale purificate sau recombinate, existând mai multe platforme de testare de tip singleplex sau multiplex. Aceste platforme conţin principalele alergene respiratorii şi alimentare care sunt responsabile de producerea reacţiilor alergice. Diagnosticul molecular al alergiilor a fost inclus în algoritmul de diagnostic conform ghidului EAACI, fiind şi decontat în unele state ale Uniunii Europene, motiv pentru care propunem un set de investigaţii paraclinice de precizie pentru diagnosticarea şi monitorizarea bolilor alergice mediate IgE cu forme severe şi/sau cu risc evolutiv şi/sau cu comorbidităţi prin teste moleculare şi de laborator specifice ale pacienţilor cu afecţiuni alergice, în baza recomandărilor din ghidurile EAACI.
Prevalenţa bolilor alergice şi impactul asupra sistemului de sănătate în România
Bolile alergice au cunoscut o prevalenţă crescândă în ultimele decenii în întreaga lume. În ceea ce priveşte prevalenţa bolilor alergice în România, datele statistice se bazează pe informaţiile obţinute în cursul unor studii internaţionale publicate în ultimii ani (tabelul 1).
Conform acestor date, prevalenţa astmului este de 4-9,9% din populaţia generală, iar datele Institutului Naţional de Sănătate Publică din România confirmă că prevalenţa acestei afecţiuni în România este de 4-7%, corespunzând unui număr de aproximativ 900 000 de pacienţi, iar dintre aceştia cel puţin 60% sunt alergici, corespunzând unui număr de aproximativ 500 000 de pacienţi. Majoritatea pacienţilor cu astm alergic prezintă şi simptome de rinoconjunctivită alergică. Dintre pacienţii cu astm, 5-10% evoluează spre forme severe (Wang et al., 2020), care necesită terapii complexe, au frecvente exacerbări care necesită vizite în serviciul de urgenţă sau internări, toate generatoare de costuri mari pentru sistemul de sănătate publică, absenteism de la locul de muncă şi alterarea calităţii vieţii pacientului, inclusiv risc de deces. Din datele Institutului Naţional de Sănătate Publică din România, mortalitatea prin astm este de 0,9 la 100 000 de locuitori. Conform datelor publicate de Universitatea Washington în sistemul VizHub.healthdata.org (Healthdata, 2022), povara creată de astm în România se concretizează prin: mortalitate de 1,3 la 100 000, ani de viaţă ajustaţi cu incapacitate (disability-adjusted life years; DALY) de 190 la 100 000 şi ani de viaţă trăiţi cu incapacitate (years of healthy life lost due to disability; YLD) de 170 la 100 000. Un diagnostic corect de astm trebuie să cuprindă şi evaluarea etiologiei alergice din primele stadii, pentru un management eficient al bolii.
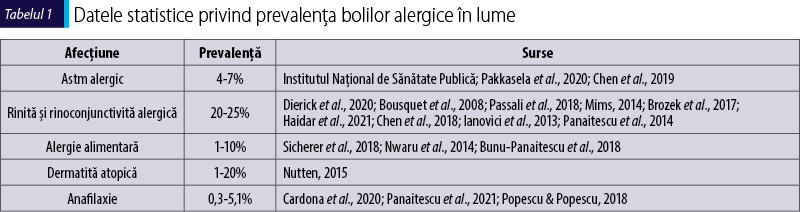
Pentru rinita şi rinoconjunctivita alergică, datele generale apreciază o prevalenţă de 20-25%, fiind cea mai frecventă manifestare a bolilor alergice, afectând una din 4 sau 5 persoane, corespunzând unui număr de aproximativ 3 600 000 de pacienţi în România. Dintre aceştia, majoritatea au forme uşoare de boală, dar la aproximativ 20% dintre ei există riscul de progresie spre astm alergic şi spre forme severe de boală (Acevedo-Prado et al., 2022), care generează costuri pentru sistemul de sănătate publică.
Prevalenţa alergiilor alimentare este foarte variabilă, între 1% şi 10% din populaţia generală, afectând un maxim de 1 800 000 de persoane în România, fiind mai frecvente la copii. O parte dintre acestea, greu de apreciat statistic, evoluează spre forme severe, ameninţătoare de viaţă, manifestate prin şoc anafilactic. Alergiile alimentare complicate cu anafilaxie necesită vizite în serviciul de urgenţă sau internări, toate generatoare de costuri mari pentru sistemul de sănătate publică, absenteism de la locul de muncă sau de la şcoală şi alterarea calităţii vieţii pacientului, inclusiv risc de deces. Un diagnostic corect al alergiilor alimentare trebuie să cuprindă şi evaluarea riscului alergologic de evoluţie spre şoc anafilactic, posibil numai prin diagnostic molecular, pentru un management eficient al bolii, inclusiv stabilirea unei diete restrictive şi a necesarului de a purta în permanenţă o seringă preîncărcată cu adrenalină.
Prevalenţa dermatitei atopice este foarte variabilă, între 1% şi 20% din populaţia generală, afectând un maxim de 3 600 000 de persoane în România, fiind mai frecventă la copii. O parte dintre acestea, greu de apreciat statistic, implică şi mecanisme IgE mediate. Conform datelor publicate de Universitatea Washington în sistemul VizHub.healthdata.org (Healthdata, 2022), povara creată de dermatita atopică în România se concretizează prin: ani de viaţă ajustaţi cu incapacitate (DALY) de 43 la 100 000 de bolnavi şi ani de viaţă trăiţi cu incapacitate (YLD) de 42,8 la 100 000 de bolnavi. Un diagnostic corect al dermatitei atopice trebuie să cuprindă şi evaluarea etiologiei alergice din primele stadii, pentru un management eficient al bolii.
Prevalenţa anafilaxiei este foarte variabilă, între 0,3% şi 5,1% din populaţia generală, afectând un maxim de 900 000 de persoane în România, şi poate avea cauze multiple – alimentară, medicamentoasă, indusă de veninuri de insecte, alergia la latex (Cardona et al., 2020). Anafilaxia necesită vizite în serviciul de urgenţă sau internări, toate generatoare de costuri mari pentru sistemul de sănătate publică, absenteism de la locul de muncă sau de la şcoală şi alterarea calităţii vieţii pacientului, inclusiv risc de deces. Un diagnostic corect al bolilor alergice trebuie să cuprindă şi evaluarea riscului alergologic de evoluţie spre anafilaxie, posibil numai prin diagnostic molecular, pentru un management eficient al bolii, inclusiv stabilirea unei diete restrictive, a contraindicaţiilor administrării unor medicamente, a evitării contactului cu insecte sau cu produse cu latex, a unei terapii de desensibilizare la alergenul cauzator şi a necesarului de a purta în permanenţă o seringă preîncărcată cu adrenalină.
Avantajele diagnosticului molecular în bolile alergice
-
Utilizarea testelor moleculare şi de laborator specifice în bolile alergice prezintă multiple avantaje:
-
Abordarea de tip multiplex, prin care se evaluează răspunsul alergic la paneluri largi de alergene, permite evaluarea globală a repertoriului individual de IgE alergen-specifice, ceea ce permite stabilirea tiparului de sensibilizare pentru fiecare pacient alergic.
-
Diagnosticul molecular permite:
-
Identificarea sensibilizării la alergenele relevante – alergenele sensibilizante primare.
-
Identificarea la pacientul alergic a alergenelor relevante pentru recomandarea imunoterapiei alergenice adecvate.
-
Identificarea alergenelor care dau reacţii încrucişate, deci diagnosticul diferenţial între alergenele primare specifice şi cele care dau reacţie datorită unor proteine răspândite în multe surse de alergene sau determinanţilor carbohidraţi cu reacţie încrucişată.
-
Explicarea simptomelor datorate reactivităţii încrucişate – simptomele declanşate de anticorpi cu reacţie încrucişată pot fi diferenţiate de cele cauzate de o sensibilizare autentică, ceea ce poate ajuta medicul să rafineze planul de tratament al pacientului. În cazurile în care este identificată doar sensibilitate încrucişată, se pot efectua investigaţii de laborator pentru a găsi alergenul sensibilizant primar.
-
Evaluarea riscului clinic de reacţie severă – sensibilizarea la componentele alergenice stabile poate provoca reacţii alergice sistemice severe cu risc letal, în timp ce sensibilizarea la componente labile este în principal asociată cu reacţii locale uşoare.
-
Reducerea numărului de teste de provocare in vivo şi recomandări îmbunătăţite de evitare a alergenelor – diferenţierea dintre moleculele cu „risc scăzut” versus „risc crescut” ar putea reduce utilizarea unor proceduri diagnostice potenţial dăunătoare, cum ar fi testele de provocare.
-
Evidenţierea unor reacţii la alergene care se găsesc în concentraţie scăzută în extracte sau care sunt labile.
-
-
Diagnosticul molecular se bazează pe proteine bine definite şi purificate, în concentraţii cunoscute, spre deosebire de extractele de alergene, care sunt greu de standardizat şi de caracterizat, de multe ori având o compoziţie necunoscută sau neconţinând componentele alergenice relevante clinic.
-
Pacientul nu este expus la alergen, neexistând astfel risc de reacţii adverse, ca în cazul testelor in vivo.
-
Pot fi testate simultan mai multe alergene.
-
Pot fi teste de predicţie a evoluţiei cazului – rezultatele pozitive ale unui test multiplex pot prezice simptome alergice viitoare.
-
Număr redus de contacte între pacient-medic-laborator, mai ales în contextul pandemic actual.
-
Utilizarea mai largă a testelor de tip multiplex va facilita implementarea acestora de către companiile producătoare pentru a reduce preţurile, crescând astfel şansele de a fi compensate de către sistemele publice şi private de sănătate.
-
Rezistenţa alergologilor la progresul alergologiei moleculare, care le poate reduce câştigurile pe baza testelor in vivo, ar trebui depăşită.
Justificarea includerii testelor moleculare în algoritmul de diagnostic conform ghidului EAACI
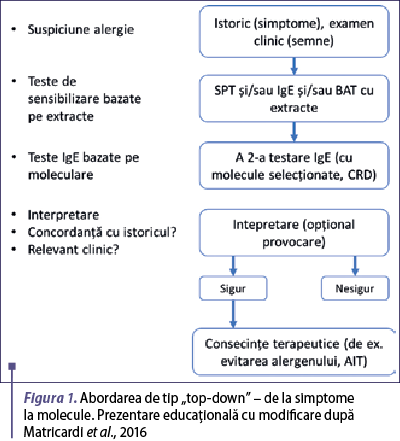
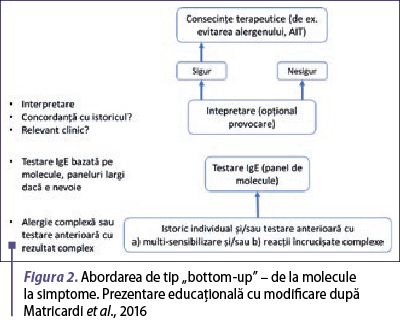
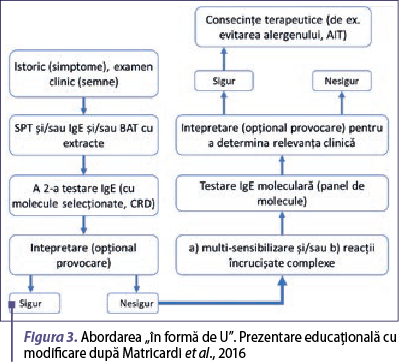
În prezent, medicii care practică abordarea moleculară ca parte a diagnosticului alergic pot fi împărţiţi în cei care urmăresc o integrare a testelor moleculare alergice într-un proces de diagnosticare tradiţional care include utilizarea de extracte alergenice, pe de o parte, şi cei care preferă să omită în general utilizarea extractelor alergenice şi care utilizează un diagnostic molecular sistematic de la început. Academia Europeană de Alergologie şi Imunologie Clinică (EAACI) propune o a treia abordare, care le integrează pe primele două (Matricardi et al., 2016).
Abordarea de tip „top-down” sau „de la simptome la molecule” (figura 1) este cea tradiţională şi include mai întâi istoricul clinic şi teste prick sau IgE cu extracte şi apoi etapa moleculară, care oferă informaţii mai detaliate cu privire la repertoriul IgE al pacientului. În acest caz, testele singleplex care vor fi utilizate sunt alese pe baza rezultatelor obţinute anterior cu extracte, reprezentând o metodă inductivă prin care medicul specialist selectează alergenele relevante.
Abordarea de tip „bottom-up” sau „de la molecule la simptome” (figura 2) utilizează teste de tip multiplex, care oferă o viziune largă şi analitică a profilului de sensibilizare al pacientului, corelând apoi rezultatele obţinute cu istoricul clinic al pacientului.
EAACI sugerează integrarea acestor două abordări într-o aşa-numită abordare „în formă de U” (figura 3). În acest caz, procedura de diagnostic se începe clasic, cu istoricul clinic, examenul obiectiv, teste cutanate sau teste IgE cu extracte şi apoi cu molecule selectate în funcţie de istoricul clinic şi rezultatele testelor cu extracte. Dacă rezultatele sunt neconcludente sau pacientul prezintă multisensibilizare ori reacţii încrucişate complexe, se efectuează testare IgE cu paneluri largi de molecule.
Investigaţii paraclinice propuse
În acest context, propunem un set de investigaţii paraclinice de precizie pentru diagnosticarea şi monitorizarea bolilor alergice mediate IgE cu forme severe
şi/sau cu risc evolutiv şi/sau cu comorbidităţi prin teste moleculare şi de laborator specifice ale pacienţilor cu următoarele boli şi afecţiuni alergice, în baza recomandărilor din ghidurile EAACI.
Boli alergice respiratorii (rinită/rinoconjunctivită alergică, astm alergic), alergii alimentare, dermatită atopică IgE-asociată
-
Determinarea IgE serice specifice pentru alergene moleculare individuale (singleplex), prin analiză fluoroimunoenzimatică (fluorescence enzyme immunoassay; FEIA) sau chemiluminescenţă (chemi-
-
luminescence immunoassay; CLIA):
-
un set de 1-8 alergene moleculare
-
utilizată pentru diagnostic molecular precoce şi screening
-
recomandată de medicii din specialitatea Alergologie şi Imunologie clinică.
-
-
Determinarea IgE serice specifice pentru alergene moleculare multiple (multiplex) bazată pe nanotehnologie macroreţea sau imunoanaliză biocip microreţea (microarray):
-
recomandată de medicii din specialitatea Alergologie şi Imunologie clinică.
-
-
Determinarea IgG4 specifice serice pentru alergene moleculare individuale (singleplex), pentru monitorizarea eficienţei terapiei alergen specifice, prin analiză fluoroimunoenzimatică sau chemiluminescenţă:
-
recomandată de medicii din specialitatea Alergologie şi Imunologie clinică.
-
Anafilaxie (alimentară, medicamentoasă, indusă de veninuri de insecte, latex)
-
Determinarea IgE serice specifice pentru alergene moleculare individuale (singleplex), prin metoda de analiză fluoroimunoenzimatică/chemilumi-nescenţă:
-
un set de 1-8 alergene moleculare
-
utilizată pentru diagnostic molecular precoce şi screening
-
recomandată de medicii din specialitatea Alergologie şi Imunologie clinică.
-
-
Determinarea IgE serice specifice pentru alergene moleculare multiple (multiplex) bazată pe nanotehnologie macroreţea sau imunoanaliză biocip microreţea:
-
recomandată de medicii din specialitatea Alergologie şi Imunologie clinică.
-
-
Determinarea triptazei serice, prin analiză fluoroimunoenzimatică:
-
recomandată de medicii din specialitatea Alergologie şi Imunologie clinică.
-
-
Testul de degranulare a bazofilelor, prin citometrie în flux:
-
recomandată de medicii din specialitatea Alergologie şi Imunologie clinică.
-
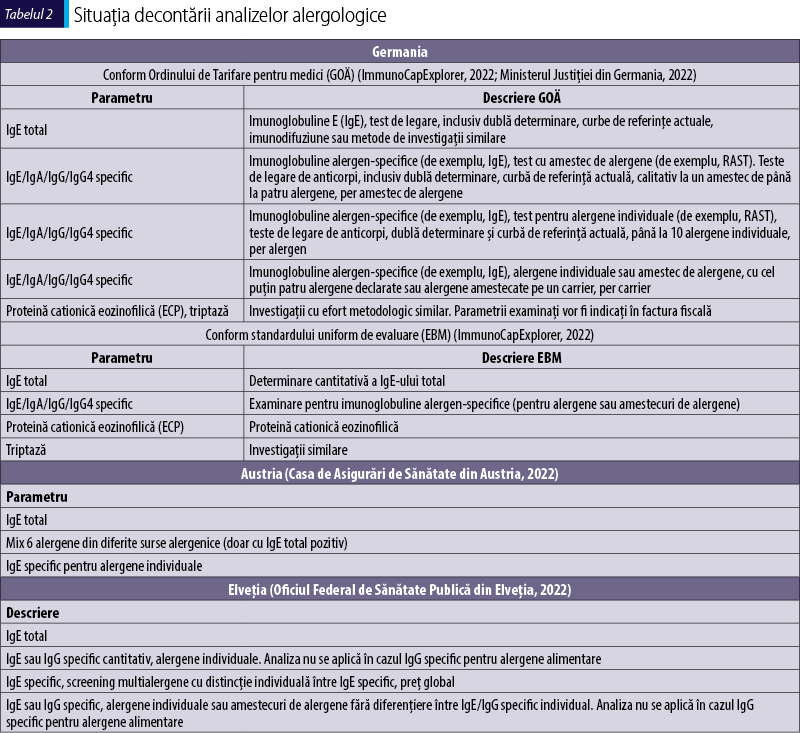
Tabelul 2 prezintă condiţiile de utilizare a testelor alergologice în ţări din Uniunea Europeană, care pot fi luate în considerare ca bune practici pentru serviciile de alergologie din România.
Criterii de eligibilitate a pacienţilor
-
Pacienţii eligibili pentru determinările de mai sus trebuie să se încadreze în următoarele situaţii: pacient cu afecţiune alergică sau suspiciune de afecţiune alergică de tip astm instabil, rinoconjunctivită, dermatită atopică severă, alergii alimentare, tulburări gastrointestinale neclare, anafilaxie, după cum urmează:
-
Pacient cu manifestări severe de boală şi/sau
-
Pacient care nu poate întrerupe medicaţia care interferează cu testele alergologice in vivo şi/sau
-
Pacient cu factori de risc pentru prognostic deficitar (risc de anafilaxie/şoc anafilactic, risc evolutiv spre forme severe de boală, risc de complicaţii) şi/sau
-
Pacient cu forme complexe de boală, cu comorbidităţi şi/sau
-
Pacient la care este necesară evaluarea riscului de reacţii sistemice severe şi/sau
-
Pacient pentru care există suspiciune de polisensibilizare pentru obţinerea profilului complet de sensibilizare alergică şi/sau
-
Pacient cu un istoric medical cu simptome nespecifice şi inconsecvente şi/sau
-
Pacient la care este necesar diagnosticul între o sensibilizare primară de o reactivitate încrucişată şi/sau
-
Pentru identificarea motivelor care fac ca un pacient să nu răspundă la tratament şi pentru prescrierea corectă a tratamentelor ţintite (imunoterapia alergen-specifică, terapia biologică) şi monitorizarea răspunsului terapeutic.
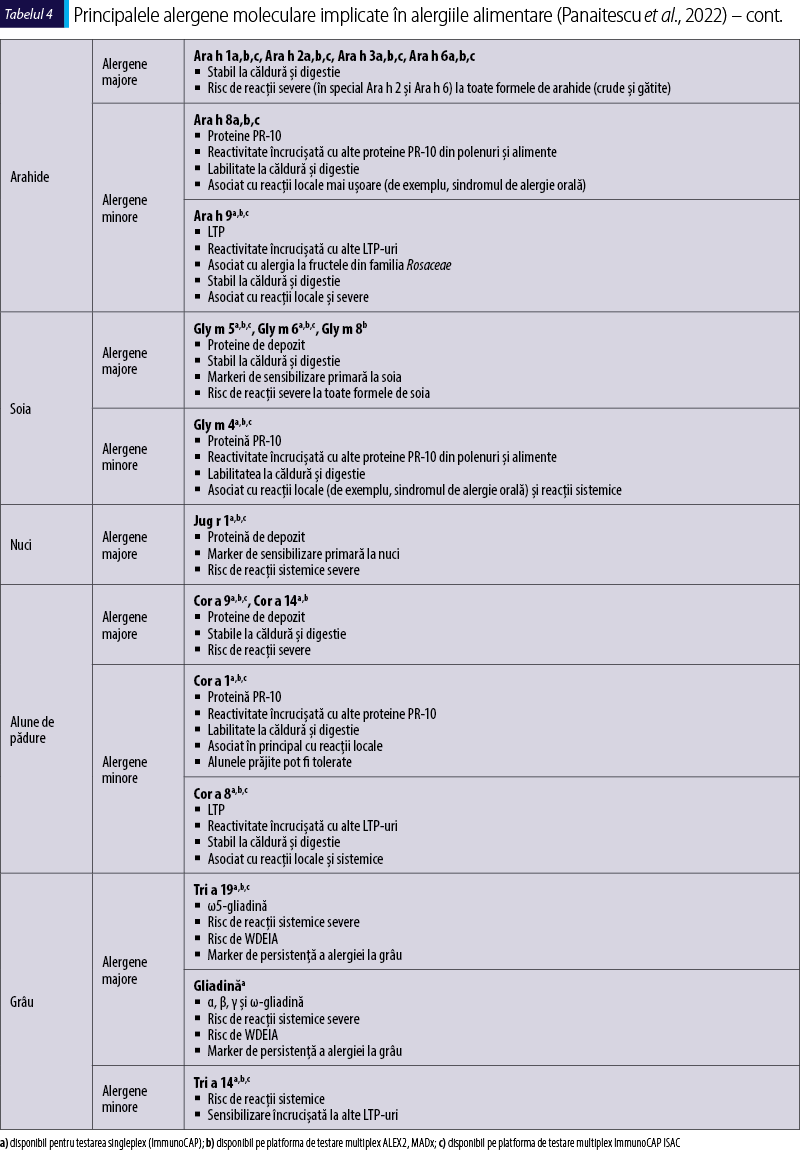
Principalele alergene moleculare implicate în alergiile respiratorii şi alimentare
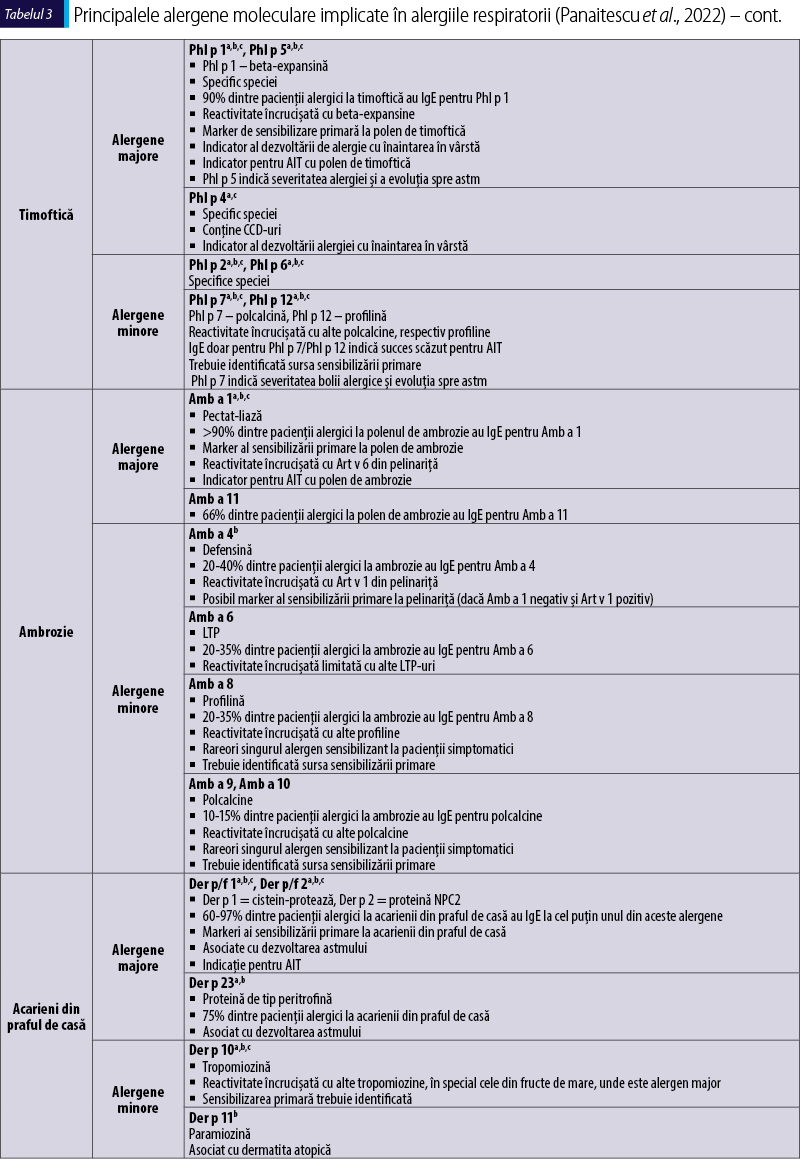
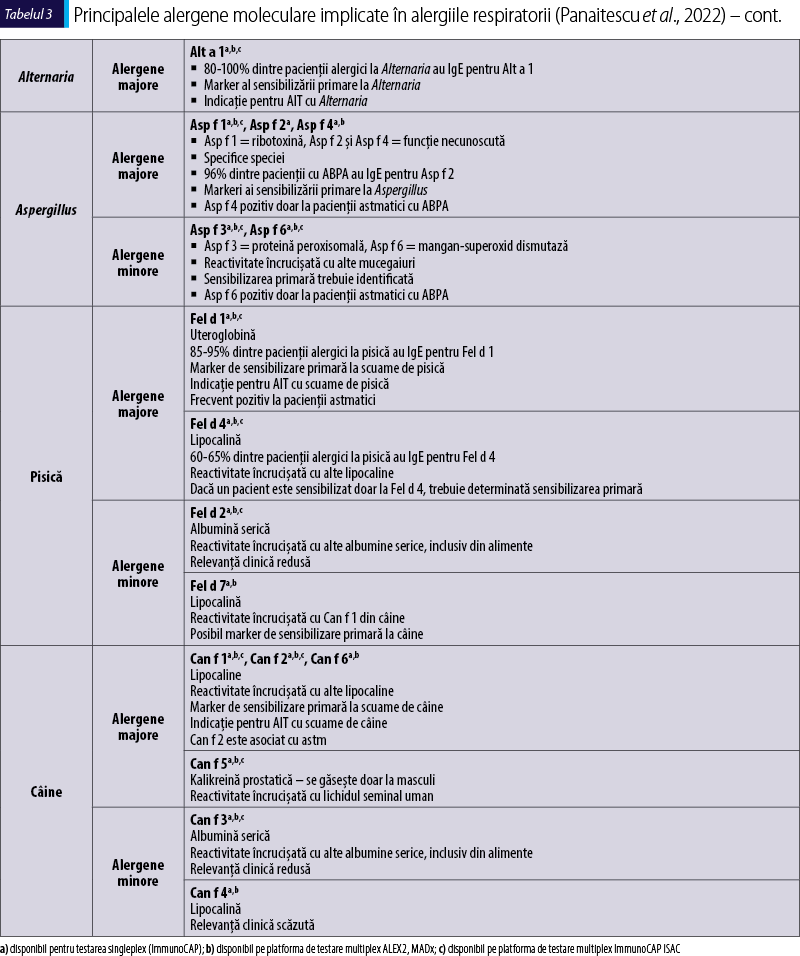
Polenul de graminee şi acarienii din praful de casă (house dust mites; HDM) au fost identificate ca fiind cele mai frecvente cauze ale alergiilor respiratorii precum rinoconjunctivita alergică şi astmul alergic. Persoanele polisensibilizate tind să prezinte simptome mai severe, absenteism accentuat şi mai multe episoade de exacerbări care necesită vizite la medic sau internări şi, în general, modelele mai complexe de sensibilizare sunt asociate cu simptome mai severe. Cele mai importante alergene aeropurtate sunt incluse în tabelul 3, alături de caracteristicile lor principale.
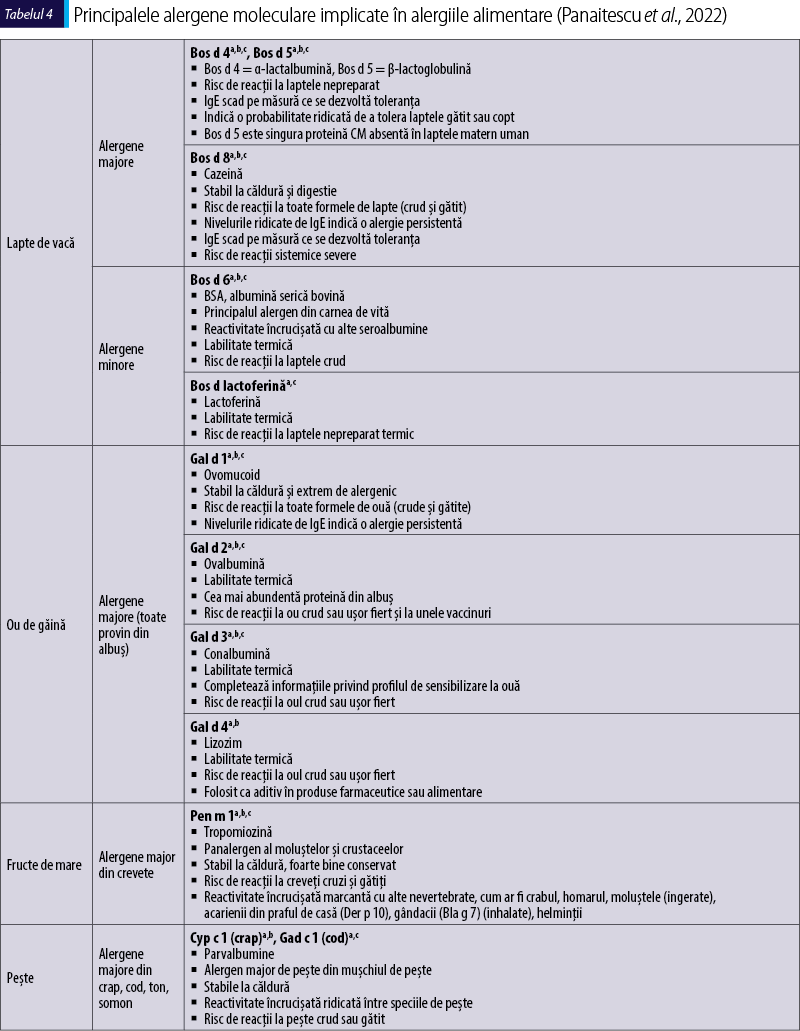
În ceea ce priveşte alergiile alimentare, până la 90% dintre acestea sunt cauzate de un grup de surse animale şi vegetale cunoscute în mod colectiv sub numele de „Cele opt mari surse de alergene”: laptele de vacă, oul de găină, arahidele, nucile, soia, grâul, peştele şi crustaceele. Pacienţii sensibilizaţi la proteine care sunt termostabile şi rezistente la digestie au un risc mai mare de a dezvolta reacţii severe la alimente crude şi chiar gătite. Cele mai importante alergene alimentare sunt incluse în tabelul 4, alături de caracteristicile lor principale.

Concluzii
Diagnosticul molecular şi de laborator a devenit un instrument foarte important în diagnosticul alergologic de precizie. În prezent există o gamă largă de variante de testare, disponibile ca platforme singleplex sau multiplex, care utilizează alergene purificate sau recombinante, pentru determinarea profilului de sensibilizare individual al pacientului. Această abordare facilitează identificarea alergenelor sensibilizante primare şi a alergenelor cu reactivitate încrucişată, precum şi evaluarea riscului de a dezvolta reacţii severe, fiind utilă şi pentru selecţia pacienţilor care ar beneficia cel mai mult de imunoterapie alergenică şi pentru monitorizarea eficacităţii acesteia. În viitor se preconizează progrese în ceea ce priveşte alegerea optimă a panelului de alergene, interpretarea îmbunătăţită prin învăţare automată şi inteligenţă artificială, precum şi posibilitatea de telemedicină la pacienţii rezidenţi în zone izolate.
Bibliografie
- Acevedo-Prado A, Seoane-Pillado T, López-Silvarrey-Varela A, Salgado FJ, Cruz MJ, Faraldo-Garcia A, Nieto-Fontarigo JJ, Pértega-Díaz S, Sanchez-Lastres J, San-José-González MA, Bamonde-Rodríguez L, Garnelo-Suárez L, Pérez-Castro T, Sampedro-Campos M, Gonzalez-Barcala FJ. Association of rhinitis with asthma prevalence and severity. Sci Rep. 2022 Apr 16;12(1):6389. doi: 10.1038/s41598-022-10448-w. PMID: 35430600; PMCID: PMC9013347.
- Bousquet J, Khaltaev N, Cruz AA, Denburg J, Fokkens WJ, Togias A, Zuberbier T, Baena-Cagnani CE, Canonica GW, van Weel C, Agache I, Aït-Khaled N, Bachert C, Blaiss MS, Bonini S, Boulet LP, Bousquet PJ, Camargos P, Carlsen KH, Chen Y, Custovic A, Dahl R, Demoly P, Douagui H, Durham SR, van Wijk RG, Kalayci O, Kaliner MA, Kim YY, Kowalski ML, Kuna P, Le LT, Lemiere C, Li J, Lockey RF, Mavale-Manuel S, Meltzer EO, Mohammad Y, Mullol J, Naclerio R, O'Hehir RE, Ohta K, Ouedraogo S, Palkonen S, Papadopoulos N, Passalacqua G, Pawankar R, Popov TA, Rabe KF, Rosado-Pinto J, Scadding GK, Simons FE, Toskala E, Valovirta E, van Cauwenberge P, Wang DY, Wickman M, Yawn BP, Yorgancioglu A, Yusuf OM, Zar H, Annesi-Maesano I, Bateman ED, Ben Kheder A, Boakye DA, Bouchard J, Burney P, Busse WW, Chan-Yeung M, Chavannes NH, Chuchalin A, Dolen WK, Emuzyte R, Grouse L, Humbert M, Jackson C, Johnston SL, Keith PK, Kemp JP, Klossek JM, Larenas-Linnemann D, Lipworth B, Malo JL, Marshall GD, Naspitz C, Nekam K, Niggemann B, Nizankowska-Mogilnicka E, Okamoto Y, Orru MP, Potter P, Price D, Stoloff SW, Vandenplas O, Viegi G, Williams D; World Health Organization; GA(2)LEN; AllerGen. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008 Apr;63 Suppl 86:8-160. doi: 10.1111/j.1398-9995.2007.01620.x. PMID: 18331513.
- Brożek JL, Bousquet J, Agache I, Agarwal A, Bachert C, Bosnic-Anticevich S, Brignardello-Petersen R, Canonica GW, Casale T, Chavannes NH, Correia de Sousa J, Cruz AA, Cuello-Garcia CA, Demoly P, Dykewicz M, Etxeandia-Ikobaltzeta I, Florez ID, Fokkens W, Fonseca J, Hellings PW, Klimek L, Kowalski S, Kuna P, Laisaar KT, Larenas-Linnemann DE, Lødrup Carlsen KC, Manning PJ, Meltzer E, Mullol J, Muraro A, O'Hehir R, Ohta K, Panzner P, Papadopoulos N, Park HS, Passalacqua G, Pawankar R, Price D, Riva JJ, Roldán Y, Ryan D, Sadeghirad B, Samolinski B, Schmid-Grendelmeier P, Sheikh A, Togias A, Valero A, Valiulis A, Valovirta E, Ventresca M, Wallace D, Waserman S, Wickman M, Wiercioch W, Yepes-Nuñez JJ, Zhang L, Zhang Y, Zidarn M, Zuberbier T, Schünemann HJ. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines-2016 revision. J Allergy Clin Immunol. 2017 Oct;140(4):950-958. doi: 10.1016/j.jaci.2017.03.050. Epub 2017 Jun 8. PMID: 28602936.
- Bunu-Panaitescu C, Marusciac L, Buzan MR, Tamas TP. Diagnosticul molecular în alergiile alimentare. Alergologia 2018;2(4):158-164.
- Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, Geller M, Gonzalez-Estrada A, Greenberger PA, Sanchez Borges M, Senna G, Sheikh A, Tanno LK, Thong BY, Turner PJ, Worm M. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020 Oct 30;13(10):100472. doi: 10.1016/j.waojou.2020.100472. PMID: 33204386; PMCID: PMC7607509.
- Casa Naţională de Asigurări de Sănătate Austria, https://www.gesundheitskasse.at/cdscontent/load?contentid=10008.701580&version=1563526218 (accesat în octombrie 2022).
- Chen KW, Marusciac L, Tamas PT, Valenta R, Panaitescu C. Ragweed Pollen Allergy: Burden, Characteristics, and Management of an Imported Allergen Source in Europe. Int Arch Allergy Immunol. 2018;176(3-4):163-180. doi: 10.1159/000487997. Epub 2018 May 22. PMID: 29788026.
- Chen KW, Zieglmayer P, Zieglmayer R, Lemell P, Horak F, Bunu CP, Valenta R, Vrtala S. Selection of house dust mite-allergic patients by molecular diagnosis may enhance success of specific immunotherapy. J Allergy Clin Immunol. 2019 Mar;143(3):1248-1252.e12. doi: 10.1016/j.jaci.2018.10.048. Epub 2018 Nov 14. PMID: 30445063.
- Dierick BJH, van der Molen T, Flokstra-de Blok BMJ, Muraro A, Postma MJ, Kocks JWH, van Boven JFM. Burden and socioeconomics of asthma, allergic rhinitis, atopic dermatitis and food allergy. Expert Rev Pharmacoecon Outcomes Res. 2020 Oct;20(5):437-453. doi: 10.1080/14737167.2020.1819793. Epub 2020 Sep 14. PMID: 32902346.
- Gesetze im Internet, https://www.gesetze-im-internet.de/go__1982/BJNR015220982.html (accesat în octombrie 2022).
- Haidar L, Tamas TP, Stolz F, Patrascu RFP, Chen KW, Panaitescu C. Symptom patterns and comparison of diagnostic methods in ragweed pollen allergy. Exp Ther Med. 2021 May;21(5):525. doi: 10.3892/etm.2021.9957. Epub 2021 Mar 22. PMID: 33815598; PMCID: PMC8014962.
- Healthdata, https://www.healthdata.org/data-tools-practices/interactive-data-visuals (accesat în octombrie 2022).
- Ianovici N, Panaitescu CB. Analysis of airborne allergenic pollen spectrum for 2009 in Timişoara, Romania. Aerobiologia. 2013 Mar 1;29(1):95-111.
- ImunoCapExplorer, http://www.immunocapexplorer.com/de/kassenabrechnung/abrechnung-nach-ebm-und-goeae/abrechnung-nach-goae (accesat în octombrie 2022).
- Institutul Naţional de Sănătate Publică din România, https://insp.gov.ro/ (accesat în octombrie 2022).
- Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, Aalberse RC, Agache I, Asero R, Ballmer-Weber B, Barber D, Beyer K, Biedermann T, Bilò MB, Blank S, Bohle B, Bosshard PP, Breiteneder H, Brough HA, Caraballo L, Caubet JC, Crameri R, Davies JM, Douladiris N, Ebisawa M, EIgenmann PA, Fernandez-Rivas M, Ferreira F, Gadermaier G, Glatz M, Hamilton RG, Hawranek T, Hellings P, Hoffmann-Sommergruber K, Jakob T, Jappe U, Jutel M, Kamath SD, Knol EF, Korosec P, Kuehn A, Lack G, Lopata AL, Mäkelä M, Morisset M, Niederberger V, Nowak-Węgrzyn AH, Papadopoulos NG, Pastorello EA, Pauli G, Platts-Mills T, Posa D, Poulsen LK, Raulf M, Sastre J, Scala E, Schmid JM, Schmid-Grendelmeier P, van Hage M, van Ree R, Vieths S, Weber R, Wickman M, Muraro A, Ollert M. EAACI Molecular Allergology User's Guide. Pediatr Allergy Immunol. 2016 May;27 Suppl 23:1-250. doi: 10.1111/pai.12563. PMID: 27288833.
- Mims JW. Epidemiology of allergic rhinitis. Int Forum Allergy Rhinol. 2014 Sep;4 Suppl 2:S18-20. doi: 10.1002/alr.21385. PMID: 25182349.
- Nutten S. Atopic dermatitis: global epidemiology and risk factors. Ann Nutr Metab. 2015;66 Suppl 1:8-16. doi: 10.1159/000370220. Epub 2015 Apr 24. PMID: 25925336.
- Nwaru BI, Hickstein L, Panesar SS, Muraro A, Werfel T, Cardona V, Dubois AE, Halken S, Hoffmann-Sommergruber K, Poulsen LK, Roberts G, Van Ree R, Vlieg-Boerstra BJ, Sheikh A; EAACI Food Allergy and Anaphylaxis Guidelines Group. The epidemiology of food allergy in Europe: a systematic review and meta-analysis. Allergy. 2014 Jan;69(1):62-75. doi: 10.1111/all.12305. Epub 2013 Nov 11. PMID: 24205824.
- Oficiul Federal de Sănătate Publică Elveţia, https://www.bag.admin.ch/bag/de/home/versicherungen/krankenversicherung/krankenversicherung-leistungen-tarife/Analysenliste.html (accesat în octombrie 2022).
- Pakkasela J, Ilmarinen P, Honkamäki J, Tuomisto LE, Andersén H, Piirilä P, Hisinger-Mölkänen H, Sovijärvi A, Backman H, Lundbäck B, Rönmark E, Kankaanranta H, Lehtimäki L. Age-specific incidence of allergic and non-allergic asthma. BMC Pulm Med. 2020 Jan 10;20(1):9. doi: 10.1186/s12890-019-1040-2. PMID: 31924190; PMCID: PMC6954552.
- Panaitescu C, Bodnari M, Tatu C, Haidar L. Rolul diagnosticului molecular în anafilaxie. Alergologia. 2021;6(3):135-144.
- Panaitescu C, Haidar L, Buzan MR, Grijincu M, Spanu DE, Cojanu C, Laculiceanu A, Bumbacea R, Agache I. Precision medicine in the allergy clinic: the application of component resolved diagnosis. Expert Rev Clin Immunol. 2022 Feb;18(2):145-162. doi: 10.1080/1744666X.2022.2034501. Epub 2022 Feb 12. PMID: 35078387.
- Panaitescu C, Ianovici N, Marusciac L, Cernescu L, Tamas P, Lazarovicz RA. Sensitisation to Ambrosia pollen and other airborne allergens in the population of the Western region of Romania: 1181. Allergy: European Journal of Allergy and Clinical Immunology. 2014 Sep;69.
- Passali D, Cingi C, Staffa P, Passali F, Muluk NB, Bellussi ML. The International Study of the Allergic Rhinitis Survey: outcomes from 4 geographical regions. Asia Pac Allergy. 2018 Jan 25;8(1):e7. doi: 10.5415/apallergy.2018.8.e7. PMID: 29423374; PMCID: PMC5796967.
- Popescu F, Popescu FD. Discuţii despre epidemiologia hipersensibilităţii medicamentoase. Alergologia. 2018;2(1):6-11.
- Sicherer SH, Sampson HA. Food allergy: A review and update on epidemiology, pathogenesis, diagnosis, prevention, and management. J Allergy Clin Immunol. 2018 Jan;141(1):41-58. doi: 10.1016/j.jaci.2017.11.003. Epub 2017 Nov 21. PMID: 29157945.
- Wang E, Wechsler ME, Tran TN, Heaney LG, Jones RC, Menzies-Gow AN, Busby J, Jackson DJ, Pfeffer PE, Rhee CK, Cho YS, Canonica GW, Heffler E, Gibson PG, Hew M, Peters M, Harvey ES, Alacqua M, Zangrilli J, Bulathsinhala L, Carter VA, Chaudhry I, Eleangovan N, Hosseini N, Murray RB, Price DB. Characterization of Severe Asthma Worldwide: Data From the International Severe Asthma Registry. Chest. 2020 Apr;157(4):790-804. doi: 10.1016/j.chest.2019.10.053. Epub 2019 Nov 27. Erratum in: Chest. 2021 Nov;160(5):1989. PMID: 31785254.