In recent decades, the field of medical and nutritional sciences has seen remarkable progress in understanding the complex interactions between drugs and foods. However, the importance of knowing and properly managing these interactions has remained an essential topic, especially in the context of developing personalized nutritional plans. Medicines and food are two important components of human health, and the way they interact can significantly influence the effectiveness of treatments, the assimilation of nutrients and even the general well-being of individuals. Since the notion of ”healthy eating” is at the heart of a healthy life, knowing how drugs can interact with nutrients in the diet is of crucial importance to physicians, pharmacists, dietitians and health researchers. Medicines contain many substances that interact and determine certain changes in the human body, depending on each individual. At the same time, food is also rich in vitamins, minerals, antioxidants and other active compounds that participate in the body’s homeostasis, and in some cases they can interact with the patient’s pharmacological therapy.
Importanţa cunoaşterii interacţiunilor medicament-aliment în contextul elaborării planurilor nutriţionale
The importance of knowing drug-food interactions in the context of developing nutritional plans
First published: 27 noiembrie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.215.6.2023.8974
Abstract
Rezumat
În ultimele decenii, domeniul ştiinţelor medicale şi al nutriţiei a cunoscut progrese remarcabile în ceea ce priveşte înţelegerea complexă a interacţiunilor dintre medicamente şi alimente. Cu toate acestea, importanţa cunoaşterii şi gestionării adecvate a acestor interacţiuni a rămas un subiect esenţial, mai ales în contextul elaborării planurilor nutriţionale personalizate. Medicamentele şi alimentele reprezintă două componente importante ale sănătăţii umane, iar modul în care acestea interacţionează poate influenţa semnificativ eficacitatea tratamentelor, asimilarea substanţelor nutritive şi chiar starea generală de bine a indivizilor. Întrucât noţiunea de „alimentaţie sănătoasă” este în centrul unei vieţi sănătoase, cunoaşterea modului în care medicamentele pot interacţiona cu nutrienţii din dietă este de o importanţă crucială pentru medici, farmacişti, dieteticieni şi cercetători în domeniul sănătăţii. Medicamentele conţin numeroase substanţe care interacţionează şi determină anumite modificări în organismul uman, în funcţie de fiecare individ în parte. În acelaşi timp, alimentele sunt, de asemenea, bogate în vitamine, minerale, antioxidanţi şi alţi compuşi activi care participă la homeostazia organismului, iar în unele cazuri acestea pot interacţiona cu terapia farmacologică a pacientului.
Introducere
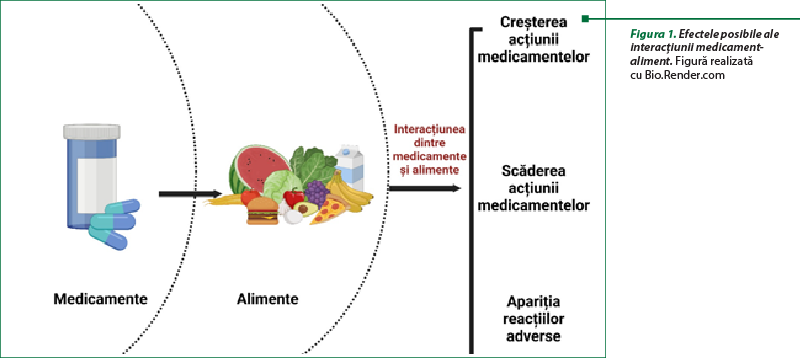
Interacţiunea medicament-aliment sau medicament-nutrient se referă la reacţiile fizice, chimice, biochimice, fiziologice şi/sau fiziopatologice dintre substanţele active conţinute într-un medicament şi cele prezente în anumite alimente. De cele mai multe ori, compuşii din alimente afectează buna funcţionare a medicamentelor (figura 1): diminuarea efectelor terapeutice, potenţarea efectelor terapeutice cu risc de toxicitate, dezvoltarea unui nou efect secundar care, în mod obişnuit, nu este indus de niciuna dintre substanţele asociate(1,2).
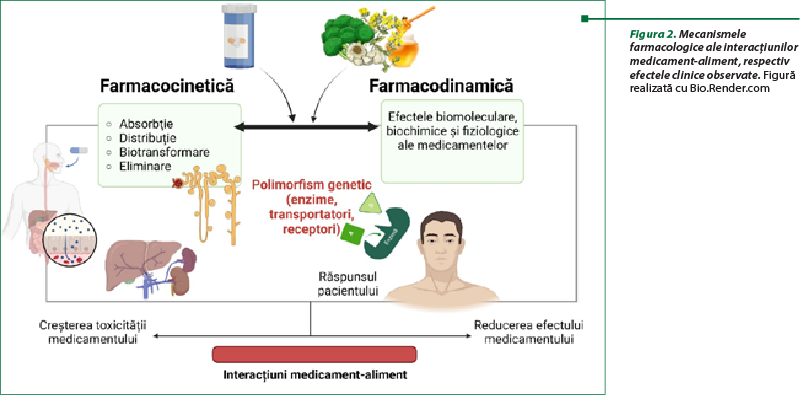
Aceste interacţiuni pot modifica farmacocinetica şi/sau farmacodinamica unui medicament (figura 2). În ceea ce priveşte interacţiunea farmacodinamică, aceasta poate avea efecte aditive, sinergice sau antagoniste asupra receptorilor implicaţi în efectul terapeutic. În schimb, interacţiunea farmacocinetică influenţează absorbţia, distribuţia, metabolismul şi excreţia medicamentului, dar şi a nutrienţilor care pătrund în corp concomitent, înainte sau la scurt timp după administrarea medicamentului(2,3). Comparativ cu interacţiunile farmacodinamice care implică acţiunea asupra receptorilor specifici, interacţiunile farmacocinetice pot fi depistate cu uşurinţă prin dozarea nivelului medicamentului în plasmă.
Pacienţii cei mai predispuşi la interacţiuni medicamentoase sunt vârstnicii, din cauza polimedicaţiei, dar şi a dificultăţii în epurarea şi eliminarea anumitor substanţe ca urmare a degradării funcţiei organelor, care apare odată cu înaintarea în vârstă(4,5). De asemenea, printre pacienţii susceptibili pentru interacţiunile medicament-aliment se numără şi pacienţii posttransplant, pacienţii oncologici, cei seropozitivi, subnutriţi, dar şi pacienţii hrăniţi enteral(6).
Deoarece interacţiunile medicament-aliment devin problematice în contextul creşterii numărului de pacienţi cu boli cronice care necesită tratament farmacologic, dar şi în contextul consumului de alimente nesănătoase, în ultimii ani au apărut numeroase softuri sau pagini web care identifică potenţialele interacţiuni dintre medicamentele administrate şi anumite componente din dieta fiecărui individ în parte (DrugBank, Drugs.com, Drug Interaction Checker [WebMD], Medscape, Brigham and Women’s Hospital, RxList, Stockley’s Interactions Checker etc.).
Astfel, cercetările intensive din domeniul interacţiunilor medicament-aliment/medicament-nutrient au potenţialul de a depista metoda cea mai eficientă pentru administrarea personalizată şi în condiţii de siguranţă a terapiei farmacologice, dar şi pentru realizarea planurilor alimentare individualizate care să asigure necesarul optim de macro- şi micronutrienţi, fără a determina efecte secundare.
Totuşi, până în momentul în care vom beneficia de metoda ideală de realizare a planurilor personalizate în contextul polimedicaţiei, este importantă cunoaşterea alimentelor şi substanţelor bioactive din componenţa acestora care produc modificări în ceea ce priveşte activitatea medicamentelor.
Interacţiuni băuturi-medicamente
Dintre toate băuturile, sucul de grepfrut este responsabil pentru cele mai multe dintre interacţiunile medicament-aliment. Prin intermediul substanţelor active din grepfrut – şi anume, furanocumarinele (naringina, naringenina, bergamotina, 6’,7’‑ dihidroxibergamotina, psoraleni) –, acesta are capacitatea de a altera principala cale de metabolizare a majorităţii xenobioticelor, şi anume metabolizarea hepatică, prin inhibarea enzimelor citocromului P450 (CYP3A4)(2,7,8).
CYP3A4 este localizat la nivelul enterocitelor care căptuşesc intestinul subţire şi colonul, dar şi în hepatocite, astfel că un medicament administrat pe cale orală este metabolizat de două ori înainte să pătrundă în circulaţia sistemică. Felodipina are o biodisponibilitate de 15% când este administrată pe cale orală (cu toate că la nivelul tubului digestiv este absorbită în proporţie de 100%), fiind metabolizată în principal în enterocitele de la nivelul intestinului subţire, iar apoi în hepatocite. În situaţia în care felodipina este asociată cu sucul de grepfrut, se observă o creştere semnificativă a concentraţiei acesteia în plasmă (figura 3), fiind un risc major de supradoză din cauza abolirii activităţii CYP3A4, în principal de la nivelul intestinului subţire(9).
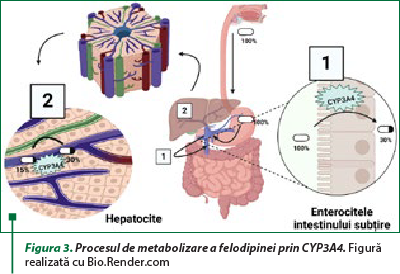
Chiar şi concentraţii micromolare de naringină au fost incriminate pentru efectul de reducere a biodisponibilităţii fexofenadinei(10).
Conform literaturii de specialitate (figura 4), există multiple clase de medicamente ale căror efecte terapeutice sunt afectate de utilizarea în alimentaţie a sucului de grepfrut(9), pe care le redăm în continuare.Agenţi antineoplazici: crizotinib, dasatinib, erlotinib, everolimus, lapatinib, nilotinib, pazopanib, sunitinib, vandetanib, vemurafenib – s-au depistat ca efecte adverse mielotoxicitate şi torsada vârfurilor (formă particulară de tahicardie ventriculară polimorfă nesusţinută).Agenţi antiinfecţioşi: eritromicină, halofantrină, primachină, chinină, rilpivirină – s-au depistat ca efecte adverse torsada vârfurilor, hipotensiune ortostatică, sincopă, mielotoxicitateAgenti hipolipemianţi: atorvastatină, lovastatină, simvastatină – s-au depistat ca efecte adverse mialgii şi rabdomiolizăMedicamente care acţionează asupra sistemului cardiovascular: amiodaronă, apixaban, clopidogrel, dronedaronă, eplerenonă, felodipină, manidipină, nifedipină, chinidină, rivaroxaban, ticagrelor – s-au depistat ca efecte adverse torsada vârfurilor, sângerări gastrointestinale şi renale, hiperkaliemie, aritmii severe, edeme periferice, hipotensiunMedicamente care acţionează asupra sistemului nervos: alfentanil, buspironă, dextrometorfan, fentanil, ketamină, lurasidonă, oxicodonă, pimozidă, quetiapină, triazolam, ziprasidonă – s-au depistat ca efecte adverse ameţeli, sedare, somnolenţă, halucinaţii, hipoventilaţie, torsada vârfurilor, hipotensiune ortostatică, sincopăMedicamente care acţionează asupra sistemului gastrointestinal: domperidonă – s-a depistat ca efect advers torsada vârfurilor.Omunosupresoare: ciclosporină, everolimus, sirolimus, tacrolimus – s-au depistat ca efecte adverse nefrotoxicitate şi mielotoxicitate.Medicamente pentru afecţiuni urinare: darifenacină, fesoterodină, solifenacină, silodosin, tamsulosin – s-au depistat ca efecte adverse retenţie urinară, constipaţie, hipotensiune ortostatică şi ameţeală.
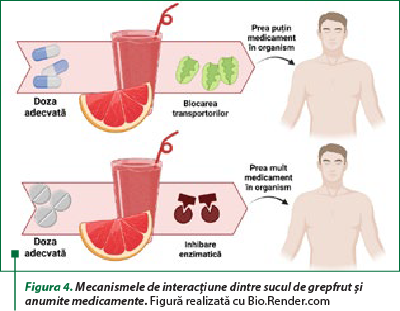
Deşi sucul de grepfrut este cel mai cunoscut în ceea ce priveşte interacţiunile cu terapia farmacologică, nu trebuie excluse şi restul sucurilor citrice (de portocale, lămâie sau pomelo).
Sucul de pomelo modifică farmacocinetica ciclosporinei (creşterea AUC şi Cmax, scăderea t1/2) şi a inhibitorilor de fosfodiesterază de tip 5 (PDE5)(11,12). Sucul de portocale, datorită conţinutului de hesperidină, scade absorbţia alendronatului cu aproximativ 60% şi interacţionează cu unele antihistaminice (fexofenadin), beta-blocante (atenolol, celiprolol) sau agenţi antiastmatici (montelukast)(12). Sucul de mere interacţionează cu unele antihistaminice (fexofenadin), beta-blocante (atenolol), antiastmatice (montelukast) şi antihipertensive (aliskiren)(12).
Sucul de mere interacţionează cu atenolol, un beta-blocant folosit pentru tratarea hipertensiunii arteriale. Un studiu a investigat modificările farmacocinetice în cazul administrării a 50 mg de atenolol concomitent cu suc de mere în cantităţi de 600 mL, respectiv 1200 mL. Conform rezultatelor, AUC s-a redus cu 82% după ingestia de 1200 mL de suc de mere: AUC (atenolol) 600 mL = 885,3; AUC (atenolol) 1200 mL = 389,7; AUC (atenolol) apă = 2110, fără a fi determinate modificări în ceea ce priveşte farmacodinamica. Se consideră că interacţiunea este determinată de inhibarea transportorului de la nivel intestinal OATP2B1, dar este luată în considerare şi aciditatea gastrică ridicată, pusă pe seama cantităţii crescute de suc de mere din stomac(13).
De asemenea, există şi anumite sucuri de fructe îmbogăţite cu calciu, care, prin asocierea cu anumite medicamente, determină chelarea medicamentelor cu calciul şi generează scăderea efectului terapeutic. Dintre medicamentele incriminate, cele mai cercetate sunt antibioticele (fluorochinolone), însă mai pot apărea interacţiuni şi în cazul suplimentelor cu aluminiu şi fier(12).
Anumite fructe, precum bananele, portocalele, prunele şi caisele, consumate ca atare sau sub formă de suc de fructe singure ori în combinaţii cu sucuri de legume (suc de morcovi, de roşii), au un conţinut ridicat de potasiu. În combinaţie cu anumite medicamente care influenţează balanţa hidroelectrolitică şi au efect asupra concentraţiei de potasiu, cum ar fi inhibitorii enzimei de conversie a angiotensinei (ramipril), diureticele (spironolactonă, amilorid, triamterenă etc.), blocanţii receptorilor de angiotensină (ARBs) şi mai ales în cazul pacienţilor cu afecţiuni renale supuşi hemodializei şi cu hipoaldosteronism, ar putea induce hiperkaliemie, care poate fi fatală, prin stop cardiac(12). Sucul de prune este folosit ca laxativ eficient, astfel încât se impune necesitatea atenţionării pacientului cu privire la reacţiile adverse care pot apărea la administrarea acestuia concomitent sau la scurt timp înainte ori după ingerarea medicamentelor.
Sucul de merişoare are virtuţi terapeutice excelente în infecţiile de tract urinar. Cu toate acestea, mai multe studii au investigat interacţiunile dintre consumul sucului de merişoare şi administrarea de warfarină (anticoagulant cu indice terapeutic redus). Totuşi, există rezultate contradictorii, deoarece unii autori nu au identificat aceste interacţiuni în studii clinice(14,15).
Sucurile din fructe tropicale, precum ananas, papaya, kiwi şi fructul pasiunii, au fost studiate in vitro pentru potenţiale interacţiuni medicament-aliment ca urmare a efectelor lor inhibitorii asupra CYP2C9 şi CYP3A4. Sucul de ananas, având concentraţie ridicată de bromelaină, are cel mai puternic efect inhibitor asupra CYP2C9, comparativ cu celelalte sucuri de fructe tropicale. S-a constatat că efectul de inhibare este direct proporţional cu creşterea aportului de suc de ananas(12).
Sucul de afine în combinaţie cu etanercept, utilizat în tratamentul artritei juvenile idiopatice, a determinat îmbunătăţirea simptomatologiei, precum şi diminuarea efectelor adverse ale medicamentului(16).
Consumul de Coca-Cola în doze unice şi/sau multiple se pare că măreşte gradul de absorbţie al ibuprofenului(2).
Unele studii in vitro au arătat că anumite componente din ceai – şi anume, epigalocatehin galatul (EGCG) şi epicatehin galatul (ECG) – inhibă captarea estrone-3 sulfatului mediată de OATP2B1 şi OATP1A2 cu aproximativ 70%, respectiv 75%. Consumul unei cantităţi între 240 şi 300 mL (o cană sau două) de ceai verde ar determina o creştere a concentraţiei intestinale a ECG şi EGCG până la un nivel care inhibă activitatea OATP(17). Studiile in vivo au arătat că ceaiul verde are capacitatea de a inhiba OATP2 de la nivel hepatic, determinând astfel o reducere a captării hepatice şi o creştere a concentraţiei plasmatice în cazul atorvastatinei(18).
Cafeaua este a doua cea mai consumată băutură atât dimineaţa, la micul-dejun, cât şi uneori la prânz, după masa principală. Deşi consumată în cantităţi moderate exercită efecte cardioprotectoare şi tonice cerebrale, având chiar şi proprietăţi antioxidante datorită abundenţei de compuşi bioactivi, există totuşi anumite restricţii în ceea ce priveşte consumul acesteia în cazul anumitor terapii farmacologice. Cafeaua influenţează farmacocinetica mai multor medicamente prin(19):
-
reducerea absorbţiei – oxalat de escitalopram, fier şi medicamente care conţin fier, midazolam, fenotiazină şi butirofenonă, tiroxină, calciu şi vitamina D, glucoză;
-
creşterea absorbţiei - aspirină, felodipină, halofantrină, ergotamină, levodopa;
-
reducerea distribuţiei – memantină, donepezil;
-
creşterea distribuţiei – levodopa;
-
inhibarea/reducerea metabolismului – clozapină, amitriptilină, litiu, teofilină, warfarină, clomipramină, fluvoxamină, imipramină, haloperidol, olanzapină, lidocaină, mexiletină, propranolol, triamterenă, verapamil, ropivacaină, melatonină, dextrometorfan, metotrexat, pefloxacină, propafenonă;
-
creşterea metabolismului – paracetamol;
-
creşterea excreţiei – anumite minerale (calciu, magneziu, sodiu, clor), vitamine hidrosolubile (complexul B), oxandrolonă şi epioxandrolonă.
Consumul de băuturi alcoolice este incriminat pentru diverse interacţiuni cu multiple clase de medicamente. Cu toate acestea, consumul moderat de alcool (unul sau două pahare de vin sau bere la diverse evenimente sociale) nu prezintă un risc considerabil, comparativ cu consumul cronic excesiv de alcool.
Vinurile sunt bogate în polifenoli, iar vinul roşu prezintă cea mai mare cantitate de polifenoli (resveratrol, antociani, taninuri, catehine). Polifenolii se pare că modulează anumite procese metabolice, însă efectele acestora sunt minime în cazul consumului moderat, comparativ cu consumul excesiv de alcool(20).
În cazul consumului cronic excesiv de alcool, se produc interacţiuni de tip farmacocinetic (inducerea CYP2E1, CYP3A3 şi CYP2A1) şi de tip farmacodinamic. Interacţiunile de tip farmacodinamic apar la asocierea consumului de alcool cu medicamente specifice asupra SNC (sedative, antidepresive, antiepileptice, antipsihotice), cu aspirină, anticoagulante, antialgice care cresc riscul de sângerare (mai ales la nivel digestiv), cu paracetamol, care creşte riscul de hepatotoxicitate, şi cu antidiabetice, situaţie în care se poate instala o stare de hipoglicemie(21).
De asemenea, pot apărea reacţii de tip Antabuz/disulfiram (cefalee pulsatilă, greaţă, transpiraţie, dureri abdominale, palpitaţii, tahicardie) în cazul administrării de metronidazol, ketoconazol, griseofulvin şi cefalosporine (cefuroxim, cefotetan, ceftriaxonă, cefoperazonă, ceftriazonă)(22).
Este de importanţă vitală cunoaşterea interacţiunilor dintre medicamente şi băuturile consumate pe parcursul zilei. Multe persoane asociază la micul-dejun un pahar de suc de fructe, ceai sau cafea. Acestea, prin abundenţa de principii active, interacţionează puternic cu anumite medicamente administrate (deoarece multe medicamente se administrează, de asemenea, dimineaţa).
Dieta şi grupele alimentare în interacţiune cu medicamentele
Similar cu băuturile, şi alimentele, fie de origine vegetală, fie de origine animală, prezintă anumite interacţiuni cu anumite clase de medicamente. Abundenţa în principii nutritive şi compuşi bioactivi a acestora, precum şi complexitatea proceselor biochimice şi fiziologice care au loc în organism interferează de multe ori cu mecanismele farmacologice ale anumitor terapii.
Simvastatina, ezetimib, pravastatina şi fluvastatina pot fi administrate fără necesitatea unei consideraţii referitoare la aportul alimentar. Cu toate acestea, alimentele şi dietele cu conţinut crescut de fibre pot diminua eficacitatea acestor medicamente. Administrarea concomitentă a statinelor împreună cu alimente poate altera farmacocinetica sau farmacodinamica acestor medicamente, crescând astfel riscul de reacţii adverse, cum ar fi miopatia ori rabdomioliza, sau diminuându-le efectul farmacologic.
Consumul de pectină sau de tărâţe de ovăz în asociere cu lovastatină poate reduce absorbţia acestui medicament(2). Cu toate acestea, lovastatina ar trebui administrată concomitent cu alimentele pentru a potenţa absorbţia sa gastrointestinală şi biodisponibilitatea. În contrast, absorbţia rosuvastatinei, un alt agent hipolipemiant, a fost semnificativ diminuată în condiţii de saţietate comparativ cu postul, indicând necesitatea administrării rosuvastatinei înainte de consumul alimentelor(2).
Dietele hiperproteice, în care se pune accentul mai mult pe alimentele cu proteine de înaltă calitate, influenţează eficacitatea anumitor clase de medicamente şi pot genera anumite reacţii adverse. În cazul beta-blocantelor (metoprolol, propranolol) s-au identificat ca reacţii adverse bradicardie, hipotensiune şi bronhoconstricţie secundare creşterii biodisponibilităţii acestora. Aceleaşi efecte adverse au fost observate şi în cazul administrării de carbidopa, levodopa şi teofilină la scurt timp după o masă bogată în proteine(23).
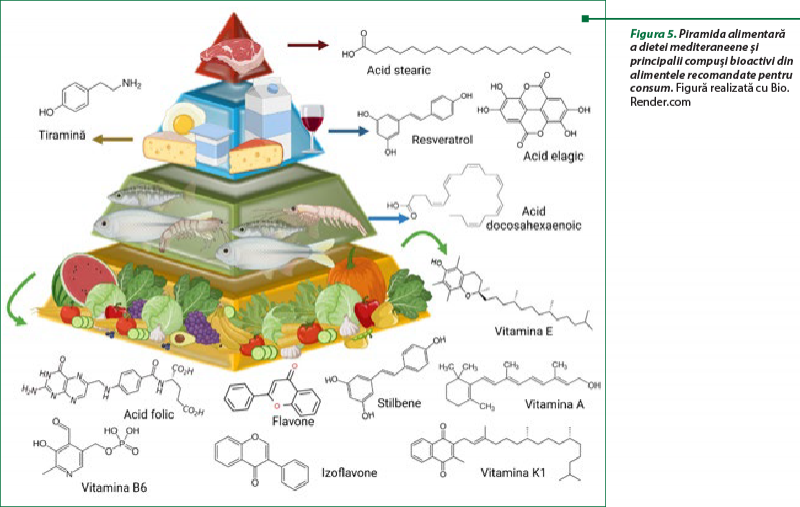
Dieta mediteraneeană este cunoscută în lume pentru beneficiile sale asupra prevenirii, dar şi ameliorării anumitor boli cronice. Se recomandă consumul în cantităţi mari de fructe, legume, nuci, cereale, cantităţi moderate de produse marine, acizi graşi Omega-3, produse lactate, ouă şi un consum limitat de produse care conţin acizi graşi saturaţi şi zaharuri rafinate. În ceea ce priveşte alcoolul, se recomandă consumul moderat de vin roşu sau alte băuturi fermentate(24). Prin abundenţa de principii active constituite în alimentele asociate dietei mediteraneene (figura 5), există posibilitatea ca aportul de anumite grupe alimentare să interfereze cu terapia farmacologică a unui pacient (în situaţia în care pacientul adoptă dieta mediteraneeană pentru ameliorarea simptomatologiei şi îmbunătăţirea calităţii vieţii).
Există multiple date clinice care demonstrează că un consum crescut de anghinare, broccoli, varză, varză de Bruxelles, conopidă, roşii, morcovi, ţelină, mărar, coriandru, păstârnac, pătrunjel, usturoi şi chiar de busuioc poate determina apariţia unor interacţiuni farmacocinetice medicament-aliment. Recomandările pentru moderaţie şi consumul prudent se impun la pacienţii care sunt sub tratament cu substrate de CYP1A2, cum ar fi clozapină, olanzapină, fluvoxamină, haloperidol, melatonină, ramelteon, tiazinidină şi teofilină(25). De asemenea, anumite legume şi leguminoase bogate în vitamina K (spanac, broccoli, varză de Bruxelles, varză kale, pătrunjel, sparanghel, ardei gras etc.) influenţează siguranţa şi eficacitatea terapiei anticoagulante (warfarină, acenocumarol). Consumul de alimente gătite pe grătar poate reduce activitatea warfarinei, iar consumul de ceapă preparată termic poate creşte activitatea acestui medicament(2,14).
Anasonul (Pimpinella anisum) şi uleiul esenţial de anason potenţează efectele medicamentelor cu acţiune asupra sistemului nervos central: codeină, diazepam, midazolam, pentobarbital, imipramină şi fluoxetină, dacă este utilizat în doze mari(26).
Usturoiul (Allium sativum) are proprietăţi terapeutice importante la pacienţii diabetici, dar în administrare cu medicamentele antidiabetice are capacitatea de a potenţa efectele farmacologice ale acestora(27).
Consumul de peşte şi fructe de mare, dar şi de uleiuri sănătoase, surse bogate de acizi graşi Omega-3, ar putea reduce factorii de coagulare (fibrinogenul şi protrombina) şi ar putea afecta medicaţia anticoagulantă (aspirină, clopidogrel, ticlodipină, dipiridamol, dalteparină, enoxaparină, apixaban, rivaroxaban, heparină, warfarină), în sensul potenţării efectelor acesteia. Cu toate acestea, studiile nu au identificat interacţiuni majore între consumul de peşte şi fructe de mare sau suplimente cu ulei de peşte şi administrarea concomitentă de warfarină(25).
Produsele lactate (lapte, iaurt, brânzeturi, smântână, unt) sunt cunoscute pentru interacţiunile cu anumite clase de medicamente (antibiotice, inhibitori de monoaminoxidază). Acestea sunt surse bogate de ioni divalenţi (calciu, magneziu) care complexează cu anumite clase de antibiotice şi le împiedică absorbţia: ciprofloxacina, norfloxacina, tetraciclina, doxorubicina(2). Chiar şi adăugarea în cafea sau în ceai a unei cantităţi mici de lapte inhibă puternic absorbţia tetraciclinei(2).
În ceea ce priveşte inhibitorii de monoaminoxidază (MAOI), asocierea lor cu alimente bogate în tiramină (brânză maturată, murături, bere, banane coapte, carne de vită, carne procesată, extractul de drojdie, fructe uscate, soia, ciocolată, pastă de creveţi) declanşează criza hipertensivă sau aşa numitul „cheese effect”(2). Tiramina este un precursor al catecolaminelor, acţionează ca un simpatomimetic, iar inhibarea metabolismului acesteia duce la creşterea concentraţiei de catecolamine şi determină un răspuns presor, cu risc de hemoragie cerebrală(25).
În contextul suplimentării cu fier, consumul de lapte trebuie dozat corespunzător, deoarece cazeina leagă fierul şi împiedică absorbţia acestuia. Totodată, asocierea de mercaptopurină cu laptele de vacă reduce biodisponibilitatea medicamentului, din cauza conţinutului crescut de xantin oxidază din lapte(25).
Consumul moderat de carne face parte dintr-un stil alimentar echilibrat. Este important ca produsul să nu fie ultraprocesat, sărat sau foarte bogat în grăsimi şi este de preferat să se opteze pentru carnea slabă de pasăre (pui sau curcan) sau carnea de peşte. Conţinutul de grăsime al cărnii depinde de specia animalului, precum şi de partea din carne care este utilizată. Se evită carnea grasă sau cantităţile considerabile de grăsime, deoarece pot induce o creştere a secreţiei biliare şi conduc la solubilizarea medicamentelor şi suplimentelor lipofile(28). Acelaşi lucru se întâmplă şi în cazul dietelor bogate în grăsimi, astfel fiind afectată biodisponibilitatea anumitor medicamente, precum pazopanib, vemurafenib sau lapatinib(29).
Similar cu mecanismele prin care anumite alimente modifică farmacocinetica unor medicamente, există şi situaţii în care medicamentele afectează semnificativ statusul nutriţional, inducând deficit de anumite vitamine sau minerale.
Au fost documentate următoarele deficienţe nutriţionale la administrarea medicamentelor(30):
-
Deficit de calciu – administrarea de anticonvulsivante, corticosteroizi, antagoniştii receptorilor H2, diuretice de ansă.
-
Deficit de magneziu – administrarea de contraceptive orale, antagoniştii receptorilor H2, diuretice de ansă, diuretice tiazidice, inhibitori de pompă de protoni.
-
Deficitde potasiu – administrarea de corticosteroizi, diuretice de ansă, diuretice tiazidice.
-
Deficit de zinc – administrarea de antagonişti ai receptorilor H2, diuretice de ansă, diuretice tiazidice.
-
Deficit de vitamină A – administrarea de sechestranţi ai acizilor biliari.
-
Deficit de vitamină B12 – administrarea de metformin, antagoniştii receptorilor H2, inhibitori de pompă de protoni.
-
Deficit de vitamină D – administrarea de anticonvulsivante, sechestranţi ai acizilor biliari, antagoniştii receptorilor H2.
-
Deficit de vitamină K – administrarea de sechestranţi ai acizilor biliari.
Un stil de viaţă sănătos şi echilibrat, consumând o diversitate de alimente naturale şi cât mai puţin procesate, reprezintă una dintre cele mai eficiente strategii de prevenţie a bolilor cronice. Cu toate acestea, aderenţa la un stil de viaţă sănătos este foarte redusă în ceea ce priveşte populaţia din România(31).
Concluzii
Medicii nutriţionişti, dieteticienii şi nutriţioniştii se confruntă des cu pacienţi sub tratament pentru diverse patologii. În această situaţie, sunt cruciale cunoaşterea şi înţelegerea interacţiunilor dintre medicamente şi alimente în contextul elaborării planurilor nutriţionale. Cercetările efectuate până acum au demonstrat că aceste interacţiuni pot avea un impact semnificativ asupra eficacităţii tratamentelor medicamentoase şi, în consecinţă, asupra stării de sănătate a pacienţilor. Din acest motiv, este esenţial ca profesioniştii din domeniul sănătăţii să fie bine informaţi cu privire la aceste interacţiuni şi să le ia în considerare când realizează planuri nutriţionale personalizate.
Prin conştientizarea acestor interacţiuni, putem maximiza beneficiile terapiei medicamentoase şi, în acelaşi timp, minimiza riscurile asociate cu posibilele efecte secundare sau interferenţe neaşteptate. Astfel, cunoaşterea interacţiunilor medicament-aliment devine un element esenţial în promovarea unei asistenţe medicale de calitate şi pentru îmbunătăţirea calităţii vieţii pacienţilor.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Chan LN. Drug-nutrient interactions. JPEN J Parenter Enteral Nutr. 2013 Jul;37(4):450-9. .
-
Bushra R, Aslam N, Khan AY. Food-drug interactions. Oman Med J. 2011 Mar;26(2):77-83. .
-
Choi JH, Ko CM. Food and Drug Interactions. J Lifestyle Med. 2017 Jan;7(1):1-9.
-
Adalbjörnsson BV, Ramel A. Food-Drug Interaction in Older Adults. In: Interdisciplinary Nutritional Management and Care for Older Adults. 2021;249–259.
-
Witkamp RF. Food–Drug Interactions in Older People. Food for the Ageing Population: A volume in Woodhead Publishing Series in Food Science, Technology and Nutrition. 2009;458–477.
-
Ziani K, Negrei C, Ioniţă-Mîndrican C, et al. Drug-food interactions: the influence on the patient’s therapeutic plan. Farmacia. 2022;70(5):785-97..
-
Kenakin TP. Pharmacokinetics I: Permeation and Metabolism. Pharmacology in Drug Discovery and Development. 2017;157–191.
-
Paine MF, Widmer WW, Hart HL, et al. A furanocoumarin-free grapefruit juice establishes furanocoumarins as the mediators of the grapefruit juice-felodipine interaction [published correction appears in Am J Clin Nutr. 2006 Jul;84(1):264]. Am J Clin Nutr. 2006;83(5):1097-1105.
-
Bailey DG, Dresser G, Arnold JM. Grapefruit-medication interactions: forbidden fruit or avoidable consequences? CMAJ. 2013 Mar 5;185(4):309-16. 1.
-
Bailey DG, Dresser GK, Leake BF, Kim RB. Naringin is a major and selective clinical inhibitor of organic anion-transporting polypeptide 1A2 (OATP1A2) in grapefruit juice. Clin Pharmacol Ther. 2007 Apr;81(4):495-502. .
-
Grenier J, Fradette C, Morelli G, Merritt GJ, Vranderick M, Ducharme MP. Pomelo juice, but not cranberry juice, affects the pharmacokinetics of cyclosporine in humans. Clin Pharmacol Ther. 2006 Mar;79(3):255-62. .
-
Petric Z, Žuntar I, Putnik P, Bursać Kovačević D. Food-Drug Interactions with Fruit Juices. Foods. 2020 Dec 24;10(1):33. 3.
-
Jeon H, Jang IJ, Lee S, Ohashi K, Kotegawa T, Ieiri I, Cho JY, Yoon SH, Shin SG, Yu KS, Lim KS. Apple juice greatly reduces systemic exposure to atenolol. Br J Clin Pharmacol. 2013 Jan;75(1):172-9. .
-
Zikria J, Goldman R, Ansell J. Cranberry juice and warfarin: when bad publicity trumps science. Am J Med. 2010 May;123(5):384-92. .
-
Hamann GL, Campbell JD, George CM. Warfarin-cranberry juice interaction. Ann Pharmacother. 2011 Mar;45(3):e17. 1.
-
Zhong Y, Wang Y, Guo J, Chu H, Gao Y, Pang L. Blueberry Improves the Therapeutic Effect of Etanercept on Patients with Juvenile Idiopathic Arthritis: Phase III Study. Tohoku J Exp Med. 2015 Nov;237(3):183-91. .
-
Roth M, Timmermann BN, Hagenbuch B. Interactions of green tea catechins with organic anion-transporting polypeptides. Drug Metab Dispos. 2011 May;39(5):920-6. .
-
Yao HT, Hsu YR, Li ML. Beverage-Drug Interaction: Effects of Green Tea Beverage Consumption on Atorvastatin Metabolism and Membrane Transporters in the Small Intestine and Liver of Rats. Membranes (Basel). 2020 Sep 14;10(9):233. .
-
Belayneh A, Molla F. The Effect of Coffee on Pharmacokinetic Properties of Drugs : A Review. Biomed Res Int. 2020 Jul 24;2020:7909703. .
-
Fernandes I, Pérez-Gregorio R, Soares S, Mateus N, de Freitas V. Wine Flavonoids in Health and Disease Prevention. Molecules. 2017 Feb 14;22(2):292. 2.
-
Chan LN, Anderson GD. Pharmacokinetic and pharmacodynamic drug interactions with ethanol (alcohol). Clin Pharmacokinet. 2014 Dec;53(12):1115-36. .
-
Mergenhagen KA, Wattengel BA, Skelly MK, Clark CM, Russo TA. Fact versus Fiction: a Review of the Evidence behind Alcohol and Antibiotic Interactions. Antimicrob Agents Chemother. 2020 Feb 21;64(3):e02167-19. .
-
D’Alessandro C, Benedetti A, Di Paolo A, Giannese D, Cupisti A. Interactions between Food and Drugs, and Nutritional Status in Renal Patients: A Narrative Review. Nutrients. 2022 Jan 4;14(1):212. 2.
-
Bach-Faig A, Berry EM, Lairon D, Reguant J, Trichopoulou A, Dernini S, Medina FX, Battino M, Belahsen R, Miranda G, Serra-Majem L; Mediterranean Diet Foundation Expert Group. Mediterranean diet pyramid today. Science and cultural updates. Public Health Nutr. 2011 Dec;14(12A):2274-84. 5.
-
Spanakis M, Patelarou E, Patelarou A. Drug-Food Interactions with a Focus on Mediterranean Diet. Applied Sciences. 2022;12(20):10207.
-
Samojlik I, Mijatović V, Petković S, Skrbić B, Božin B. The influence of essential oil of aniseed (Pimpinella anisum, L.) on drug effects on the central nervous system. Fitoterapia. 2012 Dec;83(8):1466-73. 2.
-
Gupta RC, Chang D, Nammi S, Bensoussan A, Bilinski K, Roufogalis BD. Interactions between antidiabetic drugs and herbs: an overview of mechanisms of action and clinical implications. Diabetol Metab Syndr. 2017 Jul 26;9:59. .
-
Lopes M, Coimbra MA, Costa MDC, Ramos F. Food supplement vitamins, minerals, amino-acids, fatty acids, phenolic and alkaloid-based substances: An overview of their interaction with drugs. Crit Rev Food Sci Nutr. 2023;63(19):4106-4140. 9.
-
Willemsen AE, Lubberman FJ, Tol J, Gerritsen WR, van Herpen CM, van Erp NP. Effect of food and acid-reducing agents on the absorption of oral targeted therapies in solid tumors. Drug Discov Today. 2016 Jun;21(6):962-76. .
-
Drug-Induced Nutrient Depletions: What Pharmacists Need to Know. https://www.uspharmacist.com/article/druginduced-nutrient-depletions-what-pharmacists-need-to-know (accessed 30 October 2023).
-
Mititelu M, Cobelschi P, Gheorghe E, et al. Evaluation of nutritional status and adherence to a healthy diet among the Romanian population. Farmacia. 2023;71(5):980-90.