Viruses are the smallest and simplest pathogens, necessarily intracellular, that use the metabolic apparatus of the host cell to multiply. To enter into invaded cells, they use pre-existing host structures, so viruses have tropism for those systems that possess these structures, viral infections being generally confined to those tissues and organs. Viral infections have different symptoms; some infections are asymptomatic, others can be severe, even fatal. Viral infections can develop chronically or acutely. When viruses are highly contagious and when new viruses appear, which the host population has not met and for which it has no immunity, epidemics and pandemics can occur. Some viruses are involved in the genesis of cancer. Viruses are classified primarily by the nucleic acid they contain, in DNA viruses and RNA viruses. Antiviral agents have different mechanisms of action, interfering different life cycle stages of different viruses. Pharmacotherapeutic classification of antiviral drugs is made according to the viral infections in which they are active. Antiviral medication is most often used as curative treatment, but some antiviral drugs can also be used prophylactically. Vaccination is the prophylactic method of active immunization, but unfortunately for many viruses there is no vaccine.
Medicamente antivirale (I) Generalităţi. Antiretrovirale. Medicamente folosite în infecţii produse de virusurile respiratorii
Antiviral drugs. Background. Antiretrovirals. Drugs used in infections caused by respiratory viruses
First published: 16 aprilie 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.193.2.2020.3088
Abstract
Rezumat
Virusurile sunt cei mai mici şi mai simpli patogeni, obligatoriu intracelulari, care folosesc aparatul metabolic al celulei pe care o invadează pentru a se multiplica. Deoarece pentru a intra în celule folosesc structuri preexistente ale gazdei, virusurile au tropism pentru acele aparate şi sisteme care posedă aceste structuri, infecţiile virale având în general localizări determinate. Infecţiile virale au diferite simptome; unele infecţii sunt asimptomatice, altele pot fi severe, chiar fatale. Infecţiile virale pot evolua cronic sau acut. Când virusurile sunt foarte contagioase şi când prin mutaţii apar virusuri noi cu care populaţia-gazdă nu s-a întâlnit şi pentru care nu are imunitate, pot apărea epidemiile şi pandemiile. Unele virusuri sunt implicate în procesul de apariţie a cancerelor. Virusurile se clasifică în primul rând după acidul nucleic pe care îl conţin, în virusuri ADN şi virusuri ARN. Medicamentele antivirale au diferite mecanisme de acţiune, împiedicând etape ale ciclului de viaţă al diferitelor virusuri. Clasificarea farmacoterapeutică a medicamentelor antivirale se face în funcţie de infecţiile virale în care sunt active. Medicaţia antivirală se foloseşte de cele mai multe ori curativ, dar unele dintre medicamente se pot folosi şi profilactic. Vaccinarea este metoda profilactică de imunizare activă, însă din nefericire pentru multe dintre virusuri nu există vaccin.
Virusurile sunt paraziţi infecţioşi obligatoriu intracelulari. Sunt incapabile de multiplicare în afara celulei pe care o parazitează şi al cărei aparat metabolic îl deturnează, însă genomul viral conţine informaţii care permit desfăşurarea unui ciclu infecţios complet într-o celulă-gazdă. Sunt cele mai mici (de regulă, au 20-30 nm diametru) şi mai simple microorganisme (unii cercetători au chiar îndoieli în a le considera vii(1)). Virusurile sunt alcătuite din acizi nucleici (ADN sau ARN) aflaţi în interiorul unui înveliş proteic numit capsidă. Suplimentar, unele virusuri mai au un înveliş de protecţie lipoproteic, numit anvelopă (SARS-CoV-2 are un astfel de înveliş, care poate fi distrus cu alcool etilic, săpun etc.). Capsida şi lipoproteinele de suprafaţă pot avea proprietăţi antigenice.
Ciclul de multiplicare al unui virus începe prin identificarea şi intrarea în celula-gazdă potrivită (definită ca specifică anumitor structuri pe care virusul le foloseşte); la nivelul celulei-gazdă, virusul poate rămâne dormant, cu integrare în ADN-ul celulei, sau se poate multiplica, prin confiscarea aparatului metabolic celular. Acizii nucleici se replică, se sintetizează proteinele virale şi noi particule virale se asamblează în interiorul celulei-gazdă. Acestea sunt apoi eliberate lent din celula-gazdă, cu prezervarea acesteia, sau sunt eliberate masiv, cu distrugerea celulei-gazdă, pentru a infecta apoi alte celule-gazdă(2).
Pentru a intra în celula-gazdă, virusurile folosesc structuri existente la nivelul acesteia, care în mod normal au diferite roluri fiziologice. Astfel de exemple sunt receptorii adrenergici, receptorii pentru citokine, glicoproteine şi altele. De exemplu, SARS-CoV-2 foloseşte pentru a intra în celule receptorii ACE2, structuri care funcţionează şi ca enzime ale sistemului renină-angiotensină-aldosteron, care convertesc octapeptidul angiotensină II în heptapeptida vasodilatatoare angiotensină (1-7)(3).
Replicarea virusurilor este aşadar restrânsă la nivelul celulelor-gazdă specifice în care pot pătrunde. Consecutiv, infecţiile produse de anumite virusuri sunt în general circumscrise unui anumit organ sau aparat şi sistem anatomofiziologic. O clasificare a virusurilor utilă din punct de vedere farmacoterapeutic se poate face pornind de la structurile pe care le infectează.
Ciclul de viaţă al unui virus descris la modul general este acelaşi pentru toate virusurile. În funcţie de acidul nucleic conţinut şi de alte particularităţi structurale, virusurile au specificităţi în ciclul de viaţă, de aceea anumite antivirale sunt active doar în infecţii cu anumite virusuri. Vom discuta particularităţile pentru fiecare virus în parte, împreună cu mecanismele de acţiune ale medicamentelor antivirale. Dar este utilă o privire de ansamblu asupra etapelor pe care le parcurge orice virus pentru multiplicare în organismul pe care îl parazitează. După intrarea virusului în organism, acesta identifică celulele care au structurile pe care le poate folosi pentru a intra în celule. Virusul se ataşează la aceste structuri şi pătrunde în celulă, unde are loc decapsidarea, cu eliberarea acizilor nucleici. Aceştia deturnează celula-gazdă, care realizează sinteză de acizi nucleici virali şi sinteză de proteine virale. Componentele virale suferă procese de maturare şi sunt înglobate în noi particule virale care sunt eliberate din celula în care s-au format; acestea pot infecta alte celule(4).
Lucrarea prezintă generalităţi despre virusuri şi infecţii virale şi despre medicamentele antivirale active pe unele virusuri ARN: HIV şi virusurile respiratorii. A doua parte a ciclului va prezenta informaţii despre alte infecţii virale produse de alte virusuri ARN şi despre virusuri ADN şi medicamentele folosite, iar a treia parte se va opri asupra antiviralelor folosite în hepatitele virale.
Virusuri. Clasificare. Infecţii produse
Virusurile se clasifică în funcţie de acidul nucleic conţinut (virusuri ADN şi virusuri ARN), de structura monocatenară sau bicatenară a acidului nucleic, de formă şi dimensiune, de prezenţa sau absenţa anvelopei şi de modul în care virusul se comportă în procesul de multiplicare(2).
Virusuri ADN (cu excepţia parvovirusului, toate conţin ADN dublu-catenar)(2):
poxvirusuri (anvelopate, tetraedrice): virusul variolei, virusul vaccinia, Moluscum contagiosum;
virusuri herpetice (icosaedrice, anvelopate): virusul herpes simplex 1 şi 2 (HSV-1, HSV-2), virusul varicelo-zosterian (VZV), virusul Epstein-Barr (EBV), citomegalovirusul (CMV), herpesvirusurile umane 6, 7, 8 (HHV-6, HHV-7, HHV-8), virusul febrei glandulare;
-
hepadnavirusuri (sferice, anvelopate): virusul hepatitei B (HBV);
-
adenovirusuri (icosaedrice, neanvelopate): adenovirus;
-
papilomavirusuri (icosaedrice, neanvelopate): papilomavirusul uman (HPV);
-
poliomavirusuri (icosaedrice, neanvelopate): virusul John Cunningham (JCV);
-
parvovirusuri: parvovirusul B19.
Virusuri ARN (toate conţin ARN monocatenar, cu excepţia rotavirusului, care conţine ARN dublu-catenar)(2):
-
reovirusuri (icosaedrice, neanvelopate): rotavirus;
-
ortomixovirusurile (sferice, anvelopate): virusurile gripale;
-
paramixovirusuri (sferice, anvelopate): virusuri paragripale, virusul rujeolei, virusul oreionului, virusul sinciţial respirator;
-
togavirusuri (icosaedrice, anvelopate): virusul rubeolei, virusul encefalitei ecvestre;
-
rabdovirusuri (formă alungită, neanvelopate): virusul rabiei;
-
filovirusuri (filamentoase, anvelopate): virusul Ebola, virusul Marburg;
-
picornavirusuri (icosaedrice, neanvelopate): virusul poliomielitei, rinovirusuri, virusuri Coxackie, virusul hepatitei A;
-
retrovirusuri (icosaedrice, neanvelopate): HIV, virusul cu tropism pentru limfocitele T al primatelor;
-
arenavirusuri (sferice, anvelopate): virusul febrei Lassa, virusul limfocitic coriomeningitic;
-
flavivirusuri (sferice, anvelopate): virusul Dengue, virusul febrei galbene, virusul West Nile, virusul Zika, virusul hepatitic C (HCV);
-
coronavirusuri (sferice, anvelopate): coronavirusul uman, SARS-CoV, MERS-CoV, SARS-CoV-2.
Deşi virusurile produc cel mai frecvent simptome localizate la nivelul unui anumit sistem, uneori simptomele unei infecţii virale pot fi complexe şi nespecifice. De exemplu, infecţiile cu virusuri respiratorii pot debuta cu rash cutanat sau manifestări digestive şi se pot complica cu meningite sau encefalite ori cu disfuncţii multiple de organ(2).
Virusul imunodeficienţei umane (HIV)
Se estimează că aproximativ 40 de milioane de persoane sunt infectate cu HIV la nivel mondial, dintre care 2,4 milioane de copii. Prevalenţa cea mai mare este în ţările cele mai sărace(2).
HIV este un virus ARN anvelopat. HIV se localizează preponderent la nivelul limfocitelor T CD4 activate; intrarea în aceste celule se face prin legarea de receptorii CD4, folosind drept coreceptori structuri cunoscute precum CCR5 şi CXCR4. Alte celule susceptibile la infectarea cu HIV sunt limfocitele T CD4 în repaus, monocitele, macrofagele, celulele dendritice, astrocitele (cu afectare neurologică) şi celulele epiteliale renale (cu neuropatie)(2).
Transmiterea HIV se face prin contact direct cu fluidele biologice contaminate (sânge, spermă, secreţie vaginală) sau cu ţesuturi infectate. Forma acută a afecţiunii se dezvoltă la 2-4 săptămâni după infectare, cu simptome asemănătoare gripei sau mononucleozei infecţioase. În primele 3 luni poate să apară meningita aseptică. Simptomele iniţiale dispar în 2-3 săptămâni, dar virusul continuă să se replice la nivelul limfocitelor T CD4, producând moartea acestora. Când numărul limfocitelor T CD4 scade sub 500 de celule/microL de sânge sau când încărcătura virală este mare (peste 75 000 copii/mL), forme severe ale bolii pot să apară, cu scădere în greutate şi diaree şi cu instalarea infecţiilor oportuniste, a malignităţii sau a demenţelor. Infecţiile oportuniste care apar în SIDA includ candidozele orale, pneumonia cu Pneumocystis, meningitele cu Cryptococcus, toxoplasmoza cerebrală, tuberculoza, diareea datorată micobacteriilor, Salmonella, Shigella, Campilobacter şi altele(2).
Diagnosticul se pune pe baza testelor imunologice şi genetice; determinarea genetică a acizilor nucleici este metoda cea mai sensibilă de diagnostic, fiind folosită şi la stadializarea afecţiunii şi la monitorizarea eficacităţii terapiei antiretrovirale.
În cei aproape 40 de ani de când a fost identificat HIV, metabolismul virusului a fost bine descris şi multe medicamente antiretrovirale eficace au fost dezvoltate. HIV dezvoltă rapid rezistenţă, de aceea este nevoie de tratamente complexe cu mai multe medicamente, aderenţa la tratament fiind extrem de importantă pentru controlul infecţiei. Ghidurile de tratament se actualizează frecvent, pentru a ţine cont de toate aceste aspecte(5,6).
Prevenţia transmiterii virusului se face prin evitarea comportamentelor riscante (sex neprotejat, folosirea comună a seringilor în cazul toxicomanilor etc.).
Profilaxia transmiterii HIV de la gravida infectată la făt se face prin administrarea antiretroviralelor în trimestrele 2 şi 3 de sarcină. Se pot folosi în sarcină următoarele antiretrovirale:
-
NRTI: abacavir, emtricitabină, lamivudină, fumarat de tenofovir disoproxil, zidovudină;
-
NNRTI: efavirenz; de alternativă (rilpivirină);
-
PI: atazanavir/ritonavir, darunavir/ritonavir; de alternativă (lopinavir/ritonavir);
-
inhibitori de integrază: raltegravir(7).
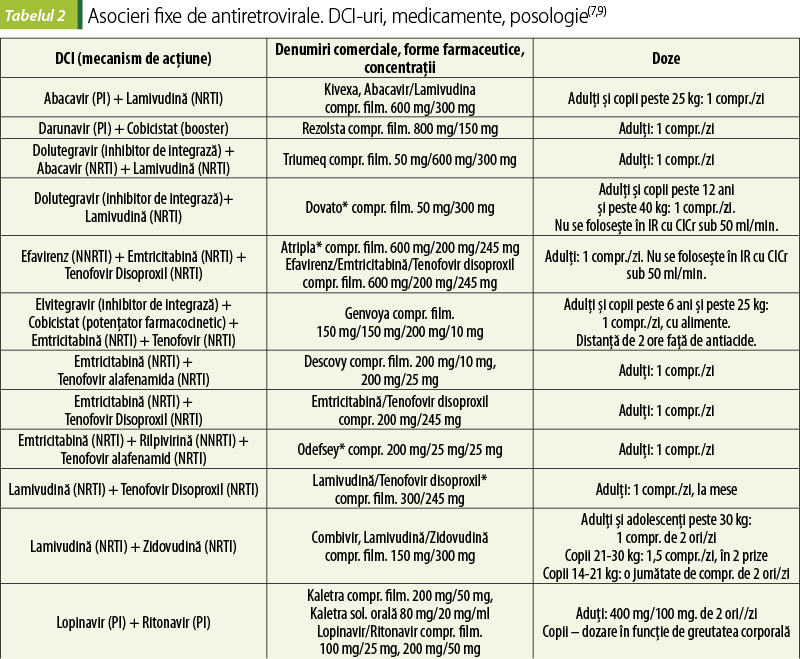
Medicamentele antiretrovirale au diferite mecanisme de acţiune care interferează cu etape ale replicării HIV (tabelele 1 şi 2).
1. Antiretrovirale care inhibă intrarea HIV în celulele-gazdă
1.a. Inhibitori ai fuziunii virale: enfuvirtid
Pentru a intra într-o celulă-gazdă, HIV fuzionează cu membrana celulară gazdă. Această fuziune este facilitată de o modificare conformaţională a unei glicoproteine virale, gp41, în membrana celulelor virale. Enfuvirtid este o peptidă cu 36 de aminoacizi care se leagă de glicoproteina gp41 şi previne modificarea conformaţională, blocând fuziunea HIV şi intrarea în celulele-gazdă. Enfuvirtid se utilizează când există rezistenţă sau intoleranţă la alte medicamente antiretrovirale(8).
Reacţiile adverse ale enfuvirtidului sunt: reacţii la locul injectării, hipersensibilitate, insomnie, durere de cap, ameţeală, greaţă, eozinofilie; creşte riscul de pneumonie bacteriană(7).
1.b. Inhibitori ai coreceptorilor CCR5: maraviroc
CCR5 este un receptor pentru mai multe chemokine şi proteine inflamatorii MIP-1a şi MIP-1b de la nivelul macrofagelor. CCR5 este exprimat pe multe celule, inclusiv celule T, macrofage, celule dendritice şi microglia. CCR5 acţionează, de asemenea, ca un coreceptor viral care facilitează intrarea HIV în celulă. Unele tulpini HIV folosesc alţi receptori pentru chemokine, cum ar fi CCR4, sau folosesc ambii receptori – CCR4 şi CCR5 – pentru a intra în celule. Tulpinile HIV care utilizează CCR5 predomină la începutul infecţiei. Maravirocul se leagă selectiv de CCR5 şi previne interacţiunea cu tulpinile de HIV cu tropism pentru CCR5, inhibând intrarea acestora în celulă. Medicamentul nu are niciun efect asupra virusurilor care utilizează CCR4 sau au tropism dual pentru CCR4 şi CCR5. Maravirocul se utilizează în asociere cu alte medicamente antiretrovirale, la pacienţii cărora li s-au administrat deja alte tratamente antiretrovirale. Rezistenţa este mai puţin frecventă, dar poate apărea ca urmare a modificărilor glicoproteinelor anvelopei virale care interacţionează cu CCR5(8).
2. Inhibitori ai reverstranscriptazei
Aceste medicamente inhibă replicarea virusului ARN prin inhibarea reversibilă a reverstranscriptazei, care transcrie invers ARN-ul viral în ADN, în vederea introducerii acestuia în secvenţa ADN-ului gazdă.
2.a. Inhibitori nucleozidici/nucleotidici ai reverstranscriptazei (NRTI)
Inhibitorii nucleozidici de reverstranscriptază sunt analogi ai precursorilor purinicilor şi pirimidinicilor implicate în transcrierea ADN. Zidovudina este un analog al timidinei, emtricitabina şi lamivudina sunt analogi ai citidinei, iar abacavirul este un analog al deoxiguanonizei. Tenofovir disoproxil este un prodrog al tenofovir, un analog nucleotidic al adenozinei(7). Alte NRTI mai puţin folosite în prezent sunt didanozina (analog de deoxiadenozină) şi stavudina (analog de timidină).
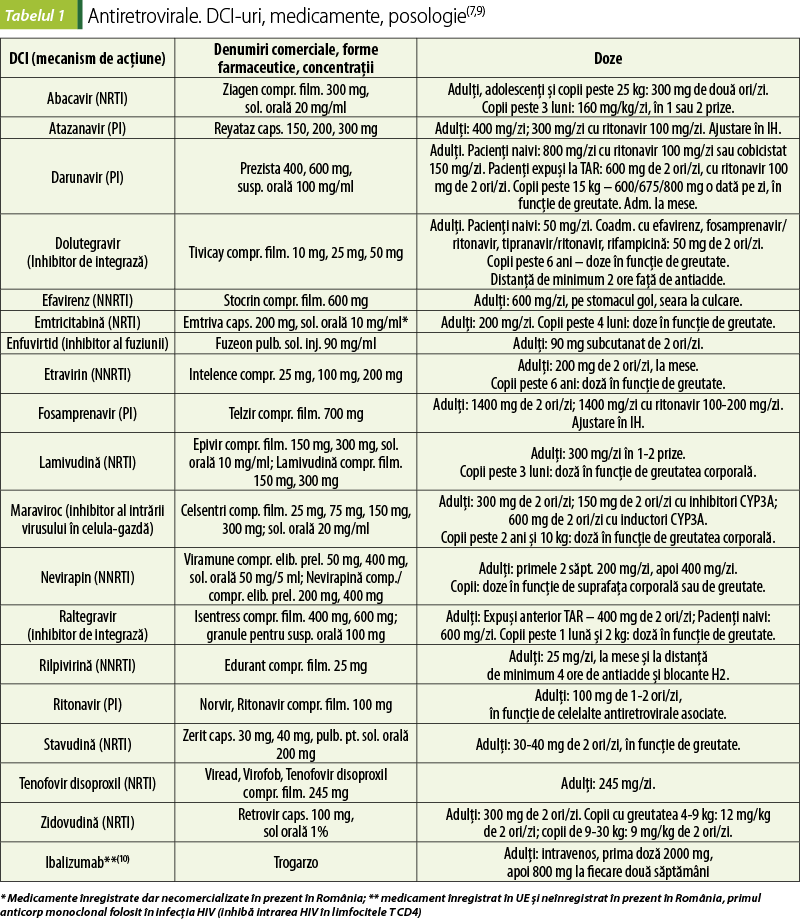
Inhibitorii nucleozidici/nucleotidici de reverstranscriptază sunt activaţi prin fosforilare în două etape până la forma de 5´-trifosfat, de către kinazele celulare. Inhibarea replicării virale se realizează prin legarea competitivă a medicamentului activat la complexul enzimatic care realizează reverstranscrierea, în locul 5´-deoxinucleozid-trifosfaţilor. Medicamentele nu dispun de grupul hidroxil în poziţia 3´ pe fracţiunea dezoxiriboză necesară pentru formarea normală a unei legături fosfodiesterice cu următoarea nucleotidă, astfel încât stopează alungirea lanţului ADN(8). Rezistenţa poate să apară după câteva săptămâni de tratament prin mutaţii care afectează locul de legare a medicamentului de reverstranscriptază sau prin eliminarea medicamentului de la nivelul ADN-ului în urma pirofosforolizei, care permite elongarea normală a ADN-ului(8).
Reacţiile adverse ale NRTI sunt adesea atât de severe încât duc la întreruperea tratamentului. Acestea sunt probabil legate de inhibarea enzimelor mitocondriale gazdă, cu afectarea formării de adenozin trifosfat intracelular (ATP), care duce la mai multe tulburări de organe. Astfel apar:
-
neutropenia şi anemia
-
greaţă, vărsături, diaree, dureri abdominale
-
dureri de cap, insomnie
-
mialgie sau miozită, în special la doze mari
-
hepatomegalie severă, care poate pune viaţa în pericol, cu steatoză şi acidoză lactică
-
pancreatită
-
sindrom lipodistrofic, cu redistribuirea grăsimii (pierderea de grăsime subcutanată, mărirea sânilor), rezistenţă la insulină şi dislipidemie(8).
2.b. Inhibitori nonnucleozidici ai reverstranscriptazei (NNRTI)
Delavirdin, efavirenz, etravirin, nevirapin şi rilpivirin se leagă de reverstranscriptază, realizând o modificare conformaţională a acesteia, cu împiedicarea alosterică a activităţii ADN polimerazei ARN şi ADN dependente (reverstranscriptază). Şi în cazul lor, rezistenţa apare rapid.
Reacţiile adverse ale NNRTI sunt:
-
erupţii cutanate (severe la 10% din cazuri), în special în cazul nevirapinei
-
greaţă, vărsături, dureri abdominale, diaree
-
dureri de cap, somnolenţă, oboseală
-
depresie şi tulburări psihice, pentru efavirenz şi rilpivirin
-
hepatotoxicitate după nevirapin, cu apariţia hepatitei fulminante letale, rar.
NNRTI prezintă interacţiuni multiple cu medicamente metabolizate de CYP3A4 şi CTP2B6, inclusiv inhibitori de protează HIV, medicamente antifungice şi inhibitori ai pompei de protoni(8).
3. Inhibitori de integrază
Raltegravir, elvitegravir şi dolutegravir inhibă enzima care introduce ADN viral rezultat în urma reverstranscrierii în ADN-ul celulei-gazdă.
Reacţiile adverse ale acestor medicamente sunt:
-
greaţă, vărsături, diaree, dureri abdominale
-
dureri de cap, ameţeli, insomnie, vise anormale
-
erupţii cutanate, uneori cu febră, artralgie, mialgie, angioedem şi hepatită(8).
4. Inhibitori de protează
În urma procesului de transcriere, ARN-ul viral este translatat în poliproteine precursoare inerte. Virusul funcţional are nevoie de proteine funcţionale. Proteaza HIV-1 virală este cea care permite maturarea virală, prin clivarea acestor poliproteine precursoare la proteinele structurale şi enzimele necesare virusului pentru înmugurirea prin membrana celulei-gazdă. Inhibitorii de protează HIV blochează proteaza virală şi determină producerea de particule de virus defecte care sunt mai puţin infecţioase. Acestea nu afectează activitatea virusului în celulele-gazdă care sunt deja infectate(4).
Inhibitori de protează (PI): fosamprenavir, indinavir, lopinavir, ritonavir, nelfinavir, tipranavir, saquinavir, atazanavir, darunavir.
Reacţiile adverse ale inhibitorilor de protează sunt:
-
greaţă, vărsături, dureri abdominale, diaree
-
sindrom lipodistrofic asemănător NRTI
-
disfuncţie hepatică
-
nefrolitiază (indinavir)
-
pancreatită
-
parestezii (ritonavir)(8).
PI dau naştere la numeroase interacţiuni medicamentoase. Inhibarea CYP3A4 poate potenţa efectele adverse ale inhibitorilor de protează. Utilizarea concomitentă a inductorilor CYP3A4 poate reduce concentraţiile plasmatice ale PI şi poate promova rezistenţa virală. Inhibarea CYP3A4 cu o doză mică de ritonavir poate creşte efectul clinic al altor PI, aceasta fiind o acţiune utilă care permite administrarea mai puţin frecventă sau în doze mai mici a celuilalt medicament. Ritonavirul inhibă, de asemenea, metabolizarea medicamentelor cum sunt warfarina şi carbamazepina. Utilizarea PI cu simvastatină trebuie evitată, din cauza unui risc crescut de miopatie(8).
Virusuri respiratorii
Cu excepţia virusurilor gripale, pentru virusurile care produc cel mai frecvent infecţii respiratorii nu există vaccin şi tratament specific. Cel mai adesea, diagnosticul se pune pe baza testelor genetice, de amplificare a acizilor nucleici; în cazul gripei şi al coronavirusurilor se pot face şi teste imunologice, de detectare a anticorpilor în sânge(2).
Rinovirusurile sunt cea mai frecventă cauză a infecţiilor acute de tract respirator superior, producând răcelile comune. Rinovirusurile se localizează la nivelul celulelor epiteliale ciliate ale arborelui respirator, unde determină inflamaţie prin creşterea expresiei citokinelor şi chemokinelor(2).
Răceala comună este mai frecventă toamna şi primăvara, transmiterea virusului făcându-se prin intermediul picăturilor expulzate prin strănut sau tuse, care prin intermediul mâinilor contaminate ajung la nas sau la gură; cu cât simptomele sunt mai intense, cu atât bolnavul este mai contagios. Apar în principal simptome ale infecţiei de tract respirator superior: iritaţii şi dureri în gât, rinoree, congestie nazală, tuse şi strănut; pot apărea şi cefalee sau febră. Simptomele durează o săptămână sau mai mult. Imunitatea produsă este de scurtă durată; acest lucru, împreună cu faptul că există mai mult de 100 de serotipuri de rinovirus fac ca răceala comună să fie recurentă(2).
Coronavirusurile sunt virusuri ARN anvelopate. Coronavirusurile se multiplică în celulele epiteliale ale nazofaringelui.

Majoritatea coronavirusurilor produc răceală comună (15% dintre răcelile comune se datorează coronavirusurilor). Există însă tulpini care produc afecţiuni mult mai severe, cel puţin la unele grupe de risc. Astfel, în 2002, în China a apărut un coronavirus denumit SARS-CoV, care s-a răspândit rapid în regiune şi apoi în Hong Kong, Vietnam, Singapore şi mai puţin în alte zone, unde a fost dus de călători provenind din aceste zone în care a fost endemic. Epidemia a durat 18 luni, fiind caracterizată de transmitere facilă de la om la om (multe dintre persoanele afectate au fost cadre medicale implicate în îngrijirea pacienţilor infectaţi) şi de mortalitate ridicată, mai ales în rândul vârstnicilor şi al celor suferinzi de alte boli cronice (de exemplu, mortalitatea a fost de 50% la pacienţii care sufereau deja de boli pulmonare). În 2012, un alt focar de infecţii severe produse de un coronavirus a apărut în Arabia Saudită. Virusul a fost denumit MERS-CoV, deoarece a circulat (şi continuă să circule, dată fiind rata de mutaţii rapide) în Orientul Mijlociu(2).
Simptomele de răceală comună care apar în infecţia cu coronavirus se datorează producerii de citokine şi chemokine; apar după o perioadă de incubaţie de 2 zile şi au un maxim la 3-4 zile după expunere(2).
Răspunsul inflamator exagerat produs de SARS-CoV, MERS-CoV şi SARS-CoV-2 este cel care generează morbiditatea şi mortalitatea ridicate. După cum arată şi numele acestor virusuri, implicarea pulmonară este severă în cazul lor. Infecţiile cu SARS-CoV nu prezintă uzual manifestări ale răcelii comune; tipic, apar febră ridicată, cefalee, mialgie şi tuse neproductivă, care progresează către afectare pulmonară severă, mai ales la vârstnici şi la pacienţii afectaţi de boli cronice (diabet, boli cardiovasculare, hepatită, boli pulmonare cronice). Infecţiile cu MERS-CoV pot avea manifestări medii de infecţii ale tractului respirator superior, dar în multe cazuri se agravează, cu apariţia insuficienţei respiratorii sau a insuficienţei multiple de organe(2).
În lipsa terapiei antivirale specifice şi a vaccinului, pentru controlul şi prevenţia infecţiilor severe cu coronavirusuri sunt de maximă importanţă distanţarea socială şi folosirea corespunzătoare a echipamentelor personale de protecţie.
Tratamentul antiviral în infecţiile cu noul coronavirus (SARS-CoV-2), cel care a declanşat pandemia din 2020, foloseşte câteva medicamente autorizate de a fi folosite în infecţiile cu HIV: asocierea lopinavir/ritonavir sau asocierea darunavir/cobicistat. Protocoalele de tratament, la momentul martie-aprilie 2020, sunt permanent reactualizate şi recomandă tratament simptomatic în stadiile uşoare (paracetamol) şi tratament cu hidroxiclorochină cu sau fără antivirale în stadiile medii şi severe(11,12).
Virusurile gripale sunt virusuri anvelopate conţinând ARN monocatenar, al căror genom este fragmentat în 8 segmente. Dacă o celulă este infectată simultan cu două virusuri gripale, structura discretă a ARN-ului acestora permite ca în timpul replicării să aibă loc rearanjări ale acidului nucleic, cu apariţia unui al treilea virus gripal, nou. De aceea rata mutaţiilor virusurilor gripale este mai mare chiar decât a altor virusuri ARN. Virusul nou apărut este unul pe care organismele infectate nu l-au mai întâlnit, de aceea nu au imunitate faţă de el. Acesta este motivul pentru care fiecare sezon gripal este gestionat cu vaccinuri care conţin tulpinile cele mai probabile pentru anul respectiv, iar vaccinarea gripală se recomandă a se face anual. Rata mare a mutaţiilor face ca la câţiva ani să apară epidemii de gripă. Pandemiile gripale se declanşează când virusul gripal circulant este nou şi foarte contagios; dacă virusul este şi înalt virulent, pandemia poate determina mortalitate mare. Vaccinurile gripale pandemice sunt diferite de cele sezoniere şi conţin tulpina virală implicată în pandemie(2).
Există trei tipuri de virusuri gripale: A, B şi C. Virusurile gripale A şi B pot produce epidemii, virusul gripal A fiind asociat formelor mai severe de gripă. Virusul gripal C produce de obicei infecţii respiratorii superioare uşoare. Virusurile gripale sunt identificate şi denumite pornind de la tipul lor şi de la proteinele de suprafaţă hemaglutinină (H) şi neuraminidază (N) pe care le conţin (de exemplu, pandemia gripală declarată de Organizaţia Mondială a Sănătăţii în 2009 a fost produsă de virusul A H1N1/09). Diferenţele care apar la nivelul acestor proteine sunt urmarea mutaţiilor genetice suferite de virusurile gripale. Hemaglutinina virală are rol în intrarea virusului în celule; neuraminidaza are un rol important în ieşirea din celula-gazdă în care s-au multiplicat particule virale nou formate şi în răspândirea lor către alte celule pe care le infectează. Tulpinile gripale A pot circula şi la păsări (gripa aviară) sau la porci (gripa porcină – cum a fost pandemia din 2009), cu creşterea probabilităţii de mutaţii cu virulenţă crescută(2,13).
Circulaţia virusurilor gripale predomină în sezonul rece. Transmiterea de la persoană la persoană se face fie pe cale aeriană, prin strănut sau tuse, fie prin contact cu particule infecţioase depuse pe suprafeţe contaminate. Virulenţa tulpinii şi imunitatea pentru virusul circulant sunt cele care determină severitatea simptomelor(2).
Virusurile gripale infectează şi se multiplică în celulele epiteliale ciliate ale traheii şi bronhiilor. După 1-2 zile de incubaţie, simptomele debutează brusc, cu febră, frisoane, dureri musculare, cefalee, tuse şi dureri în piept, simptome care pot dura şi mai mult de o săptămână. Complicaţiile includ pneumonia virală sau pneumonia bacteriană secundară, patogenii cel mai frecvent implicaţi fiind Staphylococcus aureus şi Streptococcus pneumonia.
Amantadina şi rimantadina s-au folosit în trecut pentru tratamentul gripei produse de virusul gripal A, dar dezvoltarea rezistenţei a limitat folosirea acestora(2).
În prezent, pentru profilaxia şi tratamentul gripei se folosesc inhibitoarele de neuraminidază oseltamivir, zanamivir şi peramivir; administrarea curativă este cu atât mai eficace cu cât se face mai devreme după debutul simptomelor(9,14).
Virusurile paragripale reprezintă cea mai frecventă cauză a crupului la copii şi una dintre cauzele majore de infecţii severe de tract respirator inferior la imunocompromişi. La copii, frecvent infecţiile paragripale se pot localiza şi la nivelul sinusurilor şi al urechii medii(2).
Virusurile paragripale infectează celulele ciliate ale tractului respirator superior şi inferior. Transmiterea se face prin picături eliminate prin tuse sau prin contact cu suprafeţe contaminate.
Există patru serotipuri de virusuri paragripale patogene pentru om. Tipurile 1 şi 2 circulă toamna, producând laringotraheobronşite (crup), manifestate iniţial cu febră, rinoree şi faringită, care apoi progresează spre tuse lătrătoare, cu durere în piept şi dificultăţi de respiraţie. Tipurile 3 şi 4 produc focare de infecţie primăvara; virusul paragripal 3 este asociat mai ales cu pneumonia şi bronşiolita la copii, pe când tipul 4 produce în general infecţii de tract respirator superior de severitate medie(2).
Nu există tratament antiviral specific şi nici vaccin. Crupul se tratează simptomatic prin administrare de corticosteroizi şi nebulizare de adrenalină(2).
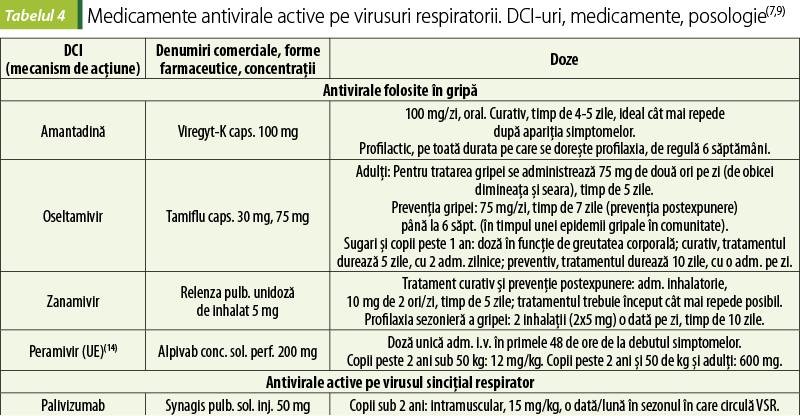
Virusul sinciţial respirator (RSV) produce majoritatea bronşiolitelor şi otitelor medii la copii. O mare parte din pneumoniile care necesită spitalizare la copii se datorează RSV. La adulţi, simptomele infecţiei respiratorii cu RSV sunt în general medii, dar la vârstnici, la imunocompromişi şi la pacienţii cu BPOC sau insuficienţă cardiacă congestivă pot să apară complicaţii severe(2).
RSV este un virus ARN anvelopat, cu două grupuri antigenice majore (A şi B), care infectează celulele epiteliale ciliare columnare ale căilor respiratorii inferioare şi pneumocitele.
Transmiterea se face pe cale respiratorie, prin inhalarea virusului conţinut în particule expiratorii sau prin preluarea virusului de pe suprafeţe contaminate şi intrarea lui în organism la nivelul mucoaselor bucale, nazale sau oculare. Infecţiile predomină în sezonul rece.
Infecţiile apar devreme în viaţă, de aceea este importantă profilaxia acestora cu anticorpul monoclonal palivizumab la copiii prematuri şi la cei sub 2 ani cu displazie pulmonară sau cu boli cardiace congenitale semnificative din punct de vedere hemodinamic(9). Infecţiile dezvoltate în copilăria mică pot fi urmate de infecţii de intensitate medie, recurente, întreaga viaţă. La sugari, simptomele se declanşează după 2-5 zile de incubaţie, iniţial luând forma bronşiolitei, care poate progresa către pneumonie; crupul apare mai rar. La copiii mai mari şi la adulţi, infecţia cu RSV se prezintă în general cu simptome de tract respirator superior, cu congestie nazală şi tuse. La copii, otita medie se poate coinfecta bacterian, cu apariţia unor forme mai severe.
Manifestările medii ale infecţiilor cu RSV se tratează simptomatic. Bronşiolita se tratează cu corticosteroizi şi bronhodilatatoare. Încercările terapeutice de administrare a ribavirinei (analog nucleozidic care inhibă printr-un mecanism incomplet cunoscut sinteza virală de ARN) în administrare orală la pacienţii imunocompromişi(15) sau în administrare inhalatorie la copiii cu infecţii de tract respirator inferior(16) nu au fost foarte concludente; în România, ribavirina nu este autorizată pentru folosirea în infecţiile cu RSV(9).
Următoarele două părţi ale lucrării vor aborda alte infecţii virale.
Bibliografie
- Brown Ni, Bhella D. Are viruses alive? Microbiology Today. 2016. https://microbiologysociety.org/publication/past-issues/what-is-life/article/are-viruses-alive-what-is-life.html (accesat 29 martie 2020).
- Murray PR. Viruses. In: Basic medical microbiology. Elsevier; 2018. p. 93–126.
- Patel AB, Verma A. COVID-19 and Angiotensin-Converting Enzyme Inhibitors and Angiotensin Receptor Blockers. JAMA . 2020 Mar 24. https://jamanetwork.com/journals/jama/fullarticle/2763803 (accesat 30 martie 2020).
- Ritter J, Flower R, Henderson G, Loke YK, MacEwan D, Rang H. Antiviral Drugs. In: Rang & Dale’s Pharmacology. Elsevier; 2019. p. 678–89.
- Flexner CF. Antiretroviral Agents and Treatment of HIV Infection. In: Brunton L, Knollmann B, Hilal-Dandan R, editors. Goodman and Gilman’s The Pharmacological Basis of Therapeutics. 13th ed. McGraw-Hill Education; 2017. p. 1137–57.
- American Academy of HIV Medicine | HIV Treatment Guidelines. https://aahivm.org/hiv-treatment-guidelines/ (accesat 30 martie 2020).
- Safrin S. Antiviral Agents. In: Katzung BG, editor. Basic & Clinical Pharmacology. McGraw-Hill Education Medical; 2017. p. 863–94.
- Waller DG, Sampson AP. Viral Infections. In: Medical Pharmacology and Therapeutics. Elsevier Limited; 2018. p. 604–11.
- Chiriţă C, Marineci CD. Agenda medicală. Ediţia de buzunar. Bucureşti: Editura Medicală; 2020.
- EMA. Trogarzo conc. sol. perf. 200 mg (abalizumab). Rezumatul Caracteristicilor Produsului. Ultima actualizare martie 2020.
- ORDINUL MS nr. 487/23 martie 2020 pentru aprobarea protocolului de tratament al infecţiei cu virusul SARS-Cov-2 MI (Monitorul Oficial 242/24 martie 2020).
- Coronavirus disease 2019 (COVID-19) pandemic: increased transmission in the EU/EEA and the UK – seventh update. https://www.ecdc.europa.eu/sites/default/files/documents/RRA-seventh-update-Outbreak-of-coronavirus-disease-COVID-19.pdf (accesat 30 martie 2020).
- WHO | World now at the start of 2009 influenza pandemic. WHO . 2010 https://www.who.int/mediacentre/news/statements/2009/h1n1_pandemic_phase6_20090611/en/ (accesat 30 martie 2020).
- EMA/CHMP. Alpivab 200 mg concentrat pentru soluţie perfuzabilă (peramivir). Rezumatul Caracteristicilor Produsului. Ultima actualizare iunie 2019.
- Marcelin JR, Wilson JW, Razonable RR, Mayo Clinic Hematology/Oncology and Transplant Infectious Diseases Services. Oral ribavirin therapy for respiratory syncytial virus infections in moderately to severely immunocompromised patients. Transpl Infect Dis. 2014 Apr;16(2):242–50.
- Randolph AG, Wang EE. Ribavirin for respiratory syncytial virus infection of the lower respiratory tract. Cochrane database Syst Rev . 2000 (2):CD000181. http://www.ncbi.nlm.nih.gov/pubmed/10796503 (accesat 30 martie 2020).
Articole din ediţiile anterioare
Tratamentul simptomelor asociate gripei şi răcelii
Răceala şi gripa sunt infecţii virale acute ale tractului respirator superior (IACRS) şi sunt frecvente în populaţie, astfel că adulţii suferă într...
Eficacitatea vaccinării antigripale
Scopul acestui studiu este de a evidenţia eficacitatea vaccinării antigripale, în special la grupele cu risc: copii, femei însărcinate şi pe...