Medicamente antivirale (II) Virusuri hepatice şi tratamentul hepatitelor virale
Antiviral agents (II). Hepatic viruses and viral hepatitis management
Abstract
Viral hepatitis are acute or chronic infections caused by viruses with liver tropism.Viral hepatitis’ profilaxy and treatment can prevent cirrhosis, end‑stage liver disease or hepatocellular carcinoma. Hepatitis A and hepatitis B vaccines are currently available. Pre- and especially post-exposure hepatitis B prophylaxis is given by administration of anti-hepatitis B immunoglobulin. The treatment of chronic hepatitis B is done with interferons or nucleoside/nucleotide analogues. Antivirals are sometimes given for long periods because the hepatitis B virus cannot be eradicated with currently existing medication.
In contrast, recent therapeutic advances allow a sustained virological response in over 90% of treated patients. Currently, the treatment of chronic hepatitis C is done with direct-acting antivirals, possibly associated with ribavirin, in most cases the administration of interferon being no longer necessary.
Keywords
hepatic viruseschronic hepatitis Bchronic hepatitis Cinterferonsdirect-acting antiviralsRezumat
Hepatitele virale sunt infecţii acute sau cronice produse de virusuri cu tropism hepatic.Prevenirea şi tratarea hepatitelor virale pot împiedica apariţia cirozei, a insuficienţei hepatice cronice sau a carcinomului hepatocelular. Sunt disponibile la momentul actual vaccinuri împotriva hepatitei A şi a hepatitei B. Profilaxia hepatitei B pre- şi mai ales postexpunere se face prin administrare de imunoglobulină antihepatită B. Tratamentul hepatitei cronice B se face cu interferoni sau cu analogi nucleozidici/nucleotidici; administrarea antiviralelor se face uneori pe perioade lungi, deoarece virusul hepatitei B nu poate fi eradicat cu mijloacele terapeutice actuale. În schimb, progresele terapeutice recente permit un răspuns virologic susţinut la procente de peste 90% dintre pacienţii trataţi. În prezent, tratamentul hepatitei cronice C se face cu antivirale cu acţiune directă, eventual asociate cu ribavirină, în cele mai multe cazuri administrarea de interferon nemaifiind necesară.
Cuvinte Cheie
virusuri hepaticehepatită cronică Bhepatită cronică Cinterferoniantivirale cu acţiune directăPrincipalele virusuri cu tropism hepatic sunt virusuri hepatice A (VHA), B (VHB), C (VHC), D (VHD) şi E (VHE). Toate virusurile hepatice pot produce hepatite acute, care durează maxim şase luni. Hepatitele virale acute sunt inflamaţii difuze ale ficatului, care debutează cu anorexie, greaţă, febră şi dureri în cadranul abdominal superior drept. Frecvent se instalează icterul, pe măsură ce restul simptomelor se remit. Vindecarea este de obicei spontană, dar unele cazuri se cronicizează. Cazurile acute fulminante pot progresa spre insuficienţă hepatică acută. Cel mai frecvent, hepatitele virale acute se datorează virusurilor hepatice şi mai rar altor virusuri (virusul Epstein-Barr, virusul febrei galbene, citomegalovirusul)(1).
Hepatitele care durează mai mult de şase luni sunt hepatite cronice; VHB, VHC şi VHD sunt asociate cu hepatite cronice, ale căror consecinţe pot fi ciroza, insuficienţa hepatică cronică (engl.: end‑stage liver disease; ESDL) şi carcinomul hepatocelular(2). Complicaţiile insuficienţei hepatice cronice sunt ascita, edemele, encefalopatia hepatică, infecţiile, sindromul hepatorenal şi varicele esofagiene.(2).
Hepatita A
Hepatita A afectează anual aproximativ 1,5 milioane de persoane la nivel global. VHA este un virus ARN neanvelopat, monocatenar, din genul Hepatovirus, familia Picornaviridae; se transmite pe cale fecal-orală. Infecţia este autolimitantă şi nu se cronicizează; rar, poate evolua spre hepatită fulminantă(2).
Nu există tratament specific pentru hepatita A. Prevenţia se face prin respectarea regulilor de igienă şi prin gestionarea corespunzătoare a deşeurilor din canalizări.
Profilaxia hepatitei A pre- sau postexpunere la persoanele cu risc mare de a contracta VHA se face prin administrarea imunoglobulinei G cu administrare intramusculară (IGIM), care realizează o imunizare pasivă(2).
Vaccinarea cu vaccin hepatic A (Avaxim®, Havrix®) se face la copii de peste 1 an şi adulţi, prin administrarea a două doze, la interval de minimum şase luni, de vaccin conţinând VHA inactivat(2,3). Este disponibil şi un vaccin combinat, care asigură imunizare împotriva VHA şi a VHB.
Hepatita B
Se estimează că, la nivel global, 2 miliarde de oameni au fost infectaţi cu VHB şi că aproximativ 240 de milioane suferă de hepatită B cronică, afecţiune care poate conduce la ciroză şi complicaţii ale insuficienţei hepatice cronice; mai mult de 780 000 de decese anuale sunt datorate VHB. Cea mai mare prevalenţă a hepatitei cronice B este în regiunile OMS Pacificul de Vest (6,2%) şi Africa (6,1%). În Europa, prevalenţa este 1,6%, dar în România hepatita B cronică afectează de trei ori mai mulţi oameni decât în restul continentului, reprezentând o problemă de sănătate publică(4,5). Principalele căi de transmitere a VHB sunt contactul cu sânge sau fluide biologice infectate, la naştere sau în timpul actului sexual neprotejat.
Nu este disponibil niciun tratament specific pentru hepatita B acută, care de regulă se remite spontan.
VHB
VHB uman este un virus ADN mic, anvelopat, din familia Hepadnaviridae. Virusul este compus dintr-o nucleocapsidă miez (HBcAg – core antigen) învelită de o anvelopă externă lipoproteică, ce conţine antigenul de suprafaţă (HBsAg). ADN-ul parţial dublu-catenar, organizat într-o formă relaxat circulară (rcADN), conţine patru cadre de citire (ORF – open reading frames), care codifică şapte proteine: HBeAg (antigenul e al VHB), HBcAg (core-antigenul VHB, proteină nucleocapsidică), VHB polimeraza/reverstranscriptaza (enzimă cu dublu rol), PreS1/PreS2/HBsAg (antigenul de suprafaţă, alcătuit dintr-un amestec de proteine mici, medii şi mari) şi HBx (antigenul x al VHB, reglator al transcripţiei necesare pentru iniţierea infecţiei)(6).
Ciclul de viaţă al VHB constă în:
1. Intrarea virusului în celulă, prin ataşare la receptori de la suprafaţa hepatocitelor şi penetrare prin endocitoză.
2. Dezasamblarea.
3. Intrarea rcADN-ului în nucleu.
4. Formarea ccc-ADN-ului (ADN covalently closed circular). CccADN se răsuceşte pe histone, cu formarea unor microcromozomi, care determină transcripţia (această formă de ADN persistă în nucleul celulei-gazdă după tratamentele antivirale existente în prezent, ceea ce face ca hepatita B cronică să fie o boală care nu se vindecă, putându-se reactiva la întreruperea tratamentului).
5. Transcripţia, cu formarea ARN pregenomic şi a ARNm.
6. Exportul din nucleu şi translaţia ARNm, cu formarea diferitelor proteine virale. Unele dintre aceste proteine pot fi eliberate din celula infectată fără material genetic, sub formă de particule subvirale care exprimă HBsAg, contribuind la toleranţa imună şi la epuizarea celulelor T.
7. Încapsidarea.
8. Reverstranscrierea (ARN-ul pregenomic formează catena minus de ADN) – VHB este unul dintre puţinele virusuri nonretrovirale care foloseşte reverstranscriptaza în procesul de replicare.
9. Sinteza catenei plus a ADN-ului. Se formează astfel virionul cu ADN-ul parţial dublu-catenar, care poate relua ciclul de multiplicare în interiorul aceleiaşi celule sau care iese din celulă, după ce preia anvelopa lipoproteică de la nivelul aparatului Golgi(7,8).
Fiziopatologia hepatitei cronice B
Afectarea hepatocelulară se produce din cauza unei reacţii imune citotoxice, care apare când HBcAg este expus la suprafaţa hepatocitului. Replicarea virală este însoţită de obicei de prezenţa HBeAg circulant în sânge. Nivelul de ADN viral este o măsură a infectivităţii şi a replicării virale. Vindecarea după hepatita B acută se produce cu dezvoltarea anticorpilor anti-HBe şi anti-HBs (care conferă imunitate pe viaţă), iar ADN-ul VHB devine nedetectabil. Dacă însă sistemul imunitar al gazdei nu dezvoltă anticorpi (cum se întâmplă la imunocompromişi), se instalează hepatita B cronică, cu inflamaţie şi fibroză hepatică. Hepatita cronică B se instalează la sub 5% dintre pacienţii de peste 5 ani, însă rata de cronicizare la nou-născuţii din mame infectate cu VHB este de mai mult de 90%(2).
Infecţia cu VHB reflectă dinamic interacţiunea dintre replicarea VHB şi răspunsul imun al gazdei, nu toţi pacienţii cu infecţie acută având hepatită B cronică. Astfel, sunt descrise cinci faze ale infecţiei cu VHB, care nu se succedă obligatoriu una alteia:
Faza 1: infecţia cronică B HBeAg (+) sau faza toleranţei imune; pacienţii sunt înalt contagioşi din cauza nivelurilor ridicate de ADN VHB, nu prezintă inflamaţie necrotică sau fibroză hepatică, dar procesul carcinogenetic poate fi demarat deja.
Faza 2: hepatita cronică B HBeAg (+); în ser sunt prezenţi HBeAg; se înregistrează niveluri crescute de ADN viral şi de ALT; în ficat apare inflamaţie necrotică şi fibroza progresează; cei mai mulţi pacienţi realizează seroconversia HBeAg şi suprimarea ADN-ului viral.
Faza 3: infecţia cronică HBeAg (-) (faza de purtător inactiv); în ser apar anticorpii anti‑HBe, iar ADN‑ul viral e nedetectabil; pacienţii au risc scăzut de progresie spre fibroză.
Faza 4: hepatita cronică B HBeAg (-); unii dintre pacienţi dezvoltă mutaţii la nivelul genomului VHB care previn formarea antigenilor HBeAg, în pofida replicării active a VHB; la nivelul ficatului sunt prezente inflamaţia şi fibroza.
Faza 5: faza HBsAg (-); sau infecţie ocultă cu VHB; imunosupresia poate duce la reactivarea bolii(7,6).
Managementul hepatitei cronice B
Scopul principal al tratamentului hepatitei B cronice este îmbunătăţirea supravieţuirii şi a calităţii vieţii, prin împiedicarea progresiei bolii şi a dezvoltării carcinomului hepatocelular. Alte scopuri ale farmacoterapiei în hepatita cronică B sunt prevenirea transmiterii de la mamă la făt, împiedicarea reactivării hepatitei B şi prevenirea şi tratamentul manifestărilor extrahepatice produse de VHB(6).
Administrarea medicamentelor anti-VHB are ca scop suprimarea pe termen lung a ADN‑ului viral. Inducerea dispariţiei HBeAg, cu sau fără seroconversie (apariţia anticorpilor anti-HBe), este un scop al terapiei, realizând un control imun parţial al infecţiei cronice cu VHB. Răspunsul biologic este reprezentat de normalizarea valorilor ALT(6).
Cine trebuie să fie tratat? Conform EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection, trebuie să primească tratament pentru hepatita cronică B:
-
toţi pacienţii cu hepatită cronică B HBeAg (+) sau (-), definiţi prin: ADN VHB > 2 000 UI/ml, ALT > valorile-limită normale şi cel puţin inflamaţie necrotică sau ciroză a ficatului;
-
pacienţii cu ciroză compensată sau decompensată, indiferent de nivelurile de ADN VHB şi ALT;
-
pacienţii cu ADN VHB > 20 000 UI/ml şi ALT > dublul valorilor-limită normale, indiferent de gradul de fibroză(6).
Farmacoterapia hepatitei B cronice
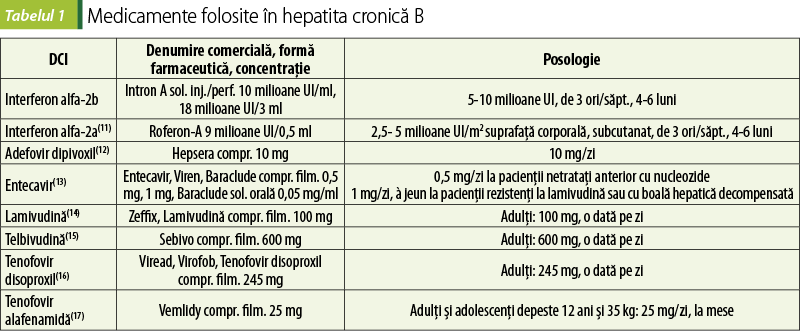
De primă alegere este administrarea pe termen lung a analogilor nucleozidici/nucleotidici cu potenţial mic de dezvoltare a rezistenţei (entecavir, tenofovir dipivoxil sau tenofovir alafenamidă)(6).
Toţi analogii nucleozidici (entecavir, lamivudină, telbivudină) sau nucleotidici (adefovir, tenofovir) devin activi după fosforilare intracelulară la trifosfaţi, formă care inhibă competitiv ADN polimeraza virală, oprind elongarea lanţului ADN.
Pacienţii care primesc medicaţie pentru hepatita cronică B trebuie monitorizaţi privind apariţia acidozei lactice şi a hepatomegaliei severe, deoarece unele cazuri au fost letale. În plus, testele funcţiei hepatice trebuie monitorizate atent dacă tratamentul trebuie întrerupt, deoarece au fost raportate exacerbări acute severe ale hepatitei. Sunt necesare ajustări ale dozei la pacienţii cu disfuncţie renală pentru toate regimurile orale anti-VHB. Pacienţii trebuie testaţi pentru infecţia cu HIV înainte de a începe un regim terapeutic cu un singur medicament anti-VHB, deoarece rezistenţa la HIV se poate dezvolta. Pacienţii infectaţi cu HIV şi cu VHB trebuie să primească concomitent terapie antiretrovirală foarte activă (HAART) cu un medicament anti-VHB(2).
Interferonul alfa şi peginterferonul alfa
Interferonii sunt citokine potente, cu efecte antivirale, imunomodulatoare şi antiproliferative, sintetizate de celulele-gazdă ca răspuns la diverşi stimuli. După legarea de receptorii membranari, interferonul iniţiază o secvenţă complexă de evenimente intracelulare care includ inducţia anumitor enzime. Aceasta duce la răspunsuri celulare, precum:
-
inhibarea replicării virale în celulele infectate de virus;
-
supresia proliferării celulare;
-
activităţi imunomodulatoare – creşterea activităţii fagocitare a macrofagelor;
-
creşterea citotoxicităţii specifice a limfocitelor pentru celulele-ţintă(9).
Prin ataşarea interferonului la moleculele mari inerte de polietilenglicol (PEGilare) se încetineşte absorbţia, scade clearance-ul şi se realizează concentraţii serice mai mari şi pe durată mai lungă, ceea ce permite administrarea o dată pe săptămână(10). Deşi în tratamentul hepatitei cronice C utilizarea interferonilor s-a redus după apariţia antiviralelor cu acţiune directă, interferonii rămân importanţi în tratamentul hepatitei B cronice la persoanele cu replicare continuă a ADN-ului viral şi inflamaţie la nivelul ficatului. Interferonii sunt contraindicaţi la pacienţii cu boală hepatică avansată, deoarece pot precipita deteriorarea clinică şi pot creşte riscul de infecţii bacteriene.
Chiar dacă avantajele interferonului sau interferonului pegilat includ o durată finită a tratamentului (spre deosebire de analogii nucleozidici/nucleotidici, care trebuie administraţi pe termen lung, uneori toată viaţa), lipsa rezistenţei, posibila dispariţie a HBsAg şi seroconversia (dezvoltarea anticorpilor anti-HBs), există mai multe dezavantaje semnificative. Acestea includ necesitatea injecţiilor subcutanate şi un profil al efectelor adverse pronunţat, care poate necesita reduceri de doze sau întreruperea tratamentului. Majoritatea pacienţilor prezintă simptome asemănătoare gripei (febră, frisoane şi mialgii), uşoare până la moderat-severe; acestea apar de obicei la prima injecţie, se diminuează odată cu continuarea tratamentului şi pot fi gestionate prin premedicaţie cu paracetamol sau AINS. Reacţiile adverse psihice apar frecvent şi pot include iritabilitate, depresie şi, rareori, ideaţie suicidară, care pot necesita antidepresive sau anxiolitice. Pacienţii cu simptome severe, inclusiv ideaţie suicidară, trebuie să întrerupă imediat tratamentul(2).
Analogi nucleozidici/nucleotidici
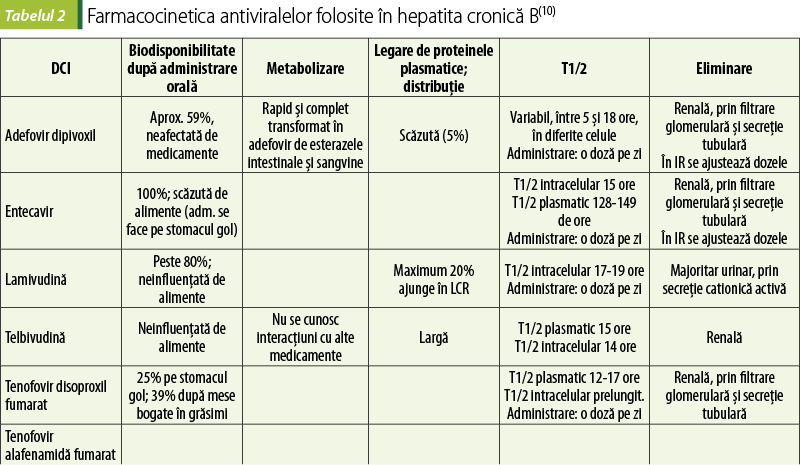
Adefovir dipivoxil este un prodrog, ester dietilic al adefovirului, un analog al adeninei. Inhibă competitiv ADN polimerazele VHB. In vitro, este activ asupra mai multor virusuri ADN şi ARN (VHB, HIV, herpesvirusuri)(10).
Este mai puţin eficient în scăderea nivelurilor de ADN viral şi în inducerea seroconversiei HBeAg comparativ cu alte medicamente folosite în tratamentul hepatitei B virale. Rezistenţa poate apărea la aproximativ o treime din cazuri după cinci ani de utilizare, dar nu este încrucişată cu cea produsă de lamivudină sau entecavir(10).
La dozele folosite în tratamentul hepatitei cronice C, adefovirul poate determina creşteri ale creatininei serice la 3-9% dintre utilizatori, după patru-cinci ani de tratament. Alte reacţii adverse pot fi cefaleea, diareea, astenia sau durerile abdominale. Poate determina disfuncţii renale. Acidoza lactică şi steatoza hepatică pot apărea ca urmare a disfuncţiei mitocondriale (aceasta este o reacţie adversă comună tuturor inhibitorilor nucleozidici/nucleotidici de reverstranscriptază). În studii preclinice, adefovirul este embriotoxic şi genotoxic(10).
Entecavirul este un analog nucleozidic derivat de guanozină care inhibă competitiv funcţiile ADN polimerazei virale.
Realizează supresia ADN-ul viral într-o mai mare măsură decât lamivudina sau adefovirul. Comparativ cu lamivudina, dezvoltă mai rar rezistenţă. Pacienţii care au dezvoltat rezistenţă la lamivudină dezvoltă mai uşor rezistenţă şi la entecavir(10).
În general, este bine tolerat; reacţiile adverse comune sunt cefaleea, oboseala, ameţeala, greaţa şi durerea abdominală superioară. Poate produce acidoză lactică, uneori severă; de aceea, dacă ficatul este decompensat, se evită utilizarea. Intră în competiţie cu alte medicamente care se elimină prin secreţie renală, cu risc de supradozare relativă. În experimente pe animale, a produs modificări neoplazice, dar relevanţa clinică a acestora nu este cunoscută(10).
Lamivudina este un analog de citozină folosit atât în hepatita cronică B (deoarece inhibă ADN polimeraza VHB), cât şi în infecţia cu HIV (deoarece inhibă reverstranscriptaza HIV). Lamivudina intră în competiţie cu deoxicitidina trifosfat şi inhibă competitiv aceste enzime, cu blocarea elongării lanţului de acid nucleic(10).
Până la 65% dintre pacienţi dezvoltă, după cinci ani de tratament, rezistenţă la lamivudină, care este asociată cu puseuri de hepatită şi cu progresia afectării hepatice. Rezistenţa este încrucişată cu entecavir, dar nu şi cu adefovir sau tenofovir(10).
Lamivudina opreşte progresia hepatitei cronice B şi dezvoltarea cancerului hepatocelular cu aproximativ 50%. Lamivudina este unul dintre antiviralele care se pot folosi în sarcină, deoarece, dacă este administrată în ultimele patru săptămâni, previne transmiterea verticală a VHB la nou-născut(10).
Reacţiile adverse ale lamivudinei includ cefalee, ameţeli, insomnie, oboseală, xerostomie şi tulburări gastrointestinale. Combinaţia chimioterapeutică trimetoprim-sulfametozazol creşte concentraţiile plasmatice ale lamivudinei. Coinfecţia cu HIV poate creşte riscul de pancreatită. Lamivudina se poate administra pacienţilor cu boală hepatică decompensată(10).
Telbivudina este un analog nucleozidic derivat de timidină, care induce răspuns serologic superior lamivudinei şi adefovirului. Rezistenţa poate apărea la 22% dintre pacienţi după un an de tratament. Nu este activă pe VHB care a devenit rezistent la lamivudină(10).
Majoritatea reacţiilor adverse sunt uşoare: oboseală, cefalee, tuse, greaţă, diaree. Uneori, poate să producă mialgii, miopatii şi neuropatie periferică, precum şi acidoză lactică şi hepatomegalie severă cu steatoree. La întreruperea tratamentului, hepatita se poate reactiva(10).
Tenofovir dipivoxil şi tenofovir alafenamidă. Ambii compuşi sunt prodroguri ale tenofovirului, care este un analog nucleotidic al adenozinei, care are şi activitate antiretrovirală prin inhibarea reverstranscriptazei. Tenofovirul are o rată scăzută de dezvoltare a rezistenţei în hepatitele cronice B şi este activ şi asupra VHB care a devenit rezistent la lamivudină sau entecavir. Dezvoltă răspuns virologic mai bun decât celelalte antivirale folosite în hepatita cronică B şi determină îmbunătăţiri histologice la nivelul ficatului(10).
Tenofovir alafenamida este un prodrog al tenofovirului, cu o cedare îmbunătăţită a substanţei active la nivelul hepatocitelor şi al celulelor limfoide. Nivelurile plasmatice ale tenofovirului sunt cu aproximativ 90% mai mici după tenofovir alafenamidă decât după tenofovir dipivoxil, deoarece metabolizarea primeia are loc într-o mult mai mare măsură în limfocite, macrofage şi hepatocite; acest lucru permite folosirea unor doze mai mici, care antrenează o toxicitate scăzută(10).
Tenofovir alafenamida este substrat al glicoproteinei-P, inductorii sau inhibitorii acesteia modificând nivelurile de tenofovir.
Reacţiile adverse comune ale tenofovirului sunt greaţă, dureri abdominale, diaree, ameţeli şi oboseală. Poate să apară insuficienţă renală cronică secundară afectării tubului contort proximal. Reacţiile adverse, precum scăderea densităţii osoase şi sindromul Fanconi, care apar la folosirea tenofovirului disoproxil în infecţiile cu HIV, nu au fost observate la pacienţii care au luat tenofovir pentru hepatită cronică B(10).
Prevenţia infecţiei cu VHB
Riscul contaminării cu VHB poate fi scăzut prin evitarea contactului cu sânge şi fluide biologice contaminate şi prin imunizare anti-VHB.
Screeningul femeilor gravide pentru VHB şi vaccinarea tuturor nou-născuţilor împotriva hepatitei B constituie metode eficace în prevenirea hepatitei B. În România, schema naţională actuală de imunizare include vaccinare cu vaccin conţinând HBsAg recombinant (în vaccin hexavalent, care oferă protecţie şi împotriva altor boli infecţioase – Hexacima®, Infanrix Hexa®), administrat în maternitate, în primele 24 de ore de viaţă, urmat de administrări la medicul de familie, la 2, 4, 11 luni şi la 14 ani(18). Imunizarea anti-HCB se poate face şi cu vaccinuri (pentru adulţi sau pentru copii) monovalente (Engerix B®, Euvax®) sau bivalente, care conferă protecţie şi împotriva infecţiilor VHA (Twinrix®), în scheme de vaccinare cu trei doze, administrate la 0-1-6 luni (raportat la prima administrare)(3).
În unele cazuri, poate fi recomandată profilaxia postexpunere cu imunoglobulina antihepatită B (HBIG – Hepatect CP® 50 UI/ml), pentru a preveni dezvoltarea infecţiilor acute şi a complicaţiilor asociate VHB.(2)
Hepatita C
OMS estimează că 71 de milioane de persoane au hepatită cronică C(19).
Persoanele cu risc crescut de infectare cu VHC sunt consumatorii de droguri injectabile (se estimează că 70‑90% dintre aceştia au hepatită cronică C), furnizorii de servicii de sănătate care intră în contact cu ace infectate, pacienţii hemodializaţi, persoanele cu parteneri sexuali multipli, pacienţii infectaţi cu HIV. Transmisia perinatală este de aproximativ 5%. Tatuajele realizate fără sterilizarea corespunzătoare a ustensilelor pot duce la infectare cu VHC. În prezent, transfuziile sangvine poartă un risc foarte scăzut de transmitere a VHC, datorită măsurilor sporite de securitate (0,001% pe unitate de sânge transfuzat), dar în trecut transfuziile cu sânge contaminat au fost responsabile de multe infectări(2).
Progresele în tratamentul HCC sunt printre cele mai spectaculoase din istoria medicinei. VHC a fost identificat în 1989, iar în 2013 au fost introduse pe piaţă antiviralele cu acţiune directă, care au surclasat interferonii singuri sau în combinaţie cu ribavirina, în privinţa eficacităţii. În prezent, AAD sunt medicamentele de elecţie folosite în tratamentul HCC, cu sau fără ribavirină, surclasând interferonii, care au multe reacţii adverse. Dezavantajul AAD este preţul ridicat, dar ratele de RVS sunt mult mai mari comparativ cu variantele anterioare de tratament, aceste medicamente putând să eradicheze VHC(20).
VHC
Virusul hepatitei C este un virus ARN monocatenar, aparţinând familiei Flaviviridae din genul Hepacivirus. Virusul are şapte genotipuri clasificate în mai multe zeci de subtipuri, cu specificitate geografică, deşi nivelul ridicat al migraţiei modifică în prezent această specificitate(21). Genotipurile nu sunt corelate cu severitatea hepatitei, dar determină durata terapiei şi pot fi mai sensibile la unele dintre antivirale, deşi apariţia antiviralelor pangenotipice a dus la depăşirea acestei limitări terapeutice.
Ciclul de viaţă al VHC
Genomul VHC este reprezentat de o catenă pozitivă de ARN, care codează:
-
trei proteine structurale (miez = core, E1 şi E2);
-
proteine p7 cu rol de canal ionic;
-
şase proteine nestructurale: NS2, NS3, NS4A, NS4B, NS5A şi NS5B. NS3/4A joacă rol de proteaze; NS5A este o proteină implicată în replicarea şi asamblarea particulelor virale; NS5B are rol de polimerază ARN dependentă, implicată în procesele posttranslaţionale(10,22).
VHC intră în hepatocit după legare de anumiţi receptori sau prin endocitoză, apoi se decapsidează şi componentele virale care sunt eliberate în celula infectată. Replicarea VHC are loc în citoplasma celulei-gazdă, prin translaţie directă a ARN-ului viral la nivelul ribozomilor, cu sinteză de poliproteine virale (imature şi nefuncţionale) care conţin proteine structurale şi nestructurale ale VHB. Poliproteinele sunt scindate sub acţiunea proteazelor virale şi ale gazdei la proteine virale funcţionale. ARN-ul viral se multiplică şi el şi este asamblat împreună cu proteinele virale, cu formarea virionului, care ulterior este eliberat din celula-gazdă(10).
Hepatita C acută
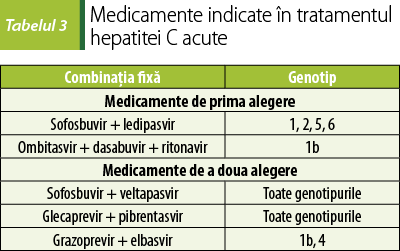
Contrar practicii mai vechi, în prezent se recomandă ca pacienţii cu hepatită C acută să fie trataţi cu antivirale directe, pentru a evita cronicizarea afecţiunii, care în lipsa tratamentului apare la 50‑90% dintre pacienţi. Medicamentele recomandate sunt cele prezentate în tabelul 3, administrate opt săptămâni, cu determinarea RVS la 12 şi la 24 de săptămâni după terminarea tratamentului(20).
Nu se recomandă terapie antivirală ca profilaxie postexpunere, dacă transmiterea VHC nu a fost confirmată(20).
Hepatita cronică C
Scopurile terapiei hepatitei cronice C sunt eradicarea VHC, prevenirea cirozei hepatice sau a decompensării acesteia, a carcinomului hepatocelular şi în ultimă instanţă a decesului. Eradicarea VHC scade rata de decompensare a cirozei şi reduce apariţia cancerului hepatic la pacienţii cu fibroză avansată sau cu ciroză. Tratamentul îşi atinge scopul când, după finalizarea lui, ARN viral este nedetectabil sau antigenul central al VHC este nedetectabil (dacă nu se poate doza ARN‑ul viral). RVS este definit ca ARN‑ul VHC nedetectabil la cel puţin 12 săptămâni după sfârşitul terapiei şi reprezintă vindecarea virologică(20).
De-a lungul mai multor ani, HCC a fost tratată prin administrare îndelungată de interferon subcutanat, asociat sau nu cu ribavirină, un analog nucleozidic. Ratele RVS erau scăzute, iar medicamentele erau greu tolerate. Din 2013 au intrat în terapie AAD, medicamente care vizează în mod direct diferite etape în ciclul de viaţă al VHC. AAD sunt administrate pe cale orală, în una sau două prize zilnice, sunt bine tolerate, se administrează pe o perioadă finită de 8, 12 sau 24 de săptămâni şi ating rate de RVS de cel puţin 90% la majoritatea populaţiilor de pacienţi(7).
Interferonul alfa/peginterferonul alfa şi ribavirina
Interferonul a fost primul medicament autorizat pentru a fi folosit în HCC, dar nu mai este recomandat, deoarece mai puţin de 10% dintre pacienţii cu genotip 1 şi doar aproximativ 30% din cei cu genotip 2 sau 3 ating RVS. Ratele RVS pentru interferonul pegilat pot fi crescute până la aproximativ 50% dintre pacienţi prin adăugarea ribavirinei, un analog sintetic de guanozină, care inhibă polimeraza virală. Din 2002 până la apariţia AAD, această combinaţie a fost considerată standardul de tratament al HCC. În prezent nu mai este indicată din cauza a mai multor reacţii adverse ale interferonului şi a eficacităţii depăşite.
Ribavirina este larg distribuită în organism şi are un timp de înjumătăţire lung, de 7-10 zile. În IR se reduc dozele. Ribavirina determină anemie hemolitică şi neutropenie dependente de doză, care pot necesita reducerea dozei sau întreruperea tratamentului. Tulburările hematologice pot fi corectate prin terapii adjuvante (factori de stimulare a coloniilor granulocitare, epoetină alfa sau darbepoetină). Deoarece ribavirina poate fi teratogenă şi embriocidă, toate femeile aflate la vârsta fertilă şi bărbaţii care pot să conceapă trebuie să utilizeze două forme de contracepţie în timpul tratamentului cu ribavirină şi timp de şase luni după tratament(2).
Antivirale cu acţiune directă
Există în prezent mai multe categorii de AAD; toate inhibă formarea diferitelor proteine structurale vitale pentru replicarea VHC:
-
inhibitori de protează (NS3/4A):
-
telaprevir, boceprevir (prima generaţie) – nu se mai folosesc, pentru că au reacţii adverse importante (discrazii sangvine, toxicitate dermatologică), posologie inconvenabilă, cu multe prize zilnice, numeroase contraindicaţii şi potenţial crescut de dezvoltare a rezistenţei;
-
grazoprevir, paritaprevir, simeprevir (contraindicat în IH), glecaprevir, voxilaprevir;
-
inhibitori de polimerază NS5B (polimerază ARN dependentă implicată în procese posttranslaţionale):
-
inhibitori nucleotidici, care inhibă competitiv enzima – sofosbuvir (se foloseşte cu precauţie în IR);
-
inhibitori nonnucleozidici, care inhibă alosteric enzima – dasabuvir.
-
inhibitori de proteină NS5A (implicată în replicarea şi asamblarea particulelor virale):
-
daclatasvir, ledipasvir, ombitasvir, elbasvir, veltapasvir, pibrentasvir(10).
Multiplele interacţiuni medicamentoase pe care le generează AAD fac intervenţia farmacistului absolut necesară. Acesta are la dispoziţie numeroase surse unde poate verifica existenţa interacţiunilor medicamentoase (de exemplu, online la https://www.hep-druginteractions.org).
Monitorizarea tratamentului
Monitorizarea eficacităţii se face prin determinarea ARN VHC în ser sau plasmă ori, dacă aceasta nu e disponibilă sau este prea scumpă, prin determinarea antigenului central al VHC din ser sau plasmă, la 12 sau 24 de săptămâni după terminarea tratamentului(20).
Cele mai frecvente reacţii adverse ale antiviralelor cu acţiune directă raportate în studii clinice au fost senzaţia de oboseală şi cefaleea. Deoarece şi alte reacţii adverse pot apărea, monitorizarea siguranţei tratamentului hepatitei C presupune:
-
determinarea ALT la începutul tratamentului, la 12 şi 24 de săptămâni de administrare şi ori de câte ori este necesar;
-
monitorizarea bilirubinei indirecte la pacienţii care primesc dasabuvir sau combinaţia paritaprevir-ombitasvir potenţată farmacocinetic de ritonavir;
-
funcţia renală se monitorizează la toţi pacienţii cu RFC scăzută care primesc sofosbuvir;
-
la pacienţii cu IH severă (clasa Child-Pugh B sau C, ciroză decompensată) sunt contraindicaţi inhibitorii de protează (pibrentasvir, grazoprevir, paritaprevir, voxilaprevir)(20).
Hepatita D
VHD face parte din genul Delta virus din familia Deltaviridae, fiind un virus ARN monocatenar. Infecţia cu hepatită D necesită prezenţa VHB (în lipsa VHB, replicarea virală VHD nu are loc), de aceea vaccinarea împotriva hepatitei B poate preveni indirect infecţiile cu virusul hepatitic D.(2)
Tratamentul recomandat pentru infecţia cu VHD este interferon pegilat timp de 48 până la 72 de săptămâni(2).
Hepatita E
Hepatita E se transmite pe cale fecal-orală, fiind provocată de VHE, un virus ARN monocatenar, neanvelopat, din genul Hepevirus. Hepatita E este uzual autolimitantă, conducând rareori la complicaţii. Cronicizarea apare rar, mai ales la pacienţii imunocompromişi sau transplantaţi(2).
Am atins, aşadar, în primele două părţi ale lucrării medicaţia activă pe virusurile respiratorii, hepatice şi pe retrovirusuri. Următoarea parte va trece în revistă restul antiviralelor.
Bibliografie
-
Kumar S. Hepatitis. Merck Manual. Professional Version. 2019 [accesat aprilie 2020]. https://www.merckmanuals.com/professional/hepatic-and-biliary-disorders/hepatitis/overview-of-acute-viral-hepatitis?query=viral hepatitis
-
Chan J. Viral Hepatitis. In: Chisholm-Burns M, Schwinghammer T, Wells B, Malone P, DiPiro J, Kolesar JM, editors. Pharmacotherapy Principles and Practice. McGraw-Hill; 2016.
-
Chiriţă C, Marineci CD. Agenda medicală. Ediţia de buzunar. Bucureşti: Editura Medicală; 2020.
-
WHO. Hepatitis B. Fact Sheet. 18 July 2019, https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
-
Universal access to testing and treatment is key to eliminating viral hepatitis. 2018 Jul 26 [accesat aprilie 2020]; http://www.euro.who.int/en/countries/romania/news/news/2018/7/universal-access-to-testing-and-treatment-is-key-to-eliminate-viral-hepatitis
-
EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. [accesat aprilie 2020]. Available from: https://easl.eu/wp-content/uploads/2018/10/HepB-English-report.pdf
-
Kiser JJ, Flexner CW. Treatment of Viral Hepatitis (HBV/HCV). In: Brunton L, Knollmann B, Hilal-Dandan R, editors. Goodman and Gilman’s The Pharmacological Basis of Therapeutics. 13th ed. McGraw-Hill Education; 2017. P. 1119–35.
-
Morikawa K, Suda G, Sakamoto N. Viral life cycle of hepatitis B virus: Host factors and druggable targets. Hepatol Res. 2016; 46(9):871–7.
-
EMA. Intron. Rezumatul caracteristicilor produsului. Ultima actualizare martie 2020.
-
Safrin S. Antiviral Agents. In: Katzung BG, editor. Basic & Clinical Pharmacology. McGraw-Hill Education Medical; 2017. P. 863–94.
-
EMA. Roferon. Rezumatul caracteristicilor produsului. Ultima actualizare octombrie 2019.
-
EMA. Hepsera. Rezumatul caracteristicilor produsului. Ultima actualizare august 2019.
-
EMA. Baraclude. Rezumatul caracteristicilor produsului. Ultima actualizare februarie 2020.
-
EMA. Zeffix. Rezumatul caracteristicilor produsului. Ultima actualizare noiembrie 2019.
-
EMA. Sebivo. Rezumatul caracteristicilor produsului. Ultima actualizare mai 2018.
-
EMA. Viread. Rezumatul caracteristicilor produsului. Ultima actualizare aprilie 2020.
-
EMA. Vemlidy. Rezumatul caracteristicilor produsului. Ultima actualizare februarie 2020.
-
INSP/CNSCBT. Calendarul naţional de vaccinare 2020 [accesat aprilie 2020]. https://www.cnscbt.ro/index.php/calendarul-national-de-vaccinare
-
World Health Organization. Hepatitis C. Key facts. 2019 [accesat aprilie 2020]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-c
-
European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol. 2018.
-
Smith DB, Bukh J, Kuiken C, Muerhoff AS, Rice CM, Stapleton JT, et al. Expanded classification of hepatitis C virus into 7 genotypes and 67 subtypes: updated criteria and genotype assignment web resource. Hepatology. 2014; 59(1):318–27.
-
EMA. Viekirax. Rezumatul caracteristicilor produsului. Ultima actualizare noiembrie 2018.
-
EMA. Pegintron. Rezumatul caracteristicilor produsului. Ultima actualizare decembrie 2018.
-
EMA. Pegasys. Rezumatul caracteristicilor produsului. Ultima actualizare octombrie 2019.
-
Rebetol. Rezumatul caracteristicilor produsului. Ultima actualizare noiembrie 2019.
-
EMA. Exviera. Rezumatul caracteristicilor produsului. Ultima actualizare noiembrie 2019.
-
EMA. Sovaldi. Rezumatul caracteristicilor produsului. Ultima actualizare noiembrie 2019.
-
EMA. Zepatier. Rezumatul caracteristicilor produsului. Ultima actualizare martie 2020.
-
EMA. Maviret. Rezumatul caracteristicilor produsului. Ultima actualizare octombrie 2019.
-
EMA. Harvoni. Rezumatul caracteristicilor produsului. Ultima actualizare ianuarie 2020.
-
EMA. Vosevi. Rezumatul caracteristicilor produsului. Ultima actualizare februarie 2020.