Introduction. Isthmocele is a defect similar to a diverticulum located on the anterior uterine isthmus at the corresponding level after caesarean scar that involves discontinuity myometrial. There is no unity in definitions, the literature can refer to this entity as a deficiency, uterine scar dehiscence of, niche or uterine diverticulum. The reported incidence in the literature varies from 4.9% to 19% in recent studies. Its presence was associated with a syndrome characterized by uterine bleeding, dyspareunia, dysmenorrhea and fertility disorders. The objective of our study was to identify the correlations between isthmocele and the presence of symptoms such as uterine bleeding in women who requested consultations in Medlife Clinic between 2014-2015. Material and method. We retrospectively evaluated a total of 146 patients who presented to the Medlife Unirii Clinic with vaginal haemorrhagia (11% of requests for consultations). We performed clinical transvaginal ultrasound examination to all patients. We considered the diagnosis of ishtmocele if ultrasound revealed a deficiency in the caesarian with thickness of myometrium less than 2.5 mm. Results and discussion. 18 patients were found to meet the requirements of diagnosis. 4 of them had a history of two caesarean sections, 6 patients had retroverted uterus ,10 patients had elective interventions and 3 patients reported secondary infertility. Conclusion. Isthmocelul folowing caesarean section is responsible for uterine bleeding, infertility and medically induced dysmenorrhea but unfortunately still insufficiently recognized and treated.
Istmocelul uterin - o nouă entitate iatrogenă
Uterine isthmocele- a new iatrogenic entity
First published: 15 octombrie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Introducere. Istmocelul este un defect similar unui diverticul situat la nivelul istmului uterin, anterior, corespunzător la nivelul cicatricei după operaţie cezariană, care presupune discontinuitate miometrială. Nu există o unitate în definiţii, literatura se poate referi la această entitate ca deficienţă, dehiscenţă a cicatricei uterine, nişă sau diverticul uterin. Incidenţa raportată în literatură este variabilă de la 4,9% la 19%. Doar în studii recente prezenţa sa a fost asociată cu un sindrom caracterizat de sângerări intermenstruale, dispareunie, dismenoree, tulburări de fertilitate. Studiul nostru a avut ca obiectiv identificarea corelaţiei dintre istmocel şi prezenţa simptomatologiei reprezentate de sângerări intermenstruale la femeile care au solicitat consultaţii în Clinica Medlife între 2014 si 2015. Material şi metodă. Am evaluat retrospectiv 146 de paciente care s-au prezentat pentru sângerări intermenstruale în Clinica Medlife Unirii (11% dintre solicitările de consultaţii). În cadrul bilanţului clinic şi paraclinic am efectuat sistematic tuturor ecografii transvaginale. Am considerat diagnosticul de istmocel dacă ecografia a evidenţiat o deficienţă a cicatricei de histerorafie care să reducă grosimea miometrului la mai puţin de 2,5 mm. Rezultate şi discuţii. Au fost evidenţiate 18 paciente care au îndeplinit condiţiile de diagnostic. Dintre acestea, 4 au prezentat două operaţii cezariene în antecedente, 6 prezentau uter retrovers, 10 au prezentat intervenţii elective şi 3 paciente raportau infertilitate secundară. Concluzie. Istmocelul uterin post-operaţie cezariană este o entitate responsabilă de sângerări, infertilitate şi dismenoree indusă medical, dar din păcate încă insuficient tratată şi recunoscută.
Introducere
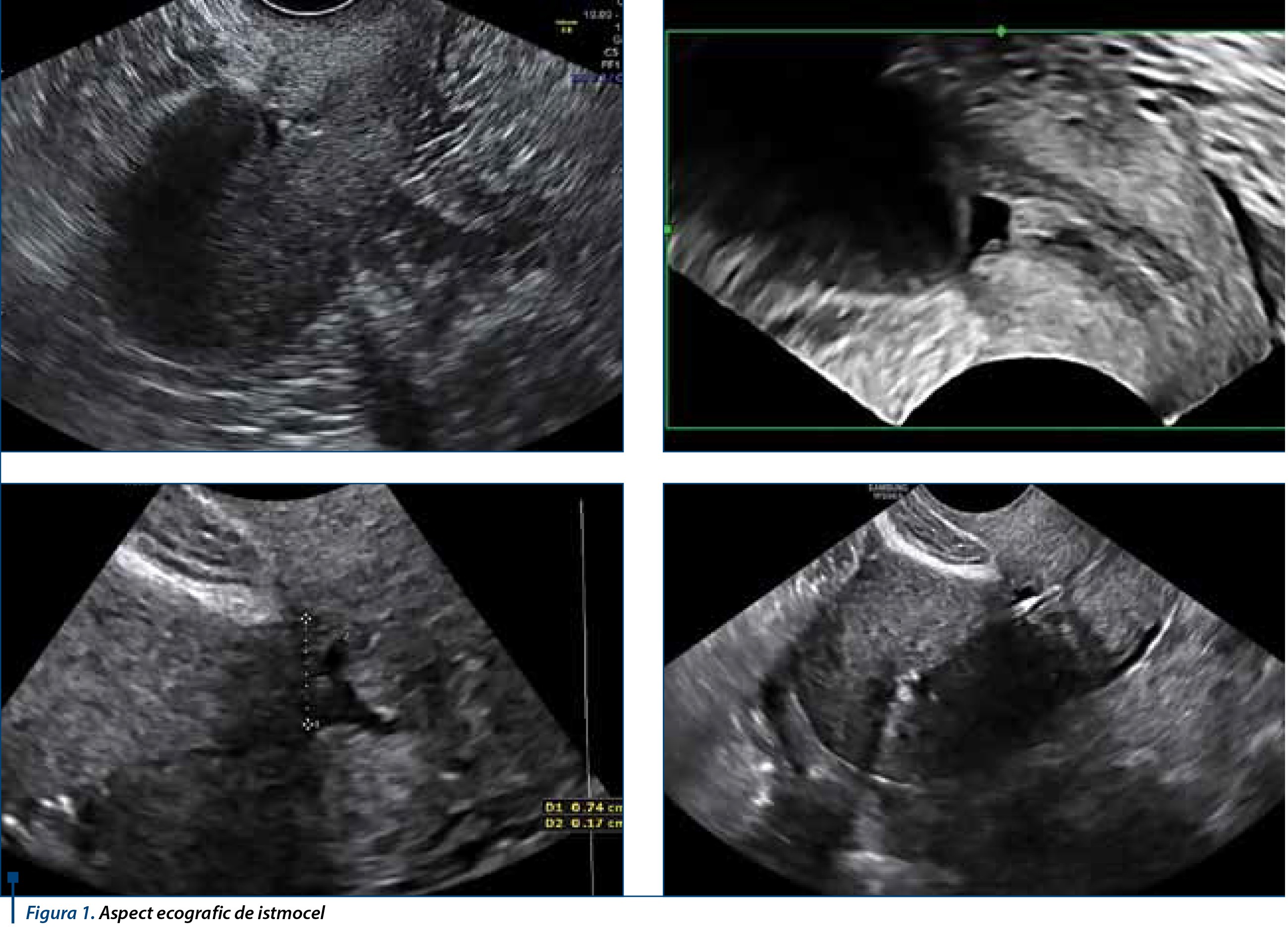
Istmocelul este un defect similar unui diverticul sau reces situat la nivelul istmului uterin anterior, corespunzător nivelului cicatricei/cicatricelor după operaţie cezariană a cărui principală caracteristică este discontinuitatea miometrială. Defectul poate să afecteze toată lungimea tranşei sau doar porţiuni din aceasta. Nu există o unitate în definiţii, literatura se poate referi la această entitate ca deficienţă, dehiscenţă a cicatricei uterine, nişă sau diverticul uterin.Incidenţa raportată în literatură este variabilă de la 4,9% la 19%. Doar în studii recente prezenţa sa a fost asociată cu simptomatologie reprezentată de sângerări intermenstruale, dispareunie, dismenoree sau tulburări de fertilitate(1).
Cea mai facilă, reproductibilă şi lipsită de invazivitate metodă de diagnostic a istmocelului este ecografia transvaginală.
Există însă posibilitatea utilizării sau coroborării cu alte metode diagnostice, cum ar fi: histerosalpingografia, histerosonografia cu soluţie salină, histeroscopia, rezonanţa magnetică nucleară.
Dintre acestea, aspectul particular este cel evidenţiat la histeroscopie, unde istmocelul apare sub forma unei duble ogive la nivelul istmului sau a unui reces la acest nivel, mai bine evidenţiat la retragerea histeroscopului.
Factorii de risc cunoscuţi pentru apariţia istmocelului sunt:
- efectuarea operaţiei cezariene după debutul travaliului;
- dilataţie mare peste 5 cm şi staţie joasă a capului la momentul efectuării operaţiei;
- numărul operaţiilor cezariene, riscul creşte exponenţial după fiecare intervenţie;
- uter retrovers;
- obezitate;
- complicaţii intraoperatorii.
Studiul nostru a avut ca obiectiv identificarea corelaţiei dintre diagnosticul istmocelului şi prezenţa simptomatologiei reprezentate de sângerări intermenstruale la femeile care au solicitat consultaţii în Clinica Medlife între 2014 şi 2015.
Material şi metodă
Am evaluat retrospectiv pacientele care s-au prezentat pentru sângerări intermenstruale în Clinica Medlife Unirii în intervalul ianuarie 2014 - decembrie 2015. Echipamentul utilizat a fost diferit: ecograf Voluson E, E8, Samsung cu sondă transvaginală volumetrică, ceea ce a permis obţinerea de reconstrucţii 3D, precum şi echipament Doppler pentru evidenţierea vascularizaţiei la nivelul zonelor examinate. Toate pacientele au fost examinate prin ecografie transvaginală, efectuată cu metoda standard: după golirea vezicii, pacienta plasată în poziţie de decubit dorsal, cu coapsele flectate pe abdomen, secţiunile de examinare fiind sagitale, transversale şi obţinerea de volume cu ROI în secţiune sagitală. Am stabilit diagnosticul de istmocel dacă erau întrunite criteriile relativ la discontinuitatea miometrului, la nivelul peretelui anterior al uterului, cu reducerea grosimii la mai puţin de 2,5 mm, prezenţa unei imagini eco negative, cu forme variabile, localizate în grosimea miometrului la acest nivel, continuitatea seroasei uterine. Am măsurat pentru fiecare pacientă pe secţiune sagitală grosimea miometrului restant de la suprafaţa seroasei până la limita cu zona eco negativă, precum şi înălţimea istmocelului în cel mai înalt punct al său.
Rezultate şi discuţii
În studiu au fost incluse 146 de paciente, care s-au prezentat pentru sângerări intermenstruale în Clinica Medlife Unirii. Acestea au reprezentat 11% dintre solicitările de consultaţii. În cadrul bilanţului clinic şi paraclinic am efectuat sistematic tuturor ecografii transvaginale.Au fost evidenţiate 18 paciente care să îndeplinească condiţiile de diagnostic. Dintre acestea, 4 au prezentat două operaţii cezariene în antecedente, 6 prezentau uter retrovers, 10 au prezentat intervenţii elective şi 3 paciente raportau infertilitate secundară.
Prevalenţa defectelor este necunoscută, incidenţa raportată fiind variabilă (19,4% Ofili Yebovi, 6,9% Wang, 7% Tahara, 4% Bij de Vaate), diferenţa se datorează definiţiei diferite şi metodei de diagnostic(4).
S-a dovedit că pacientele cu o primă naştere prin operaţie cezariană prezintă la o evaluare ecografică un perete anterior uterin mai subţire comparativ cu pacientele cu o naştere pe cale vaginală în antecedente(5). Printre metodele de evaluare a cicatricei uterine, ecografia transvaginală şi histerografia cu soluţie salină sunt cele mai fiabile, reproductibile, ieftine şi simplu de efectuat(6). Prin ecografie, cicatricea uterină posthisterorafie poate apărea ca un defect de formă triunghiulară sau dom eco negativ, care a fost denumit „nişă” de către Monteagudo et al. Gubbini et al. l-au redenumit „istmocel”, în timp ce Regnard et al. au optat pentru termenul de „dehiscenţă”(7).
S-a încercat raportarea incidenţei şi prevalenţei istmocelului la nivelul cicatricei de histerorafie, după operaţie cezariană, prin evaluarea pacientelor cu potenţiale simptome ginecologice asociate nişei la femeile negravide. Prevalenţa raportată a nişelor variază în studii în funcţie de criteriile de includere a pacientelor privind simptomatologia, dar şi de metodele de investigaţie folosite. Cu toate acestea, simptomul dominant care predispune la un astfel de diagnostic este spottingul postmenstrual la pacientele cu operaţie cezariană în antecedente(8).
Histerosalpingografia este o tehnică de investigaţie esenţială la femeile cu infertilitate, iar numărul acestor investigaţii a crescut în ultimii ani ca o consecinţă a tehnicilor de reproducere asistată şi a amânării obţinerii unei sarcini la femeile active profesional. Aceasta este o tehnică utilă şi pentru diagnosticul istmocelului(9).
Într-o evaluare recentă se raportează prezenţa nişei la circa 56% dintre femeile care au avut operaţie cezariană în urmă cu 6 luni - 1 an la examinarea GIS (Gel Instillation Sonohysterography) care prezintă sângerări intermenstruale. Nişele semicirculare şi triunghiulare sunt descrise ca fiind cele mai comune, dar în acelaşi studiu se subliniază faptul că forma nu este corelată cu simptomatologia(10). Cicatricea uterină post-operaţie cezariană rămâne vizibilă la majoritatea femeilor supuse unei examinări ecografice. Grosimea acesteia s-a dovedit a fi măsurabilă în toate trimestrele de sarcină. Diferenţele de măsurare între evaluatori s-au constatat a fi semnificative pentru trimestrele II şi III ale sarcinii, spre deosebire de primul trimestru, când rezultatele sunt similare(11).
Un studiu care a inclus 108 paciente cu vârste cuprinse între 20 şi 42 de ani a analizat eficacitatea ecografiei în evaluarea cicatricei uterine după operaţie cezariană. Scopul a fost observarea diferenţelor între ecografia 2D şi 3D în măsurarea grosimii miometrului la nivelul cicatricei. Concluzia a fost că ecografia 3D are o mai mare acurateţe şi, în funcţie de grosimea cicatricei, se poate stabili dacă o pacientă care are iniţial o naştere prin operaţie cezariană poate naşte spontan la următoarea sarcină. Valoarea de cut-off este de 3,5 mm grosimea peretelui uterin, care ar permite o naştere vaginală(12).
Un studiu recent a evaluat concordanţa între dimensiunea defectului parietal la nivelul cicatricei după operaţie cezariană şi numărul operaţiilor cezariene. De asemenea, s-au analizat poziţia uterului, sângerarea uterină postmenstruală, dismenoreea şi durerea pelviană cronică. S-a constatat că numărul operaţiilor cezariene din antecedente influenţează dimensiunea defectului parietal uterin. Pacientele cu multiple operaţii cezariene au un istmocel mai adânc şi cu o suprafaţă mai mare. De asemenea, pacientele cu uter în retroversoflexie accentuată au un defect parietal important(13). Mecanismul pare să fie acelaşi ca la pacientele cu mai multe operaţii cezariene, şi anume, o scădere a perfuziei tisulare. La acest nivel apare un proces de fibroză accentuată, observat la examenul microscopic. Pe de altă parte, sarcina ectopică la nivelul cicatricei post-operaţie cezariană pare a avea o incidenţă în continuă creştere(14,15). Diagnosticul diferenţial al istmocelului prin evaluare ecografică se face cu chist al canalului Gartner sau adenomioză, datorită aspectului diverticular pe care îl poate căpăta deseori defectul parietal uterin. Pentru susţinerea diagnosticului de adenomioză se poate efectua examinare IRM(16).
Există o clasificare a dehiscenţei uterine: tipul 1 - completă şi tipul 2 - incompletă. În dehiscenţa uterină de tipul 2, miometrul este întrerupt la acel nivel, dar seroasa este intactă. Ruptura uterină survine mai frecvent în dehiscenţa de tip 1 şi se produce la nivelul vechii incizii de histerotomie. Morbiditatea şi mortalitatea materno-fetală sunt reduse în dehiscenţa uterină de tip 2, comparativ cu cea de tip 1(17).
S-a observat că ţesutul miometrial restant la nivelul cicatricei de histerorafie are o grosime mai mare după închiderea tranşei de histerotomie în dublu strat, comparativ cu monostrat. Dimensiunea defectului parietal după închiderea în strat dublu este mai redusă comparativ cu histerorafia în monostrat la cezariana electivă(18).
Un studiu care a inclus cercetarea principalelor baze de date medicale pe tema istmocelului a evidenţiat aspectul cicatricei uterine după operaţie cezariană prin histerografie, sonohisterografie şi ecografie transvaginală. S-a dovedit că oricare dintre aceste mijloace de investigaţie este fezabil pentru identificarea defectelor de substanţă de la nivelul cicatricei uterine. Mai mult, pacientele cu un defect parietal important au risc crescut de ruptură uterină la următoarea sarcină(19).
Prin analiza bazelor de date MEDLINE, Embase şi Cochrane s-a realizat un studiu referitor la simptomatologia pacientelor identificate cu nişă uterină după operaţie cezariană şi tratamentul chirurgical ales. Au fost incluse paciente care au prezentat sângerări uterine anormale, durere locală, disfuncţie sexuală şi modificări ale calităţii vieţii. Terapia abordată a presupus: rezecţia histeroscopică a nişei (8 studii cu 484 de paciente), intervenţie laparoscopică (un studiu cu 13 paciente), intervenţie pe cale vaginală asistată laparoscopic (două studii cu 47 de paciente) sau tratament contraceptiv (un studiu cu 11 paciente). Concluzia a fost că sunt necesare mai multe raportări pentru a se stabili care este atitudinea terapeutică optimă pentru aceste paciente(20). Printr-o evaluare histeroscopică a 120 de paciente simptomatice la care s-a efectuat şi istmoplastie s-a realizat cura acestui defect parietal cu remisiunea simptomatologiei la toate pacientele. Astfel se poate stabili că histeroscopia reprezintă principala metodă curativă pentru această patologie(21).
Concluzie
Istmocelul uterin este o entitate descrisă în ultimele decenii, explicabilă prin creşterea globală a incidenţei operaţiei cezariene.Deşi nu este simptomatic în toate cazurile, poate fi responsabil de sângerări, infertilitate, dismenoree şi dureri abdominale cronice.
Diagnosticul istmocelului este exclusiv imagistic, ecografia transvaginală fiind gold-standardul.
La pacientele cu uter cicatriceal şi simptomatologie specifică, recunoaşterea sa permite tratamentul.
Bibliografie
2. Vikhareva Osser O., Valentin L. Risk factors for incomplete healing of the uterine incision after caesarean section. BJOG,2010;117(9):1119-26.
3. Chang Y., Tsai E.M., Long C.Y., Lee C.L., Kay N. Resectoscopic treatment combined with sonohysterographic evaluation of women with postmenstrual bleeding as a result of previous cesarean, 2009;200(4):370.e1-4.
4. Ofili-Yebovi D.1, Ben-Nagi J., Sawyer E., Yazbek J., Lee C., Gonzalez J., Jurkovic D. Deficient lower-segment Cesarean section scars: prevalence and risk factors. Ultrasound Obstet Gynecol, 2008;31(1):72-7.
5. Cheung V.Y., Constantinescu O.C., Ahluwalia B.S. Sonographic Evaluation of the Lower Uterine Segment in Patients With Previous Cesarean Delivery. J Ultrasound Med, 2004;23(11):1441-7.
6. Gubbini G., Casadio P., Marra E. Resectoscopic correction of the “isthmocele” in women with postmenstrual abnormal uterine bleeding and secondary infertility. J Minim Invasive Gynecol, 2008;15(2):172-5.
7. Osser O.V., Jokubkiene L., Valentin L. Cesarean section scar defects: agreement between transvaginal sonographic findings with and without saline contrast enhancement. Ultrasound Obstet Gynecol, 2010;35(1):75-83.
8. Bij de Vaate A.J., van der Voet L.F., Naji O., Witmer M., Veersema S., Brölmann H.A., Bourne T., Huirne J.A. Prevalence, potential risk factors for development and symptoms related to the presence of uterine niches following Cesarean section: systematic review. Ultrasound Obstet Gynecol, 2014;43(4):372-82.
9. Simpson W.L., Beitia L.G., Mester J. Hysterosalpingography: a reemerging study. Radiographics, 2006;26(2):419-31.
10. Bij de Vaate A.J., Brölmann H.A., van der Voet L.F., van der Slikke J.W., Veersema S., Huirne J.A. Ultrasound evaluation of the Cesarean scar: relation between a niche and postmenstrual spotting. Ultrasound Obstet Gynecol, 2011;37(1):93-9.
11. Naji O., Daemen A., Smith A., Abdallah Y., Saso S., Stalder C., Sayasneh A., McIndoe A., Ghaem-Maghami S., Timmerman D., Bourne T. Visibility and measurement of Cesarean section scars inpregnancy: a reproducibility study. Ultrasound Obstet Gynecol, 2012;40(5):549-56.
12. Basic E., Basic-Cetkovic V., Kozaric H., Rama A. Ultrasound evaluation of uterine scar after Cesarean section and next birth. Med Arch, 2012;66(3 Suppl 1):41-4.
13. Wang C.B., Chiu W.W., Lee C.Y., Sun Y.L., Lin Y.H., Tseng C.J. Cesarean scar defect: correlation between Cesarean section number, defect size, clinical symptoms and uterine position. Ultrasound Obstet Gynecol, 2009; 34(1):85-9.
14. Ash A., Smith A., Maxwell D. Cesarean section pregnancy. BJOG, 2007; 114:253–63.
15. Wang C.B., Tseng C.J. Primary evacuation therapy for Cesarean scar pregnancy: three new cases and review. Ultrasound Obstet Gynecol, 2006;27:222–6.
16. Surapaneni K., Silberzweig J.E.Cesarean Section Scar Diverticulum: appearance on hysterosalpingography, AJR Am J Roentgenol, 2008; 190(4):870-4.
17. Wagner M.S., Bédard M.J. Postpartum uterine wound dehiscence: a case report. J Obstet Gynaecol Can, 2006;28(8):713-5.
18. Glavid J., Madsen L.D., Uldjberd N., Dueholm M. Ultrasound evaluation of Cesarean scar after singleand double-layer uterotomy closure: a cohort study, Ultrasound Obstet Gynecol, 2013;42: 207–212. Published online in Wiley Online Library (wileyonlinelibrary.com).
19. Roberge S., Boutin A., Chaillet N., Moore L., Jastrow N., Demers S., Bujold E. Systematic review of cesarean scar assessment in the nonpregnant state: imaging techniques and uterine scar defect.Am J Perinatol, 2012;29(6):465-71.
20. Van der Voet L.F., Vervoort A.J., Veersema S., BijdeVaate A.J., Brölmann H.A., Huirne J.A. Minimally invasive therapy for gynaecological symptoms related to a niche in the caesarean scar: a systematic review. BJOG, 2014;121(2):145-56.
21. Raimondo G., Grifone G., Raimondo D., Seracchioli R., Scambia G., Masciullo V. Hysteroscopic treatment of symptomatic cesarean-induced isthmocele: a prospective study. J Minim Invasive Gynecol, 2015;22(2):297-301.