The progress of biologic and ultrasound assessments in pregnancy has a favorable impact, demonstrated in the case we are presenting, in terms of monitoring the pregnancy reaching the term, in a patient diagnosed with obstetrical antiphospholipid syndrome and septated uterus diagnosed after a previous spontaneous abortion at 6 weeks of gestation, when ultrasonographic evaluation and uterine cavity control have been performed. We pay attention to this case from the point of view of placental abnormalities that can occur if the uterine malformation leads to an anatomical perturbation of the insertion and development of the placenta, but also to the placental abnormalities from the antiphospholipid syndrome in which thrombosis can lead to placental dysfunction. These aspects are supported by laboratory tests that highlight the antiphospholipid antibodies and ultrasound findings obtained from pregnancy monitoring (placental anomalies, fetal growth curve, uterine artery, umbilical artery and middle cerebral artery Doppler flows, amniotic fluid index). From the category of anti-phospholipid antibodies, anti-annexin V antibodies are directly involved in the disruption of placenta as early as 7 weeks of gestation.
Managementul materno-fetal al unui caz cu anomalie anatomică uterină şi sindrom antifosfolipidic obstetrical
Maternal-fetal management and outcome in a case of uterine anatomic abnormality and obstetric antiphospholipid syndrome
First published: 18 decembrie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.18.4.2017.1324
Abstract
Rezumat
Progresul evaluărilor biologice şi ultrasonografice în sarcină are un impact favorabil, demonstrat în cazul pe care îl prezentăm, în ceea ce privește monitorizarea sarcinii care a ajuns la termen la o pacientă diagnosticată cu sindrom antifosfolipidic obstetrical și uter septat constatat în urma unui avort spontan la 6 săptămâni de gestaţie, când s-au efectuat examen ultrasonografic şi controlul cavităţii uterine. Acordăm atenţie acestui caz prin prisma anomaliilor de placentaţie ce pot apărea în situaţia în care malformaţia uterină duce la perturbarea inserţiei şi dezvoltării placentei de cauză anatomică, dar şi a anomaliilor placentare din cadrul sindromului antifosfolipidic în care apariţia trombozelor poate duce la disfuncţie placentară. Aceste aspecte sunt susţinute de teste de laborator ce pun în evidenţă anticorpii antifosfolipidici şi de constatări ultrasonografice obţinute în urma monitorizării sarcinii (anomalii placentare, curba de creştere fetală, velocimetrii în arterele uterină, ombilicală și cerebrală medie, indexul de lichid amniotic). Din categoria anticorpilor antifosfolipidici, anticorpii antianexină V sunt implicaţi direct în perturbarea placentaţiei încă de la 7 săptămâni de gestaţie.
Introducere
Malformaţiile uterine fac parte din categoria malformaţiilor mulleriene, alături de malformaţiile renourinare, având origine comună, şi anume ductele mulleriene. Embriogenetic, uterul se formează prin fuzionarea celor două ducte mulleriene, numite și paramezonefrotice, urmată de regresia totală a segmentelor mediale(1-3).
În literatura de specialitate au existat numeroase clasificări ale malformaţiilor tractului reproductiv feminin. Clasificarea propusă de Societatea Americană de Fertilitate(1) este:
-
hioplazia segmentară sau agenezie mulleriană
- vaginal
- cervical
- uterin
- tubar
- combinat
-
uter unicornuat:
- corn rudimentar, cu cavitatea endometrială şi comunicare cu uterul unicornuat
- corn uterin rudimentar, cu cavitate endometrială, fără comunicare cu uterul unicornuat
- corn uterin rudimentar, fără cavitate rudimentară
- uter unicorn fără corn rudimentar
- uter didelf
-
uter bicorn
- bifurcare completă (cu două cornuri rudimentare)
- bifurcare incompletă (cu un singur corn)
-
uter septat
- sept complet
- sept incomplet
- uter arcuat
- anomalii secundare expunerii la dietilstilbestrol.
În urma fuzionării ductelor mulleriene şi a absenţei regresiei sau regresiei parţiale a segmentelor mediale, se poate forma un sept în interiorul cavităţii uterine, ducând la apariţia malformaţiilor uterine, numite uterul septat și uterul arcuat.
Uterul arcuat reprezintă malformaţia caracterizată prin prezenţa unui sept de dimensiuni reduse, situat la nivelul fundului uterin. Prognosticul reproductiv nu este înrăutăţit prin prezenţa acestei mici denivelări fibromusculare de la nivelul fundului uterin, dar la pacientele la care s-au exclus celelalte etiologii ale infertilităţii se impune rezecţia chirurgicală.
Forma şi dimensiunea septului depind de cantitatea ţesutului restant. El poate fi localizat doar la nivelul regiunii fundice a uterului - uter septat parţial sau localizarea sa se poate întinde de la nivelul fundului uterin până la nivel cervical - uter septat complet. Dezvoltarea segmentară a septului poate duce la comunicarea parţială între cele două părţi ale uterului(4).
Histologic, structura septului poate varia de la fibros la fibromuscular.
Incidenţa reală a malformaţiilor uterine (uter septat, uter arcuat) nu este cunoscută. O mare parte a acestor malformaţii sunt descoperite la pacientele cu complicaţii obstetricale. Deşi aceste malformaţii nu cresc riscul travaliului prematur sau al naşterii prin operaţie cezariană, ele sunt asociate cu creşterea ratei de avort spontan. Această rată în primul trimestru este de 48%(1).
Pierderea sarcinii se datorează, probabil, implantării embrionare într-o arie a septului avasculară, distorsionării cavităţii uterine sau asocierii malformaţiilor endometriale şi cervicale. Septurile fibromusculare au o vascularizaţie mai redusă comparativ cu miometrul normal.
Datele diagnostice pot fi obţinute prin histerosalpingografie, histerografie, ultrasonografie și rezonanţă magnetică nucleară. Rezecţia septului se poate face prin metroplastie abdominală, ce are ca dezavantaje terminarea naşterii prin operaţie cezariană sau apariţia aderenţelor pelvi-abdominale, cu scăderea ratei fertilităţii. Alternativa eficientă este rezecţia histeroscopică a septului, asociată cu supravegherea laparoscopică. Avantajele septoplastiei histeroscopice sunt: reducerea riscului de apariţie a aderenţelor pelviene, recuperarea postoperatorie bună, cu reducerea morbidităţii postoperatorii, durata spitalizării reduse, reducerea procentului de naşteri prin operaţie cezariană.
Sindromul antifosfolipidic reprezintă una din cele mai importante cauze dobândite de hipercoagulabilitate, fiind definit ca o asociere între evenimente trombotice arteriale şi venoase, complicaţii obstetricale şi prezenţa anticorpilor antifosfolipidici(5). Acesta face parte din categoria trombofiliilor, mai exact din categoria trombofiliilor dobândite(5,7-10).
Autoanticorpii din sindromul antifosfolipidic atacă peretele celulelor ce căptuşesc vasele sangvine. Implantarea normală şi dezvoltarea fetală adecvată necesită în primul rând o invazie trofoblastică adecvată a deciduei şi arterelor spiralate(11-13). Un rol esenţial în acest sens este atribuit prezenţei pe suprafaţa sincițiotrofoblastului a unei proteine numite anexină V(5).
Această proteină este exprimată pe suprafaţa externă a sincițiotrofoblastului începând cu săptămâna a 7-a de gestaţie şi până la termen, poziţionarea anatomică a acesteia fiind ideală pentru menţinerea fluidităţii sângelui intravilos(5,14).
În cadrul sindromului antifosfolipidic, formarea de anticorpi direcţionaţi împotriva fosfolipidelor şi a proteinelor plasmatice legate de acestea presupune şi formarea de anticorpi împotriva anexinei V, anticorpi responsabili de disrupţia stratului superficial pe care îl formează aceasta(15-17).
Prezenţa anticorpilor antianexină V pare a fi implicată şi în eşecul fertilizării in vitro şi al transferului embrionar în cadrul fertilizării in vitro(3,18).
Prezentare de caz
Articolul prezintă cazul unei sarcini obţinute spontan la o pacientă diagnosticată anterior cu uter malformat, sindrom antifosolipidic şi avort spontan în antecedente.
Studiul a fost realizat în conformitate cu principiile Declarației de la Helsinki și a fost aprobat de Comitetul de Etică al universității. Pacienta a fost pe deplin informată cu privire la posibilele consecințe ale studiului de față și a completat un formular de consimțământ informat pentru a participa.
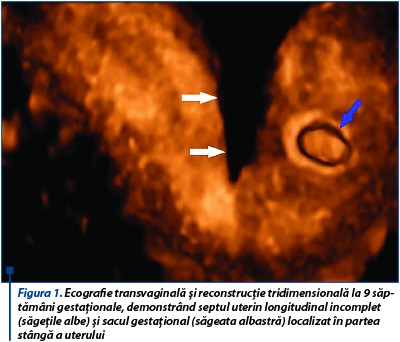
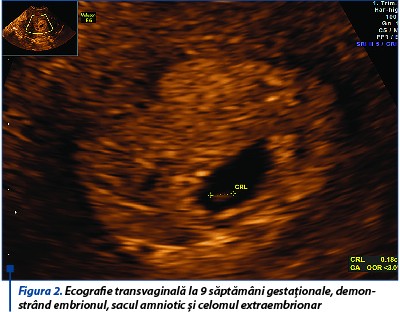
Sarcina a fost monitorizată clinic şi pacienta examinată ecografic la 9 săptămâni de gestaţie, 22, 31 şi 36 de săptămâni. În ecografia 3D la 9 săptămâni de gestaţie sunt evidenţiate septul uterin longitudinal incomplet şi sacul gestaţional localizat în hemiuterul stâng, fără imagine de decolare recentă sau hematom decidual (figurile 1 și 2). Pacienta a fost internată pentru sângerare vaginală şi a urmat tratament progestativ (utrogestan 400 mg/24 h și duphaston 10 mg/24 h), antispastic (no-spa 120 mg/24 h), antitrombotic (aspenter 75 mg/24 h) și vitaminoterapie (acid folic 5 mg/24 h).
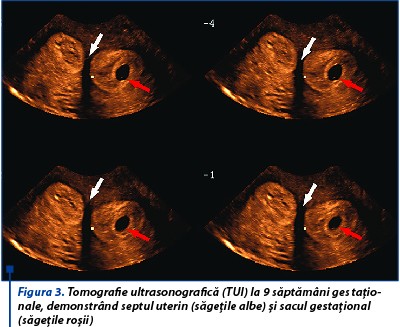
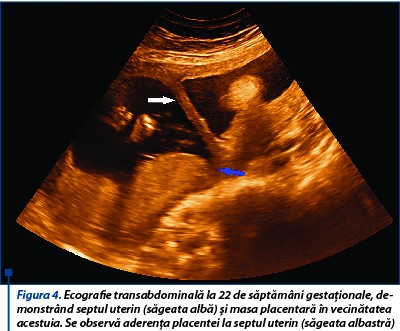
La examinarea morfologică fetală din trimestrul al doilea, creşterea fetală este în limite normale, placenta este situată în vecinătatea septului uterin (figurile 3 și 4), lichid amniotic în cantitate normală, indici velocimetrici în parametri normali, colul uterin are 3,05 cm. Clinic, sângerarea vaginală şi contracţiile uterine sunt absente.
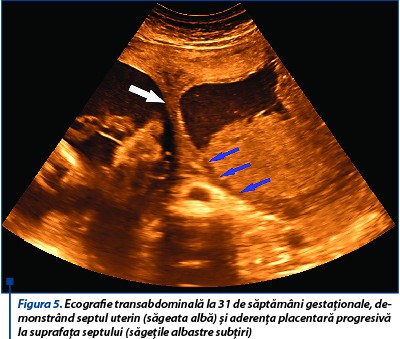
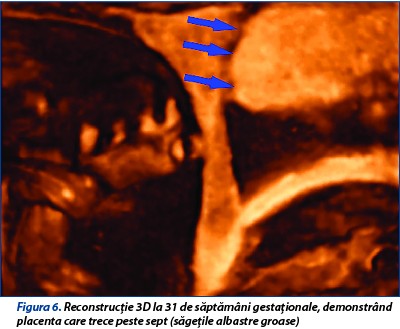
La 31 de săptămâni de gestaţie este vizualizată placenta ce aderă la septul uterin, biometrie fetală corespunzătoare vârstei gestaţionale, lichidul amniotic este în cantitate normală şi indici velocimetrici în limite normale în arterele uterine, cerebrală medie şi ombilicală (figurile 5 și 6).
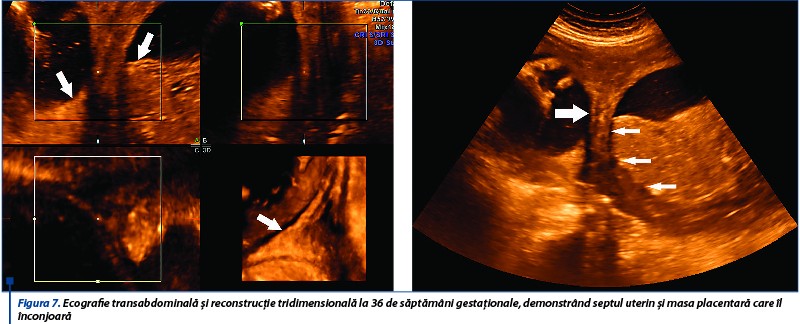
Scorul biofizic la 36 de săptămâni de gestaţie este 8/10 (lichid amniotic în cantitate redusă/index al lichidului amniotic - 3), fătul este aşezat longitudinal, cu craniul proximal şi suprafaţa placentară inserată la nivelul septului mai extinsă (figura 7).
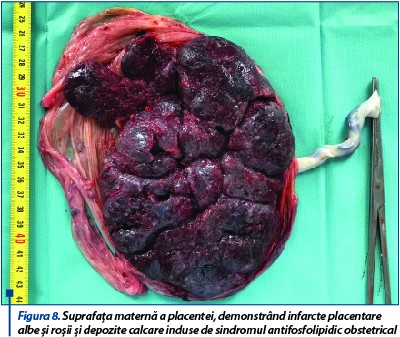
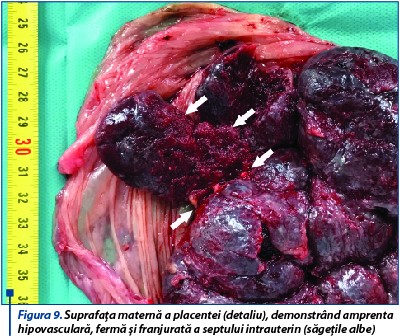
Pacienta se internează cu diagnosticul: IIGIP sarcină 38 de săptămâni. Prezentaţie pelviană. Membrane intacte. Bazin eutocic. Uter malformat - septat. Oligoamnios. Contracţii uterine dureroase. Managementul cazului impune extracţia prin operaţie cezariană a fătului de sex feminin ce a cântărit 2800 de grame, scorul Apgar a fost 9 şi evoluția neonatală bună. Delivrenţa deficitară a necesitat extracţia manuală a placentei, care a prezentat la nivelul feţei materne franjurări în zona inserţiei pe septul uterin, iar pe toată suprafaţa placentară infarcte roşii şi depozite calcare secundare sindromului antifosfolipidic (figurile 8 și 9). Lehuza şi nou-născutul au fost externaţi la cinci zile după operaţia cezariană.
Discuţii
Datorită progresului spectaculos al medicinei materno-fetale, în prezent morbiditatea şi mortalitatea perinatală în sarcinile complicate cu uter malformat şi sindrom antifosfolipidc sunt comparabile cu cele ale femeilor însărcinate sănătoase(18).
Deşi s-a crezut că uterul septat poate fi diagnosticat cu acurateţe prin imagistică cu rezonanţă magnetică, mai recent, ecografia 3D s-a dovedit a avea acurateţe superioară(18,19).
Uterul septat poate duce la apariţia malformaţiilor fetale, cazuri descrise de Heinoven încă din anul 1999(1,19).
Monitorizarea ultrasonografică riguroasă a evidențiat absenţa malformaţiilor fetale congenitale sau a celor datorate prezenţei septului uterin.
Incidenţa exactă a anomaliilor uterine congenitale este dificil de determinat, deoarece multe femei cu acest tip de anomalii nu sunt diagnosticate, în special dacă sunt asimptomatice, dar incidenţa estimată ar fi în jurul a 3-4% în populaţia generală, mai puţin de jumătate având manifestare clinică(19).
Cea mai frecventă dintre anomaliile uterine congenitale este uterul septat. În primul trimestru de sarcină, riscul de avort spontan la aceste paciente este estimat între 28% și 48%, iar în trimestrul al doilea scade la 5%(6).
Concluzii
Monitorizarea clinică, biologică şi imagistică riguroasă a sarcinii la pacienta cu uter malformat şi sindrom antifosfolipidic identifică inserţia placentară la nivelul septului uterin, progresia extinderii acesteia în raport cu septul şi starea fetală în fiecare etapă a dezvoltării lui. Pacienta cu uter malformat şi sindrom antifosfolipidic obstetrical prezintă risc crescut de sângerare pe parcursul sarcinii, din cauza inserţiei placentare la nivelul şi/sau în vecinătatea septului şi a tulburărilor hematologice datorate sindromului antifosfolipidic.
Tratamentul antitrombotic şi/sau anticoagulant administrat gravidelor diagnosticate cu sindrom antifosfolipidic obstetrical reduce complicaţiile trombotice şi scade rata avorturilor spontane în primul şi al doilea trimestru, precum şi rata naşterilor premature.
Bibliografie
2. Norton M., Scoutt L., Feldstein V., Vlădăreanu R. Callen, Ultrasonografie în Obstetrică și Ginecologie, Ed. Hipocrate, 2017, 852-6.
3. Tănăsescu C. Sindromul antifosfolipidic, Ed. Academiei Române, 2005, 83-328.
4. Dendrinos S., Sakkas E., Makrakis E. Low-molecular-weight heparin versus intravenous immunoglobulin for recurrent abortion associated with antiphospholipid antibody syndrome. Int J Gynaecol Obstet, 2009;104(3): 223-5.
5. Miyakis S., Lockshin M.D., Atsumi T. et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost, 2006;4(2):295-306.
6. Kurjak A., Chervenak F., Vlădăreanu R. Donald School. Tratat de Ultrasonografie în Obstetrică și Ginecologie, Ed. Amaltea, 2012, 745-75.
7. Cervera R., Rodriguez-Pinto I., Colafrancesco S. et al. 14th International Congress on Antiphospholipid Antibodies Task Force report on catastrophic antiphospholipid syndrome. Autoimmun Rev, 2014;13(7):699-707.
8. Savu I., Horhoianu V.V., Vlădăreanu S., Cîrstoiu M.M. Intrauterine growth restriction and maternal thrombophilia. Ginecologia.ro, 2015;3(7):10-14.
9. Bramham K., Thomas M., Nelson-Piercy C. et al. First-trimester low-dose prednisolone in refractory antiphospholipid antibody-related pregnancy loss. Blood, 2011; 117(25):6948-51.
10. Stone S., Pijnenborg R., Vercruysse L. et al. The placental bed in pregnancies complicated by primary antiphospholipid syndrome. Placenta, 2006; 27(4-5):457-67.
11. Espinosa G., Cervera R. Current treatment of antiphospholipid syndrome: lights and shadows. Nat Rev Rheumatol, 2015;11(10):586-96.
12. Mehedinţu C., Brătilă E., Vlădăreanu S., et al. Umbilical vein thrombosis. Case report. Ginecologia.ro, 2016;4(11):12-4.
13. Ofer-Shiber S., Molad Y. Frequency of vascular and pregnancy morbidity in patients with low vs. moderate-to-high titers of antiphospholipid antibodies. Blood Coagul Fibrinolysis, 2015;26(3):261-6.
14. Bouvier S., Cochery-Nouvellon E., Lavigne-Lissalde G., et al. Comparative incidence of pregnancy outcomes in treated obstetric antiphospholipid syndrome: the NOH-APS observational study. Blood, 2014;123(3):404-13.
15. Lefkou E., Mamopoulos A., Dagklis T. et al. Pravastatin improves pregnancy outcomes in obstetric antiphospholipid syndrome refractory to antithrombotic therapy. J Clin Invest, 2016;126(8):2933-40.
16. Voicu D., Bohîlţea R., Bodean O., et al. Screening for inherited thrombophilia in pregnancy in Bucharest Emergency University Hospital. Perinatologia, 2017;1(1):11-4.
17. Galli M., Luciani D., Bertolini G., Barbui T. Lupus anticoagulants are stronger risk factors for thrombosis than anticardiolipin antibodies in the antiphopholipid syndrome: a systematic review of the literature. Blood, 2003;101(5):1827-32.
18. Cervera R., Serrano R., Pons-Estel G.J., et al. Morbidity and mortality in the antiphospholipid syndrome during a 10-year period: a multicentre prospective study of 1000 patients. Ann Rheum Dis, 2015;74(6):1011-8.
19. Hoffman B., Schorge J., Schaffer J., Halvorson L., Bradshaw K., Cunningham F.G. (Ed), Vlădăreanu R. (Ed. ediţia în limba română). Williams Obstetrica, Ed. Hipocrate, 2017, 36-43.
Articole din ediţiile anterioare
Managementul ante-, peri- şi postnatal al unei gravide cu histiocitoză pulmonară cu celule Langerhans - prezentare de caz
Histiocitozele cu celule Langerhans sunt un grup de patologii rare produse prin proliferarea clonală a celulelor dendritice Langerhans, care pot af...
Complicaţiile hipertensiunii arteriale induse de sarcină – management terapeutic şi prognostic
Managementul sarcinii asociate cu hipertensiune gestaţională se realizează în funcţie de severitatea hipertensiunii arteriale, de vârsta ges...
Rolul infecţiilor orale în naşterea prematură
Prematuritatea şi greutatea scăzută la naştere sunt unele din complicaţiile frecvente ale sarcinilor. Infecţiile orale, în special bolile parodonta...
Hemangiom vertebral agresiv care determină afectare neurologică severă în al treilea trimestru de sarcină – prezentare de caz
Hemangiomas are benign vascular tumors characterized by endothelial cell proliferation, most commonly affecting the soft tissues, but they can al...