Aspecte ale cardiotoxicităţii terapiei oncologice
Cardiotoxicity aspects of oncological therapy
Abstract
Cardiovascular pathology in the oncological patient is increasingly common in current practice and imposes difficult and complex challenges. Cardiovascular risk assessment in oncology patients is a complex approach. The main effects of cardiotoxicity of oncological therapy are analyzed (cardiac dysfunction, myocarditis, vascular toxicity, hypertension, arrhythmias, QT prolongation, pericardial damage, thromboembolic events, hemorrhagic complications, pulmonary hypertension, valvular damage, indirect toxicity), identifying diagnostic and treatment criteria.Keywords
oncological therapycardiotoxicity of oncological treatmenRezumat
Patologia cardiovasculară la pacientul oncologic este din ce în ce mai frecventă în practica curentă şi impune provocări dificile şi complexe. Evaluarea riscului cardiovascular la pacientul oncologic este un demers complex. Sunt analizate principalele efecte ale cardiotoxicităţii terapiei oncologice (disfuncţia cardiacă, miocardita, toxicitatea vasculară, HTA, aritmii, prelungirea QT, afectarea pericardică, evenimente trombembolice, complicaţii hemoragice, hipertensiune pulmonară, afectare valvulară, toxicitate indirectă), identificând criterii de diagnostic şi tratament.Cuvinte Cheie
terapie oncologicăcardiotoxicitatea tratamentului oncologicBolile cardiovasculare şi cele oncologice reprezintă cele mai importante cauze de mortalitate. Atât patologia oncologică, dar şi cea cardiovasculară prezintă un trend crescut al prevalenţei. Aceasta are un impact considerabil asupra calităţii vieţii pacienţilor, a speranţei de viaţă sănătoase, a speranţei de viaţă, dar şi asupra poverii impuse sistemului de sănătate.
Progresele obţinute atât în demersul diagnostic şi de monitorizare, dar şi în intervenţiile terapeutice, aduc noi provocări, pacienţii din ce în ce mai vârstnici, la care coexistă numeroase patologii, fiind dificil de abordat. De asemenea, avem de gestionat şi sindromul de fragilitate, precum şi alte patologii specifice vârstnicului.
Evaluarea iniţială a riscului cardiovascular este prezentată standardizat în Ghidul ESC – Cardio-oncologie 2022(1) (figura 1).
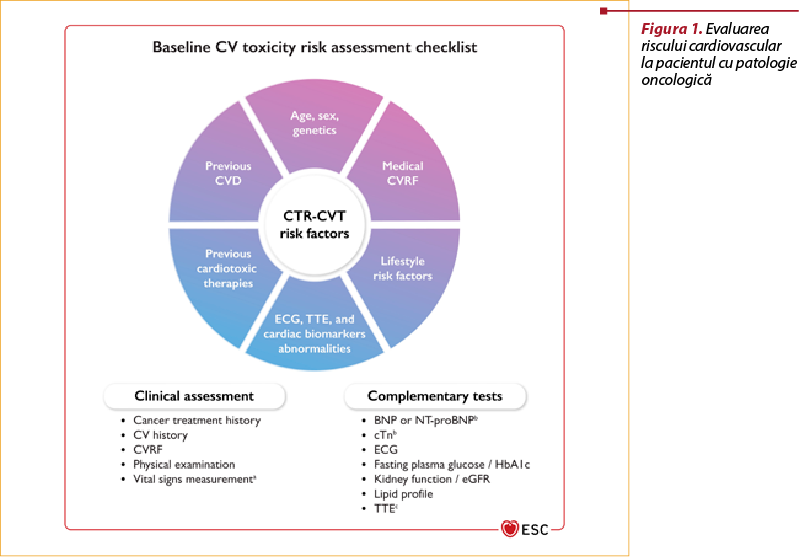
Evaluarea este clinică şi paraclinică şi de laborator. În evaluarea clinică sunt urmărite următoarele repere: vârstă, gen, factori genetici, factori de risc cardiovascular (hipertensiune arterială, diabet zaharat, dislipidemie, fumat, sedentarism, obezitate etc.), factori de risc în relaţie cu stilul de viaţă, istoric de boală cardiovasculară, istoric de terapii cardiotoxice antecedente, examen fizic, inclusiv măsurarea semnelor vitale.
Evaluarea complementară vizează: ECG, BNP/NT-proBNP, troponină, glicemie, hemoglobină glicozilată, funcţia renală (eGRF, creatinină), profilul lipidic, teste imagistice (ecografie transtoracică, alte teste, precum RM cardiac, angio-CT etc.).
Utilizarea scorurilor clasice (SCORE, SCORE2 sau SCORE OP) nu este aplicabilă pacienţilor oncologici, motiv pentru care se va apela la scorurile de stratificare elaborate de HFA-ICOS (Heart Failure Association şi International Cardio-Oncology Society)(2).
Stratificarea riscului cardiovascular se face înaintea iniţierii terapiei oncologice. În funcţie de riscul mic, intermediar, înalt sau foarte înalt, se decid iniţierea terapiei şi coordonatele monitorizării şi ale reevaluărilor.
Cea mai frecventă problemă este cardiotoxicitatea terapiilor oncologice. Aceasta este condiţionată de: profilul de risc cardiovascular al pacientului, antecedentele cardiovasculare, tipul chimioterapiei, asocierea chimio- şi radioterapie.
Cele mai frecvente efecte adverse cardiovasculare consecutive terapiei oncologice sunt reprezentate de(3):
-
Disfuncţia cardiacă
-
Miocardita
-
Toxicitatea vasculară
-
HTA
-
Aritmii, prelungire QT
-
Altele – afectare pericardică, evenimente tromboembolice, complicaţii hemoragice, hipertensiune pulmonară, afectare valvulară, toxicitate indirectă (tiroidă, suprarenale, hipofiză, pancreas).
Disfuncţia cardiacă (insuficienţă cardiacă sau cardiomiopatie) este secundară chimioterapiei cu: antracicline, antagonişti ai receptorului factorului uman de creştere epidermal 2 (HER2), inhibitori proteazomici, inhibitori tirozin-kinazici(3). Diagnosticul pozitiv este generat de simptome şi semne, evaluarea imagistică (FEVS) şi biomarkeri cardiaci (peptide natriuretice, troponine). Biomarkerii cardiaci pot oferi un diagnostic precoce, precum şi o estimare prognostică. Disfuncţia cardiacă poate fi asimptomatică sau simptomatică, cu diferite grade de severitate. Recomandările Ghidului ESC 2022(1) indică utilizarea de: I-ECA/BRA, inhibitor de receptor angiotensină/neprilisină, betablocant, inhibitor al cotransportorului 2 de sodiu-glucoză, antagonist de receptori mineralocorticoizi.
Miocardita poate fi cauzată de chimioterapie (doxorubicină, fluorouracil, ciclofosfamidă), radioterapie şi imunoterapie (inhibitorii punctului de control imunitar; ICI). Diagnosticul este structurat prin date clinice (fatigabilitate, durere toracică, palpitaţii, mialgii, dispnee, sincopă, şoc cardiogen, diplopie etc.), imagistice (ecografie transtoracică cardiacă, rezonanţă magnetică cardiacă), laborator (troponine) şi histopatologice (infiltrat inflamator multifocal). În cazul etiopatogeniei legate de toxicitatea inhibitorilor punctelor de control imunitar (ICI), terapia oncologică trebuie întreruptă, implicând o dificilă alegere între eficienţă şi risc.
Toxicitatea vasculară poate fi indusă de: chimioterapie (5-fluorouracil, derivaţi de platină, ciclofosfamidă, gemcitabină, carfilzomib, everolimus, inhibitori ai factorului de creştere vascular, inhibitori ai tirozin-kinazei breakpoint etc.), dar şi de radioterapie. Mecanismele patogenetice sunt complexe (ateroscleroză, tromboză, vasoreactivitate anormală, vasculită), dar în principal consecutive efectelor proinflamatorii şi protrombotice induse de neoplazii. În Ghidul ESC 2022(1) se realizează includerea manifestărilor în: toxicitate vasculară asimptomatică şi toxicitate vasculară simptomatică.
-
Toxicitatea vasculară asimptomatică include: boala arterială coronariană, boala arterială periferică a membrelor inferioare, boala arterială carotidiană, tromboza arterială, tromboza venoasă, vasoreactivitate anormală (periferică, epicardică şi de microcirculaţie coronariană).
-
Toxicitatea vasculară simptomatică se manifestă prin: AVC/AIT, infarct miocardic, sindrom coronarian acut, sindroame coronariene cronice, boală arterială periferică, angină vasospastică, angină microvasculară, sindrom Raynaud.
În sindroamele coronariene acute se recomandă tratament invaziv sau neinvaziv, în funcţie de tipul leziunii cardiace şi de statusul pacientului. Mono sau dubla antiagregare plachetară este indicată atunci când există un risc înalt de sângerare. Administrarea este însă contraindicată în prezenţa trombocitopeniei (sub 10000 pentru aspirină, sub 30000 pentru clopidrogrel şi sub 50000 pentru ticagrelor)(1) (figurile 2 şi 3).
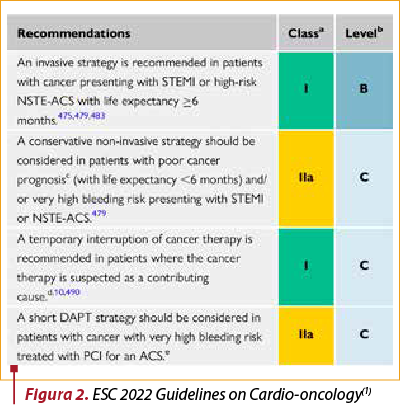
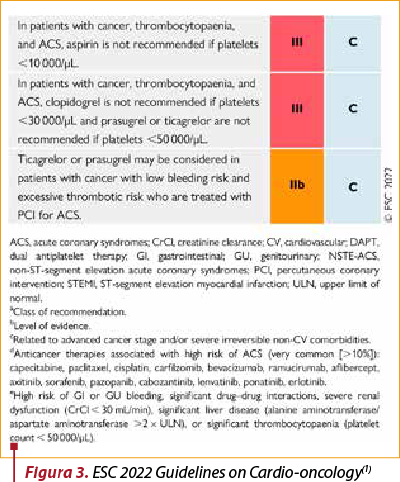
În cazul sindroamelor coronariene cronice, la pacientul cu tratament oncologic, cu tratament de revascularizare, dubla antiagregare plachetară are clasă de recomandare IC, dar durata necesită individualizare, în funcţie de riscul trombotic şi de sângerare, stadiul cancerului şi de tipul de tratament pentru cancer.
Hipertensiunea arterială secundară terapiei oncologice este pusă în relaţie cu: inhibitorii căii de semnalizare a VEGF (VSPI), carfilzomib, inhibitori mTOR, inhibitori tirozin-kinazici ai BRAF, inhibitorii tirozin-kinazei Bruton (BTK), inhibitorii proteinei activate mitogen/kinază extracelulară semnal-reglată (MEK)(3). Prezenţa hipertensiunii arteriale drept comorbiditate deja existentă este frecventă şi creşte riscul evenimentelor cardiovasculare, dar şi al cardiotoxicităţii. Abordarea pacientului, indiferent de cauza hipertensiunii arteriale, se va face conform ghidurilor actuale vizând HTA. Respectiv, cu clasă de recomandare I: IECA/BRA, BCC dihidropiridinice, iar în caz de HTA rezistentă (cu clasă de recomandare IIa): betablocante, spironolactonă, nitraţi oral sau transdermic. Terapia cu combinaţii fixe (IECA/BRA cu dihidropiridină) este de elecţie pentru atingerea valorilor-ţintă. La pacienţii cu tonus simpatic crescut, dintre betablocante, nebivololul şi carvedilolul sunt de preferat. La nebivolol, prin efectul asupra NO, avem un efect suplimentar, cu reducerea stresului oxidativ şi a inflamaţiei cronice(4). Temporizarea terapiei oncologice este indicată doar în prezenţa urgenţelor hipertensive (encefalopatie hipertensivă, AVC, infarct miocardic, disecţie de aortă etc.) şi necesită o reevaluare imediat după stabilizarea pacientului.
Aritmiile şi prelungirea QTc sunt puse în relaţie cu: trioxid de arseniu, inhibitori de tirozin-kinază, inhibitori de VEGF, inhibitori ai kinazelor ciclin dependente 4/6. Prelungirea intervalului QT (QT corectat >500 ms conform formulei Fridericia) este un efect secundar frecvent al terapiei oncologice. Pacientul oncologic prezintă adesea comorbidităţi cu potenţial proaritmogen, precum şi medicaţie nononcologică care induce risc de prelungire QT.
Fibrilaţia atrială este o asociere frecventă şi bidirecţională la pacientul oncologic. Din totalitatea cazurilor de pacienţi care au fibrilaţie atrială, un sfert asociază o neoplazie(5). Cel mai frecvent apare asocierea fibrilaţiei atriale la cei cu cancer pulmonar, digestiv sau de tract urinar. Patogeneza este complexă: inflamaţie, hipoxie, remodelare electrică, modificări structurale miocardice, toxicitatea unor chimioterapice (ibrutinib, clorafabină, ponatinib), efecte ale radioterapiei. Tratamentul fibrilaţiei atriale la pacientul oncologic este reprezentat de: anticoagulare, antiaritmice, dispozitive implantabile de ritm (terapia de resincronizare [CRT], defibrilatoare cardiace implantabile [ICD]). Tratamentul anticoagulant cu heparine cu greutate moleculară mică (HGMM) este rezervat doar neoplaziilor active, severe, care au contraindicaţie la anticoagulante orale directe (DOAC). Antivitaminele K (din cauza dificultăţii în administrare şi riscului crescut hemoragic) au indicaţie restrânsă doar pentru cei cu proteze valvulare. De elecţie rămâne utilizarea DOAC (rivaroxaban, edoxaban, apixaban), care s-au dovedit egal eficiente cu AVK şi superioare din punctul de vedere al siguranţei, conform studiilor ROCKET AF (rivaroxaban), ENGAGE AF-TIMI 48 (edoxaban) şi ARISTOTLE (apixaban)(1,6).
Pericardita poate fi cauzată de: radioterapie, chimioterapie (antracicline, bleomicină, ciclofosfamidă, citarabină), precum şi de imunoterapie (în special ICI).
Riscul trombotic este o problematică majoră, atât prin creşterea indicelui de morbiditate, cât şi a celui de mortalitate. Pacientul oncologic prezintă un risc crescut de tromboză venoasă profundă, tromboembolism pulmonar şi de recurenţă a acestora.
Riscul crescut de fibrilaţie atrială conduce mai frecvent la accident vascular cerebral, apariţia sau agravarea insuficienţei cardiace.
De asemenea, apare în plus riscul crescut de sângerare, care impune noi dificultăţi de abordare.
Fiziopatogenia tromboembolismului, sintetizată în triada Wirchow (stază, leziunea endoteliului vascular şi hipercoagulabiliate), prezintă la pacientul oncologic aspecte complexe. Riscul trombotic este dependent de tipul tumorii, extinderea acesteia şi efectele de vecinătate, de tipul terapiei, dar şi de profilul pacientului (factori de risc individual, comorbidităţi, reacţii individuale).
Tromboza asociată cancerului se manifestă ca(7):
-
tromboembolism venos
-
tromboembolism arterial
-
coagulare vasculară diseminată
-
microangiopatie trombotică.
Riscul trombotic este dependent de particularităţile pacientului, de tipul cancerului şi de tipul tratamentului oncologic (figura 4).
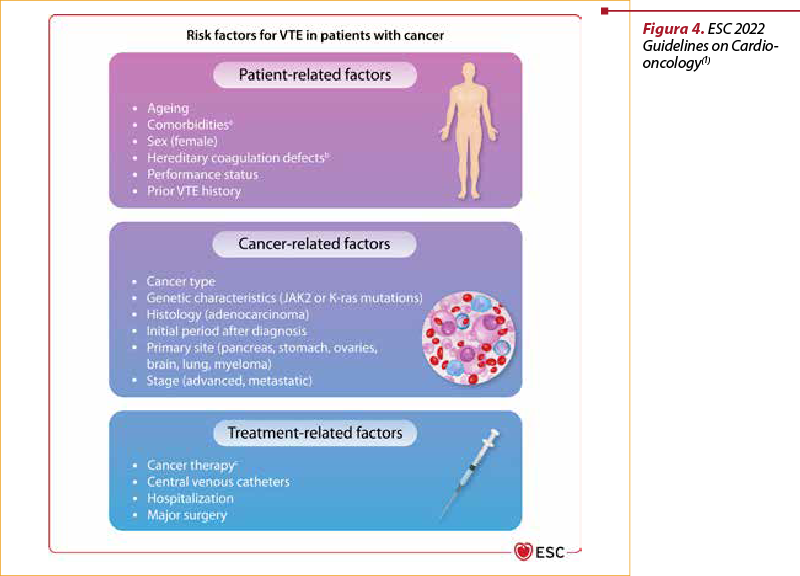
Elemente care ţin de particularitatea pacientului (vârsta înaintată, rasa afro-americană, extreme ale greutăţii corporale, deficite funcţionale, comorbidităţi) vor trebui considerate ca având potenţial protrombotic crescut(1).
Riscul trombotic este puternic determinat de localizarea cancerului, cele digestive expunând la un risc foarte înalt (figura 5).
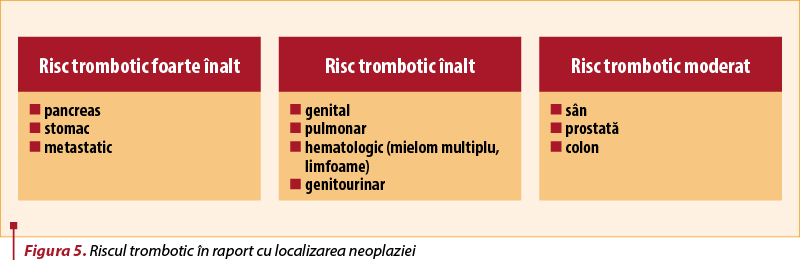
Nu doar localizarea, ci şi stadiul cancerului, precum şi tipul tratamentului oncologic determină riscul trombotic. Chimioterapicele (doxorubicina, fluorouracil), imunoterapia (interleukina 2, ipilimumab, nivolumab, pembrolizumab, nilotinib) şi terapia hormonală cresc riscul trombotic(8).
Tratamentul chirurgical creşte de două ori riscul unui tromboembolism venos şi de patru ori riscul de tromboembolism pulmonar letal(9).
Cuantificarea riscului se face prin utilizarea Scorului Khorana (pentru tromboembolismul venos) sau a Scorului COMPASS-CAT.
Tratamentul tromboembolismului la pacientul oncologic va fi profilactic pentru tromboza venoasă, recurenţele acesteia şi pentru accidentul vascular cerebral (AVC) la cei cu fibrilaţie atrială, sau indicaţie de tratament curativ în tromboza venoasă profundă sau tromboembolismul pulmonar.
Alegerea terapiei antitrombotice – antivitamine K (VKA), anticoagulante orale directe (DOAC), heparine cu greutate moleculară mică (LMWH) – se face în funcţie de riscul tromboembolic, riscul de sângerare, interacţiuni medicamentoase şi de opţiunea pacientului(1) (figura 6).
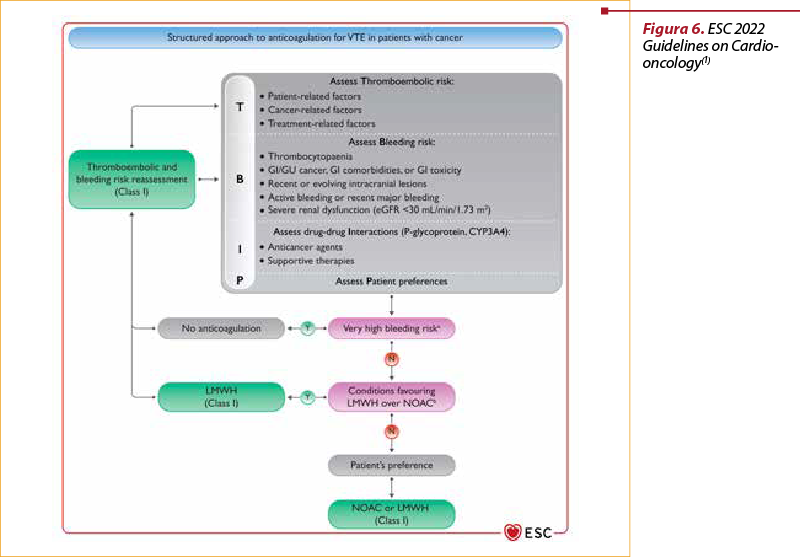
Pentru anticoagulantele orale directe (DOAC) avem dovezi de eficienţă şi siguranţă, dar şi mai puţine interacţiuni medicamentoase(9,10).
Studii clinice recente(9) au comparat eficienţa şi siguranţa DOAC faţă de deltaparină: HOKUSAI VTE Cancer (edoxaban-deltaparin), SELECT-D Pilot trial (rivaroxaban-deltaparin), CARAVAGIO (apixaban-deltaparin), demonstrând noninferioritatea acestora.
Studii înalt semnificative(9) prin designul pe care au fost structurate au arătat eficienţa şi siguranţa DOAC în comparaţie cu warfarina: EINSTEIN PE/DVT (rivaroxaban-warfarin) pentru VTE simptomatic sau recurent, AMPLIFY (apixaban-warfarin) pentru VTE şi VTE letal, HOKUSAI-VTE (edoxaban-warfarin) pentru tromboza venoasă profundă recurentă şi tromboembolismul pulmonar letal/nonletal, ENGAGE AF-TIMI 48 (edoxaban-warfarin) pentru AVC sau evenimentul sistemic embolic, ARISTOTLE (apixaban-warfarin) pentru AVC sau evenimentul sistemic embolic.
Contraindicaţii relative pentru DOAC sunt: neoplasmele gastrointestinale, istoric de sângerare gastrointestinală, extreme ale greutăţii (<50 sau >150 kg), disfuncţia renală (statusul funcţiei renale necesită o indicaţie individualizată). Dintre DOAC, potrivit datelor actuale bazate pe medicina axată pe dovezi, dintre cele existente (dabigatran, apixaban, rivaroxaban, edoxaban), reprezintă o indicaţie de elecţie pentru rivaroxaban, edoxaban şi apixaban. În alegerea DOAC, funcţia renală este punctul central de referinţă. Clearance-ul renal al DOAC este diferit, respectiv 80% la dabigatran, 50% la edoxaban, 33% la rivaroxaban şi 27% la apixaban. Monitorizarea funcţiei renale este un parametru important, având în vedere dinamica rapidă la aceşti pacienţi. Sunt totuşi necesare noi dovezi vizând această terapie la pacientul oncologic.
Chiar dacă au apărut informaţii multe şi importante asupra asocierii patologiei oncologice şi cardiovasculare, este nevoie de noi studii cu înaltă relevanţă biostatistică pentru a putea controla mai bine problemele complexe şi dificile cu care ne confruntăm.
Conflict de interese: niciunul declarat.
Suport financiar: niciunul declarat.
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.
Bibliografie
-
Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS) [published correction appears in Eur Heart J. 2023 May 7;44(18):1621]. Eur Heart J. 2022;43(41):4229-4361.
-
Lyon AR, Dent S, Stanway S, Earl H, Brezden-Masley C, Cohen-Solal A, et al. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society. Eur J Heart Fail. 2020;22:1945–1960.
-
Herrmann J, Lenihan D, Armenian S, et al. Defining cardiovascular toxicities of cancer therapies: an International Cardio-Oncology Society (IC-OS) consensus statement. Eur Heart J. 2022;43(4):280-299.
-
Williams B, Mancia G, Spiering W, Rosei EA, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39:3021–3104.
-
Melloni C, Shrader P, Carver J, et al. Management and outcomes of patients with atrial fibrillation and a history of cancer: the ORBIT-AF registry. Eur Heart J Qual Care Clin Outcomes. 2017;3:192–7.
-
Steffel J, Verhamme P, Potpara TS, et al. The 2018 EHRA practical guide on the use of NOACs in patients with atrial fibrillation. Eur Heart J. 2018;39:1330–93.
-
Grover SP, Hisada YM, Kasthuri RS, Reeves BN. Cancer Therapy Associated Thrombosis. Arterioscler Thromb Vasc Biol. 2021 Apr;41(4): 1291-1305.
-
Moslehi JJ. Cardiovascular toxic effects of targeted cancer therapies. N Engl J Med. 2016;375:1457–67.
-
Mosarla RC, Vaduganathan M, Qamar A, Moslehi J, Piazza G, Giugliano RP. Anticoagulation Strategies in Patients with Cancer: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;73(11):1336-1349.
-
Al-Samkari H, Connors JM. Managing the competing risks of thrombosis, bleeding, and anticoagulation in patients with malignancy. Blood Adv. 2019;3(22):3770-3779.




