Evaluarea efectului statinelor asupra procesului de calusare prin metoda spectroscopiei în infraroşu cu transformare Fourier (FT-IR)
Evaluation of the effect of statins on the callus process by Fourier transform infrared spectroscopy (FT-IR)
Abstract
Introduction. Bone is a dynamic tissue that is constantly formed and resorbed. The occurrence of a fracture initiates a cascade of inflammatory, repair and remodeling processes. Bone repair is performed by indirect ossification and direct ossification, indirect ossification being the most common. The similarities in bone tissue biology between human and rat bone led us to choose the rats as experimental models for the study of statin-induced changes. Statins play a very important role in the clinical management of osteoporosis and callusing process, cartilage calcification proving to be an excellent model to examine the role of lipids in mineralization. The lipids maintain cell viability, interact with membrane proteins and help regulate transcellular ionic flux. The current study aimed to investigate at the molecular level the effects of simvastatin treatment on the callusing process in rats, using Fourier transform infrared spectroscopy (FT-IR). Materials and method. The study was performed on a lot of 12 rats, divided into two groups: untreated neovarectomized rats, the control group (12 rats), and simovastatin-treated neovarectomized rats (12 rats). Considering that the completion of the callus process is possible in week 8 post-fracture, we followed the evolution of the ratio of saturated and unsaturated lipids correlated with the ratio of protein structures and the types of minerals in the two groups studied. Results. The lipid-lowering treatment, compared to the control group, increased the amount of unsaturated lipids in the organic matrix of bone tissue and increased the amount of structures with asymmetric vibration of carbon hydrogen bonds in the CH2 group of lipid. In the case of protein structures, there was a doubling of the amount of Amide I and an increase of almost six times of Amide II. In mineral structure, there was an increase in the amount of phosphates accompanied by a decrease in the amount of carbonates. Conclusions. The lipid-lowering treatment not only influences the lipid component of the organic matrix of the bone tissue, but also influences its protein component, and these changes of the organic matrix will also influence the degree of mineralization of the organic matrix. Regarding the ratio between carbonates and phosphates, its changings can influence the hardness/the brittleness of the bone.Keywords
Introduction. Bone is a dynamic tissue that is constantly formed and resorbed. The occurrence of a fracture initiates a cascade of inflammatoryrepair and remodeling processes. Bone repair is performed by indirect ossification and direct ossificationindirect ossification being the most common. The similarities in bone tissue biology between human and rat bone led us to choose the rats as experimental models for the study of statin-induced changes. Statins play a very important role in the clinical management of osteoporosis and callusing processcartilage calcification proving to be an excellent model to examine the role of lipids in mineralization. The lipids maintain cell viabilityinteract with membrane proteins and help regulate transcellular ionic flux. The current study aimed to investigate at the molecular level the effects of simvastatin treatment on the callusing process in ratsusing Fourier transform infrared spectroscopy (FT-IR). Materials and method. The study was performed on a lot of 12 ratsdivided into two groups: untreated neovarectomized ratsthe control group (12 rats)and simovastatin-treated neovarectomized rats (12 rats). Considering that the completion of the callus process is possible in week 8 post-fracturewe followed the evolution of the ratio of saturated and unsaturated lipids correlated with the ratio of protein structures and the types of minerals in the two groups studied. Results. The lipid-lowering treatmentcompared to the control groupincreased the amount of unsaturated lipids in the organic matrix of bone tissue and increased the amount of structures with asymmetric vibration of carbon hydrogen bonds in the CH2 group of lipid. In the case of protein structuresthere was a doubling of the amount of Amide I and an increase of almost six times of Amide II. In mineral structurethere was an increase in the amount of phosphates accompanied by a decrease in the amount of carbonates. Conclusions. The lipid-lowering treatment not only influences the lipid component of the organic matrix of the bone tissuebut also influences its protein componentand these changes of the organic matrix will also influence the degree of mineralization of the organic matrix. Regarding the ratio between carbonates and phosphatesits changings can influence the hardness/the brittleness of the bone.Rezumat
Introducere. Osul este un ţesut dinamic care se formează şi se resoarbe constant. Apariţia unei fracturi iniţiază o cascadă de procese inflamatorii, reparatorii şi de remodelare. Reparaţia osului se realizează prin osificare indirectă şi osificare directă, osificarea indirectă fiind cea mai frecventă. Asemănările existente în biologia ţesutului osos între osul uman şi cel de şobolan au determinat alegerea şobolanilor ca modele experimentale pentru studierea modificărilor induse de statine. Statinele joacă un rol foarte important în managementul clinic al osteoporozei şi al calusării, calcificarea cartilajului dovedindu-se a fi un model excelent pentru a examina rolul lipidelor în mineralizare. Acestea menţin viabilitatea celulară, interacţionează cu proteinele membranei şi ajută la reglementarea fluxului ionic transcelular. Studiul actual a urmărit să investigheze, la nivel molecular, efectele tratamentului cu simvastatină asupra procesului de calusare la şobolani, utilizând spectroscopia în infraroşu cu transformare Fourier (FT-IR). Materiale şi metodă. Studiul a fost efectuat pe un lot de 12 şobolani, împărţit în două grupuri: şobolani neovarectomizaţi fără tratament, grup-martor (12 şobolani), respectiv şobolani neovarectomizaţi trataţi cu simvastatină (12 şobolani). Ţinând cont că finalizarea procesului de calusare este posibilă în săptămâna 8 post-fractură, am decis să urmărim evoluţia ponderii lipidelor saturate şi nesaturate corelate cu ponderea structurilor proteice şi a tipurilor de minerale în cadrul celor două grupuri studiate. Rezultate. Tratamentul hipolipemiant, faţă de lotul-martor, are ca efect creşterea semnificativă a cantităţii de lipide nesaturate de la nivelul matricei organice a ţesutului osos, creşterea cantităţii structurilor ce prezintă vibraţie asimetrică a legăturilor carbon-hidrogen din gruparea CH2 a structurilor lipidice, dublarea cantităţii Amidei I şi creşterea de aproape şase ori a Amidei II în cazul structurilor proteice, creşterea cantităţii de fosfaţi, însoţită de scăderea cantităţii de carbonaţi în cazul mineralelor. Concluzii. Tratamentul hipolipemiant nu influenţează doar componenta lipidică a matricei organice a ţesutului osos, ci şi componenta proteică a acesteia, iar aceste modificări ale matricei organice vor influenţa şi gradul de mineralizare a matricei organice. În ceea ce priveşte raportul dintre carbonaţi şi fosfaţi, modificarea acestuia poate influenţa duritatea/casabilitatea osului.Cuvinte Cheie
matrice organică osoasăFT-IRstatinelipideproteinemineraleIntroducere
Osul este un ţesut dinamic care se formează şi se resoarbe constant ca răspuns la modificări mecanice şi alţi factori, cum ar fi concentraţia calciului, stimuli paracrini şi endocrini. Apariţia unei fracturi iniţiază o cascadă de procese inflamatorii, reparatorii şi de remodelare. Reparaţia osului se realizează prin osificare indirectă şi osificare directă. Osificarea indirectă este cea mai frecventă şi are loc atunci când osul fracturat nu a fost fixat rigid, existând astfel o mobilitate mică la locul fracturii. Osificarea directă are loc atunci când a existat o fixare rigidă a osului. Osteogeneza reparatorie secundară prezintă cinci etape clasice: etapa formării hematomului, etapa inflamatorie, etapa ţesutului de granulaţie, etapa formării calusului şi etapa de remodelare a calusului(1).
Prima etapă de vindecare osoasă este reprezentată de formarea hematomului. A doua etapă este cea de inflamaţie acută. În această etapă se formează o reţea de fibrină care serveşte ca matrice provizorie pentru celulele inflamatorii. Neutrofilele ajung la locul de fractură în primele 24 de ore, unde secretă mediatori ai inflamaţiei şi mediatori chimiotactici, ceea ce determină al doilea val de infiltrat de celule inflamatorii, reprezentat de monocite şi macrofage. Macrofagele secretă şi mediatori chimiotactici, inflamatori ce iniţiază recrutarea fibroblaştilor, a celulelor stem mezenchimale şi a celulelor osteoprogenitoare din măduva osoasă locală, periost şi pereţii capilari(2).
Hematomul şi inflamaţia acută vor fi înlocuite de ţesutul de granulaţie, acesta reprezentând a treia etapă de vindecare osoasă(3). Următoarea etapă a procesului de vindecare osoasă este reprezentată de formarea calusului. Procesul se datorează celulelor mezenchimale tinere recrutate şi celulelor osteoprogenitoare periostale care se diferenţiază în osteoblaşti, aceştia formând direct ţesut osos. Până la urmă, ţesutul osos acoperă suprafaţa externă a calusului fibrocartilaginos, oferind astfel stabilitate mecanică suplimentară(4).
Procesul continuă cu hipertrofia condrocitelor din calusul moale care secretă calciu şi mediatori ce stimulează îngroşarea vaselor sanguine, în urma îmbunătăţirii vascularizaţiei, observându-se vindecarea locurilor de fractură în paralel cu diferenţierea celulelor osteoprogenitoare în osteoblaste şi, prin urmare, depunerea de ţesut osos pe cartilaj. În procesul de vindecare, acesta reprezintă stadiul formării calusului dur.
Ultima etapă a procesului de vindecare este reprezentată de remodelarea osoasă. Această etapă este iniţiată de osteoclaste, care încep îndepărtarea ţesutului osos imatur şi a matricei cartilaginoase subiacente. Procesul de remodelare are ca rezultat restabilirea structurii tipice de osteon şi sistem haversian, având o durată mult mai lungă decât a celorlalte etape(5).
Procesul de vindecare al fracturilor este similar la rozătoare şi animalele mai mari, dar la rozătoare are loc într-o perioadă mai scurtă. Astfel, la şobolani de exemplu, primele 7-10 zile cuprind etapa hematomului şi a inflamaţiei apărute post-fractură, iar aceste etape prezintă o celularitate crescută pe preparatele histologice(6). La două săptămâni post-fractură, calusul moale, fibros, ajunge la volumul maxim(7). Urmează procesul de proliferare, în urma căruia condrocitele devin hipertrofice, eliberează calciu şi suferă apoptoză, astfel încât după 10-14 zile de la formarea calusului moale începe şi osificarea endocondrală. Sintetic, putem afirma că la 4 săptămâni încă vorbim de calus fibrocartilaginos, predominant fibros, iar perioada următoare, până la 6 săptămâni, cuprinde procesul de formare a calusului condrohialin(6). La 8-16 săptămâni post-fractură putem vorbi despre vindecare(7). Asemănările existente în biologia ţesutului osos între osul uman şi cel de şobolan au determinat alegerea şobolanilor ca modele experimentale pentru studierea modificărilor induse de statine(8).
Statinele reprezintă tratamentul standard pentru toţi pacienţii cu risc înalt de boală cardiovasculară(9). Fiind agenţi antiresorbtivi şi anabolici în acelaşi timp, statinele joacă un rol foarte important în managementul clinic al osteoporozei şi al calusării, prin mai multe mecanisme, printre care proliferarea, diferenţierea şi protecţia osteoblaştilor, iar pe de altă parte, prin reducerea osteoclastogenezei(10). Aceste acţiuni asupra osului se numesc efecte pleotropice(11).
Asocierea strânsă a lipidelor cu depunerea mineralelor a fost bine stabilită. Studiile din literatura de specialitate au indicat că lipidele, în special fosfolipidele, joacă un rol important în reglarea mineralizării biologice. Ca principali constituenţi ai membranei celulare, lipidele menţin viabilitatea celulară, interacţionează cu proteinele membranei şi ajută la reglementarea fluxului ionic transcelular. Drept componente ale matricei extracelulare, acestea se găsesc sub formă de complexe de acizi fosfolipidici şi proteolipide, fiind intim asociate cu promovarea mineralizării(12-13).
Calcificarea cartilajului s-a dovedit a fi un model excelent pentru a examina rolul lipidelor în mineralizare încă de la începutul procesului de depunere a hidroxiapatitei(14). Ţesutul osos mineralizat în sine conţine, de asemenea, cantităţi mici de lipide, care ar putea juca un rol important în fiziologia osoasă(15).
Studiul actual a urmărit să investigheze, la nivel molecular, efectele tratamentului cu simvastatină asupra procesului de calusare la şobolani, utilizând spectroscopia în infraroşu cu transformare Fourier (FT-IR), metodă inovatoare ce oferă informaţii despre modificările compoziţionale şi conformaţionale de la nivel macromolecular, putând fi eficientă în rezolvarea controverselor cu privire la efectele moleculare ale simvastatinei asupra ţesutului osos.
Spectroscopia FT-IR este o tehnică analitică standard de măsură care permite analiza rapidă a unei game largi de ţesuturi biologice(16). În ultimul deceniu, tehnica a demonstrat un potenţial considerabil ca instrument de analiză avansată a probelor biologice, bazată pe amprenta metabolică a acestora(17). Metoda măsoară absorbţia radiaţiei infraroşii în interacţiune cu vibraţiile legăturilor chimice din molecule, rezultând din tranziţii între nivelurile de energie de vibraţie. Celălalt avantaj al acestei tehnici este că poate detecta modificări foarte mici ale lungimilor şi unghiurilor dintre legăturile chimice ale unor molecule-ţintă din ţesuturile de interes. Acestea sunt sensibile la administrarea de medicamente sau la dezvoltarea de patologii ale subiecţilor şi nu sunt uşor detectabile folosind metodele morfologice clasice. Ca domeniu de cercetare emergent, un număr semnificativ de studii FT-IR au fost efectuate pe ţesuturi precum ficat, creier, muşchi şi ţesuturi osoase mineralizate(18).

Materiale şi metodă
Studiul a fost efectuat pe un lot de 12 şobolani, împărţit în două grupuri: şobolani neovarectomizaţi fără tratament, grup-martor (12 şobolani), respectiv şobolani neovarectomizaţi trataţi cu simvastatină (12 şobolani). Fiecare şobolan a suferit o fractură mediodiafizară a femurului drept, care a fost fixată cu ajutorul unei tije în canalul medular femural, pentru a putea evidenţia efectul tratamentului cu simvastatină asupra procesului de calusare la 8 săptămâni după fractură. Având în vedere faptul că, în conformitate cu datele din literatură, finalizarea procesului de calusare este posibilă în săptămâna 8 post-fractură, am decis să urmărim evoluţia ponderii lipidelor saturate şi nesaturate, corelată cu ponderea structurilor proteice şi a tipurilor de minerale în cadrul celor două grupuri studiate.
Măsurătorile prin FT-IR s-au realizat în transmisie, utilizând un spectrometru Jasco 6200. Pentru aceasta, 10-15 mg de fragment de calus osos femural au fost incluse prin mojarare în 200 mg de KBr (bromură de potasiu). Pulberea rezultată a fost compactată într-un disc cu diametrul de aproximativ 0,5 mm cu ajutorul unei prese manuale. Pentru o mai bună compactare, aerul a fost eliminat folosind o pompă de vid. Pentru măsurători s-a folosit o probă-etalon preparată în acelaşi fel, dar fără fragment de calus. Domeniul de măsură – numărul de undă a fost cuprins între 4000 cm-1 şi 350 cm-1. După fiecare măsurătoare, pentru fiecare spectru, s-a făcut corecţia liniei de bază.
Pentru analiză, s-a măsurat separat o probă de parafină, iar semnalul parafinei a fost extras numeric (folosind în acest scop un program scris în MathCad) din fiecare măsurătoare. În programul MathCad s-au selectat trei domenii de interes: i) pentru semnalul lipidelor (2800-3050 cm-1); ii) pentru semnalul proteinelor (1400-2000 cm-1) şi iii) pentru semnalul mineralelor (800-930 cm-1). Pentru analiza detaliată a benzilor de absorbţie asociate cu cantitatea de lipide nesaturate, cu legăturile C-H asimetrice din CH3, cu legăturile C-H asimetrice din CH2, cu legăturile C-H simetrice din CH2, Amida I, Amida II, şi cu cantitatea mineralelor (v4 PO43-, v2 CO32-), fiecare subspectru a fost supus procedurilor de deconvoluţie şi s-au măsurat ariile integrale. Pentru asocierea benzilor de absorbţie cu componentele organice sau anorganice a matricei osoase, s-au folosit datele din lucrarea scrisă de Sebnem Garip şi Feride Servercan(19).
Rezultate
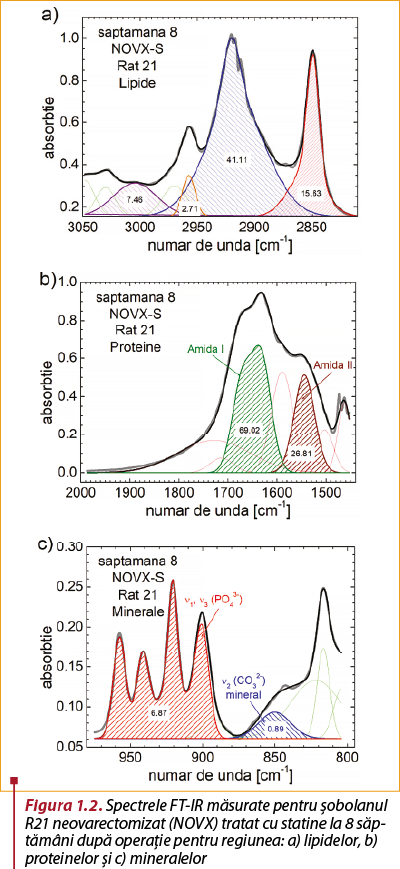
Tratamentul hipolipemiant are ca efect, pentru semnalul înregistrat în intervalul 2975-3050 cm-1, creşterea semnificativă a cantităţii de lipide nesaturate de la nivelul matricei organice a ţesutului osos, aceasta având în cazul tratamentului cu simvastatină o valoare aproape dublă faţă de lotul-martor (figurile 1.1.a şi 1.2.a). În ceea ce priveşte grăsimile cu vibraţie asimetrică a legăturilor trivalente ale atomilor de carbon CH3, pentru semnalul înregistrat în intervalul 2935-2975 cm-1 se înregistrează o scădere semnificativă a acestora în cazul lotului tratat cu simvastatină (figurile 1.1.a şi 1.2.a).
În ceea ce priveşte vibraţia simetrică şi asimetrică a legăturilor bivalente ale atomilor de carbon CH2 din structurile lipidice asociate unor structuri proteice, acizilor nucleici sau carbohidraţilor, pentru semnalul înregistrat în intervalul 2800-2975 cm-1, în lotul cu tratament hipolipemiant s-a înregistrat o creştere a cantităţii acestor structuri (figurile 1.1.a şi 1.2.a).
În cazul lotului tratat cu simvastatină, structurile proteice de la nivelul matricei organice a ţesutului osos au înregistrat o dublare a cantităţii Amidei I şi o creştere de aproape şase ori a Amidei II (figurile 1.1.b şi 1.2.b).
Cantitatea de minerale de la nivelul calusului a fost influenţată de modificarea matricei organice, astfel înregistrându-se o creştere a cantităţii de fosfaţi la lotul cu tratament hipolipemiant. În ceea ce priveşte cantitatea de carbonaţi, faţă de lotul-martor, aceasta a înregistrat o scădere în cazul lotului tratat cu simvastatină (figurile 1.1.c şi 1.2.c).
Concluzii
Tratamentul hipolipemiant nu infuenţează doar componenta lipidică a matricei organice a ţesutului osos, ci şi componenta proteică a acesteia, iar aceste modificări ale matricei organice vor influenţa şi gradul de mineralizare a matricei organice. În ceea ce priveşte raportul dintre carbonaţi şi fosfaţi, modificarea acestuia poate influenţa duritatea/casabilitatea osului.
Scăderea cantităţii de carbonaţi poate fi corelată cu scăderea cantităţii de lipide saturate, iar creşterea cantităţii de fosfaţi, cu creşterea cantităţii structurilor ce prezentau vibraţia simetrică a legăturilor bivalente ale atomilor de carbon din structurile lipidice asociate unor structuri proteice, acizilor nucleici sau carbohidraţilor.
Tratamentul cronic pentru diverse comorbidităţi, de cele mai multe ori, trece neobservat atunci când se realizează reducerea şi imobilizarea unei fracturi, însă medicul de familie cunoaşte medicaţia cronică a pacientului şi poate corela diversele vicii de calusare cu această medicaţie. Pe baza acestor informaţii, durata imobilizării post-fractură poate fi ajustată, astfel încât şansele de recuperare să fie mai bune.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
-
Ahmad O, Somayeh M, Amin BS. Bone Injury and Fracture Healing Biology. Biomed Environ Sci. 2015;28(1):57-71.
-
Thompson Z, Miclau T, Hu D, Helms JA. A model for intramembranous ossification during fracture healing. J Orthop Res. 2002;20:1091–8.
-
Ghiasi MS, Chen JE, Rodriguez EK, Vaziri A, Nazarian A. Computational modeling of human bone fracture healing affected by different conditions of initial healing stage. BMC Musculoskelet Disord. 2019;20(1):562.
-
Fischer V, Haffner-Luntzer M, Amling M, Ignatius A. Calcium and vitamin D in bone fracture healing and post traumatic bone turnover. European Cells and Materials. 2018;35:365-385.
-
Marsell R, Einhorn TA. The biology of fracture healing. Injury. 2011;42(6):551‐555.
-
Şipoş RS, Pap Z, Szalai AS, et al. Statins - Possible Double Potential in Public Health Policies. Acta Medica Marisiensis. 2010;56(5):479-483.
-
Claes L, Recknagel S, Ignatius A. Fracture healing under healthy and inflammatory conditions. Nat Rev Rheumatol. 2012;8(3):133-143.
-
Şipoş RS, Fechete R, Moldovan D, et al. Ovariectomy-Induced Osteoporosis Evaluated by 1H One- and Two-Dimensional NMR Transverse Relaxometry. Appl Magn Reson. 2016;47:1419-1437.
-
Rader DJ. New Therapeutic Approaches to the Treatment of Dyslipidemia. Cell Metab. 2016;23(3):405-412.
-
An T, Hao J, Sun S, Li R, Yang M, et al. Efficacy of statins for osteoporosis: a systemic review and meta-analysis. Osteoporos Int. 2017;28(1):47-57.
-
Şipoş RS, Fechete R, Chelcea IR, et al. Ovariectomized rats` femur treated with fibrates and statins. Assessment of pore-size distribution by 1H-NMR relaxometry. Rom J Morphol Embryol. 2015;56(2):743-752.
-
Boskey AL, Di Carl EF, Gilder H, Donnelly R, Weintroub S. The Effect of Short-term Treatment with Vitamin D Metabolites on Bone Lipid and Mineral Composition in Healing Vitamin D-deficient Rat. Bone. 1988;9:309-318.
-
Boskey AL, Timchak DM. Phospholipid changes in the bones of the vitamin D-deficient, phosphate-deficient, Immature Rat, Metab Bone. 1983;5:81-85.
-
Boyan DB, Schwartz Z, Swain DL, Khare A. Role of lipids in calcification of cartilage. The Anatomical Record. 1989;224(2):211-219.
-
During A, Penel G, Hardouin P. Understanding the local actions of lipids in bone physiology. Progress in Lipid Research. 2015 Jul;59:126-46.
-
Boskey A, Camacho NP. FT-IR imaging of native and tissue engineered bone and cartilage. Biomaterials. 2007;28:2465–2478.
-
Ellis DJ, Goodacre R. Metabolic fingerprinting in disease diagnosis: biomedical applications of Infrared and Raman spectroscopy. Analyst. 2006;131:875–885.
-
Boyar H, Zorlu F, Mut M, Severcan F. The effects of chronic hypoperfusion on rat cranial bone mineral and organic matrix. A Fourier transform infrared spectroscopy study. Anal. Bioanal. Chem. 2004;379:433–438.
-
Garip S, Severcan F. Determination of simvastatin-induced changes in bone composition and structure by Fourier transform infrared spectroscopy in rat animal model. Journal of Pharmaceutical and Biomedical Analysis. 2010;52(4):580–588.



