Obstructive sleep apnea (OSA) is one of the sleep-disordered breathing, with a pediatric prevalence between 1% and 5%. Adenoid and tonsillar hypertrophy, along with obesity are the most common causes in children. OSA should not be neglected because the potential impact on cardiovascular, neurocognitive, behavioral and metabolic systems is significant. It differs from adult disorder by epidemiology, risk factors, diagnostic criteria and therapy approach. The gold standard evaluation for diagnosis is polysomnography. However, this is difficult to perform in young children, so that alternative diagnostic methods are used. Polysomnography is reserved for selected patients. This paper summarizes some of the clinical aspects, risk factors, diagnostic methods and treatment principles underlying OSA.
Abordare practică în sindromul de apnee de somn de tip obstructiv la copil
Practical approach in childhood obstructive sleep apnea syndrome
First published: 28 decembrie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.52.4.2018.2154
Abstract
Rezumat
Sindromul de apnee de somn de tip obstructiv (SASO) aparţine grupului de patologii respiratorii legate de somn, cu o prevalenţă în pediatrie de 1-5%, având drept principale cauze la copii hipertrofia adenoamigdaliană şi obezitatea. Prin complicaţiile pe care le poate asocia, cardiovasculare, neurocognitive, comportamentale şi metabolice, constituie o patologie cu morbiditate importantă şi nu trebuie neglijată. SASO la copii diferă de cel de la adulţi prin epidemiologie, factori de risc, criterii de diagnostic şi tratament. Standardul de aur pentru diagnostic îl constituie polisomnografia. Totuşi, aceasta este de cele mai multe ori dificil de efectuat la copiii de vârstă mică, astfel încât metode alternative de diagnostic sunt utilizate pentru orientare către un diagnostic precoce, polisomnografia fiind rezervată unor cazuri selecţionate. Această lucrare rezumă câteva aspecte care stau la baza înţelegerii sindromului de apnee de somn de tip obstructiv la copil, factorii de risc, diagnostic şi principii de tratament.
Introducere
Sindromul de apnee de somn de tip obstructiv (SASO) este caracterizat prin episoade de obstrucţie completă sau parţială a căilor respiratorii superioare în timpul somnului, adesea având drept consecinţe fragmentarea somnului şi anomalii ale schimburilor de gaze, cum ar fi hipoxie episodică sau hipercapnie intermitentă. Spre deosebire de apneea centrală de somn, în care mişcările respiratorii devin nedecelabile odată cu întreruperea fluxului de aer, în SASO oprirea fluxului de aer este însoţită de persistenţa efortului respirator. Abordarea diagnostică şi terapeutică a SASO la copil este în mare măsură diferită de cea de la adulţi. Netratat, SASO poate afecta în mod negativ creşterea şi dezvoltarea cognitivă şi emoţională a copilului, asociind dificultăţi de învăţare şi de comportament, precum şi complicaţii cardiovasculare importante(1).
Epidemiologie
Sforăitul este obişnuit în copilărie, fiind prezent la aproximativ 10% dintre copiii cu vârste între 2 şi 8 ani(2). Prevalenţa SASO la copil este estimată la 1-5%. Poate surveni la orice vârstă, dar mai frecvent între 2 şi 6 ani(3).
Date fiziopatologice
Fiziologic, somnul poate fi divizat în două faze: REM (rapid eye movement) şi non-REM. Somnul REM se caracterizează prin: atonie musculară generalizată, creşterea fluxului sangvin cerebral, desincronizare electroencefalografică (EEG), variaţii în frecvenţa cardiacă, frecvenţa respiratorie şi presiunea arterială, precum şi creşterea rezistenţei în căile respiratorii superioare. Comparativ, somnul non-REM se caracterizează prin: reducerea, dar nu absenţa, tonusului muscular, reducerea fluxului sangvin cerebral, sincronizare EEG, regularitate în frecvenţa cardiacă, frecvenţa respiratorie şi presiunea arterială, cu persistenţa rezistenţei crescute în căile aeriene superioare(4). Un ciclu de somn REM–non-REM durează de la 60 de minute, la sugar, până la 90-110 minute la adolescenţi şi adulţi, apoi se reia. În timpul somnului, unui copil normal i se produc o serie de modificări fiziologice ale funcţiei aparatului respirator: creşte moderat rezistenţa în căile respiratorii superioare, prin diminuarea tonusului neuromuscular la nivelul muşchilor dilatatori ai faringelui, scade frecvenţa respiratorie, scade capacitatea reziduală funcţională, scade PaO2 cu 3-9 mmHg (saturaţia în oxigen scade cu aproximativ 2%), creşte PCO2 cu 3-7 mmHg. Scurte perioade de apnee centrală pot apărea în mod obişnuit în timpul somnului, dar crizele de apnee de tip obstructiv nu apar niciodată în mod normal la copil. În mod particular, în tulburările de respiraţie legate de somn, creşterea rezistenţei în căile aeriene superioare este exagerată, prin reducerea calibrului căilor respiratorii superioare până la colabarea acestora, determinând creşterea semnificativă a efortului respirator şi, secundar, apariţia sforăitului, a apneei obstructive de somn şi/sau a hipoventilaţiei alveolare de tip obstructiv, rezultând fragmentarea somnului, hipoxie şi hipercapnie(1,5).
Factori de risc
Tulburările de respiraţie legate de somn de tip obstructiv la copii sunt asociate cu o serie de factori de risc care produc un dezechilibru între anatomia căilor aeriene superioare, complianţa pereţilor acestora şi controlul neuromuscular. Prezenţa concomitentă a hipertrofiei adenoamigdaliene şi a obezităţii facilitează apariţia SASO. Obezitatea contribuie la SASO prin infiltrarea adipoasă în structura căilor aeriene superioare. De asemenea, acumularea de ţesut adipos visceral abdominal diminuează mişcările diafragmatice, iar la nivel toracic scade complianţa plămânilor, determinând hipoventilaţie, atelectazie şi modificarea raportului ventilaţie-perfuzie. Obstrucţia căilor aeriene superioare poate surveni la unul sau la mai multe niveluri, de la nazofaringe, cavitate bucală, regiunea retrolinguală până la hipofaringe şi laringe. Alături de hipertrofia amigdaliană şi de obezitate se mai evidenţiază ca factori de risc pentru SASO anomaliile craniofaciale (deviaţie de sept nazal, atrezie coanală, macroglosia, retro-/micrognaţia, bolta palatină ogivală), diverse procese inflamatorii localizate în căile aeriene superioare, rinita alergică/nonalergică, expunerea la diferiţi factori de mediu, astmul, prematuritatea, laringotraheomalacia, paralizia de corzi vocale, neurofibroame, hemangioame, hipotiroidismul, paraliziile cerebrale, sindromul Down, distrofie musculară/alte boli neuromusculare (precum atrofia musculară spinală, sindromul Guillain-Barré), mielomeningocel, acondroplazia, sindrom Prader-Willi, precum şi istoricul familial semnificativ pentru SASO(1,2,6). Între pacienţii cu risc crescut se încadrează şi cei diagnosticaţi cu siclemie. În cazul sindroamelor congenitale, anomaliilor craniofaciale, mucopolizaharidozelor sau bolilor neuromusculare, SASO este multifactorial, necesitând abordare complexă(6). Afecţiunile neuromusculare asociază slăbiciunea musculaturii respiratorii, disfuncţie bulbară, cu hipotonie a musculaturii căilor respiratorii superioare şi tuse ineficientă, determinând anomalii ale ventilaţiei, cu hipoventilaţie alveolară nocturnă, iniţial de somn. Aceasta este secundară obstrucţiei căilor respiratorii superioare, ca urmare a accentuării slăbiciunii musculare în timpul fazei REM a somnului. În cazul acestor copii, sindromul de apnee de somn de tip obstructiv se asociază celui de tip central.
Manifestări clinice
Recunoaşterea tulburărilor de respiraţie legate de somn poate fi dificilă în cazul copiilor de vârstă mică. Atenţia anturajului este deosebit de importantă în sesizarea problemei şi prezentarea la medic. Copiii cu SASO prezintă episoade de apnee predominant în timpul fazei REM de somn, în general spre dimineaţă, putând trece uşor neobservate de către părinţi. Anamneza trebuie să cuprindă întrebări sistematice cu privire la simptomatologie, uneori părinţii neputând asocia anumite simptome cu tulburări de respiraţie. La sugarii de la 3 la 12 luni, semne sugestive pentru tulburări respiratorii legate de somn pot fi: plâns excesiv în timpul nopţii, anomalii ale ritmului nictemeral, sforăit sau respiraţie zgomotoasă, transpiraţii profuze nocturne, supt dificil, falimentul creşterii, evenimente aparent ameninţătoare de viaţă, episoade de apnee sau pauze în respiraţie documentate în timpul somnului, infecţii recurente de căi respiratorii superioare. La copilul mic, între 1 şi 3 ani, sunt mai evidente sforăitul, respiraţia orală, agitaţia şi crizele de plâns inconsolabil pe parcursul nopţii, tulburări ale comportamentului diurn dominate de agresivitate, alături de refuzul alimentaţiei şi creştere deficitară. În cazul copiilor de vârstă şcolară, simptomatologia nocturnă cuprinde sforăit (≥3 nopţi/săptămână), respiraţie zgomotoasă, perioade de apnee, tuse, somn agitat, poziţie adaptată a corpului în timpul somnului (hiperextensia gâtului pentru a menţine permeabile căile respiratorii superioare), transpiraţii nocturne, la care se asociază enurezis nocturn şi parasomnii, precum somnambulismul sau teama de a adormi. În timpul zilei, oboseala poate fi mai puţin evidentă comparativ cu adulţii. Aceasta se poate manifesta prin episoade scurte de adormire în cursul zilei, necorespunzătoare pentru vârstă, inclusiv la şcoală, atenţie deficitară, probleme de învăţare sau tulburări de comportament(7).
Complicaţii
Principalele complicaţii secundare ale SASO vizează sistemul cardiovascular şi dezvoltarea neurocognitivă. Episoadele frecvente de obstrucţie parţială sau completă a căilor respiratorii superioare, determinând hipoxie şi hipercapnie intermitente, precum şi modificările de presiune intratoracică produc un dezechilibru în controlul autonomic neuronal, mediat prin baroreceptori şi chemoreceptori centrali sau periferici, cu instalarea hipertensiunii arteriale sistemice şi pulmonare, a remodelării cardiace şi a disfuncţiei endoteliale. La copil, hipertensiunea pulmonară este mai rar întâlnită, în formele severe, netratate(2,8).
Alături de complicaţiile cardiovasculare, hipoxia induce, de asemenea, modificări endocrinologice şi metabolice, precum hiperinsulinemie şi hiperglicemie(1).
Neurocognitiv, SASO se asociază cu anomalii comportamentale exteriorizate sub formă de agresivitate, impulsivitate, hiperactivitate, tulburări de conduită sau asociate cu iritabilitate, instabilitate emoţională, toleranţă scăzută la frustrare, anxietate, dificultăţi de concentrare sau performanţe şcolare reduse(1,9). Este important să se considere SASO ca diagnostic diferenţial în investigarea unor copii cu tulburări de comportament sau tulburări de hiperactivitate cu deficit de atenţie (ADHD), putând exista o suprapunere considerabilă a simptomatologiei.
Diagnostic
Evaluarea SASO cuprinde mai multe etape succesive.
Anamneza trebuie să fie amănunţită privind factorii de risc pentru SASO, precum şi simptomatologia nocturnă sau diurnă, cu atenţie deosebită asupra următoarelor aspecte: prezenţa sforăitului, pauze în respiraţie cu efort respirator menţinut, somn agitat, enurezis nocturn, tulburări de atenţie şi de comportament. Au fost elaborate o serie de chestionare cu accent asupra caracteristicilor frecvent întâlnite în tulburările de somn asociate cu hipoventilaţie. Deşi acestea pot fi de ajutor, nu sunt suficiente pentru a susţine diagnosticul pozitiv. Se pot utiliza totodată şi pentru aprecierea calităţii vieţii după iniţierea terapiei.
Examenul clinic poate fi normal sau poate oferi informaţii, în mod direct sau indirect, privind creşterea rezistenţei în căile respiratorii superioare. După cum este menţionat anterior, obezitatea constituie un factor de risc pentru SASO, iar hipotrofia ponderală poate constitui semnul unei evoluţii prelungite. O atenţie deosebită se va acorda pentru examinarea anomaliilor craniofaciale, a cavităţii nazale şi a cavităţii bucale, identificând defecte anatomice, semne de inflamaţie acută şi hipertrofie adenoamigdaliană. Poziţia uvulei în raport cu limba este evaluată după clasificarea Mallampati, care oferă o estimare asupra gradului de obstrucţie la nivelul orofaringelui. Această clasificare se bazează pe vizualizarea structurilor, având gura deschisă şi limba în protruzie maximă, fiind descrise patru clase: clasa I (pilierii faringieni, uvula şi palatul moale sunt vizibile în întregime), clasa II (sunt vizibile doar palatul moale şi uvula), clasa III (este vizibil doar palatul moale) şi clasa IV (nu este vizibil nici palatul moale)(10).
Investigaţii paraclinice pentru identificarea factorilor de risc pentru SASO sau a complicaţiilor acestuia pot fi utile: EKG, ecografie cardiacă, explorarea funcţiei tiroidiene, investigaţii imagistice de tipul tomografie computerizată sau rezonanţă magnetică nucleară (pentru a identifica sediul exact al obstrucţiei sau pentru identificarea unor malformaţii craniocerebrale).
Polisomnografia (PSG) reprezintă standardul de aur pentru diagnosticul tulburărilor de ventilaţie asociate somnului. Aceasta constituie o investigaţie complexă, neinvazivă, care cuprinde electroencefalogramă (EEG), electrocardiogramă (EKG), electromiogramă (EMG), flux aerian nazal, mişcări respiratorii toraco-abdominale, electrooculogramă (EOG), pulsoximetrie, capnografie şi supraveghere video. În urma datelor anamnestice şi clinice se stabileşte indicaţia de a efectua PSG pentru diagnosticul pozitiv de SASO, dar şi pentru a evalua severitatea şi deciziile terapeutice ulterioare. PSG are accesibilitate limitată, fiind costisitoare şi necesitând examinare specializată(7). Poligrafia respiratorie (RP) este PSG fără monitorizare EEG, EMG, EOG, fiind mai accesibilă şi mai uşor de utilizat. Aceasta este acceptată ca metodă de diagnostic al SASO în unele centre, însă există risc de subestimare a evenimentelor respiratorii(11). O alternativă de diagnostic, când PSG şi PR nu sunt disponibile, o constituie pulsoximetria nocturnă. Aceasta are o specificitate redusă pentru diagnosticul SASO la copil, iar rezultatele fals negative sunt frecvente. Conform criteriilor McGill, ≥3 desaturări de minimum 4% şi ≥3 desaturări sub 90% sunt considerate anormale(1).

Tabelul 1 rezumă principalele evenimente documentate pe rapoartele de PSG. Spre deosebire de adulţi, unde evenimentele se definesc ca având o durată ≥10 secunde, criteriile pediatrice prevăd că trebuie să dureze ≥2 cicluri de respiraţie (care pot fi sub 10 secunde, mai ales la sugari şi copii mici). Evenimentele surprinse de PSG pot fi: apnee, hipopnee, RERA (Respiratory Effort Related Arousal), microtreziri, sforăit, modificări ale poziţiei corpului, mişcări ale membrelor(7).
Pentru diagnosticul pozitiv şi evaluarea severităţii SASO se utilizează următorii parametri:
-
Indexul de apnei-hipopnei (IAH), care reprezintă numărul total de apnei şi hipopnei înregistrate raportat la timpul de înregistrare.
-
Respiratory disturbance index (RDI), definit prin numărul de apnei, hipopnei şi RERA, raportat la timpul de somn.
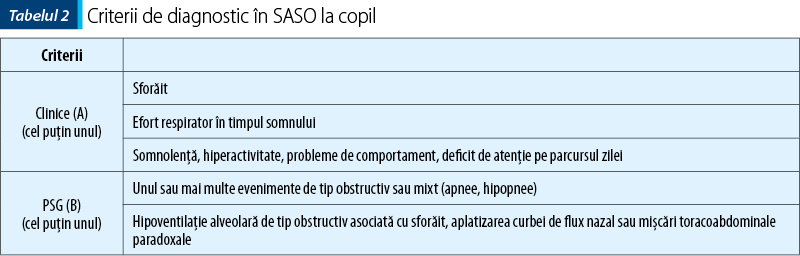
Criteriile de diagnostic ale SASO în pediatrie sunt diferite de cele de la adult. Conform Academiei Americane de Medicină a Somnului, acestea cuprind criterii clinice şi criterii polisomnografice, prezentate în tabelul 2(12). SASO trebuie diferenţiat de sforăitul primar, care nu asociază apnee obstructivă, microtreziri sau anomalii de gaze sangvine.
În funcţie de IAH, se poate aprecia severitatea SASO. Astfel, se consideră că IAH cuprins între 1 şi 4,9, încadrează SASO în forma uşoară, între 5 şi 9,9, în forma moderată, iar valori de peste 10, în forma severă. Aceste valori sunt alese în urma datelor observate în practică(1).
Principii de tratament
Decizia de iniţiere a unui tratament şi alegerea terapiei depind de vârsta copilului, comorbidităţi asociate, prezenţa factorilor de risc, simptomatologia clinică, precum şi de rezultatul PSG. În general, intervenţia specifică de tratament este recomandată când IAH >5 sau dacă evenimentele respiratorii sunt asociate cu desaturări <85% în aerul atmosferic. Dacă IAH este cuprins între 1 şi 5, trebuie luaţi în considerare şi alţi factori clinici(1,8).
Scăderea ponderală în cazul pacienţilor supraponderali sau obezi şi măsurile de igienă a somnului sunt esenţiale. Expunerea la pneumalergeni trebuie evitată, deoarece poate induce suplimentar congestie nazală şi creşterea rezistenţei în căile respiratorii superioare. Administrarea de corticosteroizi topici, intranazal, poate reduce dimensiunea vegetaţiilor adenoidiene în cazul alergiilor sezoniere, determinând temporar rezultate pozitive în cazurile de SASO uşor sau moderat ca tratament alternativ adenoamigdalectomiei, fără să elimine însă necesitatea intervenţiei chirurgicale(8).
Adenoamigdalectomia constituie indicaţia de primă intenţie în cazul copiilor cu SASO şi hipertrofie adenoamigdaliană (conform Academiei Americane de Pediatrie). Succesul acestei intervenţii terapeutice la copiii normoponderali, fără alte comorbidităţi, este de 75%. Riscul pentru SASO rezidual este crescut în caz de obezitate, SASO sever cu IAH>20/h, scor Mallampati de clasă înaltă, astm, anomalii craniofaciale, boli neuromusculare şi anomalii cromozomiale asociate(1,8).
În cazuri selecţionate, şi mai ales la copiii cu SASO rezidual după intervenţia chirurgicală sau în cazul celor care nu au hipertrofie adenoamigdaliană semnificativă, se poate recurge la ventilaţie neinvazivă cu presiune pozitivă (continuă – CPAP sau bilevel – BiPAP) pentru hipoventilaţia nocturnă, având drept scop menţinerea permeabilităţii căilor aeriene superioare, îmbunătăţirea capacităţii reziduale pulmonare şi reducerea efortului respirator. Ventilaţia în sistem BiPAP este utilă mai ales în cazul persistenţei hipoventilaţiei alveolare nocturne cu hipercapnie, mai frecvent întâlnită în bolile neuromusculare, sindroame craniofaciale, precum şi în sindromul obezitate-hipoventilaţie(1,7). În cazul asocierii hipoxemiei nocturne legate de SASO, se poate asocia oxigenoterapie pe parcursul nopţii, până la abordarea terapeutică definitivă, fiind necesară monitorizarea PSG pentru detectarea hipercapniei. Este important de menţionat că oxigenoterapia nocturnă ameliorează hipoxemia, dar nu previne obstrucţia căilor aeriene superioare legată de somn, microtreziri sau efortul respirator.
Copiii diagnosticaţi cu sindroame congenitale, anomalii craniofaciale, mucopolizaharidoze sau boli neuromusculare dezvoltă SASO prin mecanisme multiple, necesitând deseori intervenţii chirurgicale suplimentare (chirurgie oromaxilofacială, faringoplastie). Traheotomia este rezervată pentru cazurile severe.
Concluzii
SASO este o patologie cu incidenţă în creştere, concomitent cu creşterea frecvenţei cazurilor pediatrice de obezitate din ultimii ani. Spre deosebire de adulţi, la copii datele clinice sunt insuficiente pentru diagnosticul SASO. Sforăitul prezent în cel puţin trei nopţi pe săptămână necesită o evaluare mai amănunţită şi, eventual, investigaţii suplimentare. Polisomnografia este standardul de aur pentru diagnostic. Teste alternative se pot folosi când polisomnografia nu este disponibilă, precum poligrafia respiratorie sau pulsoximetria nocturnă, utile dacă rezultatul este pozitiv. De îndată ce diagnosticul SASO este confirmat de evaluarea clinică şi polisomnografie, decizia de iniţiere a terapiei trebuie făcută în colaborare cu familia, luând în considerare gradul de severitate, simptomatologia diurnă, vârsta copilului, prezenţa hipertrofiei adenoamigdaliene şi anomaliile polisomnografice. Diagnosticul precoce şi tratamentul pot îmbunătăţi calitatea vieţii şi reduce apariţia complicaţiilor severe, precum cele cardiovasculare şi metabolice sau neurocognitive şi comportamentale. Adenoidectomia constituie principala linie de tratament. Ventilaţia neinvazivă se poate lua în considerare pentru pacienţii care nu au indicaţie de intervenţie chirurgicală sau care nu răspund la tratament chirurgical.
Conflict of interests: The author declares no conflict of interests.
Bibliografie
- Dehlink E, Tan UL. Update on paediatric obstructive sleep apnoea. Journal of Thoracic Disease. 2016 Feb; 8(2):224-235.
- Chang SJ, Chae KY. Obstructive sleep apnea syndrome in children: epidemiology, pathophysiology, diagnosis and sequelae. Korean J Pediatr. 2010; 53:863–71.
- Marcus CL, Brooks LJ, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome. American Academy of Pediatrics Pediatrics. 2012; 130(3):e714.
- Hudgel DW, Martin RJ, et al. Mechanics of the respiratory system and breathing pattern during sleep in normal humans. J Appl Physiol Respir Environ Exerc Physiol. 1984;56(1):133.
- Berry RB, Albertario CL, et al. American Academy of Sleep Medicine. The AASM Manual for the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specifications, Version 2.5, www.aasmnet.org, American Academy of Sleep Medicine, Darien, IL 2018.
- Qubty WF, Mrelashvili A. Comorbidities in infants with obstructive sleep apnea. J Clin Sleep Med. 2014;10(11):1213.
- Guilleminault CH, Lee JH, Chan A. Pediatric Obstructive Sleep Apnea Syndrome. Arch. Pediatr. Adolesc. Med. 2005; 159: 775-785.
- Capdevila OS, Gozal LK. Pediatric obstructive sleep apnea – complications, management and long-term outcomes. American Thoracic Society. 2008 Feb; 5(2): 274-282.
- Quan SF, Archbold K, et al. Long-Term Neurophysiologic Impact of Childhood Sleep Disordered Breathing on Neurocognitive Performance. Southwest J Pulm Crit Care. 2013;7(3):165-175.
- Samsoon GL, Young JR. Difficult tracheal intubation: a retrospective study. Anaesthesia. 1987; 42:487.
- Tan HL, Gozal D, Ramirez HM, et al. Overnight polysomnography versus respiratory polygraphy in the diagnosis of pediatric obstructive sleep apnea. Sleep. 2014;37:255-60.
- American Academy of Sleep Medicine. International Classification of Sleep Disorders, 3rd ed, American Academy of Sleep Medicine, Darien 2014.
Articole din ediţiile anterioare
Factori legaţi de stilul de viaţă pentru obezitatea infantilă în preadolescenţă
Supraponderalitatea şi obezitatea sunt definite ca acumularea anormală sau excesivă de grăsime, care prezintă un risc pentru sănătate. Obezitatea a...
The importance of microbiome in pediatric obesity
Copilăria implică aspecte privind intervenţii ce configurează microbiomul pentru a atenua tulburările legate de obezitate.
Aportul de vitamină D şi starea greutăţii la copiii preşcolari
Ghidul privind evaluarea şi terapia deficitului de vitamină D la gravide, nou-născuţi şi la copiii preşcolari subliniază importanţa abordării per...
Evaluarea managementului respirator la copiii cu distrofie musculară Duchenne
Distrofia musculară Duchenne este o boală genetică cu transmitere X-linkată, care afectează gena implicată în sinteza distrofinei. Nivelurile ...